Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.27 no.4 Lima Oct./dec. 2010
REVISIÓN
Diagnóstico y manejo de la neurocisticercosis en el Perú
Neurocysticercosis diagnosis and management in Peru
Herbert Saavedra1,a, Isidro Gonzales1,a , Manuel A. Alvarado1,a, Miguel A. Porras1,a, Victor Vargas1,a, Román A. Cjuno1,a, Hector H. Garcia1,b, S. Manuel Martinez1,b
1 Servicio de Enfermedades Transmisibles, Departamento de Neuropediatria y Enfermedades Transmisibles, Instituto Nacional de Ciencias Neurológicas, Ministerio de Salud. Lima, Perú.
a Médico neurólogo; b Médico, Doctor en salud internacional.
RESUMEN
La neurocisticercosis (NCC) es la parasitosis humana más frecuente del sistema nervioso central y es causada por las larvas del céstodo Taenia solium. La NCC es endémica en prácticamente todos los paises en vías de desarrollo. En general se presenta como formas intraparenquimales asociadas con convulsiones o formas extraparenquimales asociadas con hipertensión endocraneana. La sospecha clínica y epidemiológica es importante pero el diagnóstico se realiza primariamente por imágenes y se confirma con serología. La tomografía axial computarizada y la resonancia magnética son las pruebas imagenológicas usadas. Como prueba confirmatoria se usa el diagnóstico inmunológico a través de western blot, que actualmente se pude realizar en el Instituto Nacional de Ciencias Neurológicas tanto en suero como en líquido cefalorraquídeo. El tratamiento involucra medidas sintomáticas (control de convulsiones o hipertensión endocraneana según sea el caso) y tratamiento antiparasitario (albendazol o praziquantel). El tratamiento antiparasitario debe hacerse bajo condiciones de hospitalización y en hospitales de tercer nivel.
Palabras clave: Neurocisticercosis; Albendazol; Praziquantel; Taenia solium; Perú (fuente: DeCs BIREME).
ABSTRACT
Neurocysticercosis (NCC) is the most common parasitic disease of the central nervous system and is caused by larvae of the tapeworn Taenia solium. NCC is endemic in almost all developing countries. It presents as intraparenchymal forms associated with seizures or as extraparenchymal forms associated with intracranial hypertension. The clinical and epidemiological suspicion are important but the diagnosis is made primarily by images and confirmed by serology. Computed tomography (CT) and magnetic resonance imaging tests are used. Inmunodiagnosis by Western Blot, which is currently perform in the Instituto Nacional de Ciencias Neurológicas in serum and cerebrospinal fluid serves as confirmatory test. Treatment involves symptomatic measures (control of seizures or intracranial hypertension) and anticysticercal medications (albendazole and praziquantel). Anticysticercal treatment should be used under hospital conditions because of secondary effects.
Key words: Neurocysticercosis; Albendazole; Praziquantel; Taenia solium; Peru (source: MeSH NLM).
INTRODUCCIÓN
La cisticercosis es la parasitosis por larvas del céstodo Taenia solium que se enquistan en el sistema nervioso central (SNC) y otros tejidos, tras ingerir alimentos contaminados con huevos de este parásito. El hospedero principal de la cisticercosis es el cerdo, el cual actúa como intermediario en el ciclo cisticercosis-teniasis. El hombre también puede ser hospedero intermediario ocasional (1).
La neurocisticercosis (NCC) es la parasitosis humana más frecuente del SNC, y es endémica en prácticamente todos los países en desarrollo, con excepción del mundo musulmán. Es endémica en Iberoamérica, India, partes de Asia y África; en USA y Europa se presenta con cierta frecuencia, mayormente en inmigrantes. Es menos frecuente en niños. En Latinoamérica la cisticercosis subcutánea es rara, y la cisticercosis cerebral con formas quísticas es frecuente, mientras que en Asia la cisticercosis subcutánea es común. En la India es usualmente un solo parásito en degeneración (2).
En general, la NCC se presenta como formas intraparenquimales, asociadas con cuadros convulsivos, o formas extraparenquimales, estando estas últimas asociadas con hipertensión endocraneana. Los quistes intraparenquimales pasan por las siguientes fases de evolución:
-
Fase vesicular: quistes viables, provocan una respuesta inflamatoria mínima.
-
Fase coloidal: presencia de inflamación provocada por la respuesta inflamatoria celular alrededor del quiste.
-
Fase nodulo granular: sustitución gradual por tejido fibrótico y colapso progresivo de la pared del quiste.
-
Fase de calcificación: incorporacion de calcio sobre el tejido fibrótico del parásito (3,4).
La NCC extraparenquimal incluye quistes subaracnoideos o intraventriculares. Los quistes subaracnoideos pueden alcanzan gran tamaño y forman lobulaciones (aspecto de racimo de uvas), pierden el escólex y se ubican por lo general en la base del cerebro o en la fisura de Silvio, más raramente en la convexidad. Los quistes subaracnoideos de la base llevan a hidrocefalia, mientras que los de la fisura de Silvio o de la convexidad causan efecto de masa. La NCC intraventricular provoca elevación transitoria o persistente de la presión intracraneal (PIC) secundaria a bloqueo del acueducto de Silvio o del orificio de Lushka y Magendie. La inflamación de estos quistes produce ependimitis y aracnoiditis, lo que a su vez provoca tambien hidrocefalia o vasculitis con accidente cerebro vascular (5-7).
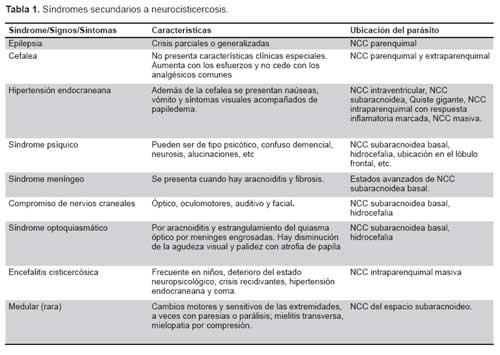
Las manifestaciones clínicas son muy variables y es frecuente encontrar una combinación de síndromes que en orden de frecuencia son (Tabla 1):
Ocasionalmente puede presentarse el síndrome de Bruns, desencadenado por cambios de posición y caracterizado por cefalea, vértigo, vómito, alteraciones cerebelosas, pérdida de conciencia y, ocasionalmente, muerte. Este síndrome se debe a quistes en el cuarto ventrículo o formas racemosas de la cisterna magna que causan obstrucción del LCR y compresiones venosas.
En la cisticercosis ocular se presentan problemas de agudeza visual progresivos. Desprendimiento de retina y pérdida de la visión, vitritis, uveitis, oftalmitis, iridociclitis, proptosis, ptosis, diplopia (forma extraocular). La cisticercosis muscular es primariamente asintomática, aunque en casos masivos puede haber hipertrofia muscular dolorosa y debilidad muscular proximal. Los nódulos subcutáneos son también asintomáticos y su biopsia ayuda al diagnóstico.
Diagnóstico
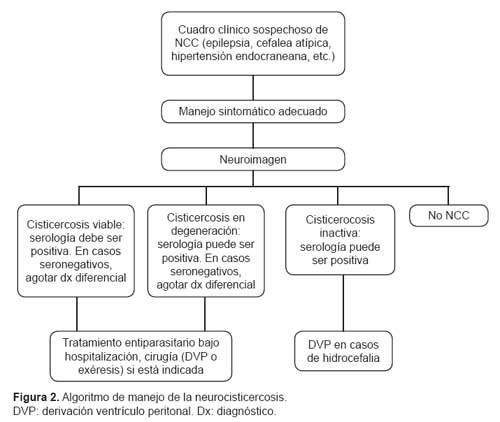
Si bien la información clinica y epidemiológica orientan el diagnóstico, en nuestro país se debe descartar cisticercosis en la mayoría de casos de crisis epilépticas, cefaleas crónicas o hipertensión endocraneana. El diagnóstico es primariamente por imagen, con la serología como herramienta confirmatoria de acuerdo al tipo de neurocisticercosis (8,9).
Neuroimágenes
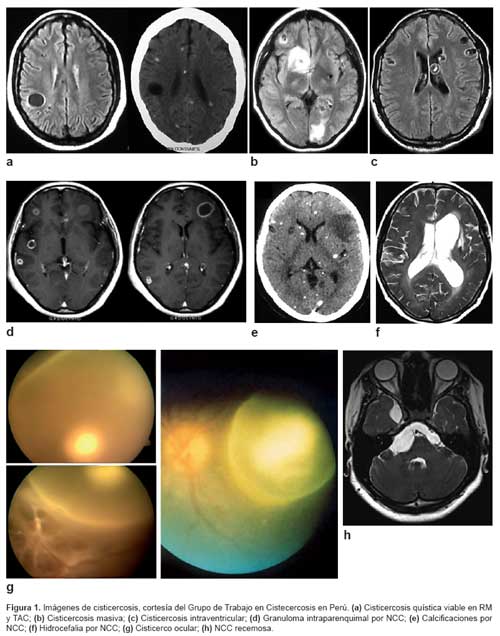
En la actualidad se usa la tomografía axial computarizada (TAC) (10,11) y la resonancia magnética (12). En consideración a su costo y disponibilidad, la TAC es el procedimiento diagnóstico más útil en NCC. Es importante enfatizar que la TAC debe ser realizada en equipos de última generación y buena calidad de imagen por que tomografias de pobre resolución dificultan el diagnóstico y resultan en pérdida de tiempo y dinero para los pacientes.
La TAC puede revelar formas activas, en degeneración e inactivas del cisticerco. Igualmente, NCC subaracnoidea con hidrocefalia, quistes intraventriculares y encefalitis cisticercósica (múltiples quistes captadores de contraste en anillo - inflamación y edema, con ventrículos laterales pequeños) (13).
La RM tiene mayor sensibilidad que la TAC, particularmente para lesiones pequeñas. Muestra imágenes mejor definidas (escólex), quistes intraventriculares (III y IV) en distintos planos espaciales. Sin embargo, no detecta bien las calcificaciones y es más costosa que la TAC (13).
Inmunodiagnóstico
El diagnóstico inmunológico se realiza mediante la técnica de inmunoelectrotransferencia (EITB), también llamada inmunoblot o western blot, con antígenos glicoproteicos purificados. Esta prueba está disponible a bajo costo en el Instituto Nacional de Ciencias Neurológicas, gracias a la colaboración de muchos años entre el Grupo de Trabajo en Cisticercosis en Perú y los Centros para el Control de Enfermedades (CDC) de los Estados Unidos. La sensibilidad de esta técnica en pacientes con más de un quiste viable es de alrededor de 98% y su especificidad es del 100% (14,15). Recientemente contamos también con la detección de antígeno parasitario tanto en suero como en liquido cefalorraquídeo (LCR) (16,17). Esta técnica nos permite monitorizar la evolución de los pacientes luego de tratamiento o cirugía.
Otros estudios complementarios
El hemograma sirve de orientación y debe tenerse de línea de base para monitorizar potenciales alteraciones debidas a la terapia antiparasitaria o antiepiléptica, al igual que las pruebas de función hepática.
El estudio de líquido céfalorraquídeo (LCR) mediante la punción lumbar (PL), puede mostrar proteínas aumentadas, glucosa baja, aumento de leucocitos, principalmente linfocitos y eosinófilos. Los anticuerpos o antígenos en LCR están más elevados en NCC racemosa (16). Se debe recordar que este procedimiento está contraindicado en pacientes con hipertensión endocraneana.
Los exámenes de fundoscopía y ecografía ocular, son importantes para descartar la presencia de quistes oculares (mayormente en el vítreo o la retina), porque el daño causado al parásito por la terapia antiparasitaria puede comprometer la visión y causar daño permanente.
El descarte de teniasis, a pesar de la baja sensibilidad de la microscopía, se debe realizar en el paciente o sus familiares, para controlar la fuente de futuras infecciones.
El estudio mediante la biopsia, en los raros casos con quistes subcutáneos o aquellos que van a cirugía, permite confirmar el diagnóstico.
Diagnóstico Diferencial
El diagnóstico diferencial depende del tipo de lesión. En las lesiones quísticas hay que pensar en un astrocitoma, hidatidosis, quiste porencefálico o más raramente metástasis quísticas. En los granulomas, el diferencial es más amplio e incluye tuberculosis, toxoplasmosis, absceso cerebral, toxocariasis y metástasis. En las calcificaciones hay que considerar toxoplasmosis o citomegalovirus.
Signos de Alarma y Complicaciones
Se debe prestar atención a la presencia de los siguientes signos que marcan la descompensación del paciente y requieren manejo de urgencia: status epiléptico, coma y signos de HIC, signos focales deficitarios, deterioro cognitivo y midriasis arreactiva. De igual forma, las principales complicaciones que se pueden presentar en la evolución de pacientes con NCC son mal control de la epilepsia, disfunción de los sistemas de derivación (hidrocefalia hipertensiva), cefalea aguda y signos deficitarios permanentes o deterioro cognitivo/ demencia.
Tratamiento
El tratamiento de la NCC involucra medidas sintomáticas (control de la cefalea, epilepsia e hipertensión endocraneana con anticonvulsivantes, esteroides, diuréticos osmóticos o analgésicos) y medicamentos antiparasitarios (albendazol o praziquantel) (18). El uso de medicamentos antiparasitarios debe hacerse bajo condiciones de hospitalización y de preferencia en centros de tercer nivel para proveer manejo adecuado de eventuales descompensaciones del cuadro neurológico. Nunca ambulatoriamente.
El manejo sintomático inicial es de extrema importancia. La presencia de hipertensión endocraneana puede acarrear un mal pronóstico si no es manejada temprano y adecuadamente. El manejo de las crisis epilépticas debe en general seguir las reglas de la Liga Internacional Contra la Epilepsia. Luego del manejo sintomático y de emergencia adecuado, el paciente tributario de tramiento antiparasitario debe ser referido a un centro de referencia local o regional.
La NCC inactiva (calcificaciones) no requiere tratamiento antiparasitario, pero podria ayudar el uso de corticoides en el control algunas molestias. La hidrocefalia secundaria a NCC puede ser tributario de válvula de derivación ventrículo peritoneal (VDVP). La NCC parenquimatosa activa usualmente requiere tratamiento antiparasitario con albendazol o paziquantel. En general, se prefiere albendazol por ser más disponible y barato, penetra mejor en quistes subaracnoideos y no presenta interacciones farmacológicas con los corticoesteroides y anticonvulsivantes. Dosis: 15mg/kg/día por 7 a 15 días. Se absorbe mejor cuando se toma alimentos grasos. Alternativamente se puede usar praziquantel a 50 mg/ kg/día por 15 días (19).
La NCC extraparenquimal y en particular la subaracnoidea (racemosa) ceden menos al tratamiento con antiparasitarios, en estos casos se recomienda terapia de un mes o más con ABZ. La terapia antiparasitaria debe ser continuada o repetida hasta conseguir la eliminación total de los parásitos vivos. La NCC intraventricular requiere tratamiento quirúrgico y, actualmente, con la introducción de la neuroendoscopía, su extirpación con este procedimiento alternativo menos invasivo es alentador (20,21). A la fecha, son pocos los casos de NCC quística gigante tributarios de manejo quirúrgico. En general, los casos de NCC deben tener un seguimiento por imágenes. Usualmente, se recomienda una TAC de control tres meses luego del tratamiento antiparasitario.
Efectos adversos del tratamiento
Los efectos secundarios, usualmente cefalea, naúseas, vómito, fiebre, hipertensión endocraneana, convulsiones y coma, al parecer ocurren por una respuesta inflamatoria del huésped provocada al morir los parásitos debido a la administración del antiparasitario (30-80% de los casos y son mayores cuando existen numerosos quistes) y por ello su uso es contraindicado en los casos de encefalitis. Por esta razón no es recomendable el manejo ambulatorio de medicación antiparasitaria en NCC. Se presentan mayormente entre el 2.º y 4.° día de tratamiento. De presentarse estos síntomas, el manejo es primariamente con esteroides (prednisona 30 a 60 mg diarios o dexametasona parenteral 4-16 mg/día). Se debe poner enfasis en el tratamiento esteroideo concomitante, en particular en las formas encefalíticas y subaracnoidea (22).
Lugar y forma de Atención
Nivel I y II
La atención en los primeros niveles es ambulatoria y orientada al manejo sindrómico, principalmente de la epilepsia y cefalea. Situaciones de emergencia incluyen el manejo de crisis convulsivas, status epilépticos, y manejo agudo de la hipertensión endocraneana. El Nivel II puede hacerse cargo del seguimiento postratamiento antiparasitario.
Nivel III y IV
El manejo neuroquirúrgico y el tratamiento antiparasitario deberían manejarse en centros de este nivel en lo posible. Sobre dudas en el manejo de casos complejos, pueden consultar a la Unidad de Cisticercosis, Instituto Nacional de Ciencias Neurológicas: Jirón Ancash 1271, Barrios Altos, Lima. Teléfono (511) 411-7700.
REFERENCIAS BIBLIOGRÁFICAS
1. Flisser A. Taeniasis and cysticercosis due to Taenia solium. Prog Clin Parasitol. 1994;4:77116. [ Links ]
2. Garcia HH, Del Brutto OH. Neurocysticercosis: updated concepts about an old disease. Lancet Neurol 2005;4(10):65361. [ Links ]
3. Escobar A. The pathology of neurocysticercosis. In: Palacios E, RodriguezCarbajal J, Taveras JM, eds. Cysticercosis of the central nervous system. Springfield: Charles C. Thomas; 1983. p.2754. [ Links ]
4. Del Brutto OH, Sotelo J, Roman GC. Neurocysticercosis. A clinical handbook. Lisse: Swets and Zeitliger; 1997. [ Links ]
5. Bickerstaff ER, Cloake PCP, Hughes B, Smith WT. The racemose form of cerebral cysticercosis. Brain. 1952;75(1):116. [ Links ]
6. Bickerstaff ER, Small JM, Woolf AL. Cysticercosis of the posterior fossa. Brain 1956;79(4):62234. [ Links ]
7. Trelles JO, Palomino L, Caceres A. [Histopathology of cerebral cysticercosis]. Acta Neuropathol (Berl). 1967;8(2):11532. [ [ Links ]article in French]
8. Del Brutto OH, Wadia NH, Dumas M, Cruz M, Tsang VC, Schantz PM. Proposal of diagnostic criteria for human cysticercosis and neurocysticercosis. J Neurol Sci. 1996;142(12):16. [ Links ]
9. Del Brutto OH, Rajshekhar V, White AC Jr., Tsang VC, Nash TE, Takayanagui OM, et al. Proposed diagnostic criteria for neurocysticercosis. Neurology. 2001;57(2):17783. [ Links ]
10. Byrd SE, Daryabagi J, Thompson R, Zant J, Locke GE, Biggers S. The computed tomographic spectrum of cerebral cysticercosis. J Natl Med Assoc. 1985;77(7):55360. [ Links ]
11. Minguetti G, Ferreira MV. Computed tomography in neurocysticercosis. J Neurol Neurosurg Psychiatry. 1983;46(10):93642. [ Links ]
12. Barkovich AJ, Citrin CM, Klara P, Wippold FJ, Kattah J. Magnetic resonance imaging of cysticercosis. West J Med. 1986;145(5):68790. [ Links ]
13. Garcia HH, Del Brutto OH. Imaging findings in neurocysticercosis. Acta Tropica. 2003;87(1):7178. [ Links ]
14. Tsang VC, Brand JA, Boyer AE. An enzymelinked immunoelectrotransfer blot assay and glycoprotein antigens for diagnosing human cysticercosis (Taenia solium). J Infect Dis. 1989;159(1):5059. [ Links ]
15. Diaz JF, Verastegui M, Gilman RH, Tsang VC, Pilcher JB, Gallo C, et al. Immunodiagnosis of human cysticercosis (Taenia solium): a field comparison of an antibodyenzymelinked immunosorbent assay (ELISA), an antigenELISA, and an enzymelinked immunoelectrotransfer blot (EITB) assay in Peru. The Cysticercosis Working Group in Peru (CWG). Am J Trop Med Hyg. 1992;46(5):61015. [ Links ]
16. Rodriguez S, Dorny P, Tsang VC, Pretell EJ, Brandt J, Lescano AG, et al. Detection of Taenia solium antigens and antiT. solium antibodies in paired serum and cerebrospinal fluid samples from patients with intraparenchymal or extraparenchymal neurocysticercosis. J Infect Dis. 2009;199(9):134552. [ Links ]
17. Garcia HH. Serological diagnosis and followup of severe neurocysticercosis using HP10 antigen detection. Nat Clin Pract Neurol. 2007;3(9):48889. [ Links ]
18. Del Brutto OH, Roos KL, Coffey CS, Garcia HH. Metaanalysis: cysticidal drugs for neurocysticercosis: albendazole and praziquantel. Ann Intern Med. 2006;145(1):4351. [ Links ]
19. Sotelo J, del Brutto OH, Penagos P, Escobedo F, Torres B, Rodriguez-Carbajal J, et al. Comparison of therapeutic regimen of anticysticercal drugs for parenchymal brain cysticercosis. J Neurol. 1990;237(2):6972. [ Links ]
20. Psarros TG, Coimbra C. Endoscopic third ventriculostomy for patients with hydrocephalus and fourth ventricular cysticercosis: a review of five cases. Minim Invasive Neurosurg. 2004;47(6):34649. [ Links ]
21. Psarros TG, Krumerman J, Coimbra C. Endoscopic management of supratentorial ventricular neurocysticercosis: case series and review of the literature. Minim Invasive Neurosurg. 2003;46(6):33134. [ Links ]
22. SpinaFranca A, Nobrega JP, Livramento JA, Machado LR. Administration of praziquantel in neurocysticercosis. Tropenmed Parasitol. 1982;33(1):14. [ Links ]
Correspondencia: Isidro Gonzales H
Dirección: Jirón Ancash 1271, Barrios Altos, Lima. Instituto Nacional de Ciencias Neurológicas - Unidad de Cisticercosis
Teléfono (511) 013288589 / 997521771
Correo electrónico: isidrogonzalesq@hotmail.com
Recibido: 08-11-10
Aprobado: 01-12-10