Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Medicina Experimental y Salud Publica
versão impressa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.28 n.2 Lima abr./jun. 2011
ARTÍCULO ORIGINAL
Estudio de actinomicetos marinos aislados de la costa central del Perú y su actividad antibacteriana frente a Staphylococcus aureus Meticilina Resistentes y Enterococcus faecalis Vancomicina Resistentes
Study of marine actinomycetes isolated from the central coast of Peru and their antibacterial activity against Methicillin-Resistant Staphylococcus aureus and Vancomycin-Resistant Enterococcus faecalis
Jorge León1,a,b, Juan José Aponte1,c, Rosario Rojas2,d,e, D´Lourdes Cuadra1,a, Nathaly Ayala1,f, Gloria Tomás3,g,h, Marco Guerrero4,g
1 Facultad de Ciencias Biológicas – Universidad Nacional Mayor de San Marcos. Lima, Perú.
2 Laboratorio de Investigación y Desarrollo. Unidad de Investigación en Productos Naturales, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Laboratorio de Investigaciones de Productos Naturales, Departamento de Química Orgánica, Universidad Nacional Mayor de San Marcos. Lima, Perú.
4 Laboratorio de Síntesis Orgánica, Departamento de Química Orgánica, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Microbiólogo; b Magíster en Ciencias Microbiológicas; c Bachiller en Microbiología; d Médico-Cirujano; e PhD en Química Médica y Farmacognosia; f Bachiller en Parasitología; g Químico; h Magíster en Química.
RESUMEN
Objetivos. Determinar el potencial antimicrobiano de actinomicetos marinos frente a cepas S. aureus meticilino-resistentes (MRSA) y E. faecalis vancomicina-resistentes (VRE). Materiales y métodos. En dos medios de cultivo se sembraron 29 cepas de actinomicetos aislados de sedimento marino. Se evaluó la capacidad inhibitoria mediante pruebas de antagonismo in vitro para MRSA y VRE. Se procesó los extractos orgánicos de tres actinomicetos seleccionados para determinar la Concentración Mínima Inhibitoria (CMI) del compuesto activo. Resultados. La mayoría de los actinomicetos aislados correspondieron a un grupo homogéneo de blanco-grisáceos (62%) con buen nivel de crecimiento en agar marino. Los porcentajes inhibitorios fueron superiores a 85% para ambos patógenos con halos de inhibición mayores a 69 y 78 mm de diámetro para MRSA y VRE respectivamente. Los extractos diclorometánicos de tres de los actinomicetos aislados (I-400A, B1-T61, M10-77) mostraron gran potencial inhibitorio de ambos patógenos, siendo M10-77 la cepa de actinomiceto de mayor actividad antibiótica frente a S. aureus ATCC 43300 resistente a meticilina y E. faecalis ATCC 51299 resistente a vancomicina con una Concentración Mínima Inhibitoria (CMI) de 7,9 y 31,7 μg/ mL respectivamente. El análisis filogenético de la cepa M10- 77 presenta un 99% de similaridad con la especie marina Streptomyces erythrogriseus. Conclusiones. El sedimento marino de la costa central del Perú es fuente promisorio de cepas de actinomicetos con gran capacidad de producir compuestos bioactivos capaces de inhibir patógenos tipificados como multidrogo-resistentes tales como S. aureus meticilino resistentes y E. faecalis vancomicina resistentes.
Palabras clave: Sedimentos marinos; Staphylococcus aureus; Enterococcus faecalis; Antibiosis; Perú (fuente: DeCS BIREME).
ABSTRACT
Objectives. To determine the antimicrobial potential of marine actinomycetes against drug-resistant pathogens represented by strains of methicillin-resistant Staphylococcus aureus (MRSA) and vancomycin-resistant Enterococcus faecalis (VRE). Materials and methods. Strains of actinomycetes (29) isolated from marine sediment were evaluated by their characteristics in two culture media and by testing their inhibitory capacity by in vitro antagonism against multi-drug resistant (MDR) pathogenic bacteria for MRSA and VRE. Organic extracts of 3 selected actinomicetes were processed to determine the minimum inhibitory concentration (MIC) of the active compound. Results. Most isolated actinomycetes belong to a homogeneous group of write-gray actinomycetes with a good growth in Marine Agar. The inhibitory rates of the isolates were above 85% for both pathogens with inhibition zones greater than 69 and 78 mm in diameter for MRSA and VRE respectively. Dichloromethane extracts of 3 isolates (I-400A, B1-T61, M10-77) showed strong inhibitory activity of both pathogens, M10-77 being the highest actinomycete strain with antibiotic activity against methicillin-resistant S. aureus ATCC 43300 and vancomycin-resistant E. faecalis ATCC 51299 with a minimum inhibitory concentrations (MIC) of 7.9 and 31.7 μg/ml respectively. Phylogenetic analysis of M10-77 strain showed 99% similarity with the marine species Streptomyces erythrogriseus. Conclusions. Marine sediments of the central coast of Peru, are a source of actinomycetes strains showing high capacity to produce bioactive compounds able to inhibit pathogens classified as multi-drugresistant such as methicillin-resistant S. aureus and vancomycin-resistant E. faecalis.
Key words: Marine sediments; Staphylococcus aureus; Enterococcus faecalis; Antibiosis; Peru (source: MeSH NLM).
INTRODUCCIÓN
Existe interés, tanto académico como industrial, por los microorganismos marinos, en parte por el creciente número de metabolitos secundarios únicos y biológicamente activos reportados a partir de bacterias marinas (1). Aunque el descubrimiento de fármacos naturales del mundo oceánico data desde 1970, en los últimos años las investigaciones se vieron incrementadas por la necesidad de desarrollar fármacos activos contra el número cada vez mayor de patógenos resistentes (2). Según la Organización Mundial de la Salud (OMS) (3), el exceso de prescripción y el uso indebido de antibióticos ha llevado a la resistencia de muchos agentes patógenos. Hoy en día, las nuevas cepas resistentes aparecen con mayor rapidez, mientras que la tasa de descubrimiento de nuevos antibióticos ha disminuido notoriamente.
Actualmente, muchos científicos se han centrado en programas de búsqueda de nuevos antimicrobianos, principalmente de origen actinomicetal, por su prolífica producción de antibióticos naturales (4). Se ha evidenciado que muchos de ellos son productores de metabolitos con actividad antimicrobiana, antiparasitaria, antiviral, antitumoral, citotóxica, etc; cuyas estructuras químicas son únicas (5).
Por otro lado, las bacterias multidrogo-resistentes (MDR) como S. aureus y Enterococcus constituyen un serio problema en ambientes hospitalarios, los cuales demandan nuevos antibióticos activos de amplio espectro (6). Las infecciones graves causadas por bacterias que se han vuelto resistentes a los antibióticos comúnmente utilizados se han convertido en un importante problema de salud a nivel mundial en el siglo XXI (7). S. aureus es un patógeno responsable de una amplia gama de infecciones como forúnculos, neumonía, osteomielitis, endocarditis, bacteriemia, etc. y ha desarrollado resistencia a la mayoría de los antibióticos convencionales (8). Por más de dos décadas se le controló con vancomicina; sin embargo, han emergido cepas resistentes a este antibiótico (9,10). El problema de resistencia antibiótica se complica aun más con la aparición de otras cepas Gram positivas y Gram negativas MDR. Esta multirresistencia incluye a los aminoglucósidos, macrólidos, fluoroquinolonas y a la primera, segunda y tercera generación de penicilinas y cefalosporinas.
Las infecciones por Enterococcus son causadas en su mayoría por la especie E. faecalis vancomicina resistentes (VRE), aunque en los últimos años E. faecium también ha surgido como un importante patógeno nosocomial no solo resistente a ampicilina/amoxicilina como E. faecalis sino también mucho más resistente a la vancomicina (11). En los últimos años nuevos agentes terapéuticos han entrado en el área clínica, desafortunadamente con ciertos efectos secundarios (12,13). Este grave problema de salud pública obliga a desarrollar nuevos antimicrobianos con mayor eficacia, pero de menor impacto negativo al organismo así como al medio ambiente (14,15). Los sedimentos marinos como fuente de actinomicetos bioactivos fue uno de los recursos menos explorados hasta hace poco, pero hoy en día constituye una de las fuentes mas promisorias (16). En el presente estudio se realiza una evaluación del efecto antimicrobiano de actinomicetos aislados de sedimento marino de la costa central del Perú sobre cepas de MRSA y VRE.
MATERIAL Y MÉTODOS.
CEPAS DE ACTINOMICETOS
Corresponden a aislamientos (n=29) obtenidos de sedimento marino colectados en la Bahía de Ancón (Lima) e Independencia (Ica) a profundidades de 34 y 100 m. Las muestras de sedimento fueron obtenidas por el método del dragado y procesadas en el laboratorio según se describe en un trabajo previo (17). En el presente estudio se describe las características culturales de estas cepas en dos medios de cultivo el agar marino y el agar Czapeck; mantenidas en estado de pureza en los mismos medios pero en estado semisólido y con adición de glicerina al 20% (v/v) a la temperatura de -20 °C.
CEPAS ESTANDAR
Se utilizaron como cepas testigo de la actividad antimicrobiana de los actinomicetos marinos al Staphylococcus aureus ATCC 43300 (meticilino-resistente); Enterococcus faecalis ATCC 51299 (vancomicina resistente); Enterococcus faecalis ATCC 29212 (vancomicina sensible) y Staphylococcus aureus MDR (cepa peruana) Estas cepas fueron proporcionadas por el Magíster Jesús Tamaríz de la Universidad Peruana Cayetano Heredia, Lima; fueron mantenidas en el laboratorio mediante subcultivos en el caldo BHI y caldo tripticasa soya y conservadas a -20 °C en ceparios en los mismos medios pero con adición de glicerina al 15% (v/v).
DETERMINACIÓN DE LA ACTIVIDAD ANTIBACTERIANA
Se realizó mediante el método de doble capa de Westerdahl et al., (1991) (18) modificado por León y García-Tello (1998) (19). Los actinomicetos fueron sembrados como macrocolonias en agar marino pH 7,6 e incubados a 28 °C por cinco a siete días. Para las pruebas de antagonismo, la cepa estándar de S. aureus meticilina resistente (MRSA), E. faecalis vancomicina resistente (VRE) y E. faecalis vancomicina sensible fueron previamente reactivadas en caldo tripticasa soya y luego ajustadas a 106 UFC/mL según la escala 0,5 de Mc Farland. Las pruebas de antagonismo se realizaron mediante la inoculación de cepas testigo en medio semisólido a modo de segunda capa sobre los cultivos de los actinomicetos marinos. Las placas en prueba fueron incubadas a 37 °C por 24 a 48 h, realizándose luego las lecturas correspondientes mediante la medida del diámetro de los halos de inhibición.
EXTRACCIÓN DEL COMPUESTO ACTIVO Y PRUEBAS DE SU ACTIVIDAD INHIBITORIA
Para la obtención de compuestos bioactivos se seleccionaron tres cepas de actinomicetos marinos (I-400A, B1- T61, M10-77). Los extractos se obtuvieron utilizando el solvente diclorometano según procedimientos descritos por Zheng et al., (2004) (20). El cultivo del actinomiceto para su fermentación se realizó en el caldo marino enriquecido con glucosa (0,5%) y almidón (1%) mantenido en constante agitación a 200 rpm a 28 °C durante diez días. El caldo se centrifugó a 4800 rpm por treinta minutos y el sobrenadante se filtró y se trató con diclorometano (v/v), agitado por treinta minutos y dejando reposar toda una noche a 8 °C. La fase orgánica fue separada y luego evaporada en un rotaevaporador hasta obtener un residuo seco. Para determinar la actividad del extracto, se pesó el residuo y luego fue resuspendido en Dimetilsulfóxido (DMSO) y probada su actividad inhibitoria frente a cultivos de S. aureus ATCC 43300 (MRSA) utilizando el método del pocillo (17). Se usó el DMSO como control negativo y la eritromicina (15 μg), estreptomicina (10 μg/ mL) y ciprofloxacina (5 μg) como controles positivos.
PRUEBA DE LA CONCENTRACIÓN MÍNIMA INHIBITORIA (CMI)
Para esta prueba se utilizó cultivos de S. aureus ATCC 43300 (MRSA) y E. faecalis ATCC 51299 (VRE) mantenidos en caldo tripticasa soya (TSB) a 37 °C de incubación. Se realizó siguiendo la metodología de pocillos en placas de microdilución según Peoples et al. (2008) (21). El extracto diclorometánico de las cepas (I-400A, B1- T61, M10-77) fue resuspendido en DMSO para preparar diluciones de 1:2. Se colocó en pocillos muestras (10 μL) de cada dilución, a los que se adicionó 80 μL de caldo tripticasa soya; luego de ser mezclados se agregó 10 μL de la suspensión bacteriana (0,5 de escala Mc Farland). El material se colocó en incubación a 37 °C durante 18 h. Transcurrido el tiempo se vertió 40 μL de una solución de cloruro de trifenil tetrazolio (TTC) en cada pocillo, para luego incubarlo a 37°C por 30 min adicionales. El viraje del medio a rojo indicó crecimiento microbiano.
SECUENCIAMIENTO DE ARNr 16S DE LA CEPA M10-77
El actinomiceto M10-77, cepa seleccionada por producir un antimicrobiano de amplio espectro, fue evaluado para su identificación filogenética a nivel de PCR. La amplificación del gen ARNr 16S se llevó a cabo usando Promega Taq y los primers universal 27F (5´-AGAGTTTGATCMTGGCTCAG- 3´) y 1492R (5´-GYTACCTTGTTACGACTT- 3´) por 30 ciclos. Los productos de PCR fueron sometidos a análisis BLAST por electroforesis en gel y las secuencias comparadas con la base de datos en el GenBank. El árbol filogenético fue elaborado usando los algoritmos de Neinghbour – Joining implementados en el programa ARB con porcentajes de similaridad > a 99%. El proceso se llevó a cabo en el Whitaker Lab – Departament of Microbiology, University of Illinois.
RESULTADOS
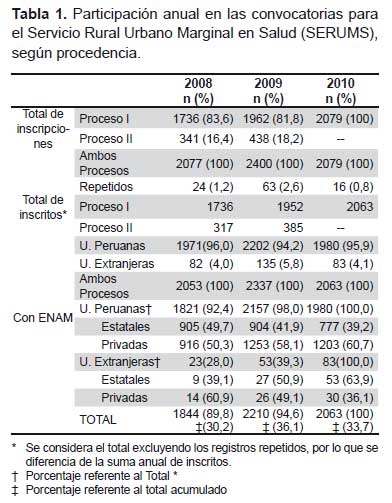
Los resultados de la caracterización de las 29 cepas de actinomicetos marinos evaluados en el presente estudio (aislados de sedimento marino) se indican en la Tabla 1. Para efectos de su cultivo en el laboratorio se evaluaron dos medios comparativos de crecimiento. Se observó ligero predomino de crecimiento en agar marino en comparación con el agar Czapeck. Este hecho ocurre generalmente a partir de los cinco a siete días de incubación hasta los 21 días. El tamaño de las colonias fue variable, desde pequeñas menores a 2 mm hasta colonias de 12 mm de diámetro. La mayoría (65%) formaron, inicialmente, colonias ligeramente húmedas y algo brillosas, pero con el transcurrir del tiempo se volvieron opacas y secas, adquiriendo una apariencia parecida al yeso. Este comportamiento hace referencia a los estados de conversión por los que pasan las hifas aéreas de los actinomicetos, hasta llegar a la formación de esporas (conidias). Se pudo observar una variedad de formas de colonia de actinomicetos siendo las más frecuentes las colonias circulares con borde liso y las colonias de bordes muy irregulares (festoneados, dactiliformes y dentados). Las colonias blanca-grisáceas pulverulentas y sin pigmentación en superficie (62%) predominaron sobre las demás variedades de colonias; sin embargo, la pigmentación al reverso de cada colonia fue variable entre el color marrón, amarillo y rojizo, especialmente observadas en el agar Czapeck.
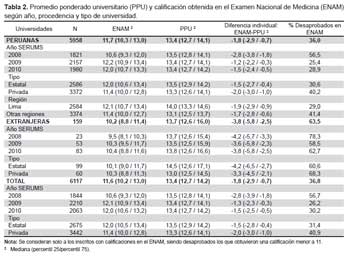
La actividad inhibitoria de las cepas de actinomicetos frente a los patógenos MDR se observa en la Tabla 2. Tal como se puede apreciar el tamaño de los halos de inhibición variaron desde 11 hasta 77 mm de diámetro, siendo, entre otras, las cepas M10-77, I-400A y B1-T61 las más efectivas con 92; 85,7% y 85,2% de inhibición, respectivamente, frente a S. aureus ATCC 43300 (meticilino resistente) (Figura 1). Asimismo, se puede apreciar la capacidad inhibitoria de los actinomicetos marinos contra otros patógenos como S. aureus MDR (cepa peruana), E. faecalis ATCC 51299 (vancomicina resistente) y E. faecalis ATCC 29212 (vancomicina sensible). Se destaca el porcentaje de inhibición de las cepas I-434A y I-434B (85,9 y 84,6% respectivamente) frente S. aureus MDR cepa peruana (un patógeno aislado de aspirado de catéter y declarado multidrogo-resistente con resistencia a ocho drogas de un total de diez de uso convencional) (17); así como la cepa M11-121 con porcentaje de inhibición mayor a 88% frente a ambas cepas estándar de E. faecalis.
El uso de solventes orgánicos para la obtención de principios activos a partir de cultivos es de aplicación frecuente en procesos microbianos. En este estudio, a partir de cultivos en agitación de las cepas elegidas (M10-77, I-400A y B1-T61) se ha logrado recoger extractos crudos utilizando el diclorometano, los cuales mostraron considerable actividad inhibitoria contra S. aureus ATCC 43300 (meticilino-resistente) (Tabla 3). El extracto crudo obtenido a partir del actinomiceto cepa M10-77 fue inicialmente probado contra este patógeno mediante el método de pocillos, cuyos primeros resultados se observan en la Figura 2. En ella, es muy notoria la actividad inhibitoria del extracto crudo a diferentes concentraciones, superando inclusive a antibióticos testigo como eritromicina (15 μg) y estreptomicina (10 μg/mL) (Figura 2 y Tabla 4). Asimismo, utilizando el método de pocillo los extractos de los actinomicetos seleccionados que fueron sometidos a pruebas comparativas mostró nuevamente a la cepa M10-77 con el mayor halo de actividad inhibitorio frente a la cepa estándar de S. aureus ATCC 43300, generando un halo de inhibición de hasta 40 mm (equivalente a 87,5% de inhibición) en comparación con el control positivo ciprofloxacina (5 μg) que alcanzó producir un halo de 35 mm de diámetro (88,5% de inhibición) (Tabla 3).
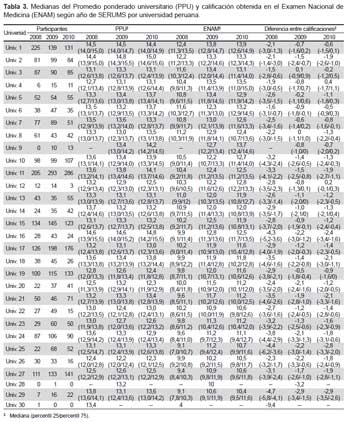
Las pruebas de la Concentración Mínima Inhibitoria (CMI) (método de microdilución) de los extractos dicloro- metánicos obtenidos a partir de los tres actinomicetos con mayor rendimiento antimicrobiano muestran resultados prometedores (Tabla 5). Fue el extracto obtenido de la cepa M10-77 la que brindó mayor rendimiento antimicrobiano, cuyo valor fue calculado en 7,9 y 31,7 μg/mL frente a S. aureus ATCC 43300 (meticilino-resistente) y E. faecalis ATCC 51299 (vancomicina-resistente) respectivamente (Tabla 5, Figura 3). La actividad biológica expresada como la concentración mínima inhibitoria (CMI) de los extractos crudos hace referencia a la bioactividad frente a bacterias Gram positivas, en este caso patógeno multidrogo-resistentes. Los valores de las CMI de los tres actinomicetos evaluados en el presente estudio oscilan entre 7,9-125 μg/mL (Tabla 5).

El análisis filogenético de las cepas M10–77 y MC-300 (este último no descrito en el presente trabajo) indica que el actinomiceto marino M10-77 pertenece al grupo de actinobacterias marinas, con porcentaje de similaridad de 99% con la especie Streptomyces erythrogriseus (Figura 4).

DISCUSIÓN
En la actualidad, la multirresistencia antibiótica pone en peligro el tratamiento de un número creciente de enfermedades infecciosas. Gracias a la participación de actinomicetos productores de metabolitos bioactivos tipo antibiótico es posible contrarrestar a algunos de estos patógenos emergentes. Así tenemos que especies del género Streptomyces de origen marino son inconsiderada actinobacterias modelos en la producción de nuevos y promisorias moléculas antimicrobianas.
En el presente estudio se pudo observar una variedad morfológica de colonias de actinomicetos siendo las más frecuentes las circulares con borde liso y las colonias de bordes muy irregulares. Asimismo, las colonias blanco-grisáceas pulverulentas y sin pigmentación en superficie predominaron sobre las demás variedades de colonias; sin embargo, la pigmentación al reverso de cada colonia fue variable entre el color marrón, amarillo y rojizo. Estas características fueron también observadas por Magarvey et al., (2004) (22) para actinobacterias que fueron identificadas, en su mayoría, como miembros de la familia Streptomycetaceae y Micromonosporaceae. Asimismo, Ramesh & Mathivanan (2009) (23) señalaron que de un total de 208 actinomicetos aislados de una bahía, 115 presentaron colonias grisáceas, 79 blancas, 6 azuladas, 7 rosáceas y solo una anaranjada; de todos ellos, 183 (87,9%) fueron identificados como Streptomyces y 25 pertenecientes a otros géneros. Otros reportes señalan también a Streptomyces como el género predominante en ambientes marinos (24-26), aunque actinomicetos como Actinoplanes, Verrucosispora, Salinispora, Actinomadura, Thermomonospora, Kocuria, Dactylosporangium, Virgosporangium, entre otros también están presentes (17,22-29).
Estos datos resultan muy interesantes en el tratamiento de los MDR emergentes del mundo contemporáneo, especialmente patógenos frecuentes como S. aureus meticilino-resistentes (MRSA) y E. faecalis vancomicina resistentes (VRE). En el Perú, existe escasa literatura científica relacionada con el aislamiento y la actividad antimicrobiana de bacterias marinas. León et al. 2007 (30) reportaron el aislamiento, caracterización fenotípica y propiedades antimicrobianas frente a patógenos humanos de diez cepas marinas que incluyen a géneros como Vibrio, Pseudomonas, Flavobacterium y dos actinomicetos, todos aislados de invertebrados intermareales de la Bahía de Ancón. Otros reportes señalan la presencia considerable de actinomicetos (aislados de sedimento marino recolectados de diferentes profundidades de la costa central del Perú) con actividad antibacteriana y antifúngica frente a patógenos de origen clínico (17).
Los resultados del presente trabajo confirman el potencial bioactivo de cepas nativas de actinomicetos. Por otro lado, la presencia de MRSA está registrada en varios reportes, entre ellos los trabajos de Mendoza et al. (2003) (31). En otras latitudes, Sujatha et al., (2005) (32), describen el aislamiento y la caracterización de Streptomyces psammoticus cepa BT-480 productora de un antibiótico poliketide SBR-22 efectiva contra S. aureus meticilino-resistentes. Asimismo, Magarvey et al., (2004) (22) describen a 17 cepas de actinomicetos aislados de sedimento marino con diversas actividades biológicas, entre ellas inhibitorias de S. aureus meticilino - resistentes, Enterococcus vancomicina - resistentes, Cryptococcus neoformans y Candida albicans. Otros investigadores como Saadoun & Gharaibeh (2003) (33) aislaron 90 Streptomyces de sedimentos, de los cuales el 54% mostraron actividad antimicrobiana remarcable contra B. subtilis, S. aureus, E. coli, Klebsiella sp y Shigella sp; asimismo, Imada et al., (2007) (34) de 100 actinomicetos marinos, encontró que 59 presentaban actividad antibacteriana. En el caso particular del presente trabajo (Tabla 2), al menos 23 actinomicetos (89,6%) mostraron actividad inhibitoria contra los patógenos MDR en prueba.
Se considera que el rendimiento de los extractos puede variar dependiendo de la naturaleza química del metabolito y la polaridad del solvente utilizado, siendo el acetato de etilo el más recomendado en la literatura. Vimal et al., (2009) (35) caracterizaron una cepa de Nocardiopsis sp. VITSVK 5 (FJ973467) aislada de sedimento marino, cuya actividad fue considerada como un metabolito de amplio espectro antimicrobiano, determinando además que los extractos obtenidos con éter de petróleo mantenían buen rendimiento contra E. coli, Ps. aeruginosa, K. pneumoniae, E. faecalis, B. cereus, y S. aureus; en cambio los extractos de acetato de etilo mantenían mejor rendimiento frente a los hongos filamentosos como Aspergillus fumigatus, A. flavus y A. niger; mientras que los extractos clorofórmicos fueron muy efectivos contra las levaduras del género Candida. Trabajos similares al presente indican que es necesario probar varios solventes orgánicos y varias cepas indicadoras; así, Leiva et al., (2004) (36) utilizando cinco solventes diferentes obtuvo mejores resultados con etilmetilcetona que mostró un rendimiento muy activo contra Bacillus subtilis. Patrón de inhibición similar fue demostrado a partir de extractos de acetato de etilo de Streptomyces marino RM17 RM42 (37), Streptomyces aislados de la Bahía de Bengala (38) y Streptomyces marinos cepa Merv 1996 y Merv 7409 (39).
Los valores de las CMI de los tres actinomicetos evaluados en el presente estudio oscilan entre 7,9–125 μg/mL (Tabla 5), valores muy similares a otros actinomicetos estudiados en otras latitudes. El-Geny et al. (2008) (39) reportaron valores de CMI de Streptomyces marinos Merv 1996 frente a B. subtilis ATCC 6051, S. aureus ATCC 6538 y M. luteus en 3,6 μg/mL, 8 μg/mL y 2 μg/mL respectivamente. En cambio Manivasagan et al. (2009) (40) reporta valores entre 16-74 μg/mL para Streptomyces sp. PM-32 frente a varios patógenos bacterianos y fúngicos, que incluye a S. aureus, Shigella, E. coli, Aspergillus, Candida, entre otros. Asimismo, Gorajana et al. (2005) (41), reportan valores CMI entre 16 a > 128 μg/mL para Streptomyces chibaensis frente a cepas estándar de Bacillus, Staphylococcus, E. coli, Proteus y Pseudomonas. Sin embargo, Pandey et al. (2004) (42) señalan que la CMI no es una constante para un agente determinado ya que está influenciada por varios factores. Estos factores incluyen la naturaleza del organismo en prueba, el tamaño del inóculo, la composición del medio de cultivo, tiempo de incubación y otros.
Se conocen aproximadamente 23 000 metabolitos secundarios de origen microbiano, de ellos, 42% son producidos por actinobacterias, 42% por hongos y 16% por otras bacterias. De los aproximadamente 10 000 antibióticos conocidos, los streptomicetos son los principales productores de antibióticos, siendo el género Streptomyces productor de aproximadamente el 55% de los antibióticos conocidos a la fecha (43,44).
En los últimos años se han venido realizando estudios específicos de metabolitos producidos por actinomicetos marinos y otras fuentes contra patógenos humanos obteniendo resultados muy satisfactorios e incluso llegando a purificar e identificar nuevas estructuras de compuestos bioactivos, como las neocitreamicinas I y II y la laidlomicina purificadas a partir de cepas nuevas de Nocardia y Streptomyces respectivamente; las cuales resultaron ser muy activos frente a S. aureus meticilina- resistente y E. vancomicina-resistentes (21,38,45,46). La producción de estos metabolitos potentes generalmente se les atribuye a nuevos miembros de las llamadas actinobacterias, las cuales son consideradas como las más abundantes que geográficamente se encuentran en suelos y sedimentos marinos, ecosistemas poco explorados (47). Sin embargo, en la búsqueda y obtención de nuevas cepas se encuentran géneros particulares con potencialidades únicas, como es el caso del actinomiceto marino Salinispora sp. prolífico productor de compuestos antineoplásicos llamado salinosporamida (48). Análisis moleculares y morfológicos posteriores permitirán dilucidar la identidad final de otras cepas en estudio.
El presente trabajo representa un avance en las investigaciones de compuestos bioactivos producidos por actinomicetos de la costa peruana. Trabajos posteriores de purificación de los compuestos activos así como la evaluación de la capacidad sinergística de los componentes obtenidos con diferentes solventes esperan ser realizados para conocer el efecto bactericida real frente a los patógenos multidrogo-resistentes así como para determinar si se trata de algún compuesto estructuralmente nuevo. Williams (2009) (49) ha señalado que las bacterias marinas representan una fuente prioritaria para el descubrimiento de nuevas clases de compuestos terapéuticos que asegure para los próximos 100 años en la batalla contra los patógenos multidrogo-resistentes.
En conclusión, el sedimento marino de la costa central del Perú es fuente promisorio de numerosas cepas de actinomicetos con gran capacidad de producir compuestos bioactivos capaces de inhibir patógenos tipificados como multidrogo-resistentes tales como S. aureus meticilino resistentes y E. faecalis vancomicina resistentes. Esta capacidad inhibitoria solo es comparable a la acción de algunos antibióticos estándares y está ratificada en el presente trabajo por la determinación de bajas dosis de Concentración Mínima Inhibitoria.
AGRADECIMIENTOS
Al Magíster Jesús Tamariz (Universidad Peruana Cayetano Heredia) por la donación de las cepas MDR, al Dr. Hinsby Cadillo por su apoyo en el análisis filogenético y al Grupo de Estudios de Ecología Marina en la persona del Dr. Juan Tarazona por el apoyo brindado en la colecta de las muestras de sedimento marino.
Contribuciones de Autoría
JL participó en la concepción y diseño del trabajo, análisis de datos y encargado de preparar el manuscrito; JA, fue el encargado del aislamiento de las cepas, pruebas de CMI; RR participó en procesos de fermentación; DLC, participó en el aislamiento de actinomicetos y pruebas de antagonismo; NA, fue la encargada de pruebas en el laboratorio; GT y MG participaron en la obtención de extractos con solventes orgánicos.
Fuente de Financiamiento
Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos a través del Proyecto: Actinomicetos Marinos: producción y caracterización de metabolitos de interés biotecnológico (Código: 091001112).
Conflictos de Interés
Los autores manifiestan no tener conflictos de interés en la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Fenical W, Jensen PR. Strategies for the discovery of secondary metabolites from marine bacteria: Ecological perspectives. Ann Rev Microbiol. 1994;48:559-84. [ Links ]
2. Fenical W. New Pharmaceuticals from marine organisms. Trends Biotechnol. 1997;5(9):339-41. [ Links ]
3. WHO. Global Strategy for Containment of Antimicrobial Resistance. Geneva: WHO; 2001. [ Links ]
4. Oskay M, Tamer AU, Azeri C. Antibacterial activity of seme actinomicetes isolated from farming soils of Turkey. African J. Biotechnol. 2004;3(9):441-6. [ Links ]
5. Prashith Kekuda, Shobha KS, Onkarappa R. Fascinating diversity and potent biological activities of Actinomycete metabolites. J Pharmacy Res. 2010;3(2):250-6. [ Links ]
6. Doern GV, Pdaller MA, Erwin ME, Brueggemann AB, Jones RN. The prevalence of fluoroquinolone resistence among clinically significant respiratory tract isolates of Streptococcus pneumoniae in the United States and Canada – 1997 results from the Sentry Antimicrobial Surveillance Program. Diagn Microbiol Infect Dis. 1998;32(4):313-6. [ Links ]
7. Alanis AJ. Resistance to antibiotics: are we in the postantibiotic era? Arch Med Res. 2005;36:697-705. [ Links ]
8. Enright MC. The evolution of a resistant pathogen the case of MRSA. Curr Opin Pharmacol. 2003;3(5):474-9. [ Links ]
9. Bozdogan B, Esel D, Whitener C. Antibacterial susceptibility of a vancomycin resistant Staphylococcus aureus strain isolated at the Hershey Medical Center. J Antimicrob Chemother. 2003;52:864-8. [ Links ]
10. Chang S, Sievert DM, Hageman JC. Infection with vancomycin resistant Stahylococcus aureus containing the vanA resistance gene. N Engl J Med. 2003;348:1342-7. [ Links ]
11. Gould IM. The Epidemiology of antibiotic resistance. Int J Antimicrob Agents. 2008;32(1):S2-9. [ Links ]
12. Levy SB, Marshall B. Antibacterial resistance worldwide: causes, challenges and responses. Nat Med. 2004;10(12):S122-9. [ Links ]
13. Wenzel RP. The antibiotic pipeline-challeges, cost, and values. N Engl J Med. 2004;351:523-6. [ Links ]
14. Urban C, Segal-Mauer S, Rahal JJ. Considerations in control and treatment of nosocomial infections due to multidrug resistant Acinetobacter baumannii. Clin Infect Dis. 2003;36:1268-74. [ Links ]
15. Paterson DL, Ko WC, Von Gottberg A, Mohapatra S, Casellas JM, Goessens H, et. al. International prospective study of Klebsiella pneumoniae bacteremia: implications of extended spectrum beta-lactamase production in nosocomial infections. Ann Intern Med. 2004;140:26-32. [ Links ]
16. Fenical W, Jensen P. Developing a new resource for drug discovery: marine actinomycete bacteria. Nat Chem Biol. 2006;2(12):666-73. [ Links ]
17. León J, Liza L, Soto I, Cuadra DL, Patiño L, Zerpa R. Actinomycetes bioactivos de sedimento marino de la costa central del Perú. Rev Per Biol. 2007;14(2):259-70. [ Links ]
18. Westerdahl A, Olsson J, Kjelleberg S, Conway P. Isolation and characterization of turbot (Scophthalmus maximus) associated bacteria with inhibitory effects against Vibrio anguillarum. Appl. Environ. Microbiol. 1991;57(8):2223-8. [ Links ]
19. León J, García-Tello P. Cepas nativas del bacterioneuston marino y su actividad inhibitoria de bacterias ictiopatógenas. Rev Per Biol. 1998;5(1):47-64. [ Links ]
20. Zheng L, Lin W, Yan X, Chen H. A primary study on antimicrobial and cytotoxic activity of marine bacteria. Ying Yong Sheng Tai Xue Bao. 2004;15(9):1633-6 [ Links ]
21. Peoples A, Zhang Q, Millet W, Rothfeder MT, Pescatore BC, Madden AA, et al. Neocitreamicins I and II, Novel Antibiotics with Activity Against Methicillin Resistant Staphylococcus aureus and Vancomycin-Resistant Enterococci. J Antibiot (Tokyo). 2008;61(7):457-63. [ Links ]
22. Magarvey NA, Keller JM, Bernan V, Dworkin M, Sherman DH. Isolation and characterization of novel marine-derived actinomycete taxa rich in bioactive metabolites. Appl Environ Microbiol. 2004;70(12):7520-9. [ Links ]
23. Ramesh S, Mathivanan N. Screening of marine actinomicetes isolated from the Bay of Bengal, India for antimicrobial activity and industrial enzymes. World J. Microbiol Biotechnol. 2009;25:2103-11. [ Links ]
24. Kokare CR, Mahadik KR, Kadam SS, Chopade BA. Isolation of bioactive marine actinomycetes from sediments isolated from Goa and Maharashtra coastlines (west coast of India). Indian J Mar Sc. 2004;33:248-56. [ Links ]
25. Fiedler HP, Bruntner C, Bull AT, Ward AC, Goodfellow M, Potterat O, et al. Marine actinomicetes as a source of novel secondary metabolites. Antonie Van Leeuwenhoek. 2005;87:37-42. [ Links ]
26. Ramesh S, Jayaprakashvel M, Mathivanan N. Microbial status in seawater and coastal sediments during pre- and post-tsunami periods in the Bay of Bengal, India. Mar Ecol. 2006;27:198-203. [ Links ]
27. Jensen P, Dwight R, Fenical W. The distribution of actinomycetes in near-shore tropical marine sediments. Appl Envirom Microbial. 1991;57:1102-8. [ Links ]
28. Maldonado LA, Fragoso-Yañez D, Pérez-García A, Rosellón- Druker J, Quintana ET. Actinobacterial diversity from marine sediments collected in México. Antonie Van Leeuwenhoek. 2008;95:111-20. [ Links ]
29. Mincer TJ, Jensen PR, Kauffman CA, Fenical W. Wide spread and persistent populations of a major new marine actinomycete taxon in oceans sediments. Appl Environ Microbiol. 2002;68:5005-11. [ Links ]
30. León J, Liza L, Soto I, Torres M, Orosco A. Bacterias marinas productoras de compuestos antibacterianos aisladas a partir de invertebrados intermareales. Rev Peru Med Exp Salud Publica. 2010;27(2):215-21. [ Links ]
31. Mendoza CA, Velásquez R, Mercado L, Ballón J, Maguiña C. Susceptibilidad antimicrobiana de Staphylococcus aureus sensible, con sensibilidad BORDERLINE y resistentes a la meticilina. Rev Med Hered. 2003;14(4):181-5. [ Links ]
32. Sujatha P, Bapi Raju KV, Ramana T. Studies on a new marine streptomycete BT-408 producing polyketide antibiotic SBR-22 effective against methicillin resistant Staphylococcus aureus. Microbiol Res. 2005;160(2):119-26. [ Links ]
33. Saadoun I, Gharaibeh R. The Streptomyces flora of Badia región of Jordan and its potential as a source of antibiotics active against resistant bacteria. J Arid Environ. 2003;53: 65-71. [ Links ]
34. Imada C, Koseki N, Kamata M, Kobayashi T, Hamada- Sato N. Isolation and characterization of antibacterial substances produced by marine actinomycetes in the presence of seawater. Actinomycetologica. 2007;21:27-31. [ Links ]
35. Vimal V, Rajan BM, Kannabiran K. Antimicrobial activity of marine actinomycete, Nocardiopsis sp. VITSVK 5 (FJ973467). Asian J Med Sci. 2009;1(2):57-63. [ Links ]
36. Leiva S, Yañez M, Zaror L, Rodríguez H, García-Quintana H. Actividad antimicrobiana de Actinomycetales aislados desde ambientes acuáticos de sur de Chile. Rev. Med. Chile. 2004;132:151-9. [ Links ]
37. Remya M, Vijayakumar R. Isolation and characterization of marine antagonistic actinomycetes from west coast of India. Faceta universitatis Series. Medicine and biology. 2008;15(1):13-9. [ Links ]
38. Peela S, Kurada B, Terli R. Studies on antagonistic marine actinomycetes from the Bay Bengal. World J Microbiol Biotech. 2005;21:583-5. [ Links ]
39. El-Gendy MAA, Shaaban M, El-Bondkly AM, Shaaban KA. Bioactive benzopyrone derivatives from new recombinant fusant of marine Streptomyces. Appl Biochem Biotechnol. 2008;150:85-96. [ Links ]
40. Manivasagan p, Gnaman S, Sivakumar K, Thangaradjou T, Vijayalaksmi S, Balasubramanian T. Antimicrobial and cytotoxic activities of an actinobacteria (Streptomyces sp. PM-32) isolated from an offshore sediments of the Bay of Bengal in Tamilnadu. Adv Biol Research. 2009;3(5-6):31- 6. [ Links ]
41. Gorajana A, Kurada B, Peela S, Jangam P, Vinjamuri S, Poluri E, Zeeck A. 1-Hydroxy-1-norresistomycin, a new cytotoxic compound from a marine actinomycete, Streptomyces chibaensis AUBN1/7. J Antibiot. 2005;58(8):526-9. [ Links ]
42. Pandey B, Ghimire P, Agrawal VP. Studies on the antibacterial activity of actinomycetes isolated from the Khumbu region of Mt. Everest. Int Confer Great Himalayas. Kathmandu University, Canada. January. 2004. p. 12-5. [ Links ]
43. Lazzarini A, Cavaletti L, Toppo C, Marinelli F. Rare genera of Actinomycetes of potential producers of new antibiotics. Antonie van Leeuwenhoek. 2000;78:399-405. [ Links ]
44. Berdy J. Bioactive microbial metabolites. A personal view. J Antibiot. 2005;58(1):1-26. [ Links ]
45. Yoo JC, Kim JH, Ha JY, Park NS, Sohng JK, Lee JY, et. al. Production and biological activity of Laidlomycin, anti-MRSA/VRE antibiotic from Streptomyces sp. CS684. J Microbiol. 2007;45(1):6-10. [ Links ]
46. Fukumoto A, Kim YP, Matsumoto A, Takahashi Y, Shiomi K, Tomoda H, Omura S. Cyslabdan, a new potentiator of imipenem activity against Methicillin-resistant Staphylococcus aureus, produced by Streptomyces sp. K04-0144. J Antibiot. 2008;61:1-6. [ Links ]
47. Ward AC, Bora N. Diversity and biogeography of marine actinobacteria. Curr Opin Microbial. 2006;9:1-8. [ Links ]
48. Jensen PR, Williams PG, Oh DC, Zeigler L, Fenical W. Species-specific secondary metabolite production in marine actinomycetes of the genus Salinispora. Appl Exper Microbiol. 2006;73(4):1146-52. [ Links ]
49. Williams, PG. Panning for chemical gold: marine bacteria as a source of new therapeutics. Trends Biotechnol. 2009;27:45-52. [ Links ]
Correspondencia: Jorge León Quispe.
Dirección: Ciudad Universitaria, Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Biológicas, Av. Venezuela s/n, Lima 1, Perú.
Correo electrónico: jorgeleonq@yahoo.com
Recibido: 12-01-11
Aprobado: 04-05-11