Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.28 no.3 Lima July/set. 2011
ARTÍCULO ORIGINAL
Estandarización de la técnica de Western blot para el diagnóstico de la fasciolosis humana utilizando antígenos de excreción-secreción de Fasciola hepática
Western blot technique standardization of the diagnosis of human fasciolosis using Fasciola hepatica excreted-secreted antigens
Hermes Escalante1,a, Kelly Davelois2,b, Pedro Ortiz3,c, Hans Rodríguez1,b, Enrique Díaz2,a, César Jara1
1 Facultad de Ciencias Biológicas, Universidad Nacional de Trujillo. La Libertad, Perú.
2 Laboratorio de Investigación y Desarrollo, Centro de Análisis e Investigación ESCALABS S.A.C. La Libertad, Perú.
3 Facultad de Ciencias Veterinarias. Universidad Nacional de Cajamarca. Cajamarca, Perú.
a Magíster en Parasitología
b Biólogo Microbiólogo
c Doctor en Inmunología
d Doctor en Ciencias Biológicas
RESUMEN
Objetivos. Evaluar la eficacia de la técnica de electroinmunotransferencia (EITB) o Western blot utilizando antígenos de excreción-secreción de las formas adultas de Fasciola hepatica (Fh E/S Ag) para el diagnóstico de la fasciolosis humana. Materiales y métodos. Los antígenos fueron obtenidos a las 18 horas de incubación en medio Minimum Essential Eagle y preparados a la concentración proteica de 0,15 ug/uL; los cuales, al ser enfrentados con un pool de sueros de pacientes con fasciolosis confirmada por el hallazgo de huevos del parásito en las heces, se detectaron los antígenos de 10, 12, 17, 23, 27, 30, 36, 43, 66 y 136 KDa, con los cuales se desarrolló la técnica de Western blot. La sensibilidad se evaluó empleando sueros de 67 pacientes con fasciolosis, y la especificidad con sueros de 57 pacientes con otras parasitosis y diez sueros de personas no parasitadas. Resultados. De los 67 sueros, 64 reaccionaron con la banda de 23 KDa y 61 con la banda de 17KDa. Estas dos bandas no fueron detectadas por ninguno de los sueros de pacientes con otras parasitosis, ni de personas no parasitadas, siendo por ello consideradas como específicas y diagnósticas. Conclusiones. La sensibilidad de la prueba, utilizando las bandas de 17 y 23 KDa, fue de 95,5 % cuando se presenta reacción positiva en una o en las dos bandas, siendo la especificidad para estos dos antígenos de 100 % con un valor predictivo positivo de 100 % y un valor predictivo negativo de 95,71 %.
Palabras clave: Fasciola hepatica; Fascioliasis; Western blot; Sensibilidad y especificidad (fuente: DeCS BIREME).
ABSTRACT
Objectives. To evaluate the performance of the enzyme-linked immunoelectrotransfer blot assay (EITB, Western blot) using excretory/secretory antigens from adult forms of Fasciola hepatica (Fh E/S Ag) for the diagnosis of human fasciolosis. Materials and methods. Antigens were obtained after 18 hours of incubation in culture medium Minimum Essential Eagle, prepared at a protein concentration of 0.15 ug/uL and run against a pool of sera of patients with proven fasciolosis (confirmed by the finding of parasite eggs in the stool microscopy). Antigens of 10, 12, 17, 23, 27, 30, 36, 43, 66 and 136 kDa were detected and used to develop the Western blot technique. The sensitivity was evaluated using sera from 67 fasciolosis patients, and the specificity using sera from 57 patients with other parasitic diseases, and 10 from healthy individuals. Results. Out of the 67 sera, 64 reacted with the 23 kDa band and 61 with the one of 17 kDa. These two bands were not detected in sera from patients with other parasitic diseases or in those from healthy volunteers and thus could be considered specific and diagnostic. Conclusions. The sensitivity of the test, using the bands of 17 and 23 kDa, was 95.5% for positive reactions to at least one of these two bands, being its specificity 100% with a positive predictive value of 100% and negative predictive value of 95.71%.
Key words: Fasciola hepatica; Fascioliasis; Blotting, Western; Sensibility and specificity (source: MeSH NLM).
INTRODUCCIÓN
La fasciolosis es una zoonosis parasitaria causada por Fasciola hepatica (F. hepatica), tremátodo que afecta a animales mamíferos herbívoros y, eventualmente, al hombre. En el Perú se han realizado estimaciones que permiten ubicarla como la segunda parasitosis en importancia desde el punto de vista veterinario, a causa de las grandes pérdidas productivas y económicas que provoca en el ganado, principalmente el ovino y bovino (1,2,3). Se le considera una de las tres más importantes zoonosis que afecta al hígado (4).
La fasciolosis fue considerada antiguamente como una enfermedad secundaria en el hombre; sin embargo, en los últimos años se ha convertido en una infección parasitaria de gran impacto en humanos (4). Se estima que existen entre 2,6 y 17 millones de personas y 51 países en el mundo parasitados por Fasciola hepatica (5). En la actualidad se le considera como la enfermedad parasitaria con la más amplia distribución latitudinal, longitudinal y altitudinal a nivel mundial (2); además, se ha encontrado que las más importantes regiones endémicas de fasciolosis humana están localizadas en América del Sur (1,6,7), habiéndose presentado un incremento en el número de casos humanos en el Perú (1,8), especialmente en los valles interandinos de Cajamarca, Junín, Cusco, Arequipa y Puno (9, 10).
La fasciolosis animal está ampliamente distribuida en 21 de los 23 departamentos del Perú, dato conocido por los informes de decomisos de vísceras parasitadas en los mataderos bajo inspección de Servicio Nacional de Sanidad Agraria (SENASA), ello afecta las principales zonas ganaderas con las mayores poblaciones de ganado vacuno como Ancash, La Libertad, Junín, Arequipa, Apurímac, Ancash, Puno y Cusco, se estima un impacto negativo en la producción animal no menor a los 50 millones de dólares americanos por año, lo que representa el 6,3 % de la producción ganadera de vacunos a nivel nacional, sin considerar las ovejas, los camélidos y las cabras, entre otros (11).
La fasciolosis humana tiene tres estadios clásicos: agudo, prepatente y crónico; la fase aguda o invasiva, que corresponde a la etapa migratoria del parásito en el parénquima hepático, puede durar entre cuatro a seis meses y se presenta clínicamente con fiebre, hepatomegalia y eosinofilia, estado en el cual no se encuentra huevos del parásito en la heces, y son en esta etapa las pruebas serológicas de gran ayuda en la detección de esta parasitosis (12). En la fase prepatente la F. hepatica aún no produce huevos, por lo tanto, la serología puede ser positiva aunque los exámenes coproparasitoscópicos sean negativos, a pesar de encontrarse el parásito en los conductos biliares (13). En la fase crónica, el parásito se encuentra en los conductos biliares, causando hiperplasia de las paredes, con marcada fibrosis hepática (13) y un extensivo daño causado por la secreción de enzimas parasitarias que destruyen el parénquima hepático (14); en esta etapa la serología y los exámenes de heces son positivos (15). En esta parasitosis el parásito elimina huevos a través de las heces del huésped, siendo un proceso intermitente, pudiendo la F. hepatica sobrevivir más de una década y causar daño de manera asintomática o con síntomas inespecíficos, sin tener el parasitado la necesidad de ser evaluado clínicamente; por ello, el inmunodiagnóstico es el método de elección para el diagnóstico de la fasciolosis en la fase aguda, prepatente y crónica (15, 16,17).
La utilización de las técnicas inmunológicas para apoyar el diagnóstico clínico de la fasciolosis se justifica por la baja sensibilidad de los exámenes coproparasitoscópicos (18). El ensayo inmunoenzimático (ELISA) es una de las pruebas más usadas en la actualidad, siendo alta su sensibilidad y relativamente baja la especificidad, dependiendo fundamentalmente de la calidad de los antígenos empleados (18, 19). Los antígenos de excreción-secreción de las formas adultas de F. hepatica (Fh E/S Ag) son considerados potentes inductores de la respuesta inmune humoral, superando a los antígenos somáticos en el inmunodiagnóstico (20, 21); sin embargo, cuando estos antígenos se utilizan en la prueba de ELISA se han observado falsos positivos hasta en 30 % (22).
Las técnicas utilizadas en el Perú para apoyar el diagnóstico de la fasciolosis son la sedimentación rápida, el arco II y la prueba de Fas2-Elisa, cuya sensibilidad es mayor que las dos primeras, llegando a 92,4 % y una especificidad de 83,6 % (16,23). La baja especificidad de la Fas2-Elisa, que implica el hallazgo de un gran número de falsos negativos, podría superarse empleando la técnica de electroinmunotransferencia o Western blot cuya especificidad es alta, debido a que previamente permite seleccionar el componente antigénico específico de cada parásito, como se ha demostrado para otras parasitosis (24, 25).
Se ha comprobado la eficiencia de la técnica de Western blot como apoyo al diagnóstico clínico, pues es utilizada como prueba confirmatoria en el diagnóstico de algunas enfermedades, tales como en la detección del Virus de la Inmunodeficiencia Adquirida (VIH), la cisticercosis y la hidatidosis(24,25). El uso de esta técnica en el diagnóstico de la fasciolosis mejoraría las deficiencias de especificidad mostrada por la técnica de ELISA, permitiendo hacer un diagnóstico más seguro y temprano que resultaría en un tratamiento a tiempo, el cual reduciría el daño hepático; la implementación de un kit de diagnóstico permitiría ser utilizado en cualquier centro de salud aportando una mejora en el diagnóstico de la fasciolosis.
Al no contar en el Perú con una técnica más sensible y especifica que las técnicas utilizadas en la actualidad (16, 23), el presente estudio estuvo orientado a estandarizar la técnica de electroinmunotransferencia o Western blot utilizando antígenos de excreción-secreción de Fasciola hepatica, para identificar aquellos que son inmunológicamente relevantes y evaluar el valor diagnóstico de la técnica para la detección de anticuerpos en pacientes con fasciolosis.
MATERIALES Y MÉTODOS ANTÍGENOS DE EXCRECIÓN-SECRECIÓN DE Fasciola hepatica.
Se obtuvieron antígenos de excreción-secreción de F. hepática (Fh E/S Ag) mediante el cultivo in vitro, en medio mínimum essential eagle (MEM) Sigma, USA (26) de formas adultas móviles de F. hepatica extraídas de los conductos biliares de bovinos naturalmente infectados y sacrificados en el camal de El Porvenir de Trujillo, Perú.
En el Laboratorio de Investigación del Centro de Análisis e investigación Escalabs de la ciudad de Trujillo, se lavaron los parásitos con buffer fosfato sódico (PBS) pH 7,2, hasta eliminar todos los restos de sangre y bilis del hospedador, luego se incubaron a 37 ºC por treinta minutos, siendo nuevamente lavadas con el medio MEM hasta que estuvieron completamente limpias, pero con vida y en movimiento; finalmente, se colocaron cinco ejemplares de F. hepatica de similar tamaño en cinco mililitros de medio en placas de Petri o tubos de 10 mL de capacidad, para ser incubados a 37 ºC por 18 horas.
Transcurrido el tiempo, los parásitos fueron eliminados y los medios de cultivo que contenía los productos de E/S se colectaron para ser centrifugados a 3500 rpm a 4 ºC durante 10 min, el sobrenadante fue separado para ser dializado en agitación con PBS durante 24 horas a 4 ºC, los antígenos obtenidos se conservaron a -20 ºC. La concentración de proteínas presentes en el sobrenadante fue determinada por el método colorimétrico de Bradford (27).
SUEROS HUMANOS
Para la evaluación de la técnica se usaron 67 sueros positivos a fasciolosis, de los cuales 25 procedieron de pobladores de Cajamarca, con edades comprendidas entre 10 a 58 años; 32 sueros provinieron de niños de Ayacucho, con edades comprendidas entre 6 y 15 años y diez procedieron de niños de La Libertad, cuyas edades estaban comprendidas entre 7 y 12 años. Los primeros 25 sueros fueron proporcionados por el Dr. Pedro Ortiz, investigador de la Universidad Nacional de Cajamarca, quien obtuvo dicho material para desarrollar un trabajo de investigación, previo consentimiento informado; los siguientes 32 sueros fueron proporcionados por la bióloga Luzmila García, egresada de la Universidad San Cristóbal de Huamanga, quien obtuvo este material durante el desarrollo de su tesis de pregrado, los diez sueros restantes fueron proporcionados por biólogo Hans Rodríguez de la Universidad Nacional de Trujillo quien obtuvo dicho material durante el desarrollo de la tesis. Todos los sueros recibidos fueron alícuotas, las cuales fueron procesadas en forma anónima, numerados correlativamente para el desarrollo de la investigación. Los sueros pertenecieron a pacientes en fase crónica de la enfermedad por el hallazgo de huevos en las heces, cuyas muestras fueron procesadas por la técnica de sedimentación rápida (TSR) (23).
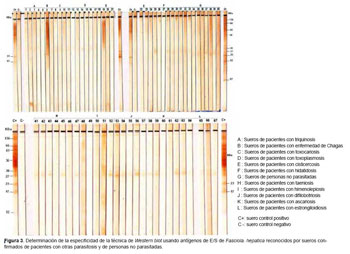
Los sueros de pacientes con otras parasitosis se obtuvieron de la Seroteca del Centro de Análisis e Investigación ESCALABS, en un total de 57 sueros, de los cuales, cinco pertenecen a pacientes con himenolepiosis, cinco con difilobotriosis y cinco con ascariosis, confirmados por el hallazgo de huevos de los parásitos en las heces; así como, cinco sueros de pacientes con estrongiloidiosis confirmados por hallazgos de larvas rabditoides en la heces. Los seis pacientes con cisticercosis fueron confirmados por la observación del parásito durante la cirugía o por resonancia nuclear magnética, siete pacientes con hidatidosis confirmados por radiografía, un paciente con la enfermedad de Chagas con serología positiva, siete pacientes con taeniosis fueron confirmados por hallazgo de huevos u obtención de proglótidos; además de seis sueros de pacientes con toxoplasmosis, cinco con triquinosis y cinco con toxocariosis que fueron donados por la Universidad de Chile. Los diez sueros de personas no parasitadas procedieron de la ciudad de Trujillo, zona no endémica de fasciolosis y negativos al examen coproparasitoscópico por la técnica de sedimentación. Los sueros se conservaron a -20 ºC en la Seroteca del Centro de Análisis e Investigación Escalabs en La Libertad, Perú durante el desarrollo de la investigación.
TÉCNICA DE WESTERN BLOT
El desarrollo de la técnica de Western blot se realizó de acuerdo a lo descrito en el manual de V. Tsang (28). Los antígenos obtenidos fueron tratados con 0,01M de Tris-HCl pH 8,0, 1 % de dodecil sulfato de sodio, 10 % de glicerol y 1 % de azul de bromofenol, para luego ser incubado a 65 ºC por veinte minutos. La concentración final del antígeno fue de 0,15 ug/uL.
En la electroforesis, las diferentes muestras fueron colocadas en los pocillos en una cantidad equivalente a 1 uL por mm de ancho de gel. Los corridos fueron hechos en minigeles de 8 x 7 x 0,05 cm a la concentración de 15 % y a 200V por 45 min. La transferencia de las proteínas del gel a la membrana de nitrocelulosa de 0,2 um se hizo usando un buffer de transferencia (0,2 M de Tris-HCl, 20 % de metanol y agua destilada) y se realizó a 2 A por 90 minutos. El mejor antígeno fue seleccionado para ser corrido en toda la superficie del minigel y luego cortado en tiras de 3 mm de ancho.
Cada uno de los sueros fue preparado a la dilución de 1/50 en PBS-Tween 20 y leche descremada en polvo a la dilución de 1/20, como bloqueador de las zonas del papel no ocupadas por antígenos; siendo incubadas en agitación constante a temperatura ambiente por una hora. Después de ser lavadas con PBS-Tween 20 se colocaron en solución de conjugado enzimático (anti IgG humana marcada con Peroxidasa – BIORAD, USA) a la dilución de 1/1000 por una hora, luego de cinco lavados, el revelado de los antígenos se realizó con un sustrato (H2O2 al 0,01 % y la diaminobenzidina a 0,5 mg/mL) por espacio de diez minutos, deteniendo la reacción con agua destilada por diez minutos.
RESULTADOS
Al evaluar la calidad inmunológica de diversos lotes de Fh E/S Ag con un pool de sueros de pacientes con fasciolosis confirmada se observó la presencia de diez bandas con los siguientes pesos moleculares: 10, 12, 17, 23, 27, 30, 36, 43, 66 y 136 KDa (Figura 1).
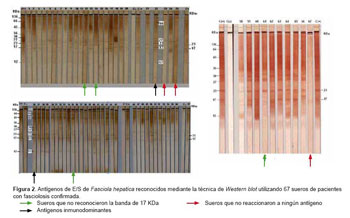
De los 67 sueros positivos a fasciolosis que fueron utilizados en forma individual para evaluar la sensibilidad de la técnica, tres no reconocieron ninguno de los antígenos (números 23, 25 y 67); los 64 sueros restantes reconocieron de cuatro a siete bandas, siendo los componentes antigénicos de 12, 17, 23, 27, 30, 43 y 66 KDa los inmunodominantes. También se encontró que los 64 sueros reaccionaron a la banda de 23 KDa y cuatro de ellos (números 12, 14, 35 y 62) no reconocieron a la banda de 17 KDa (Figura 2).
De los 57 sueros de pacientes confirmados con otras parasitosis y diez de personas no parasitadas que fueron utilizados para evaluar la especificidad de la técnica, ninguno reconoció las bandas de 17 y 23; sin embargo, los sueros reaccionaron indistintamente en forma cruzada con las bandas de 12, 27, 30, 43, 66 y 136 KDa que no son específicas (Figura 3).
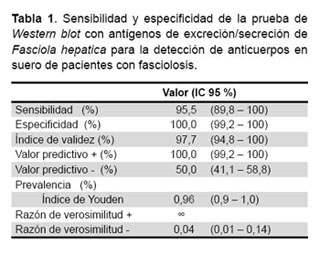
El cálculo de la sensibilidad y la especificidad de la técnica se basó en las dos bandas antigénicas específicas de 17 y 23 KDa, por lo tanto, la detección de anticuerpos por la técnica de Western blot en 64 de los 67 sueros de pacientes con fasciolosis confirmada le dan a la prueba una sensibilidad de 95,5 % (IC 95 %: 89,8-100 %), en la detección de una o las dos bandas de 17 y 23 KDa y la no respuesta a estas bandas una especificidad de 100 % (IC 95 %: 99,2-100 %). El valor predictivo positivo encontrado fue de 100 % (IC 95 %: 99,2-100 %), valor predictivo negativo 95,71 % (IC 95 %: 90,2-100 %), sin razón de verosimilitud positiva (RVP) y razón de verosimilitud negativa (RVN) de 0,04 (IC 95 %: 0,01-0,14) (Tabla 1).
Los resultados fueron procesados con el programa Epidat v3.1. Se calculó los valores de sensibilidad, especificidad, valor predictivo positivo y negativo y razón de verosimilitud positiva y negativa.
DISCUSIÓN
El uso de antígenos de excreción-secreción (E/S) en el diagnóstico de la fasciolosis es de notable importancia ,por ser los más específicos y ser los primeros en inducir la respuesta inmune (29). Se sabe que el parásito dentro del huésped sufre un recambio en su superficie tegumentaria, lo cual constituye un mecanismo de evasión a la respuesta inmunológica; igualmente, se ha encontrado en el tegumento del parásito unos gránulos secretorios que se transforman desde gránulos T0 presente en el parásito joven recién desenquistado a gránulos T1 y T2 característicos del parásito inmaduro y maduro respectivamente (30, 31). También se ha encontrado que estas estructuras poseen componentes antigénicos comunes que están muy relacionados con los antígenos de E/S y que en cada estadio el parásito libera al medio circundante, es decir, que hay una identidad existente entre los antígenos obtenidos in vitro y los excretados por el parásito in vivo (30). Los antígenos de E/S han sido considerados importantes inductores de la respuesta inmune humoral en la fasciolosis y, tanto su especificidad como su utilidad diagnóstica han sido demostradas en numerosos estudios de fasciolosis humana y animal (17, 20, 21, 32).
En investigaciones previas se han utilizado los antígenos de E/S en la técnica de Western blot para el diagnóstico de la fasciolosis, inicialmente animal y posteriormente humana (26, 32,33), habiéndose identificado bandas de variable peso molecular; tales como las de 14, 22, 27, 37 y 38 KDa en bovinos en Chile (29) y las de 17, 29 y 36 KDa en vacunos de Turquía (26), mientras que utilizando sueros de humanos encontraron las bandas de 9, 14, 27 y 65 KDa (21). Como se puede apreciar, varias bandas se repiten como la de 14 KDa, que en otros trabajos puede aparecer como la de 17 KDa (34).
De las seis bandas detectadas se han considerado para uso futuro en diagnóstico serológico las bandas de 17 y 23 KDa detectadas con sueros de humanos positivos a fasciolosis y no con los sueros de otras parasitosis; este resultado concuerda con lo encontrado por otros investigadores (29,34). En estudios realizados en ratas, se encontró que la banda de 23 KDa se detectaba en los sueros desde la primera semana de infección y se mantenía aún después de iniciada la ovoposición (20).
También se ha encontrado que aplicando la electroinmunotransferencia usando antígenos de E/S del parásito, detectaron dos polipéptidos antigénicos, uno de 17 KDa y otro de 63 kDa; sin embargo, este último presentó reactividad cruzada con otras parasitosis, sugiriendo que el antígeno de 17 KDa identificado con sueros de pacientes con más de un año de infección, es un excelente candidato para el diagnóstico de la fasciolosis aguda y crónica, y que pudiera ser específico para esta parasitosis (34).
En este trabajo se ha encontrado que la banda 23 KDa está presente en todos los sueros que dieron reacción serológica positiva, en otros trabajos reportan una banda de 24 KDa, que podría ser la misma, diferenciándose por la determinación de los pesos moleculares. Esta banda es producto de excreción-secreción, propia del tegumento del parásito que parece formar parte de las células tegumentales y gránulos tipo 1 y tipo 2 (T1 y T2) presentes en los estadios inmaduros y adultos del trematodo (30, 31), lo que indica que esta proteína es una de las más importantes en la respuesta inmune (15).
Las bandas comprendidas entre 27 al 136 KDa encontradas en el presente trabajo de investigación no son consideradas específicas por reaccionar con algunos sueros de hidatidosis, triquinosis y toxoplasmosis, pudiendo dar reacciones cruzadas debido a que poseen determinantes antigénicos compartidos como se ha demostrado en otros estudios donde los polipéptidos de 17 KDa y 23 a 28 KDa son específicos a F. hepatica a diferencia de los de mayor peso molecular, para los cuales se reporta reacción cruzada con sueros de animales infectados con Schistosoma mansoni y Trichinella spiralis (21,35).
En el presente trabajo se muestra que la técnica de Western blot utilizando antígenos de excreción-secreción de formas adultas de F. hepatica, tiene una sensibilidad similar al de la técnica de ELISA y Fas 2 –Elisa ensayadas en el Perú; sin embargo, presenta una mayor especificidad, lo que indica que la prueba de Western blot podría tener mayor utilidad para el diagnóstico específico de la fasciolosis humana.
La diferencia de especificidad reportada en otros trabajos (15,21,23) se debería a la calidad del antígeno utilizado, especialmente a la forma de su obtención.
El trabajo presentó varias limitaciones; una de ellas, la falta de serotecas en el Perú con sueros confirmados, otra es la confirmación de los sueros de pacientes con fasciolosis a través de la observación de huevos de F. hepatica en heces que es la prueba gold estándar, la cual solo puede detectar los casos en la fase crónica. Para determinar la especificidad, no se contó con sueros infectados con otros trematodos como Paragonimus, Schistosoma, Clonorchis, Opistorchis para evaluar la reacción cruzada con F. hepatica; sin embargo, solo sería de consideración Paragonimus que es coendémico en el Perú, aunque su prevalencia es muy baja.
La técnica de Western blot utilizando los antígenos de excreción-secreción de Fasciola hepatica cuenta con una sensibilidad de 95,5 % cuando se presenta reacción positiva en una o en las dos bandas diagnósticas de 17 y 23 KDa y una especificidad para estos dos antígenos de 100 %; con un valor predictivo positivo de 100 % y un valor predictivo negativo de 95,7 %. Esta técnica por su alta eficiencia podría ser aplicada como apoyo al diagnóstico de la fasciolosis en el Perú.
AGRADECIMIENTOS
A la Blga. Luzmila García por proporcionar los sueros de niños con fasciolosis utilizados en su tesis de pregrado. A Miguel Iglesias por su apoyo para la obtención de antígenos excreción-secreción.
Contribuciones de autoría
HE en la concepción y diseño del trabajo, análisis e interpretación de datos, revisión crítica de la primera y segunda versión del manuscrito, obtención de financiamiento y aprobación de su versión final. KD participó en el diseño de la investigación, procesamiento de la técnica, obtención de resultados, análisis e interpretación de datos y redacción de la primera y segunda versión del manuscrito, PO participó proporcionando parte del material de estudio, en la obtención de resultados, análisis e interpretación de datos, revisión crítica del manuscrito. HR y ED participaron en la recolección de muestras y en la realización de las pruebas y CJ participó en asesoría técnica y administrativa, en la recolección de datos y en la revisión crítica del manuscrito.
Fuentes de financiamiento
Autofinanciado.
Conflictos de interés
Los autores declaran no tener conflictos de interés en la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Marcos LA, Terashima A, Samalvides F, Miranda E, Tantaleán M, Espinoza J et al. Hiperendemicidad de Fasciolosis humana en el Valle del Mantaro, Perú: Factores de riesgo de la infección por Fasciola hepatica. Rev Gastroenterol Peru. 2004;24(2):158-64. [ Links ]
2. Mas-Coma MS, Esteban JG, Bargues MD. Epidemiologia de la fasciolasis humana: revisión y propuesta de nueva clasificación. Bull World Health Organ. 1999;77(4):340-6. [ Links ]
3. Mas-Coma S. Epidemiology of fascioliasis in human endemic areas. J Helminthol. 2005;79(3):207-16. [ Links ]
4. Marcos LA, Terashima A, Leguía G, Canales M, Espinoza JR, Gotuzzo E. La infección por Fasciola hepatica en el Perú: una enfermedad emergente. Rev Gastroenterol Perú. 2007;27(4):389-96. [ Links ]
5. Esteban JG, Bargues MD, Mas-Coma S. Geographical distribution, diagnosis and treatment of human fascioliasis: a review. Res Rev Parasitol. 1998;58:13-42. [ Links ]
6. Esteban JG, Flores A, Angeles R, Mas-Coma MS. High endemicity of human fasciolasis between Lake Titicaca and La Paz valley, Bolivia. Trans of the Royal Soc of Trop Med and Hyg. 1999;93:151-6. [ Links ]
7. Bjorland J, Bryan RT, Strauss W, Hillyer G, Mcauley J. An outbreak of Acute Fascioliasis Among Aymara Indians in the Bolivian altiplano. Clin Infect Dis. 1995;21(5):1228-33. [ Links ]
8. Marcos L, Maco V, Florencio L, Terashima A, Samalvides F, Miranda E, et al. Altas tasas de Prevalencia de Fasciolosis humana en el Perú: Una Enfermedad Emergente. Rev Per Enf Infec Trop. 2005b;3(2):8-13. [ Links ]
9. Esteban JG, Gónzalez C, Bargues MD, Angeles R, Sánchez C, Náquira C, et al. High fascioliasis infection in children linked to a man- made irrigation zone in Peru. Trop Med Int Health. 2002;7(4):339-48. [ Links ]
10. Mas-Coma S, Angeles R, Esteban JG, Bargues MD, Buchon P, Franken M, et al. The Northern Bolivian Altiplano: a region highly endemic for human fascioliasis. Trop Med Int Health. 1999;4:454-67. [ Links ]
11. Espinoza JR, Terashima A, Herrera-Velit P, Marcos LA. Fasciolosis humana y animal en el Perú: impacto en la economía de las zonas endémicas. Rev Peru Med Exp Salud Pública. 2010;27(4):604-12. [ Links ]
12. Li O , Leguía G, Espino A, Duménigo B, Díaz A, Otero O. Detección de anticuerpos y antígenos para el diagnóstico de Fasciola hepatica en alpacas naturalmente infectadas. Rev Inv Vet Perú. 2005;16(2):143-53. [ Links ]
13. Marcos LA, Yi P, Machicado A, Andrade R, Samalvides F, Sánchez J, et al. Hepatic fibrosis and Fasciola hepatica infection in cattle. J Helminthol. 2007;81(4):381-86. [ Links ]
14. Timoteo O, Maco V, Neyra V, Yi PJ, Leguía G, Espinoza JR. Characterization of the humoral immune response in alpacas (Lama pacos) experimentally infected with Fasciola hepatica against cysteine proteinases Fas1 and Fas2 and histopathological findings. Vet Immunol Immunopathol. 2005;106(1-2):77-86. [ Links ]
15. Cornejo H, Oblitas F, Cruzado S, Quispe W. Evaluación de una prueba de ELISA con antígeno metabólico de Fasciola hepatica para el diagnóstico de fasciolosis humana en Cajamarca, Perú. Rev Peru Med Exp Salud Publica. 2010;27(4):569-74. [ Links ]
16. Espinoza JR, Maco V, Marcos L, Sáez S, Neyra V, Terashima A, et al. Evaluation of Fas2-ELISA for the serological detection of Fasciola hepatica infection in humans. Am J Trop Med Hyg. 2007;76(5):977-82. [ Links ]
17. Rivera Marrero CA, Santiago N, Hillyer GV. Evaluation of immunodiagnostic antigens in the excretory-secretory products of Fasciola hepatica. J Parasitol. 1988;74(4):646-52. [ Links ]
18. Carnevale S, Rodríguez MI, Santillan G, Labbe JH, Cabrera MG, Bellegarde EJ, et al. Immunodiagnosis of human fascioliasis by ELISA and a micro-ELISA. Clin Diagn Lab Immunol. 2001;8:174-7. [ Links ]
19. Espino AM, Duménigo BE, Fernández R, Finlay CM. Immunodiagnosis of human fasciolosis by enzyme-linked immunosorbent assay using excretory-secretory products. Am J Trop Med Hyg. 1987;37:605-8. [ Links ]
20. Diaz A, Li-Elias O, Otero O, Garcia C, Espino AM. Identificación, mediante Western blot, de inmunógenos de F. hepatica, reconocidos por los sueros de ratas infectadas experimentalmente. Rev Cubana Med Trop. 1998;50:12-7. [ Links ]
21. Colmenares C, Méndez L, Díaz-Bello. Antígeno excreción- secreción de Fasciola hepatica: ultrafiltración y aplicación en inmunodiagnóstico. Acta bioquím Clín Latinoam. 2007;41(2):259-66. [ Links ]
22. Espino AM, Diaz A, Perez A, Finlay CM. Dynamics of antigenemia and coproantigens during a human Fasciola hepatica outbreak. J Clin Microb. 1998;36:2723-6. [ Links ]
23. Maco V, Marcos L, Terashima A, Samalvides F, Miranda E, Espinoza J, et al. Fas2-ELISA y la técnica de sedimentación rápida modificada por Lumbreras en el diagnóstico de la infección por Fasciola hepatica. Rev Med Hered. 2002;13(2):49-57. [ Links ]
24. Cruz O, Pérez MT, Lubián AL, Montano L, Silva E. Fluido oral y orina como muestras alternativas en el diagnóstico confirmatorio de la infección por VHI-1. Rev Cubana Med Trop. 2007;59(2). [ Links ]
25. Saavedra H, Gonzales, Alvarado M, Porras M, Vargas V, Cjuno RA, et al. Diagnóstico y manejo de la Neurocisticercosis en el Perú. Rev Peru Med Exp Salud Publica. 2010;27(4):586-91. [ Links ]
26. Sarimehmtoglu HO. Application of Western blotting for the immunodiagnosis of Fasciola hepatica in cattle using excretory/ secretory antigens. Turk J Vet Anim Sci. 2002;26:1061- 5. [ Links ]
27. Bradford M. A rapid sensitive method for the quantition of microgramo quantities of proteina utilizing the principle of protein-dye binding. Analyt Biochem. 1976;72:248-54. [ Links ]
28. Tsang V, Hancock K, Wilson M. Enzyme-linked immunoelectrotransfer Blot Technique (Western Blot) for Human T- Lymphotropic Virus Type III/Lymphadenopathy-Associated Virus (HTLV-III/LAV) Antibodies. Atlanta: U.S. Dept. of Health and Human Services, Public Health Service, Centers for Disease Control; 1986. [ Links ]
29. Espino A, Borges A, Duménigo B. Coproantígenos de Fasciola hepatica de posible utilidad en el diagnóstico de la fascioliasis. Rev Panam Salud Publica. 2000;7(4):225-31. [ Links ]
30. Miranda M, García Z. Aislamiento e identificación in situ de antígenos de Fasciola hepatica. Vet Mex. 1994;25(3):267- 71. [ Links ]
31. Knobloch J. Human fascioliasis in Cajamarca/Peru. II. Humoral antibody response and antigenemia. Trop Med Parasitol. 1985;36(2):91-3. [ Links ]
32. Gorman T, Sánchez R, Fredes, Alcaino H. Immunodiagnosis of bovine fasciolosis by ELISA and Western blot. Parasitol Día. 1998;22(1-2):12-5. [ Links ]
33. Silva M, Gorman T, Alcaíno H. Inmunodiagnóstico de fasciolosis humana y ovina empleando una fracción de 24-29 KDa de Fasciola hepatica obtenida mediante inmunoadsorción. Parasitol Latinoam. 2005;60:38-42. [ Links ]
34. Hillyer GV, Soler de Galanes M, Delgado Azañero E. Immune diagnosis of human fasciolosis in children from Cajamarca, Peru. Parasitol Día. 2001;25(3-4):21-5. [ Links ]
35. Fredes F, Alarcón J, Ilabaca P, Alcaíno H. Evaluación diagnóstica de dos proteínas purificadas de Fasciola hepatica mediante ELISA en fasciolosis ovina. Parasitol Latinoam. 2003;58:148-51. [ Links ]
Correspondencia: Hermes Mario Escalante Aorga
Dirección: Jr. Bolognesi N.o 334, Trujillo, Perú.
Teléfono: (051) 44-205937, (051) 44-203616
Correo electrónico: hermesmario@hotmail.com
Recibido: 24-01-11
Aprobado: 10-08-11