Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica v.29 n.1 Lima mar. 2012
ORIGINAL BREVE
Prueba molecular Genotype® MTBDRplus, una alternativa para la detección rápida de tuberculosis multidrogorresistente
Molecular test Genotype® MTBDRplus, an alternative to rapid detection of multidrug resistance tuberculosis
Luis Asencios1,a, Marco Galarza1,b, Neyda Quispe1,c, Lucy Vásquez1,c, Elena Leo1,c, Eddy Valencia1,c, Juan Ramírez1,c, Margoth Acurio1,c, Rosario Salazar1,c, Alberto Mendoza -Ticona2,d, Omar Cáceres3,b
1 Laboratorio de Referencia Nacional de Micobacterias, Instituto Nacional de Salud. Lima-Perú
2 Unidad de Análisis y Generación de Evidencias en Salud Pública, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima-Perú
3 Laboratorio de Biotecnología y Biología Molecular, Instituto Nacional de Salud. Lima-Perú
a Biólogo, magíster en Salud Pública; b biólogo, magíster en Bioquímica y Biología Molecular; c biólogo; d médico infectólogo
RESUMEN
La prueba molecular Genotype®MTBDRplus, es un método que permite identificar las mutaciones más frecuentes asociadas con la resistencia a las drogas antituberculosas de primera línea: isoniacida (INH) y rifampicina (RIF). El objetivo de este estudio fue evaluar el desempeño de la prueba molecular con cultivos y muestras de esputo con baciloscopía positiva. Se evaluó 95 cultivos y 100 esputos con perfiles de resistencia previamente determinados por el método de referencia proporciones agar en placa (APP). La prueba molecular a partir de cultivos mostró una sensibilidad de 100%; 97,5% y 96,9% para RIF, INH y multidrogorresistente (MDR) respectivamente; mientras que para esputo la sensibilidad fue de 95,7%; 96,8% y 95,2% para RIF, INH y MDR respectivamente. Se concluye que Genotype®MTBDRplus es una herramienta muy útil para la detección rápida de la resistencia a INH y RIF simultáneamente (MDR) en un máximo de 72 h a partir de esputo o de cultivo.
Palabras clave: Tuberculosis farmacorresistente; Técnicas de diagnóstico molecular; Mutación; Isoniacida; Rifampicina; Validez de las pruebas; Perú (fuente: DeCS BIREME).
ABSTRACT
The Genotype®MTBDRplus molecular test is a method that allows identification of the most frequent mutations associated with resistance to major first-line antituberculosis drugs, Isoniazid (INH) and Rifampicin (RFP). The aim of this study was to evaluate the performance of the molecular test with culture and smear- positive sputum samples. We evaluated 95 cultures and 100 sputum samples with resistance profiles previously determined by the reference method Agar Plate Proportions (APP). The molecular test from cultures showed a sensitivity of 100 %, 97,5 % and 96,97 % for RIF, INH and MDR respectively while from sputums the sensitivity was 95,65 %, 96,77 % and 95,24 % for RIF, INH and MDR respectively. We conclude that the molecular test Genotype®MTBDRplus is a very useful tool to detect resistance to isoniazid and rifampicin simultaneously (MDR-TB) in up to 72 hours from sputum samples or cultures.
Key words: Tuberculosis, multidrug-resistant; Molecular diagnostic techniques; Mutation; Isoniazid; Rifampin; Validity of tests; Peru (source: MeSH NLM).
INTRODUCCION
El Perú es el país con mayor número de personas afectadas de tuberculosis multidrogorresistente (TBMDR), es decir con resistencia simultánea a isoniacida (INH) y rifampicina (RIF), y uno de los veinte países con mayor severidad de la enfermedad en el mundo (1,2). Cada año se informan más de 1800 personas que ingresan al tratamiento de TB MDR, pero solo el 70% acceden a la prueba de sensibilidad, de ellos, el 80% son casos de TB MDR, por lo que se informa de aproximadamente 1500 personas como casos comprobados de TB-MDR por el Ministerio de Salud (MINSA).
El incremento de la resistencia de Mycobacterium tuberculosis pone en riesgo a la población de infectarse con cepas resistentes; por ello, es necesaria la detección rápida de TB-MDR a partir de muestras de esputo, utilizando métodos basados en biología molecular, los cuales han demostrado tener alta sensibilidad, especificidad y rapidez, pues reducen los tiempos en la obtención de los resultados. Generalmente, estos que la resistencia a RIF se debe a mutaciones presentes en la región core de 81 pb del gen que codifica a la subunidad β de la ARN polimerasa bacterial (rpoB). Se ha determinado que más del 95% de la resistencia a RIF está presente en esta región, tanto a nivel mundial como en Perú (3,4).
Por otro lado la resistencia a INH se debe a mutaciones presentes en tres genes principales de la bacteria: 1) katG, que codifica la enzima catalasa-peroxidasa, donde 50 a 95% de las mutaciones ocurren en el codón 315; generalmente la presencia de mutaciones es este gen es un indicador de alta resistencia a la droga. 2) La región promotora del gen inhA que codifica una NADH enoil ACP reductasa, donde la resistencia se presenta entre 20 a 35% y es un indicador de baja resistencia. Finalmente 3) La región intergénica oxyRahpC que codifica a la región regulatoria de la enzima alkylhidroperoxidasa y que está involucrada de 10 a 15% de la resistencia a la droga (3).
La prueba Genotype®MDRTBPlus utiliza tiras reactivas de nitrocelulosa (tecnología DNA Strip) (5) que contienen regiones parciales de los genes rpoB, katG e inhA fijadas sobre ella. La prueba está basada en un PCR multiplex que genera múltiples productos de amplificación (sondas) los cuales, mediante una hibridación reversa, reconocen las mutaciones génicas (en forma de bandas sobre la tira) más frecuentes asociadas con la resistencia a isoniacida y rifampicina. Esta prueba es novedosa, útil y rápida para la detección de la resistencia a drogas antituberculosas.
Una tira de Genotype®MTBDRplus contiene 27 bandas de reacción: 21 bandas que señalan las mutaciones (once bandas wild type (WT) es decir no presenta mutaciones y diez bandas de resistencia a antibióticos (MUT)) y seis bandas control (CC: control de conjugado, AC: control de amplificación, TUB: control de complejo M. tuberculosis y controles de amplificación para los locus (genes) rpoβ, katG e inhA). Las once bandas WT incluyen ocho bandas para el gen rpoβ, una banda WT para el gen katG y dos bandas WT para el gen inhA, mientras que las diez bandas MUT incluyen cuatro bandas con mutaciones para el gen rpoβ, dos bandas con mutaciones para el gen katG y cuatro bandas con mutaciones para el gen inhA (Figura 1) (6).
La presencia de una o más bandas MUT, la ausencia de una o más bandas WT o la combinación de ambas en cada zona de la droga, será señal de la existencia de cepas resistentes a una droga o a ambas.

El objetivo del presente estudio fue determinar el desempeño en laboratorio de la prueba molecular Genotype®MTBDRplus (Hain LifeScience, Nehren, Alemania) para la detección rápida de la resistencia a INH y RIF a partir de cultivos de M. tuberculosis y muestras de esputo baciloscopía positiva, siendo ambos tipos de muestra con resistencia conocida.
EL ESTUDIO
El presente trabajo es un estudio de tipo descriptivo y experimental en laboratorio, de la prueba molecular Genotype®MTBDRplus.
Se seleccionó aleatoriamente un total de 95 cultivos positivos con no menos de diez colonias, provenientes de pacientes nuevos con tuberculosis y pacientes antes tratados sin ninguna razón de proporcionalidad entre ellos. El criterio de selección fue que las muestras fueran previamente analizadas por la prueba de referencia proporciones agar en placa (APP) (7) para determinar la resistencia a INH y RIF, en el Laboratorio de Referencia Nacional de Micobacterias del Instituto Nacional de Salud, en el año 2010.
Adicionalmente, cien muestras aleatorias de esputo con baciloscopía positiva (mínimo una cruz) y resultado conocido de susceptibilidad antibiótica, evaluados previamente por APP, fueron también incluidas en el estudio. Estas muestras se descontaminaron siguiendo el método convencional con N-Acetil-L-cisteína y NaOH (8). Después de la descontaminación, los sedimentos concentrados fueron resuspendidos en 1,0 mL de buffer fosfato (pH 7,5) y almacenados a 4 °C hasta la extracción de ADN.
PRUEBA DE SUSCEPTIBILIDAD
Se realizó por el método de APP, prueba de referencia reconocido por la OMS para la determinación de susceptibilidad a drogas antituberculosas (7), usando concentraciones críticas de 0,2 μg/mL y 1,0 μg/mL para isoniacida y 1,0 μg/mL para rifampicina. A partir de aislamientos en medio sólido Lowenstein-Jensen (LJ), se realizó la siembra en caldo Middlebrook 7H9 y se incubaron a 37 °C por 7 días. Una parte del cultivo en medio líquido se separó y se ajustó la turbidez a escala Mc Farland 0,5. A partir de ella se prepararon diluciones (10–1 a 10-4) en solución salina-Tween 80, luego se sembraron en placas con medio Middlebrook 7H10 y se incubaron a 37 °C por 21 días. Las lecturas de las placas se realizaron con el conteo de colonias en la placa control frente a las placas conteniendo las drogas. Para la interpretación del resultado se consideró las proporciones críticas, si la proporción crítica fue mayor a 1%, se informó como resistente; y si fue menor al 1%, se informó como sensible.
EXTRACCIÓN DE ADN
De un aislamiento se extrajo una azada de colonias que luego se resuspendió en un tubo de 1,5 mL con tapa rosca conteniendo 300 μL agua destilada estéril. Para muestras clínicas, se utilizó 500 μL de esputo descontaminado. Se concentró las bacterias por centrifugación durante 5 minutos a 12000 rpm en una microcentrífuga (rotor con contención de aerosoles). Se desechó el sobrenadante y se resuspendió el sedimento en 200 μL agua estéril (cultivo puro) o 100 μL agua estéril (esputo) agitando con un vórtex. Se incubó la muestra durante 20 min a 100 °C en baño María y luego se incubó durante 15 min en un baño de ultrasonidos (sonicador). Finalmente, se centrifugó a 12 000 rpm por 5 min, luego se transfirió el sobrenadante (ADN) a un tubo de 1,5 mL nuevo y estéril y se almacenó a -20 °C hasta realizar la PCR.
GENOTYPE®MTBDRplus
Para la amplificación génica se utilizó 35 μL de mezcla de primers nucleótidos, 5 μL buffer 10X, 2 μL de MgCl2 25 mM, 0,2 μL de enzima Hot Start Taq ADN polimerasa 5 μL (Qiagen), 5 μL de ADN y agua grado molecular hasta completar un volumen final de 50 μL. Los tubos de PCR se colocaron en el termociclador (Applied Biosystems 9700) y se siguió el protocolo de amplificación: primera etapa, un ciclo de 15 min de desnaturalización a 95 °C, diez ciclos de desnaturalización a 95 °C durante 30 s y elongación a 58 °C durante 120 s. Segunda etapa: veinte ciclos de desnaturalización a 95 °C por 25 s, hibridación a 53 °C por 40 s y elongación a 70 °C por 40 s; finalmente, se realizó una extensión a 70 °C por 8 min. Cuando se procesó muestras de esputo se incrementó el número de ciclos de la segunda etapa a treinta ciclos. En cada corrida de PCR se consideró una muestra blanco (agua estéril) y una muestra control (M. tuberculosis H37Rv: cepa pansensible a drogas antituberculosas). El proceso de hibridación se realizó en un equipo semiautomatizado GTBlot 48 (Hain Lifesciences, Nehren, Alemania) donde se corrieron simultáneamente hasta 48 muestras. El programa se inició luego de mezclar previamente 20 μL del producto de amplificación más 20 μL de solución desnaturalizante en una bandeja (tray) de 48 posiciones y dejando incubar a temperatura ambiente por 5 min, automáticamente el equipo añade 1 mL de buffer de hibridación (HYB) precalentado en cada posición de muestra, se colocaron las tiras de nitrocelulosa y se incubó a 45 °C por 30 min. Luego, el equipo aspiró el exceso de HYB y añadió 1 mL de solución astringente (STR) a cada posición, se incubó las tiras a 45 °C por 15 min seguido de un lavado con 1 mL de solución de aclarado (RIN). Posteriormente, el equipo añade el conjugado de streptavidinafosfatasa alcalina diluido 1/100 y se incuba las tiras a temperatura ambiente por 30 min. La detección colorimétrica de los amplicones hibridados o sondas, ocurre luego de añadir el sustrato diluido y de incubar las tiras por 8 min. Las tiras fueron secadas y trasladadas en la bandeja y colocadas al equipo GenoScan (Hain Lifesciences, Nehren, Alemania) para su lectura a través del software BLOTRIX (Hain Lifesciences) que automáticamente lee las bandas de las tiras y determina si la muestra pertenece al complejo M. tuberculosis; además, simultáneamente determina si la muestra es sensible, monorresistente a una de las drogas o resistente a ambas drogas; sin embargo, el analista debe validar los resultados obtenidos por el software.
Para la evaluación estadística del sistema Genotype® MTBDRplus frente al método estándar, se utilizó el programa EPIDATv3.1; donde se calcularon los valores estadísticos necesarios para la evaluación del desempeño del método molecular.
HALLAZGOS
Del análisis de los cultivos por APP, se determinó que 40 (42,1%) cultivos fueron resistentes a INH y 35 (36,8%) fueron resistentes a RIF encontrándose además 33 (34,7%) cultivos MDR. Del mismo modo, al evaluar los esputos se encontró que 31 fueron resistentes a INH y 24 resistentes a RIF mientras que 21 fueron MDR.
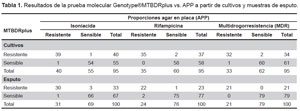
En el análisis de los cultivos con Genotype®MTBDRplus se encontró que 40 (42,1%) fueron resistentes a INH; 37 (38,9%) a RIF y 34 (35,8%) con patrón de resistencia a ambas drogas (MDR). Los esputos evaluados por el método molecular dieron como resultado 33 resistentes a INH, 23 a RIF y 21 MDR. En la Tabla 1 se muestran los resultados de susceptibilidad a INH y RIF obtenidos con el kit Genotype®MTBDRplus comparado con el método de APP, tanto para los cultivos como para esputo.
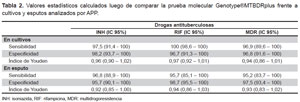
En la Tabla 2 se muestra el análisis de la comparación entre los cultivos y la prueba molecular donde la sensibilidad y especificidad para RIF fue de 100 y 97,5% respectivamente, mientras que para INH la sensibilidad y especificidad fue de 97,5 y 98,18% respectivamente; para el caso de muestras MDR, la sensibilidad y especificidad fueron muy similares, 96,97 y 96,77% respectivamente. Al analizar la prueba molecular frente a esputo se obtuvieron resultados similares a los cultivos (Tabla 2).
FRECUENCIA DE MUTACIONES DETECTADAS POR GENOTYPE®MTBDRPLUS
Las mutaciones más frecuentes en las muestras que presentaron resistencia se muestran en la Tabla 3. Con respecto a RIF, las mutaciones y la ausencia de las bandas WT más frecuentes fueron: rpoβ Mut3 con 56,4% (35/62), rpoβ Mut1 con 24,2% (15/62), ausencia de WT 7 con 6,4% (4/62) y ausencia de WT 8 con el 4,8% (3/62). Del mismo modo, para isoniacida las mutaciones y ausencia de WT más frecuentes fueron: katG Mut1 con 71,2% (52/73), katG Mut2 con 5,5% (4/73) y inhA Mut1 con 13,7% (10/73). Para esta misma droga se encontró cuatro muestras con mutación en ambos genes siendo la combinación katG Mut1 + inhA Mut1 la más frecuente con un 4,1% (3/73).

DISCUSIÓN
En el presente estudio, la prueba molecular Genotype®MTBDRplus diseñada para la detección de resistencia a isoniacida y rifampicina, fue comparada con el método de referencia de proporciones agar en placa. Se registró una elevada concordancia para cada una de las drogas así como para la condición MDR, tanto en cultivos como en muestras de esputo.
Los resultados de sensibilidad y especificidad obtenidos en este estudio, tanto para RIF, INH y para ambas drogas simultáneamente (MDR,) fueron comparables con los resultados obtenidos por otras investigaciones (5, 9-11) demostrando su utilidad para la detección rápida de la resistencia a drogas antituberculosas. Los valores del índice de Youden demuestran que la prueba molecular es muy eficiente para detectar la resistencia a las drogas antituberculosas, sobre todo cuando la muestra es esputo, siendo sus resultados muy confiables.
La elevada sensibilidad de la prueba molecular para detectar resistencia a rifampicina puede explicarse por el hecho de que las principales mutaciones de resistencia se encuentran en la región core de 81pb del gen rpoβ; en este estudio el 82,2% de todas las mutaciones encontradas se ubicaron en esa región, siendo las mutaciones Mut3 y Mut1(S531L y D516V respectivamente) las más frecuentes; sin embargo, existe un 14,4% de las muestras cuya resistencia se debe a la ausencia de las bandas WT (Tabla 4) lo que indicaría que otras mutaciones están presentes en estas muestras y que no se encuentran fijadas en la tira reactiva. Por ejemplo, la banda WT 7 señala las posiciones de los codones 526 a 529, dentro de esa región, la sonda de mutación Mut 2A detecta la mutación en el codón 526 (H526Y, histidina por tirosina) mientras que la sonda Mut2B detecta el cambio H526D (histidina por ácido aspártico), la ausencia de WT 7 y sus correspondientes sondas de mutación indican que la mutación se dio en posiciones de codones cercanos a la posición 526, es decir que se puede haber dado en las posiciones 527, 528 o 529. La variabilidad genética de las cepas podría ser el responsable de la existencia de estas mutaciones, por tanto, el secuenciamiento de ADN de esta región permitiría determinar qué mutaciones se encuentran presentes en este tipo de muestras.
Similar resultado se obtuvo al analizar las mutaciones que otorgan resistencia a isoniacida, donde la resistencia del 76,7% de las muestras se debe a la mutación en el gen katG (cambio en el codón S315T, serina por treonina) donde la mutación katG Mut1 es la más frecuente, lo que indica, además, que estas muestras presentan resistencia de alto nivel a la droga. El 13,7% de las cepas presenta resistencia de bajo nivel, siendo la mutación inhA Mut1 la más frecuente (15 C→T). Se ha observado que la ausencia de bandas WT en ambos genes así como muestras que presentaron mutaciones de alto y bajo nivel a la droga simultáneamente son poco frecuentes en este estudio.
Las mutaciones encontradas en las muestras de esputo analizadas son las mismas que se encontraron cuando se evaluaron los cultivos, lo cual confirma que katG Mut1, inhA Mut1 y rpoβ Mut3 son las mutaciones más prevalentes.
En la actualidad los métodos microbiológicos para determinar la resistencia a drogas antituberculosas demandan mucho tiempo. El método de APP demora 30 días a partir del cultivo para la obtención del resultado, mientras los métodos de BACTEC-460 y MODS (12,13) demoran entre 8 a 15 días respectivamente, desde la obtención de la muestra hasta la emisión de los resultados. Sin embargo, con la aparición de este método molecular este tiempo se ha acortado sustancialmente a un máximo de 72 horas. La aparición de otros métodos como el INNO-LiPA Rif.TB (14) y más recientemente el método de GeneXpert (15,16) han probado ser metodologías muy sensibles, específicas y rápidas para la detección de resistencia de M. tuberculosis a partir de esputo; sin embargo, ambos métodos solo detectan resistencia a RIF. Adicionalmente, en este estudio hemos visto que la monorresistencia a INH (42,1% por APP y genotype) es más prevalente que la monorresistencia a RIF por lo que los métodos moleculares mencionados anteriormente no podrían detectar este tipo de muestras.
Se debe señalar que la prueba Genotype®MTBDRplus requiere que la muestra de esputo sea frotis positivo para poder utilizarlo (6). Sin embargo, este requisito no sería problema pues todos los puestos de salud del MINSA realizan baciloscopías para diagnosticar la enfermedad, estando en la capacidad de enviar las muestras al laboratorio donde se realiza el método molecular.
Como se ha demostrado en este estudio, la prueba molecular tiene elevada concordancia frente al método de referencia, además de una gran rapidez (48 h desde la llegada de la muestra al laboratorio) detectando la resistencia a INH, RIF y a ambas drogas simultáneamente (TB-MDR) a partir de una muestra de esputo baciloscopía positiva. Sin embargo, una limitación del método molecular es que requiere de equipamiento y personal entrenado para la ejecución de la prueba, por lo que este tipo de metodologías deben ser realizadas en laboratorios con infraestructura adecuada, equipamiento y personal entrenado. Otra limitación es que se necesita una inversión alta para establecer la prueba Genotype®MTBDRplus en un laboratorio, pero el beneficio que se da a la población es valioso, puesto que la prueba molecular puede determinar la resistencia del bacilo a las drogas antituberculosas en un máximo de 72 horas a partir de esputo frotis positivo, y se puede procesar entre 12 a 48 muestras simultáneamente lo que constituye una herramienta muy útil en el diagnóstico y manejo de la tuberculosis.
Por otro lado, se deben realizar otras aproximaciones como estudios de costo-beneficio que complementen el desempeño de la prueba demostrada en este trabajo. Actualmente se está terminando de realizar un estudio de validación en campo, cuyos resultados serán publicados próximamente.
Finalmente, se concluye que Genotype®MTBDRplus tiene una alta sensibilidad y especificidad para la detección de resistencia a INH y RIF simultáneamente (TB-MDR) en muestras de esputo y cultivo provenientes de laboratorio y que puede constituirse en una herramienta alternativa para la detección rápida de la resistencia de estas drogas antituberculosas.
AGRADECIMIENTOS
Los autores agradecen por la realización de este trabajo de investigación: A la compañía Alemana Hain Lifescience por proveernos los insumos necesarios para este estudio. A los Drs. David Hain, Andreas Hillemann y a la Dra. Antje Beneke por su dedicación y orientación en la capacitación del personal en la metodología, al Blgo. Manuel Céspedes, al Dr. Pedro Valencia y al Dr. César Cabezas, por su apoyo en la realización del estudio.
Contribuciones de autoría
LA, AM y OC participaron en la concepción y diseño del trabajo; NQ y LV en la selección de las muestras y análisis de la prueba referencial APP; MG en la ejecución y análisis de la prueba molecular; EL, EV, JR, MA y RS en la ejecución de la prueba referencial APP; NQ, LV, LA y OC en la revisión crítica del manuscrito; OC y LA en la redacción del manuscrito e interpretación de los datos Todos los autores aprobaron la versión final del trabajo.
Fuentes de financiamiento
Este trabajo fue financiado por el programa de investigaciones del Instituto Nacional de Salud.
Conflictos de interés
Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. World Health Organization. Global Tuberculosis Control 2010: Annex 2 [Internet]. Ginebra: WHO; 2010 [citado el 11 de noviembre de 2011]. Disponible en: http://www.who.int/tb/publications/global_report/2010/gtbr10_a2.pdf
2. Comité de Tuberculosis Extremadamente Resistente. Análisis de la situación actual y propuesta de lineamientos técnicos para el control y prevención de la tuberculosis resistente en el Perú, 2008. Lima: TB XDR; 2008. [ Links ]
3. Telenti A, Honoré N, Bernasconi C, March J, Ortega A, Heym B, Takiff HE, Cole ST. Genotyping assessment of isoniazid and rifampin resistance in Mycobacterium tuberculosis: a blind study at reference laboratory level. J Clin Microbiol. 1997;35(3):719-23. [ Links ]
4. Agapito J, Neyra V, Castro J, Accinelli R, Rodríguez I, Espinoza JR. Caracterización de las mutaciones en el gen rpoβ Asociadas a la resistencia a rifampicina en pacientes con tuberculosis pulmonar. Rev Peru Med. Exp Salud Publica. 2002;19(3):117-23. [ Links ]
5. Hillemann D, Rusch-Gerdes S, Richter E. Evaluation of the GenoType MTBDRplus assay for rifampin and isoniazid susceptibility testing of Mycobacterium tuberculosis strains and clinical specimens. J Clin Microbiol. 2007;45(8):2635- 40. [ Links ]
6. Hain Lifescience [Internet]. Nehren, Germany: Hain Lifescience GmbH; 2010 [actualizada el 22 de agosto del 2009; citada el 12 julio del 2010]. GenoType® MTBDRplus; [aprox. 2 pantallas]. Disponible en: http://www.hainlifescience.de/en/products/microbiology/mycobacteria/genotype-mtbdrplus.html
7. Kent PT, Kubica GP (ed). Public health mycobacteriology. A guide for the level III laboratory. Atlanta, GA: U.S. Department of Health, Education, and Welfare, Centers for Disease Control and Prevention; 1995. [ Links ]
8. World Health Organization [Internet]. Geneva: WHO; c2012 [citada el 25 abril del 2011]. Laboratory services in TB control (Publication no. WHO/tb/98.258.). Disponible en: http://www.who.int/tb/publications/who_tb_98_258/en/
9. Lacoma A, Garcia-Sierra N, Prat C, Ruiz-Manzano J, Haba L, Rosés S, et al. GenoType MTBDRplus assay for molecular detection of rifampin and isoniazid resistance in Mycobacterium tuberculosis strains and clinical samples. J Clin Microbiol. 2008;46(11):3660-7. [ Links ]
10. Barnard M, Albert H, Coetzee G, OBrien R, Bosman ME. Rapid molecular screening for multidrug-resistant tuberculosis in a high-volume public health laboratory in South Africa. Am J Respir Crit Care Med. 2008 Apr 1;177(7):787-92. [ Links ]
11. Huang WL, Chi TL, Wu MH, Jou R. Performance assessment of the GenoType MTBDRsl test and DNA sequencing for detection of second-line and ethambutol drug resistance among patients infected with multidrugresistant Mycobacterium tuberculosis. J Clin Microbiol. 2011;49(7):2502-8. [ Links ]
12. Caviedes L, Lee TS, Gilman RH, Sheen P, Spellman E, Lee EH, et al. Rapid, efficient detection and drug susceptibility testing of Mycobacterium tuberculosis in sputum by microscopic observation of broth cultures. The Tuberculosis Working Group in Peru. J Clin Microbiol. 2000;38(3):1203-8. [ Links ]
13. Moore DA, Evans CA, Gilman RH, Caviedes L, Coronel J, Vivar A, et al. Microscopic-observation drugsusceptibility assay for the diagnosis of TB. N Engl J Med. 2006;355(15):1539-50. [ Links ]
14. Rossau R, Traore H, De Beenhouwer H, Mijs W, Jannes G, De Rijk P, et al. Evaluation of the INNO-LiPA Rif. TB assay, a reverse hybridization assay for the simultaneous detection of Mycobacterium tuberculosis complex and its resistance to rifampin. Antimicrob Agents Chemother. 1997;41(10):2093-8. [ Links ]
15. Boehme CC, Nabeta P, Hillemann D, Nicol MP, Shenai S, Krapp F, et. al. Rapid molecular detection of tuberculosis and rifampin resistance. N Engl J Med. 2010;363(11):1005- 15. [ Links ]
16. Helb D, Jones M, Story E, Boehme C, Wallace E, Ho K, et. al. Rapid detection of Mycobacterium tuberculosis and rifampin resistance by use of on-demand, near-patient technology. J Clin Microbiol. 2010;48(1):229-37. [ Links ]
Correspondencia: Omar Cáceres Rey
Dirección: Av. Defensores del Morro N.º 2268, Lima 9, Perú.
Teléfono: (511) 6176200 ext. 1424
Correo electrónico: ocaceres@ins.gob.pe, ocrey2002@yahoo.com
Recibido: 12-09-11
Aprobado: 25-01-12