Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.29 no.2 Lima June 2012
Variaciones en las actividades enzimáticas del veneno de la serpiente bothrops atrox jergón, de tres zonas geográficas del Perú
Variation of the enzymatic activity of bothrops atrox jergon snake venom from three geographic regions, Peru
César Ortiz1,a, Fanny Lazo1,b, Candy Bellido1,a, Edgar Gonzales1,a, Armando Yarlequé1,c
1 Laboratorio de Biología Molecular, Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima, Perú.
a Biólogo; b biólogo magíster en Biotecnología; c biólogo doctor en Ciencias Biológicas.
RESUMEN
Objetivos. Estudiar la variabilidad en la composición y actividades enzimáticas entre venenos de ejemplares adultos de Bothrops atrox. Materiales y métodos. Se emplearon venenos de serpientes adultas procedentes de Amazonas, Junín y Ucayali. A cada una de las muestras se les realizó el análisis del contenido proteico y del número de bandas por PAGESDS, así como las actividades de fosfolipasa A2, hemolítica indirecta, amidolítica, coagulante, hemorrágica y proteolítica sobre caseína y mediante zimograma; además, se hicieron ensayos de inmunodifusión y neutralización in vitro con el suero antibotrópico polivalente del Instituto Nacional de Salud de Perú. Resultados. Las actividades amidolítica, coagulante, hemorrágica, proteolítica mediante zimograma, fosfolipasa A2 y hemolítica indirecta fueron variables, evidenciándose en las tres últimas una mayor actividad en los venenos de Amazonas, mientras que en la cantidad de proteína, bandas electroforéticas y actividad proteolítica sobre caseína no se observaron diferencias. Con respecto a las pruebas de neutralización, 0,5 dosis del antiveneno fueron suficientes para neutralizar con eficacia (más del 50%) la actividad coagulante y fosfolipasa A2 de todas las muestras analizadas. Conclusiones. Algunas propiedades biológicas del veneno de ejemplares adultos de Bothrops atrox de Perú son variables, sin que ello afecte la neutralización in vitro por parte del suero antibotrópico polivalente sobre las actividades coagulante y fosfolipasa A2 del veneno.
Palabras clave: Venenos de serpiente; Bothrops; Enzimas; Antivenenos (Fuente: DeCS BIREME).
ABSTRACT
Objectives. To study the variability in the composition and enzymatic activity of venom from adult Bothrops atrox specimens. Materials and methods. We used venoms from adult snakes from Amazonas, Junín and Ucayali. Each of the venom samples underwent analysis for protein and number of bands by pagesds. Phospholipase A2, hemolytic, amidolytic, coagulant, hemorrhagic activity were analyzed, also and proteolytic activity on casein and by zymogram. Additionally, immunodiffusion and neutralization assays in vitro were done with a polyvalent botropic serum from the national institute of health of Peru. Results. The amidolytic, coagulant, hemorrhagic, proteolytic by zymogram, phospholipase A2, and indirect hemolytic activity were variable, demonstrating increased activity in the venoms from Amazonas, regarding proteolytic by zymogram, phospholipase A2, and indirect hemolytic activity. While the amount of protein electrophoretic bands and proteolytic activity on casein did not demonstrated differences. Regarding neutralization tests, a 0.5 dose of antivenom was sufficient to effectively neutralize (>50%) the coagulant activity and phospholipase A2 of all samples analyzed. Conclusions. Some biological properties of the venom from adult Bothrops atrox of Peru are variable, without interference with the in vitro neutralization by the polyvalent botropic serum on coagulant and phospholipase A2 properties of the venom.
Key words: Snake venoms; Bothrops; Enzymes; Antivenins (source: MeSH NLM).
INTRODUCCIÓN
El veneno de serpiente es una mezcla compleja de toxinas, principalmente proteicas, que cumplen las funciones de inmovilizar, matar, digerir a la presa y disuadir a los competidores y predadores (1). El contacto de estos animales con los humanos genera millones de accidentes anuales en el mundo, con una alta incidencia en África, Asia, Latinoamérica y Nueva Guinea (2).
En Latinoamérica, la mayoría de accidentes por mordeduras de serpientes son ocasionados por ejemplares del género Bothrops (1). En el Perú la especie más peligrosa es Bothrops atrox jergón, (Viperidae: Crotalinae), la cual está ampliamente distribuida en la Amazonía peruana y causa el 90% de los accidentes ofídicos (3).
Diversos estudios han demostrado que existe variabilidad intraespecífica en los efectos biológicos y bioquímicos del veneno de serpiente, dependiente de factores como la edad y la ubicación geográfica (4,5), lo cual ya ha sido investigado para venenos de B. atrox procedentes de otros países amazónicos (6-8). Además, se han realizado estudios regionales en Sudamérica sobre el proteoma de este veneno, encontrándose un nivel elevado de polimorfismo de las enzimas fosfolipasas A2 (9,10). Estas variaciones en las propiedades del veneno pueden traer como consecuencia diferentes sintomatologías en el envenenamiento generado por una misma serpiente o, en el peor de los casos, la ineficacia del antiveneno en neutralizar los efectos del envenenamiento. Debido a que el veneno de B. atrox está constituido principalmente de enzimas, que lideran el proceso de envenenamiento; los análisis de actividad enzimática y su comparación entre distintos ejemplares adultos son relevantes en la determinación de la existencia de variaciones en las propiedades biológicas del veneno.
Por ello, el objetivo del presente estudio fue realizar una evaluación de la variación del veneno en ejemplares adultos de B. atrox con respecto a las actividades enzimáticas y a algunas propiedades bioquímicas, para ello se empleó serpientes de distinta procedencia. Este estudio permitió determinar, además, la capacidad neutralizante in vitro del suero antibotrópico polivalente producido por el Instituto Nacional de Salud (INS) del Perú, sobre la toxicidad del veneno de B. atrox de diferentes regiones de nuestro país.
MATERIALES Y MÉTODOS
MATERIAL BIOLÓGICO
Se emplearon ocho lotes de veneno liofilizado de ejemplares adultos (> 75 cm) de Bothrops atrox procedentes de las regiones de Alto Marañón, departamento de Amazonas (muestras AM-1, AM-2 y AM-3), Pucallpa, departamento de Ucayali (muestras UY-1, UY-2 y UY3) y La Merced, departamento de Junín (muestras JN-1 y JN-2) extraídos de serpientes mantenidas en cautiverio en el Serpentario Oswaldo Meneses del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. Los venenos fueron extraídos por presión manual, centrifugados a 3000 rpm x 15 min para eliminar restos glandulares, luego fueron liofilizados y conservados a -4 °C hasta su uso. Para su empleo, los venenos fueron diluidos en buffer acetato de amonio 0,05 M pH 5, o en buffer fosfato salino (PBS) para las pruebas de actividad hemorrágica, coagulante y hemolítica.
Para los ensayos de neutralización se empleó el suero antibotrópico polivalente Lote: 00300078, en estado líquido producido por el Instituto Nacional de Salud de Lima (INS) en ampollas de 10 mL. Para la actividad hemorrágica se emplearon ratones albinos cepa Balb c (18-22 g) adquiridos en el bioterio del INS. Con respecto a las actividades coagulante y hemolítica, se emplearon plasma humano citratado y glóbulos rojos lavados (GRL), respectivamente obtenidos por centrifugación a partir de 10 mL de sangre venosa humana.
PROPIEDADES BIOQUÍMICAS Y ACTIVIDADES ENZIMÁTICAS
Cuantificación de proteínas. La cantidad de proteína de los venenos fue determinada empleando el método de Lowry (11) utilizando como proteína estándar, la albúmina sérica bovina. Para ello, se prepararon soluciones de veneno a 10 mg/mL a partir del cual se tomaron cantidades adecuadas considerando que la sensibilidad del método esta en un rango de 1 a 100 μg. Alternativamente, la concentración de las muestras fue determinada midiéndoles la absorbancia de luz ultravioleta a 280 nm (12).
Patrones electroforéticos. Para el análisis del contenido proteico se prepararon geles de poliacrilamida al 10% según el método de Laemmli (13). Esta metodología nos permitió un criterio homogéneo de comparación de distribución de bandas entre venenos de B. atrox de distinta procedencia, la cual ha sido empleada en estudios de variación de veneno para la misma serpiente (7, 8). Para ello, las muestras fueron preparadas bajo condiciones no reductoras y en condiciones reductoras con el agente 2β-mercaptoetanol. La corrida se realizó en una cámara vertical Mini-slab (Sigma Chemical Co.) con fuente de poder Duostat-Beckman durante una hora a 100V. Después de la corrida electroforética los geles fueron teñidos con solución de azul brillante de Coomassie R-250 al 0,05% por 15 min.
Actividad proteolítica. Se determinó por el método de Takahashi y Ohsaka (14), modificado por Loayza (15), para lo cual se empleó caseína al 1% en buffer Tris HCl 0,2 M pH 8,5 incubada con 0,1 mL de veneno a distintas concentraciones durante 10 min a 37 ºC, deteniéndose la reacción con ácido tricloroacético (TCA) 0,44 M. La actividad fue medida por la formación de productos ácido solubles a 280 nm. La actividad específica (U/mg) fue expresada como la cantidad de proteína capaz de liberar 1 μg de L-tirosina/min.
Adicionalmente, se analizó la variación entre los patrones proteolíticos de los venenos mediante la técnica de zimografía sobre gelatina. Se empleó la técnica de Antunes et al. (16). Para ello, se realizó una corrida electroforética mediante la técnica de PAGESDS incluyendo en la mezcla gelatina al 0,5% de concentración final. La corrida electroforética se realizó en una cámara vertical Mini-slab por una hora a 100V; posteriormente, se incubó el gel en Tritón X-100 al 2,5% por una hora a temperatura ambiente con agitación constante y en Tris-HCl 0,2 M CaCl2 5mM ZnCl2 0,01mM pH 8,5 a 37 °C por 22 horas. Luego se tiñó con azul brillante de Coomassie R-250 al 0,05%. Finalmente, se procedió al revelado de las bandas de digestión usando solución decolorante.
Actividad fosfolipasa A2 (PLA2). Se empleó el método de Vidal y Stoppani (17), para ello se preparó una solución lipoproteica de yema de huevo al 45% en buffer Tris HCl 10 mM CaCl2 10 mM pH 7,4. 1,5 mL de emulsión fueron incubados por 10 min a 37 °C con distintas concentraciones de cada veneno para luego medir el tiempo de retraso de coagulación de la solución a 100 °C. La actividad específica (U/mg) fue expresada como el tiempo de retardo de la coagulación de la yema por minuto por miligramo de veneno.
Actividad hemolítica indirecta. Se determinó por el método de Condrea et al. (18). Se preparó en tubos de ensayo una mezcla que contenía: 0,6 mL de buffer isotónico (glicina 0,1 M NaCL 0,9%), 0,1 mL de GRL, 0,1 mL de fosfolípidos de yema de huevo al 6,4%, 0,1 mL de CaCl2 100 mM y 0,1 mL de veneno a diferentes concentraciones. Se incubó a 37 ºC por dos horas y se detuvo la reacción con 5 mL de una solución de NaCl al 0,9% EDTA 0,5% a pH 7,3, para luego centrifugar a 1000 rpm por 5 min y leer su absorbancia a 540 nm. El grado de hemólisis total se expresó como el porcentaje de hemoglobina liberada de 0,1 mL de GRL hemolizados con 5,9 mL de agua destilada. Se procedió a la determinación de la dosis hemolítica media (DH50) la cual se define como la cantidad de veneno en μg que es capaz de lisar el 50% de los glóbulos rojos.
Actividad coagulante. Se siguió el método descrito por Copley (19), usando plasma humano citratado. Se preincubó 0,2 mL del plasma por 10 min a 37 ºC para luego agregar 0,1 mL del veneno e inmediatamente medir el tiempo en que coagula el plasma. Se calculó la dosis coagulante mínima (DCM) la cual está definida como la cantidad de muestra (μg) que produce un coágulo en un minuto.
Actividad amidolítica. Se empleó el método de Erlanger et al. (20) midiendo la capacidad de las serinoproteasas para hidrolizar el sustrato cromogénico Benzoil-Arginil-p-nitroanilida (BApNA). La mezcla de reacción contenía 1 mL de BAPNA 0,9 mM, 0,9 mL de buffer Tris-HCl 0,05 M pH 8,1 y 0,1 mL de veneno a distintas concentraciones. Luego de 15 min de incubación a 37 °C se adicionó 1 mL de ácido acético al 60% y la liberación de p-nitroanilina fue medida a 405 nm. La actividad específica (U/mg) se expresó en (μmol) de sustrato hidrolizado por minuto por miligramo de veneno.
Actividad hemorrágica. Se emplearon los lineamientos establecidos por Kondo et al. (21) y lo descrito por Isla et al. (22), para lo cual se inoculó vía intradérmica (i.d.) a ocho ratones por cada veneno. Los venenos fueron disueltos en un volumen de 100 μL de PBS pH 7,2, cada solución de veneno inoculado contenía 1,4 μg de veneno, lo cual corresponde a una dosis hemorrágica minima (DHM) según lo establecido por Segura et al. (23) para el veneno de B. atrox de Perú. Una DHM se define como la cantidad de veneno en μg que genera un diámetro hemorrágico de 10 mm luego de dos horas de la aplicación del veneno. Los animales fueron sacrificados por dislocación cervical y se les retiró la piel de la zona abdominal para observar por el lado interno y medir el diámetro y área hemorrágica.
INMUNODIFUSIÓN Y ENSAYOS DE NEUTRALIZACIÓN
Inmunodifusión. Fue realizada según el método descrito por Ouchterlony y Nilsson (24). La agarosa fue preparada con PBS pH 7,4. Se enfrentaron 50 μL de los venenos en estudio (5 mg/mL) con 50 μL del suero antibotrópico polivalente producido en el Instituto Nacional de Salud, empleando albúmina sérica bovina como control negativo.
Ensayos de neutralización in vitro. Se prepararon mezclas que contenían cantidades equivalentes a 0,5, 1 y 2 dosis neutralizantes de antiveneno con dosis retos de los venenos en estudio. Para ello se empleó como referencia la valoración de la etiqueta del antiveneno que indica que una dosis neutralizante corresponde a 10 mL del antiveneno contra 25 mg del veneno de B. atrox. Como dosis reto se empleó la cantidad de veneno correspondiente a 2 DCM y a 4 DH50 para las pruebas coagulante y hemolítica indirecta, respectivamente. Luego de 30 min de incubación de la mezcla a 37 °C se ensayaron por triplicado las actividades coagulante y hemolítica indirecta con respecto a una muestra control de veneno. Se consideró que el antiveneno fue eficaz si una dosis neutralizante logró reducir al menos el 50% de la actividad ensayada. La neutralización de la actividad hemolítica indirecta se realizó en placas de agar-agar con eritrocitos lavados al 3%, yema de huevo al 5% y CaCl2 10 mM. La incubación se realizó a temperatura ambiente y se hicieron mediciones de los halos a las 72 h (25).
RESULTADOS
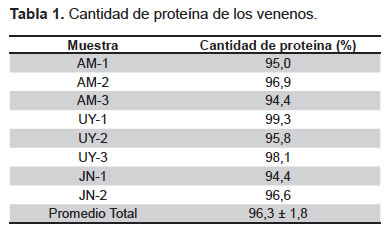
Cuantificación de proteínas. Los venenos estudiados presentaron, en todos los casos, un alto contenido proteico superando el 90% del peso total (Tabla 1).
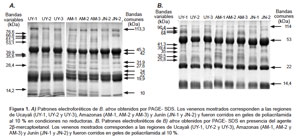
Patrones electroforéticos. Los patrones electroforéticos de B. atrox mostraron bandas de bajo, mediano y alto peso molecular en el rango de 10-114 kDa, la mayoría de las cuales se encontraron presentes en todas las muestras analizadas. En condiciones no reductoras se identificaron nueve bandas comunes, de las cuales las de 19,9, 22, y 45 kDa fueron las más representativas (Figura 1. A). Por otro lado, se encontraron ocho bandas variables en estas muestras. En condiciones reductoras se encontraron cuatro bandas comunes de peso molecular de 14,4; 22; 53 y 114 kDa, además de ocho bandas variables (Figura 1. B).
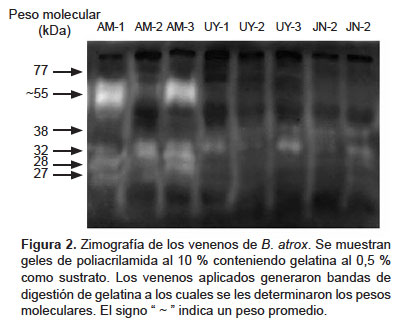
Actividad proteolítica. Esta prueba mostró similaridad entre los valores de actividad obtenidos, los cuales estuvieron en un rango de 50-61 U/mg (Tabla 2). Por su parte, la zimografía mostró mayor contenido de proteasas en las muestras de Amazonas, las cuales presentaron bandas de digestión de 27,5; 28,4; 32 y 55 kDa. Así mismo, todos los venenos presentaron una banda de digestión de 32 kDa y, a excepción de los venenos UY-1 y UY-2, presentaron también una banda de 38 kDa (Figura 2).
Actividad fosfolipasa A2. El método de retardo de coagulación de la yema de huevo evidenció una mayor actividad enzimática en los venenos procedentes de Amazonas (2,7 a 3,8 U/mg) seguidos por los de Ucayali (1,1 a 1,4 U/mg), mientras que los valores más bajos corresponden a las muestras de Junín (0,5 y 0,8 U/mg) (Tabla 2).
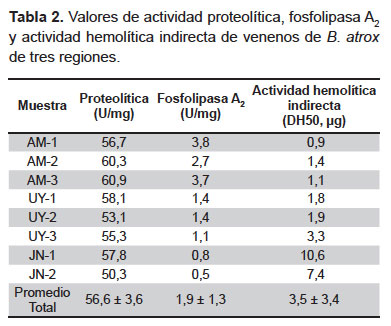
Actividad hemolítica indirecta. La prueba de actividad hemolítica indirecta coincide con lo obtenido con el método anterior, encontrándose un mayor grado de hemólisis en las muestras de Amazonas, cuyas DH50 estuvieron en un rango de 0,9 a 1,4 μg, en comparación con los venenos de Ucayali y Junín, las que estuvieron en un rango de 1,8 a 10,6 μg (Tabla 2).
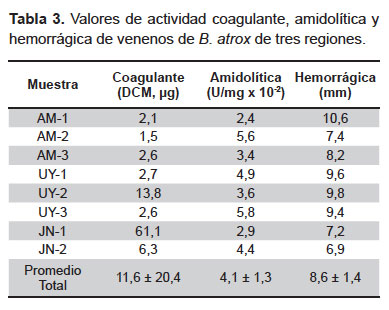
Actividad coagulante. Los DCM halladas resultaron ser muy variables y se encontraron en un rango de 1,6 a 61,1 μg obteniéndose los valores más altos en las muestras de Amazonas (2,1, 1,6 y 2,6 μg), UY-1 (2,7 μg) y UY-3 (2,7 μg) (Tabla 3).
Actividad amidolítica. El veneno de B. atrox mostró ser variable en su capacidad de escindir al sustrato BApNA estando sus valores de actividad en un rango de 2,4 x 10-2 a 5,8 x 10-2 U/mg (Tabla 3).
Actividad hemorrágica. Se observó la formación de halos de hemorragia en un rango de 6,9 a 10,6 mm (Tabla 3), correspondiendo los valores más bajos a las muestras de Junín (7,2 y 6,9 mm) y el valor más alto a la muestra AM-1 (10,6 mm).
Inmunodifusión. Todos los venenos analizados respondieron de igual manera al enfrentarse al suero antibotrópico polivalente, revelando dos bandas principales de precipitina y otras más tenues a los lados de estas.
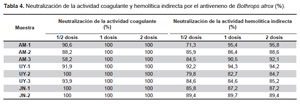
Neutralización in vitro. La actividad coagulante fue neutralizada en todos los casos al 100% con 1 y 2 dosis neutralizantes del suero antibotrópico polivalente, mientras que con la mitad de la dosis los valores de neutralización fueron variables pero superiores al 50% (Tabla 4).
Con respecto a la actividad hemolítica indirecta, los niveles de neutralización ejercidos por 0,5, 1 y 2 dosis neutralizantes fueron muy similares entre sí, variando en todos los casos entre 71 a 96% de neutralización (Tabla 4).
DISCUSIÓN
Los venenos de serpientes constituyen una mezcla compleja rica en proteínas con actividades farmacológicas y enzimáticas, cuyo objetivo principal es paralizar y digerir a la presa. La cantidad de proteína contenida en el veneno ha mostrado en ocasiones, ser variable lo que puede estar respondiendo a las necesidades de la serpiente. Los resultados del presente estudio indican que no existen diferencias en la cantidad de proteínas del veneno de ejemplares adultos de Bothrops atrox, incluso a pesar de haber empleado venenos de serpientes de distinta procedencia. Además, el porcentaje de contenido proteico resultó ser mayor al 90% (Tabla 1) lo que coincide con lo hallado por Málaga et al. (5) cuyos valores en ejemplares adultos de B. atrox de Perú fue 93,0% evidenciado, además, que según la serpiente alcanza mayor edad, la cantidad de proteína en el veneno aumenta. Sin embargo, López-Lozano et al. (26) y Murillo y Prada (27), mostraron que la cantidad de proteína en el veneno de esta serpiente no varía significativamente con la edad. Todo indicaría que existen otros factores adicionales a la edad y a la procedencia, que estarían influyendo en esta característica.
Los patrones electroforéticos por PAGE-SDS de venenos de B. atrox adultos han permitido detectar ciertas bandas variantes ninguna de las cuales parece estar compartida entre venenos de serpientes de la misma procedencia, por lo que su aparición podría estar relacionada con factores adicionales como la alimentación(6) o condiciones de cautiverio. Nuestros resultados indican además, dos conjuntos de bandas principales de 19, 9-22 kDa y 45 kDa en muestras bajo condiciones no reductoras (Figura 1A), y de 22 y 53 kDa en muestras en condiciones reductoras (Figura 1B), lo cual coincide con lo encontrado por otros autores (7, 8, 26). Al respecto, estudios proteómicos de este veneno indican la existencia de toxinas de 23 y 50 kDa, las cuales pertenecen a la familia de las metaloproteasas de tipo P-I y P-III, respectivamente (9,28). También se ha podido observar bandas de 113,3 y 114 kDa en muestras no reducidas y reducidas, respectivamente, lo que coincide con Nuñez et al. (9) quienes encontraron metaloproteasas de tipo P-III con pesos similares. Sin embargo, estas bandas también podrían corresponder a la hialuronidasa, recientemente purificada en nuestro laboratorio (29).
En relación con la actividad proteolítica, los valores hallados mediante el ensayo de digestión de la caseína indican similaridad en la actividad enzimática de todos los venenos a pesar que la zimografía evidenció que la actividad de los venenos se debe a proteasas de distintos pesos moleculares. En particular, las muestras de Amazonas poseen proteasas de alto peso molecular (alrededor de 55 kDa) que no se evidenciaron en las muestras de Ucayali y Junín (Figura 2). También se observaron otras bandas de digestión donde solo la de 32 kDa es común a todos los venenos. Este contenido variable de proteasas podría corresponder a las distintas estrategias de alimentación o supervivencia que presentan los vipéridos cuyos venenos son una fuente rica en metaloproteasas y serinoproteasas (30). Al respecto, se ha establecido la existencia de diferentes isoformas de una metaloproteasa tipo PI en diferentes poblaciones de B. atrox en Sudamérica (10).
Otra enzima de particular importancia en esta investigación fue la fosfolipasa A2. Al evaluar su actividad, tanto mediante el método de retardo de la coagulación de la yema de huevo como mediante la actividad hemolítica indirecta; se encontraron diferencias en los valores de actividad entre venenos de B. atrox de distinta procedencia, donde la actividad fue más elevada en los venenos de B. atrox de Amazonas seguidos por los procedentes de Ucayali y Junín (Tabla 2). Estos resultados podrían estar indicando distinta concentración o contenido de isoformas de fosfolipasa A2 entre venenos de diferente procedencia, lo cual requiere estudios complementarios. Al respecto, se sabe que las fosfolipasas A2 a pesar de ser estructuralmente conservadas también son altamente polimórficas, habiéndose demostrado la existencia de isoformas de estas enzimas presentes solo en ciertas poblaciones de B. atrox de otros países amazónicos (9,10).
Los venenos de las especies de Bothrops contienen numerosas proteínas que inducen varias alteraciones hemostáticas comprometiendo el sistema plaquetario, coagulante y fibrinolítico (30). Empleando sustratos como el plasma citratado o sustratos sintéticos como el BApNA es posible detectar y medir el nivel de actividad de las enzimas comprometidas en estas alteraciones. Es así, que se ha observado que la actividad coagulante y amidolítica de los venenos de B. atrox de Perú son variables (Tabla 2). En concordancia con ello, el efecto coagulante y la actividad amidolítica han sido reportados como efectos que presentan un elevado nivel de variación intraespecífica (7,8).
Un efecto biológico de máxima importancia en este análisis es la acción hemorrágica de los venenos, lo cual es más evidente en el caso de las serpientes vipéridas (30). Es así que siguiendo el objetivo comparativo, se inoculó a ratones con una cantidad fija de veneno, correspondiente a 1 DHM hallada por Segura et al. (23), y se procedió a comparar los diámetros hemorrágicos producidos por esta cantidad de veneno. Se observaron pocas diferencias en las áreas hemorrágicas producidas por los venenos analizados (Tabla 2). Sin embargo, se pudo apreciar una menor intensidad de la hemorragia en los ratones inoculados con los dos venenos de Junín.
La inmunodifusión evidenció el mismo patrón de formación de líneas de precipitina en todos los venenos cuando fueron enfrentados al suero antibotrópico polivalente. Esto indica que no existen diferencias en la capacidad del antiveneno para reconocer distintos venenos de B. atrox; sin embargo, estos resultados deben ser complementados con métodos de mayor sensibilidad si se quisiera ahondar en el tema.
En cuanto a los ensayos de neutralización in vitro con el antiveneno botrópico, tanto la actividad coagulante como PLA2 fueron eficazmente neutralizadas con las tres dosis ensayadas en todos los venenos (Tabla 3). Por tanto, se demuestra que, a pesar de que los venenos de B. atrox corresponden a distintos grupos, con distinta procedencia y con distinto nivel de actividad enzimática, el suero antibotrópico polivalente es eficaz en neutralizar dichas actividades. Estos ensayos muestran que las enzimas responsables de los principales efectos del envenenamiento pueden ser neutralizadas in vitro por el antiveneno producido por INS.
El estudio tiene limitaciones, si bien hemos determinado notables variaciones en algunas actividades enzimáticas que tienden a relacionarse con la procedencia de la serpiente, estas deben ser confirmadas en un contexto regional, para lo cual debe realizarse un muestreo que incluya un mayor número de serpientes. Además, los venenos provienen de serpientes en cautiverio, estado que podría estar afectando a la serpiente en las propiedades originales de su veneno. Por último, la efectividad del antiveneno en neutralizar a las enzimas responsables de la actividad hemolítica y coagulante, debe ser contrastada en estudios in vivo en animales de experimentación y con los datos epidemiológicos de ofidismo en el Perú.
En conclusión, se ha logrado establecer que el veneno de B. atrox contiene enzimas cuya actividad tiende a variar según el origen de la serpiente, como es el caso de las fosfolipasas A2, mientras que otras se mantienen constantes o varían independientemente a la procedencia. Estas variaciones no alteran la capacidad neutralizante del antiveneno producido en Perú.
AGRADECIMIENTOS
Los autores agradecen al Vicerrectorado de Investigación de la UNMSM por el apoyo financiero brindado para la ejecución de esta investigación.
Contribuciones de autoría
OC y BC participaron en la concepción y diseño de trabajo, recolección y obtención de resultados, análisis e interpretación de datos y redacción del manuscrito. YA y LF participaron en la concepción y diseño del trabajo, análisis e interpretación de datos, revisión crítica del manuscrito y aprobación de su versión final. GE participó en la recolección y obtención de resultados y redacción del manuscrito.
Fuentes de financiamiento
Estudio financiado por el Vicerrectorado de Investigación de la Universidad Nacional Mayor de San Marcos.
Conflictos de interés
Los autores declaran no tener conflictos de interés en la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Yarlequé A. Las serpientes peruanas y sus venenos. Lima: Fondo Editorial, Universidad Nacional Mayor de San Marcos; 2000. [ Links ]
2. World Health Organization. Rabies and envenomings: a neglected public health issue. Report of a consultative Meeting. Geneva: WHO; 2007. [ Links ]
3. Zavaleta A. Mordedura de serpiente (ofidismo): Un problema de salud en el Perú. Rev Med Hered. 2004;15(2):61-3. [ Links ]
4. Chippaux JP, Williams V, White J. Snake venom variability: methods of study, results and interpretation. Toxicon. 1991;29(11):1279-303. [ Links ]
5. Málaga O, Pantigoso C, Morante Y, Heredia V, Cárdenas J, Yarlequé A. Variaciones en la composición proteica, actividades enzimáticas y biológicas del veneno de la serpiente Bothrops atrox (Viperidae) en relación con la edad. Rev Peru Biol. 2000;7(2):161-70. [ Links ]
6. Saldarriaga M, Otero R, Nuñez V, Toro M. Variaciones ontogénicas y geográficas en los efectos tóxicos y en las características inmunohistoquímicas del veneno de serpientes del grupo Bothrops atrox del Meta y Antioquia. Iatreia. 2000;13(2):90. [ Links ]
7. Salazar M, Rodriguez-Acosta A, Girón M, Aguilar L, Guerrero B. A comparative analysis of the clotting and fibrinolytic activities of the snake venom (Bothrops atrox) from different geographical areas in Venezuela. Thromb Res. 2007;120(1):95-104. [ Links ]
8. Cavinato RA, Remold H, Kipnis TL. Purification and variability in thrombin-like activity of Bothrops atrox venom from different geographic regions. Toxicon. 1998;36(2):257-67. [ Links ]
9. Núñez V, Cid P, Sanz L, De la Torre P, Angulo Y, Lomonte B, et al. Snake venomics and antivenomics of Bothrops atrox venoms from Colombia and the Amazon region of Brazil, Peru and Ecuador suggest the occurrence of geographic variation of venom phenotype by a trend towards paedomorphism. J Proteomics. 2009;73(1):57-78. [ Links ]
10. Calvete JJ, Sanz L, Pérez A, Borges A, Vargas AM, Lomonte B, et al. Snake population venomics and antivenomics of Bothrops atrox: Paedomorphism along its transamazonian dispersal and implications of geographic venom variability on snakebite management. J Proteomics. 2011;74(4):510-27. [ Links ]
11. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biochem. 1951;193(1):165-275. [ Links ]
12. Warburg O, Christian W. Isolation and crystallization of the glycolytic enzyme enolase. Biochem Zeitschrift. 1941;31:384-421. [ Links ]
13. Laemmli UK. Cleavage of structural proteins during the Assembly of the Head of Bacteriophage T4. Nature. 1970;227:680-5. [ Links ]
14. Takahashi T, Ohsaka A. Purification and characterization of a proteinase in the venom of Trimeresurus flavoviridis. Complete separation of the enzyme from hemorrhagic activity. Biochim Biophys Acta. 1970;198(2):293-307. [ Links ]
15. Loayza S, Morante Y, Campos S, Yarlequé A. Enzimas proteolíticas en el veneno de las serpientes peruanas Lachesis muta y Bothrops atrox. Bol Soc Quím Perú. 1985;52(3):151-63. [ Links ]
16. Antunes TC, Yamashita KM, Barbaro KC, Saiki M, Santoro ML. Comparative analysis of newborn and adult Bothrops jararaca snake venoms. Toxicon. 2010;56(8):1443-58. [ Links ]
17. Vidal JC, Stoppani AO. Isolation and purification of two phospholipases A from Bothrops venoms. Arch Biochem Biophys. 1971;145(2): 543-56. [ Links ]
18. Condrea E, Devries A, Mager J. Hemolysis and splitting of human erythrocyte phospholipids by snake venom. Biochim Biophys Acta. 1964;84:60-73. [ Links ]
19. Copley A. Studies of snake venoms on the blood coagulation. The thromboserpentin enzyme in the venoms. Thrombos Res. 1973;2:487-508. [ Links ]
20. Erlanger BF, Kokowsky N, Cohen W. The preparation and properties of two new chromogenic substrates of trypsin. Arch Biochem Biophys. 1961;95:271-8. [ Links ]
21. Kondo H, Kondo S, Ikezawa H, Murata R. Studies on the quantitative method for the determination of hemorrhagic activity of Habu snake venom. Jpn J Med Sci Biol. 1960;13:43-52. [ Links ]
22. Isla M, Málaga O, Yarlequé A. Características bioquímicas y acción biológica de una hemorragina del veneno de Bothrops brazili. An Fac Med Lima. 2003;64(3):159-66. [ Links ]
23. Segura A, Castillo MC, Núñez V, Yarlequé A, Gonçalves LR, Villalta M, et al. Preclinical assessment of the neutralizing capacity of antivenoms produced in six Latin American countries against medical – relevant Bothrops snake venoms. Toxicon. 2010;56(6):980-9. [ Links ]
24. Ouchterlony O, Nilsson LA. Immunodiffussion and immunoelectrophoresis. Handbook of Experimental Immunology. 1967;I(34):655-60. [ Links ]
25. Gutiérrez JM, Avila C, Rojas E, Cerdas L. An alternative in vitro method for testing the potency of the polyvalent antivenom produced in Costa Rica. Toxicon. 1988;26(4):411-3. [ Links ]
26. López-Lozano JL, de Sousa MV, Ricart CA, Chávez- Olortegui C, Flores Sanchez E, Muníz EG, et al. Ontogenetic variation of metalloproteinases and plasma coagulant activity in venoms of wild Bothrops atrox specimens from Amazonian rain forest. Toxicon, 2002;40(7):997-1006. [ Links ]
27. Murillo J, Prada E. Estudio químico y de toxicidad del veneno de serpientes de la familia Viperidae Bothrops atrox mantenidas en cautiverio en el serpentario de la Universidad de la Amazonia. Tesis para optar al título de Biólogo. Facultad de Ciencias Básicas, Universidad de la Amazonia. Caquetá, Colombia. 2009. [ Links ]
28. Guércio RA, Shevchenko A, Shevchenko A, López- Lozano JL, Paba J, Sousa MV, et al. Ontogenetic variations in the venom proteome of the Amazonian snake Bothrops atrox. Proteome Sci. 2006;4:11. [ Links ]
29. Gonzalez E. Purificación parcial y caracterización bioquímica de un factor de difusión del veneno de la serpiente B. atrox (Jergón). Tesis para optar al grado académico de bachiller en Ciencias Biológicas. Facultad de Ciencias Biológicas, Universidad Nacional Mayor de San Marcos. Lima, Perú. 2011. [ Links ]
30. Sanchez EF, Gabriel LM, Gontijo S, Gremski LH, Veiga SS, Evangelista KS, et al. Structural and functional characterization of a P-III metalloproteinase, leucurolysin-B, from Bothrops leucurus venom. Arch Biochem Biophys. 2007;468(2):193-204. [ Links ]
Correspondencia: César Alexander Ortíz Rojas
Dirección: Francisco de Toledo Mz. L-1, LT. 7 Urb. Cercado. Lima 33, Perú.
Teléfono: (51) 980444388
Correo electrónico: cesar.alexander04@gmail.com
Recibido: 23-12-11
Aprobado: 02-05-12