Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.30 no.2 Lima Apr. 2013
Original Breve
Intervalos de referencia de subpoblaciones linfocitarias de sangre periférica en adultos sanos de Lima, Perú
Reference intervals for peripheral blood lymphocyte subsets in healthy adults in Lima, Peru
José M. Cóndor1,2,a, Marco Álvarez1,a, Luis Cano1,2,a, Edgar Matos1,b, Christian Leiva3,a, José A. Paredes2,a,c
1 Instituto de Hemaferesis y Terapia Celular “IHEMATEC”. Lima, Perú.
2 Facultad de Medicina, Universidad Nacional Mayor de San Marcos. Lima, Perú.
3 Rochem Biocare. Bogotá, Colombia.
a Tecnólogo médico; b médico inmunólogo y alergólogo; c magister en Medicina Transfusional
RESUMEN
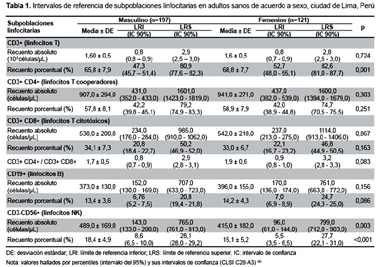
Con el objetivo de establecer los Intervalos de Referencia (InR) de las subpoblaciones linfocitarias (SPL) de sangre periférica en adultos sanos de Lima (Perú), se realizó un estudio transversal en donantes de sangre captados entre el 2011-2012. Siguiendo criterios basados en las directrices del Clinical and Laboratory Standards Institute (CLSI C28-A3), se procesaron 318 muestras, el 61,9% (197/318) de ellas procedentes de donantes de sexo masculino. Para el recuento de las SPL se empleó un citómetro de flujo de plataforma simple. Se establecieron los InR de cada SPL en personas adultas según sexo con sus respectivos límites de referencia y sus intervalos de confianza al 90%. Se encontraron diferencias en los recuentos porcentuales de CD3+ (p<0,01); y en los recuentos absolutos (p<0,01) y porcentuales (p=0,01) de CD3-CD56+. Los InR hallados son diferentes a los descritos en estudios realizados en otros países. Dichas diferencias se deben a las características de la población y al modelo de estudio.
Palabras clave: Subgrupos linfocitarios; Citometría de flujo; Valores de referencia; Perú (fuente: DeCS BIREME).
ABSTRACT
In order to establish the reference intervals (RIs) of peripheral blood lymphocyte subsets (PBL) in healthy adults in Lima (Peru), a cross-sectional study was conducted among blood donors taken in between 2011 and 2012. Based on the criteria obtained from the guidelines of the Clinical and Laboratory Standards Institute (CLSI C28-A3), 318 samples were processed, 61.9% (197/318) coming from male donors. For PBL count, a flow cytometer with a simple platform was used. The RIs are established for each PBL in adults based on sex with their respective reference limits and 90% confidence intervals. Differences were found in CD3+ percentage counts (p=0.001) and in CD3-CD56+ absolute (p=0.003) and percentage counts (p?0.001). The RIs found are different to those described in studies conducted in other countries due to the characteristics of the population and the study model.
Key words: Lymphocyte subsets; Flow cytometry; Reference values; Peru (source: MeSH NLM).
INTRODUCCIÓN
Los linfocitos CD3+ (linfocitos T), CD3+CD4+ (linfocitos T cooperadores), CD3+CD8+ (linfocitos T citotóxicos), CD19+ (linfocitos B) y CD3-CD56+ (linfocitos NK) constituyen parte de las subpoblaciones linfocitarias (SPL) clínicamente relevantes en los seres humanos. La determinación de sus niveles en el tejido sanguíneo se logra gracias a anticuerpos monoclonales conjugados con fluorocromos dirigidos contra los marcadores específicos de superficie de estas células, siendo la citometría de flujo la metodología estándar, para su identificación y recuento (1, 2). Esta técnica permite analizar las características de cada SPL tomando en cuenta los patrones de fluorescencia, tamaño celular y complejidad, propios de cada subpoblación celular (3). La determinación de las SPL permite el monitoreo, seguimiento y tratamiento de pacientes con alteraciones inmunológicas, así como de individuos con inmunodeficiencias primarias o adquiridas, como el caso de los pacientes infectados con el virus de la inmunodeficiencia humana (VIH) (4).
Los resultados de la determinación de SPL de toda persona deberían ser comparados con intervalos de referencia (InR) debidamente documentados; sin embargo, los estudios señalan InR heterogéneos para cada SPL en función a la región donde han sido efectuados (5). Es por ello que, instituciones como el Clinical and Laboratory Standards Institute (CLSI), la International Federation of Clinical Chemistry (IFCC) y la International Organization for Standardization (ISO), indican que cada laboratorio debe ser capaz de verificar la aplicabilidad de los InR a su propia población. Estas instituciones también recomiendan que para establecer InR, se debería usar como método a priori la determinación no paramétrica de al menos 120 individuos de referencia, llevando a cabo un control de calidad en los procedimientos analíticos (6, 7, 8, 9).
En el Perú no se han establecido InR de la SPL; por ello, muchos laboratorios adoptan valores de referencia, justificados en estudios realizados en otras regiones, con metodologías heterogéneas y, evidentemente, en poblaciones distintas a la peruana. Este inadecuado procedimiento influye en la interpretación de los resultados. Investigaciones previas han demostrado variaciones del recuento de SPL, según raza, edad, sexo y factores ambientales (10-20). Es entonces necesario establecer adecuadamente los parámetros de las SPL de la población peruana para así poder realizar una adecuada interpretación médica de los exámenes, que permita el adecuado monitoreo, seguimiento y tratamiento de pacientes inmunodeprimidos. El objetivo de este estudio fue establecer los InR de las SPL en adultos sanos de la ciudad de Lima, determinados para cada sexo, siguiendo criterios establecidos por guías internacionales.
EL ESTUDIO
Se realizó un estudio transversal que incluyó a 318 donantes de sangre que acudieron a campañas de donación voluntaria realizadas por el Hospital Nacional Edgardo Rebagliati Martins (EsSalud) entre los años 2011-2012. Los criterios de inclusión se determinaron siguiendo las pautas establecidas por la IFCC y la CLSI para este tipo de estudios, estas fueron: ser natural de Lima; estar clínicamente sano al momento de la donación; no tener antecedente de adicción al alcohol, tabaco o drogas; no haber consumido medicación ni haber estado sometido a estrés agudo dentro de las 24 h previas a la donación, y tener serología negativa para los siguientes marcadores: VIH, hepatitis B, hepatitis C, sífilis, HTLV I y II, infección por Tripanosoma cruzi, y proteína C reactiva (PCR); este último utilizado como marcador de presencia de inflamación. Se realizó un muestreo no probabilístico.
PROCEDIMIENTOS
Se obtuvieron 3 mL de sangre venosa periférica de cada persona, que fueron conservados en tubos con 5,4 mg de K2EDTA. Tomando en cuenta el ritmo circadiano de las SPL, la extracción de muestra fue realizada entre las 10 de la mañana y el medio día. Las muestras fueron transportadas, preservando la cadena de frio, y procesadas dentro de las cinco horas posteriores a la toma de muestra. Para la determinación de los marcadores inmunológicos se usó un citómetro de flujo de plataforma simple (Cytomics FC500MCL, Beckman Coulter, CA, USA) del Instituto de Hemaféresis y Terapia Celular (IHEMATEC, Jesús María, Perú); y la combinación de anticuerpos monoclonales conjugados con fluorocromo: TriCHROME CD3-PC5/CD4-RD1/CD8-FITC, CD19-ECD, CD56-PE y CD45-PC7 (Beckman Coulter, CA, USA). Cada muestra sanguínea se procesó en un tubo de 12 x 75 mm, en el cual se incluyó 100 uL de sangre y 10 uL de cada solución de anticuerpos conjugados, los cuales se incubaron a temperatura ambiente y en oscuridad por 20 minutos. Luego se adicionó 500 uL de agente lisante de glóbulos rojos (Opti-Lyse C, Beckman Coulter, USA), se incubó a temperatura ambiente y en oscuridad por 15 min más. Finalmente, se agregó 1 mL de tampón buffer (IsoFLOW, Beckman Coulter, USA) y 100 uL de fluoroesferas de recuento (Flow-Count, Beckman Coulter, USA).
Para el análisis de las SPL se usó el programa de análisis CXP Software (Beckman Coulter, USA). Para el cálculo de los recuentos absolutos (número de células/uL) se multiplicó el número de células contadas por la concentración de las fluoroesferas, este producto se dividió entre el número de fluoroesferas contadas. Para la selección de subpoblaciones se estableció una estrategia panel con CD45+/Side Scatter Gating (SSC).
Se realizaron procedimientos de control de calidad interno, que incluyeron la calibración del detector óptico del citómetro, y la alineación de la óptica y el sistema de fluidos del equipo; para ello, se utilizaron fluorosferas Flow-SET y Flow-Check (Beckman Coulter, USA) respectivamente; además del uso de células control Immuno-Trol (Beckman Coulter, USA) por cada procedimiento.
ANALISIS ESTADÍSTICO
Se empleó estadística descriptiva para caracterizar a la muestra. Se emplearon diagramas de cajas para detectar valores anómalos, que fueron removidos tras ser analizados. Se evaluó la relación de los valores de los parámetros medidos en función a la edad, a través de un modelo de regresión lineal. Para el establecimiento de InR se calculó la media y la desviación estándar de cada SPL; los percentiles 2,5 y 97,5, los que constituyen los límites de referencia inferior (LRI) y superior (LRS) respectivamente; y los intervalos de confianza al 90% de cada uno de ellos. Se realizó la comparación de los InR según sexo, para este fin se empleó la prueba t de Student. Un valor de p<0,05 fue considerado significativo. Para el análisis estadístico, establecimiento de InR se utilizó el programa estadístico MedCalc® V11.5.1.
ASPECTOS ÉTICOS
El protocolo de estudio fue aprobado por el Comité de Ética de la Facultad de Medicina de la Universidad Nacional Mayor de San Marcos (Acta 0141); no hubo implicancia de riesgo y se contó con la autorización de cada donante, quienes además firmaron un consentimiento informado previo a la donación. 9
HALLAZGOS
Se recolectaron muestras de 358 donantes de sangre, 40 muestras fueron descartas por ser seropositivas a alguno de los marcadores de las infecciones tamizadas. Por tanto, el tamaño final de la muestra fue de 318 donantes. De ellos, el 61,9% fueron varones, las medias de edad fueron 30,0 ± 7,9 y 30,2 ± 8,6 años los donantes de sexo masculino y femenino respectivamente, el rango de edad fue de 18-55 años. En la Tabla 1 se muestran los InR de cada SPL (valores absolutos y relativos) según sexo, con sus respectivos límites de referencia y sus intervalos de confianza al 90%. El análisis de los InR por sexo mostró diferencias en los recuentos porcentuales de CD3+ (p<0,01), siendo mayor en mujeres, y en los recuentos absolutos (p<0,01) y porcentuales (p?0,01) de CD3-CD56+, siendo mayor en varones. El análisis de regresión mostró una pobre dependencia lineal positiva entre la edad y los parámetros CD3+ y CD3+CD4+ del género femenino (r2= 0,04 y r2=0,06, respectivamente). No se encontró relación de dependencia lineal entre la edad y los parámetros del sexo masculino.
DISCUSIÓN
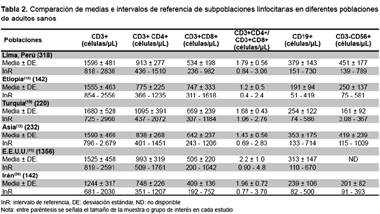
Tras haber encontrado los InR de las SPL para adultos entre 18 y 55 años en Lima, en nuestro estudio encontramos que existen diferencias entre ambos sexos para los recuentos de CD3+ y CD3-CD56+, además una relación lineal positiva en el sexo femenino entre la edad y los recuentos absolutos de CD3+ y CD3+CD4+. Estos resultados guardan diferencias con respecto a otros estudios realizados en distintas poblaciones, siendo en los recuentos absolutos de CD3+CD4+ y CD3+CD8+ en los que se aprecia mayor diferencia (Tabla 2); dichos hallazgos se pueden deber a que cada población presenta diferencias en cuanto a sus condiciones étnicas, ambientales y socioeconómicas, además a la técnica y metodología empleados en cada estudio. A este respecto, todos los estudios señalados coinciden en que todas las poblaciones evaluadas eran aparentemente sanas; aun cuando algunas de ellas no se adecúan a las recomendaciones de las guías internacionales (6, 8, 9).
Nuestros resultados sugieren que los InR de SPL están influenciados por el sexo. Se observan mayores InR de CD3+ en mujeres, al igual que estudios realizados en México y EE. UU. (10, 11); y mayores InR de CD3-CD56+ encontrados en varones, que concuerdan con estudios realizados en Italia (5), EE. UU. (11), Etiopia (12), Asia (13), Uganda (14) y España (15). Estas diferencias entre sexos se deben a la influencia secundaria de las hormonas sexuales y algunos glucocorticoides, siendo esta característica aceptada como parte del dimorfismo de sexo en el sistema inmune (16). Nuestros resultados sugieren que los InR de CD3+ y CD3+CD4+ del sexo femenino están influenciados por la edad, lo que concuerda con los hallazgos encontrados en EE. UU. (17).
Estudios previos indican que la edad influye en los InR de linfocitos en prematuros y niños (18); sin embargo, el impacto de la edad femenina adulta en los subgrupos de linfocitos no está bien establecido, esto se debe a que los estudios efectuados tienen rangos de edad heterogéneos. De haber dividido nuestra cohorte de donantes de sexo femenino por grupos de edad, se hubieran obtenido grupos sin un tamaño suficiente para evaluación, por lo que no era posible establecer sus InR.
Las recomendaciones de la CLSI 28-A3 señalan que para establecer intervalos de referencia, se necesita un tamaño muestral mínimo de 120 donantes por variable (6). Ello ha representado una dificultad en nuestro estudio, ya que existen pocos donantes naturales en Lima y no todos ellos cumplen con los criterios de selección para ser incluidos como individuos de referencia. Estos estudios demandan también de logística, materiales e insumos que minimicen todas las interferencias y posibles errores en la determinación de los InR, se debe tener presente durante la formulación de proyectos de esta naturaleza que las SPL están sujetas a factores que pueden alterar su distribución, particularmente en estudios de inmunofenotipaje. En estos últimos es importante mantener características idóneas como la relación muestra/anticoagulante, el tiempo antes del procesamiento, la procedencia de los reactivos, la conservación de anticuerpos monoclonales, y la preparación de la muestra (marcaje, lisis y patrón de recuento absoluto). Tampoco se deben dejar de lado la inclusión de protocolos de calibración, el control de calidad, ni la configuración del citómetro de flujo. Asimismo, se deben emplear softwares apropiados para la adquisición de datos y análisis e incluir estrategias de panel.
Ciertas limitaciones deben ser mencionadas, la más importante de ellas es que haber obtenido la muestra de manera no probabilística se podría afirmar que nuestros resultados no son inferenciables a la población objetivo; sin embargo, habiendo cumplido meticulosamente las recomendaciones de guías internacionales y teniendo un tamaño muestral suficiente para hacer la distinción de los InR según sexo, consideramos que nuestras estimaciones son una buena aproximación a los InR de adultos sanos de la ciudad de Lima. Estos valores solo pueden ser asumidos por laboratorios que comparten la misma metodología y técnica para el procesamiento de las muestras del presente estudio; para cualquier otra circunstancia, se deberían seguir la guía (CLSI C28-A3) (6), la cual señala que se pueden realizar ensayos para la transferencia y verificación de valores. Otra limitación es el tamaño de la muestra, el cual no nos permitió establecer la influencia de la edad en los InR de las SPL. Es por ello que sugerimos una investigación más detallada de los InR respecto a la edad completando el tamaño de muestra mínimo recomendado por la CLSI (mayor a 120); con lo cual se pudiera señalar InR para cada uno de los grupos de edad existentes. Esta recomendación, evidentemente, se extiende a todas las regiones del Perú.
En conclusión, se han establecido los InR de las SPL en adultos sanos de la ciudad de Lima; los InR mostraron ser diferentes en función al sexo en los recuentos porcentuales de CD3+ y los recuentos absolutos y porcentuales de CD3-CD56+. Los InR hallados son diferentes a otros descritos en estudios realizados en otros países. Dichas diferencias se deben a las características de la población y al modelo de estudio.
Contribuciones de autoría: JMC, MA y LC han participado en la concepción, diseño del artículo, recolección y obtención de los datos; JMC y LC realizaron el análisis e interpretación de datos y bridaron asesoría estadística; JMC, MA, LC, EM y JP participaron en laredacción y revisión crítica del artículo; MA y CL participaron de la obtención del material de estudio, financiamiento y de la asesoría técnica o administrativa. Todos los autores aprobaron la versión final del artículo.
Fuentes de financiamiento: autofinanciado.
Conflictos de interés: los autores declaran no tener conflictos de interés con la publicación de este artículo.
Referencias Bibliográficas
1. World Health Organization. Laboratory Guidelines for enumerating CD4 T Lymphocytesin the context of HIV/AIDS. New Delhi: WHO Regional Office for South-East Asia; 2007. [ Links ]
2. Romero A, García J. Principios de Citometría de Flujo . Oncología. 2006;16(3-4):170-2. [ Links ]
3. Salgado Lynn M. Citometría de Flujo: Fluorescence - ActivatedCellSorting (FACS). México, D.F.: Instituto de Biotecnología, Universidad Nacional Autónoma de México; 2002. [ Links ]
4. Carbone J, Peña JM, Gil J, Benito JM, Fernández-Cruz E. Inmunofenotipo de progresión a sida: deficiencia, activacion y disfunción de células T CD4 y CD8 . Rev Clin Esp. 2006;206(4):172-7. [ Links ]
5. Santagostino A, Garbaccio G, Pistorio A, BolisV, Camisasca G, Pagliaro P, et al. An Italian national multicenter study for the definition of reference ranges for normal values of peripheral blood lymphocyte subsets in healthy adults . Haematologica. 1999;84:499-504. [ Links ]
6. Clinical and Laboratory Standards Institute (CLSI). Defining, Establishing, and Verifying Reference Intervals in the Clinical Laboratory; Approved Guideline-Third Edition. Document C28-A3 . Wayne, PA: CLSI; 2008. [ Links ]
7. Sociedad Española de Química Clínica. Valores de referencia intraindividuales . Quím Clín. 1991;10(1):56-8. [ Links ]
8. Jones G, Barker A. Reference Intervals. Clin Biochem Rev. 2008;29(1):93-7. [ Links ]
9. Instituto Nacional de Defensa de la Competencia y de la Protección de la Propiedad Intelectual (Indecopi). Laboratorios Clínicos - Requisitos particulares para la calidad y competencia. Lima: Indecopi; 2008. [ Links ]
10. Razo D, García J, Llorente L. Cuantificación de subpoblaciones de linfocitos de sangre periférica por citometría de flujo. Determinación de intervalos de referencia en población adulta sana de la ciudad de México . Rev Mex Patol Clin. 1996;43(1):21-6. [ Links ]
11. Reichert T, DeBruyère M, Deneys V, Tötterman T, Lydyard P, Yuksel F, et al. Lymphocyte subset reference ranges in adult Caucasians . Clin Immunol Immunopathol. 1991;60(2):190-208. [ Links ]
12. Tsegaye A, Messele T, Tilahun T, Hailu E, Sahlu T, Doorly R, et al. Immunohematological reference ranges for adult ethiopians . Clin Diagn Lab Immunol. 1999;6(3):410-4. [ Links ]
13. Chang WJ, Tan GB, Kuperan P. Establishment of adult peripheral blood lymphocyte subset reference range for an asian population by single-platform flow cytometry: influence of age, sex, and race and comparison with other published studies. Clin Vaccine Immunol. 2004;11(1):168-73. [ Links ]
14. Lugada ES, Mermin J, Kaharuza F, Ulvestad E, Were W, Langeland N, et al. Population-based hematologic and immunologic reference values for a healthy ugandan population. Clin Diagn Lab Immunol. 2004;11(1):29-34. [ Links ]
15. García-Dabrio MC, Pujol-Moix N, Martinez-Perez Á, Fontcuberta J, Souto JC, Soria JM, et al. Influence of Age, Gender and Lifestyle in Lymphocyte Subsets: Report from the Spanish Gait-2 Study . Acta Haematol. 2012;127:244-9. [ Links ]
16. Da Silva JA. Sex hormones and glucocorticoids: interactions with the immune system . Ann N Y Acad Sci. 1999;876:102-17. [ Links ]
17. Tollerud DJ, Ildstad ST, Brown LM, Clark JW, Blattner WA, Mann DL, et al. T-cell subsets in healthy teenagers: transition to the adult pheno type . Clin Immunol Immunopathol. 1990;56(1):88-96. [ Links ]
18. Shahabuddin S, Al-Ayed I, El-Rab MO, Qureshi MI. Age-Related Changes in Blood Lymphocyte Subsets of Saudi Arabian Healthy Children. Clin Diagn Lab Immunol. 1998;5(5):632-5. [ Links ]
19. Yaman A, Çetiner S, Kibar F, Tasova Y, Seydaoglu G, Dündar IH. Reference Ranges of Lymphocyte Subsets of Healthy Adults in Turkey . Med Princ Pract. 2005;14(3):189-93. [ Links ]
20. Alamooti AA, Ardalan FA, Abdolahi A, Zeidi M, Firouzjaie F. Determination of Lymphocyte Subsets Reference Values in Healthy Iranian Men by a Single Platform Flow Cytometric Method . Cytometry Part A. 2010;77(9):890-4. [ Links ]
Correspondencia: José Manuel Cóndor Capcha
Dirección: Jr. Huascar 1244, Lima 11, Perú.
Teléfono: (+51 1) 330-8163
Correo electrónico: josemaco2110@gmail.com
Recibido: 28-09-12
Aprobado: 03-04-13