Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.30 no.2 Lima abr. 2013
Cartas al editor
Evaluación del Western blot con cinco antígenos hidatídicos para el diagnóstico de equinococosis humana
Evaluation of Western blot with five hydatid antigens for the diagnosis of human echinococcosis
Eduardo Miranda-Ulloa1, a, Eduardo Ayala-Sulca1, b, Herbert Flores-Reátegui2, b
1 Laboratorio de Referencia Nacional en Zoonosis Parasitaria, Centro Nacional de Salud Pública, Instituto Nacional de Salud. Lima, Perú.
2 Dirección Regional de Salud Puno, Perú.
a Biólogo, magíster en microbiología; b Biólogo.
Sr. Editor. La equinococosis humana, producida por la larva de Echinococcus granulosus, presenta altas prevalencias en el Perú, principalmente en la sierra. El diagnóstico se realiza en base a la sospecha clínica y epidemiológica, junto a exámenes de laboratorio serológicos y de imágenes. Las pruebas serológicas que se aplican para la detección de anticuerpos usan como fuente principal de antígeno el líquido hidatídico, por mostrar mejores resultados (1).
El Western blot es la prueba más fiable para el diagnóstico serológico confirmatorio. En nuestro país, las instituciones que producen los kits de Western blot con antígenos hidatídicos autóctonos son: el Instituto Nacional de Salud (INS) (2); el Instituto de Medicina Tropical Daniel Alcides Carrión de la Universidad Nacional Mayor de San Marcos (IMT), y el Laboratorio Escalabs (La Libertad). El INS usa Western blot con antígeno hidatídico de ovino (2); sin embargo, el Laboratorio del IMT y Escalabs usan el antígeno hidatídico de bovino (3). Con ninguno de los antígenos mencionados se alcanza el 100% de sensibilidad y especificidad. Adicionalmente existen resultados discordantes de casos de pacientes con diagnóstico presuntivo de hidatidosis a los que se les realizó Western blot usando ambos antígenos (ovino y bovino) por separado.
El año 2010 publicamos la evaluación del antígeno hidatídico de ovino y caprino (4); para continuar y concluir con esta investigación se propuso evaluar el Western blot usando antígeno hidatídico de bovino, porcino y alpaca para el diagnóstico de equinococosis humana. Se determinó que la concentración óptima del antígeno hidatídico de bovino para la preparación de las tiras hidatídicas de electroinmunotransblot fue de 3,0 ug/mm; mientras que para los antígenos de porcino y de alpaca fueron de 1,0 ug/mm y 2,3 ug/mm respectivamente. Las bandas específicas seleccionadas para dar el criterio de positividad con los antígenos en estudio fueron las 8, 16, 32 y 35 KDa para el antígeno bovino; las 8, 16, 21, 25, 31 y 45 KDa para el antígeno porcino, y las 8, 16, 32 y 38 KDa para el antígeno de alpaca. Bastó que aparezca al menos una banda de las señaladas para que el resultado fuera considerado positivo.
El Western blot usando antígeno de caprino y ovino obtuvo un buen rendimiento en sensibilidad, por encima del 90% (Tabla 1). Sin embargo, los resultados de sensibilidad obtenidos al evaluar los antígenos de porcino, bovino y alpaca no alcanzaron el 90%; esta variación podría deberse principalmente al tipo de cepa de E. granulosus, pues existen evidencias de que en el Perú circula más de una cepa de E. granulosus (1).
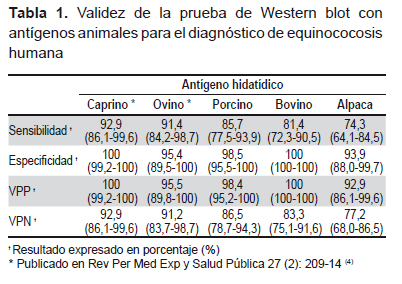
La sensibilidad y especificidad halladas con los diferentes antígenos estudiados, dependen de las bandas específicas definidas para cada antígeno y del grupo de sueros de pacientes estudiados, ya que si no colocamos sueros de pacientes con otras enfermedades parasitarias, es posible encontrar bandas con muy buena especificidad, pero que no se ajustarían a la realidad (5). En los antígenos de caprino y bovino no se evidenció reacción cruzada. Las reacciones cruzadas encontradas fueron: para el antígeno porcino en suero con cisticercosis; para el antígeno de alpaca en suero con cisticercosis, ascariosis y teniosis, y para el antígeno ovino en suero con toxoplasmosis y fasciolosis.
En el Perú, Verástegui et al. (3) evaluaron el Western blot usando antígeno hidatídico bovino en 181 sueros, ellos seleccionaron las bandas de 8, 16 y 21 KDa como específicas y obtuvieron una sensibilidad de 80% y una especificidad de 100%. Por su parte, Gómez et al. (5) evaluaron el antígeno hidatídico bovino, seleccionando la banda de 38 KDa como específica, y obtuvieron una sensibilidad y especificidad de 75 y 100% respectivamente. Al realizar la comparación con nuestros resultados (antígeno bovino), se pudo observar que la especificidad hallada fue la misma; sin embargo, la sensibilidad encontrada en nuestro estudio fue de 81,4% y las bandas específicas seleccionadas fueron: 8, 16, 32 y 35 KDa; esta diferencia podría deberse a las variaciones en la preparación de los antígenos, al panel de sueros estudiados y a probables errores en el cálculo de los pesos moleculares de las bandas. Gómez et al. (5) también evaluaron el antígeno de ovino y obtuvieron una sensibilidad de 95%, y una especificidad de 95%. Estos valores son similares a nuestros resultados (antígeno ovino), incluso también existió reacción cruzada en un suero con toxoplasmosis en ambos estudios.
Nuestros resultados muestran que el mejor candidato de antígeno para ser usado en el Western blot es el antígeno caprino (4). En caso de que no se disponga del antígeno caprino, los antígenos ovino, bovino y porcino pueden ser usados alternativamente. No se recomienda el uso del antígeno de alpaca en el Western blot, ya que presenta una menor sensibilidad.
Es relevante tomar en cuenta que en la emisión de resultados del Western blot, debe enunciarse el tipo de antígeno usado con sus valores de sensibilidad y especificidad y las bandas específicas para dicho antígeno; si el resultado es positivo, debe señalarse el número y peso molecular de las bandas específicas que se encuentren en el suero del paciente.
Finalmente, recomendamos que el Ministerio de Salud a través de la Estrategia Sanitaria Nacional de Zoonosis y del INS produzca el kit de Western blot - equinococosis humana con antígeno hidatídico caprino y lo distribuya a los laboratorios regionales de las zonas endémicas del Perú para contribuir a la vigilancia epidemiológica de la equinococosis humana.
Agradecimientos: a los biólogos Franko Velarde, Janet Medina y Rosmery Vilca. A la Lic. Nancy Linares, los TM Juan Carlos Benites Azabache y Regina Medina; a los médicos José Somocurcio, Gladys Patiño, Jorge Gonzáles, Victoria Gambetta, Sixto Sánchez y Eduardo Falconí, y al personal de los LRR de Ayacucho, Junín, Huancavelica y Puno por sus valiosos aportes en las diferentes actividades de la investigación.
Fuentes de financiamiento: Instituto Nacional de Salud.
Conflictos de interés: los autores declaran no tener conflictos de interés en la publicación de este artículo.
Referencias Bibliográficas
1. Pérez C. Proyecto de control de hidatidosis en el Perú por vigilancia epidemiológica [tesis doctoral]. Lima: Facultad de Medicina, Universidad Nacional Mayor de San Marcos; 2007. [ Links ]
2. Instituto Nacional de Salud. Manual de procedimientos para el diagnóstico serológico de las zoonosis parasitarias . Serie de Normas Técnicas Nº 32. Lima, INS; 2010.
3. Verastegui M, Moro P, Guevara A, Rodriguez T, Miranda E, Gilman RH. Enzyme-linked immunoelectrotransfer blot test for diagnosis of human hydatid disease . J Clin Microbiol. 1992;30(6):1554-61. [ Links ]
4. Miranda E, Velarde F, Somocursio J, Ayala E. Evaluación de dos pruebas de inmunoblot con antígeno hidatídico de caprino y ovino para el diagnóstico de equinococosis humana . Rev Peru Med Exp Salud Publica. 2010;27(2):209-14. [ Links ]
5. Gómez J. Valor diagnóstico de Inmunoblot con líquido hidatídico humano, frente a antígeno ovino y bovino . Rev Mex Patol Clin. 2004;51(4):75-89. [ Links ]
Correspondencia: Eduardo Fernando Miranda Ulloa
Dirección: Cápac Yupanqui 1400, Lima 11, Perú.
Teléfono: (511) 748-0000. Anexo 2137.
Correo electrónico: emiranda@ins.gob.pe
Recibido: 11-01-13
Aprobado: 23-01-13













