Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.32 no.2 Lima Apr./Jun. 2015
Articulo Original
Malaria congénita en un hospital de iquitos, Perú
Congenital malaria in a hospital in iquitos, Peru
Hermann Silva1,2,a, Bernaldo Laulate1,2,b, Carlos Coral1,2,b
1 Hospital de Apoyo de Iquitos, Iquitos, Perú.
2 Facultad de Medicina, Universidad Nacional de la Amazonía Peruana. Iquitos, Perú.
a Médico pediatra, doctor en Medicina; b médico residente de infectología.
RESUMEN
Objetivos. Determinar la frecuencia y características clínicas de los recién nacidos con malaria congénita en el Hospital de Apoyo de Iquitos en la Amazonía peruana. Materiales y métodos. Estudio descriptivo, prospectivo y transversal. De enero de 2011 a diciembre de 2013 se estudiaron 14 017 recién nacidos y a sus madres, de quienes se seleccionaron 52 portadoras de malaria gestacional mientras que a sus recién nacidos se les hospitalizó en el Servicio de Neonatología del hospital, y fueron sometidos a evaluación clínica y estudios de laboratorio. Resultados. La frecuencia de malaria gestacional fue de 0,4% y una proporción de malaria congénita de 9,6%. Plasmodium vivax fue hallado en 80% de casos de malaria gestacional y en 60% de malaria congénita. Se observó un caso de óbito fetal con gota gruesa positiva para Plasmodium falciparum. El cuadro clínico en recién nacidos fue fiebre, hipoactividad, irritabilidad y pobre succión. Conclusiones. Se documenta la presencia de malaria congénita en recién nacidos de madres con malaria gestacional. El cuadro clínico se asemeja a una sepsis neonatal. El diagnóstico precoz de malaria congénita y el tratamiento oportuno cursan con buena evolución.
Palabras clave : Malaria por Plasmodium vivax; Malaria por Plasmodium falciparum; Cloroquina (fuente: DeCS BIREME).
ABSTRACT
Objectives. To determine the frequency and clinical features of newborns with congenital malaria in the Hospital de Apoyo of Iquitos in the Peruvian Amazon. Materials and methods. Descriptive, prospective and cross-sectional study. From January 2011 to December 2013, 14.017 newborns and their mothers were studied, of whom 52 carriers of gestational malaria were selected while their infants were hospitalized in the Neonatology Unit, and underwent clinical assessment and laboratory studies. Results. Gestational malaria frequency was 0.4% and a proportion of 9.6% of congenital malaria. Plasmodium vivax was found in 80% of cases of gestational malaria and in 60% of congenital malaria. A case of fetal death with positive thick blood smear for Plasmodium falciparum was observed. The clinical presentation in newborns was fever, hypoactivity, irritability and poor suction. Conclusions. The presence of congenital malaria in infants born to mothers with gestational malaria is documented. The clinical picture resembled neonatal sepsis. Early diagnosis of congenital malaria and timely treatment present with good evolution.
Key words : Plasmodium vivax malária; Plasmodium falciparum malária; Chloroquine (source: MeSH NLM).
INTRODUCCIÓN
La malaria congénita (MC) es una infección de transmisión transplacentaria, la mayoría de los casos son causados por Plasmodium falciparum y por Plasmodium vivax. Las manifestaciones clínicas que presenta el recién nacido se aemeja a un cuadro de sepsis neonatal, con alza térmica, hipoactividad, irritabilidad y rechazo a la lactancia (1). Se puede determinar la presencia de Plasmodium en el recién nacido tan temprano como el día en que nació o presentarse más tardíamente a las dos o tres semanas de nacido (2).
Purizaca explica la baja incidencia de malaria congénita y afirma que el paso de Plasmodium a través de la placenta durante la gestación o en el trabajo de parto es de 0,3 a 3,6%, en áreas de alta endemicidad y de 10% en regiones de baja endemicidad. Plantea también que la actividad fagocítica de la placenta es una efectiva barrera a la infección, además, la inmunidad adquirida de la madre en forma pasiva y la activación del sistema inmune fetal a través del paso placentario de glóbulos rojos infectados de la madre, serían los factores que limitan la infección congénita de la malaria. Describe, además, que la MC puede causar aborto, sobre todo en infecciones ocurridas en el primer trimestre, y ello se debería a estados de hiperpirexia; también causa óbito fetal por anoxia fetal, bajo peso al nacer por secuestro placentario de glóbulos rojos, por alta producción del factor de necrosis tumoral alfa y por disminución del riego sanguíneo placentario por microinfartos (3). Ayóla et al. proponen que la infección con P. falciparum durante el embarazo afecta la respuesta inmune neonatal e infantil y lo hace propenso a la infección congénita (4). Parekh et al. reportan cambios placentarios por depósitos de hemozoina e infiltrado monocitario intervelloso en malaria placentaria, que afectan el desarrollo fetal, generando hipoxia, y se asocian a bajo peso al nacer (5).
El cuadro clínico de MC, cuando hay manifestaciones clínicas, ya que puede carecer de ellas, se inicia con alza térmica y pobre succión (3,6). Se describe, además, sobre todo en África y en áreas de alta endemicidad en Colombia, Venezuela y Brasil, casos con alta parasitemia asociados a anemia y menos frecuentemente trombocitopenia, trastornos metabólicos como hipoglicemia e ictericia y el fallecimiento del recién nacido (7), pueden también mostrarse neonatos asintomáticos y saludables (6). Se describe cinco casos de MC y las manifestaciones clínicas observadas.
MATERIALES Y MÉTODOS
DISEÑO DEL ESTUDIO
Estudio descriptivo, prospectivo y transversal realizado en el Hospital de Apoyo de Iquitos (HAI) ubicado en la ciudad de Iquitos, capital de la región Loreto, al nororiente del Perú, en la Amazonía, en selva baja tropical, ubicado a entre los 100 y 150 metros de altitud y con un índice parasitario anual (IPA) > de 10 en los últimos años (8), con alta endemicidad de malaria, alta precipitación fluvial y una humedad relativa entre 85 a 89% (9). El estudio fue iniciado el 1 de enero de 2011 y finalizado el 31 de diciembre de 2013.
PARTICIPANTES Y DEFINICIONES
Durante el periodo de estudio, nacieron 14 017 niños, de los cuales 180 fueron óbitos (1,28 por cien recién nacidos). Sus madres habían llegado al hospital para trabajo de parto, transferidas de centros de salud periféricos de la ciudad de Iquitos y, en otros casos, en trabajo de parto provenientes de los distritos de la ciudad. Los recién nacidos de madres con malaria durante el embarazo, según el resultado de gota gruesa, fueron escogidos para evaluar la presencia de MC. Los autores fueron los encargados de documentar en las historias clínicas de los recién nacidos los hallazgos clínicos de laboratorio y epidemiológicos. La malaria gestacional (MG) es la enfermedad palúdica que sufre una mujer durante la gestación, demostrada por la presencia de síntomas y signos de índole palúdico y simultáneamente gota gruesa positiva para Plasmodium.
Recién nacido hospitalizado es todo aquel menor de 28 días de edad hospitalizado en el Servicio de Neonatología del HAI, inmediatamente después de nacer en ese mismo hospital. Los criterios de selección de hospitalización para ingresar al estudio consideraron a todo recién nacido con el antecedente de madres con malaria durante la gestación, comprobada mediante gota gruesa positiva para Plasmodium.
Malaria congénita (MC) es el cortejo sintomático presentado por el neonato y atribuido a la presencia de formas asexuadas intraeritrocitarias de especies de Plasmodium en el cordón umbilical, en el momento del parto o en sangre periférica en los 30 días siguientes al parto, y con síntomas y signos clínicos (1).
ESTUDIOS DE LABORATORIO
Se tomó una muestra de sangre de 1 mL en el pliegue del codo del recién nacido para efectuar el estudio del hemograma completo con un analizador hematológico automatizado, y también velocidad de sedimentación. El estudio bioquímico de glicemia fue determinado mediante pruebas enzimáticas en un analizador automático.
La muestra de sangre para el estudio de la gota gruesa se le extrajo del talón derecho y le fue tomada a las 24 horas de nacido. Las pruebas se desarrollaron en el Laboratorio Referencial de la Dirección Regional de Salud (DIRESA), en Loreto, quienes entregaron el informe (número de registro y resultados correspondientes) en el transcurso de las siguientes 24 horas. La determinación de la densidad parasitaria de Plasmodium se efectuó con el método de conteo por cruceros: se señala menos de 40 parásitos en 100 campos; +/2 indicó 40 a 60 parásitos por 100 campos; 1+ indicó 1 parásito por campo en 100 campos; 2++ indicó 2 a 20 parásitos por campo en 100 campos; 3+ indicó 21 a 200 parásitos por campo en 100 campos; 4+ indicó más de 200 parásitos por campo en 100 campos.
ANÁLISIS ESTADÍSTICOS
Se confeccionó una base de datos en SPSS 15,0 con información documentada en las historias clínicas de las mujeres con MG y de los recién nacidos en el estudio. Se usaron las expresiones IMC: índice de masa corporal y p: probabilidad. Se calcularon frecuencias y porcentajes de gestantes atendidas, gestantes con malaria, recién nacidos con MC.
CONSIDERACIONES É TICAS
El estudio fue autorizado por el Comité de Ética del Hospital de Apoyo de Iquitos. A las gestantes en estudio se les informó la naturaleza del mismo y todas firmaron un consentimiento informado al ser incorporadas. Se les informó con detalle la naturaleza del estudio y se absolvió las preguntas presentadas.
RESULTADOS
Se encontraron un 0,4% de madres gestantes con malaria (52/14017). En cinco de los 52 neonatos (9,6%) se diagnosticó malaria congénita, de ellos dos casos fueron por P. falciparum y tres por P. vivax.
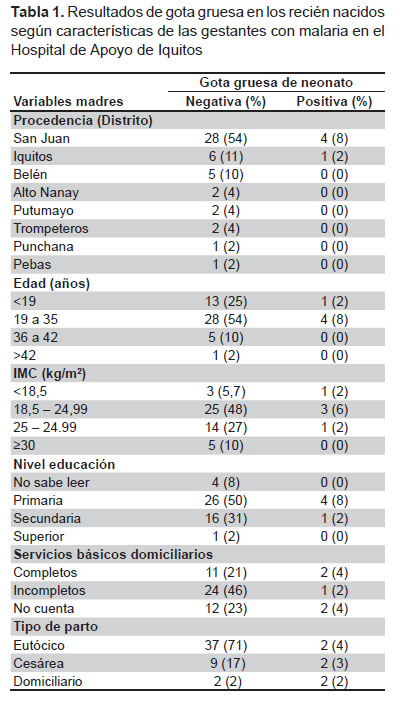
En la Tabla 1 se observa que el 61,5% de las gestantes procedían del distrito de San Juan Bautista. El 88% de madres eran menores de 35 años (promedio de edad 24,6), 7,7% estaban desnutridas y 34,8% tenían sobrepeso u obesidad, según el IMC. El 7,7% no sabía leer y el 57,7% tenían estudios primarios. El 48% de las gestantes tenían servicios básicos domiciliario incompletos y el 26,9% no contaba con ellos. En cuatro de las cinco hubo antecedente de malaria por P. falciparum y una por P. vivax. Cabe mencionar que los diagnósticos de malaria gestacional por gota gruesa se hicieron en las postas de salud de referencia, de ahí que no coincidieron con las gotas gruesas de los recién nacidos que fueron ejecutadas en el laboratorio referencia de la DIRESA Loreto. Todas las gestantes refirieron haber recibido tratamiento en sus postas médicas de referencia. Ningún caso presentó anemia.
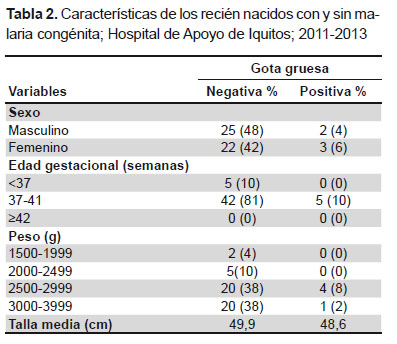
En la Tabla 2se aprecia que la frecuencia de sexo en recién nacidos con o sin malaria congénita fue similar. En ambos casos, 90% fueron recién nacidos a término. El peso corporal al nacer fue de 2500-2999 g en 46% y 3000-3999 g en 40%, lo que indica que hubo bajo peso al nacer (<2500 g) en 14% y estuvo en todo los niños con gota gruesa negativa.
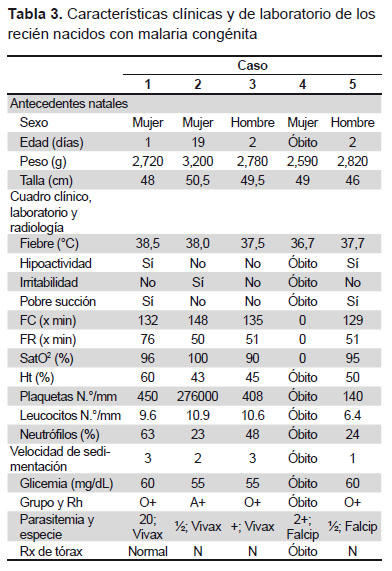
En la Tabla 3 se observa las características clínicas de los cinco neonatos con malaria congénita. Tres recién nacidos fueron mujeres, el peso promedio fue de 2822 g. El promedio de talla fue 48,6 cm. Los cuatro recién nacidos vivos presentaron fiebre desde el nacimiento. Se reportó hipoactividad en dos, irritabilidad en uno y pobre succión en dos. No se observó hipoglicemia en ninguno de los niños vivos. En tres se detectó P. vivax y en dos P. falciparum. Uno de los cinco niños fue óbito y la gota gruesa reportó P. falciparum.
DISCUSIÓN
De las 52 gestantes portadoras de malaria, cinco (9,6%) de los recién nacidos presentaron malaria congénita. El P. vivax fue el parasito más frecuente en ambos. Estudios efectuados previamente en la región Loreto no detectaron MC en recién nacidos de gestantes con MG (10). Parekh et al. describen MG en zonas de baja endemicidad de Loreto (Perú) y no detectaron casos de MC (11) . No se ha descrito MC en recién nacidos en el país, de ahí la importancia de este estudio que demuestra MC en recién nacidos de gestantes con MG en Loreto entre los años 2011 y 2013.
Se encontraron referencias de estudios diversos donde demuestran MC en países vecinos. Así, en Colombia Carmona et al. estudiaron en Antioquia, 2117 gestantes entre las cuales encontraron 220 casos de MG según gota gruesa, con una prevalencia de 10,4%, y MC en cinco recién nacidos con una proporción de MC de 2,7% (12). Oróstegui et al. en Zaragoza, al norte de Antioquía, describen MC en un recién nacido de 19 días, con historia de tres días de fiebre, irritabilidad y pobre succión (13). Sánchez et al. describen un neonato de 20 días procedente de Itungo, Antioquia, con historia de haber sido hospitalizado a los seis días de nacido por cuadro de sepsis neonatal, recibió ampicilina y amikacina por diez días, y fue dado de alta asintomático. Cuatro días después consulta por fiebre, irritabilidad e inapetencia, luego se agrega dificultad respiratoria y erupción petequial asociada con trombocitopenia severa, y gota gruesa positiva a P. vivax. Recibe cloroquina y evoluciona satisfactoriamente (14). Piñeros reporta cinco casos de MC, tres de sexo femenino y diagnosticados en los primeros 21 días, procedentes de Urabá, Antioquia, cuatro casos por P. vivax y uno por P. falciparum, con historia de fiebre, irritabilidad, anorexia, hepatoesplenomegalia, anemia hemolítica e ictericia (1). Agudelo et al., estudian 121 gestantes y determinan una prevalencia de MG de 9,1% (11/21) por gota gruesa y 14% (17/121) por reacción de cadena polimerasa (PCR). No detectaron MC por ambos métodos (15). En Venezuela, Carbajal et al. describen ocho casos de MC en el Hospital Menca de León en el estado de Bolívar, entre 2000 y 2001 con historia de fiebre y palidez, siete de los casos por P. vivax (16). En Brasil, Marques et al. describen dos casos de MC de 5 y 7 semanas de edad, procedentes de los estados de Sao Paulo y Paraná. El primer caso fue hospitalizado por palidez marcada, hepatoesplenomegalia y gota gruesa positiva a P. vivax. El segundo caso, un lactante de 50 días, cuya madre procedía del estado Mato Grosso, con historia de palidez marcada, hepatomegalia y gota gruesa positiva para P. falciparum (17). Chinelato et al. relata un caso de MC en un neonato de 14 días, con historia de fiebre, hepatoesplenomegalia e ictericia, con gota gruesa positiva para P. vivax, recibió cloroquina y evolucionó satisfactoriamente (18).
La MC es una enfermedad infrecuente en el periodo neonatal, sin embargo, en zonas endémicas de la selva y la región norte del Perú, debe considerarse como una posibilidad diagnóstica en recién nacidos de madres que cursan MG y presentan signos y síntomas como fiebre, hipoactividad, irritabilidad, hepatoesplenomegalia y trastornos hematológicos como anemia y plaquetopenia. En los cinco casos descritos en este estudio se observó que cuatro recién nacidos vivos presentaron fiebre; dos hipoactividad y uno de ellos irritabilidad. El diagnóstico en tres de los cuatro recién nacidos vivos se hizo en las primeras 48 horas de nacido. En la mayoría de casos revisados en los reportes de estudios de casos de Colombia, Venezuela y Brasil, se hicieron luego de la primera semana de vida.
La MC es más frecuente en el África, donde hay países que son áreas hiperendémicas para malaria. Mwaniki en Kenya, describe que el P. falciparum es prevalente en la zona norte de Monbaza, de una población de 4790 recién nacidos sometidos a gota gruesa demostró una tasas de prevalencia de 0,35% (19).
En el presente estudio se observó que el 90,4% de recién nacidos procedían de gestaciones a término. El bajo peso al nacer se halló en 14% de los neonatos y estuvo en todos los niños con gota gruesa negativa; además, estos datos surgieren que quizás el problema principal de la malaria congénita en esta zona no sea el bajo peso al nacer sino el menor peso de los neonatos con malaria congénita frente a quienes no la padecen.
Enweronu-Laryea en Ghana, describe en el 2008 a 405 recién nacidos sometidos a la prueba de gota gruesa, nueve de los cuales con MC; cuatro (44%) de los cuales eran prematuros y tenían menos de 2500 g de peso. El mismo autor en el 2010 estudió 522 recién nacidos, en quienes se diagnosticó MC por P. falciparum por PCR en el 12% de los neonatos, reportando que 55% tenían bajo peso al nacer (20). Opara en Ghana reporta gemelos prematuros, el primero con un peso al nacer de 2800 g y el segundo con 2500 g, siendo portadores de malaria congénita a P. falciparum (1). Sin embargo, opina diferente Kalanda, quien reporta que el peso y la talla de recién nacidos de gestantes con malaria son significativamente más bajos en gestantes con malaria que en la población en general, lo cual se asocia a insuficiencia placentaria, a alteraciones del flujo sanguíneo útero placentario y del cordón umbilical, además, a deficiente transferencia placentaria de la glucosa o a la producción inadecuada de insulina fetal (21).
El cuadro clínico que presentan los recién nacidos portadores de malaria congénita es diverso. En el presente estudio, los cuatro recién nacidos vivos presentaron hipoactividad e irritabilidad y pobre succión. Las funciones vitales fueron estables, y no se determinó alteraciones al examen físico regional. No hubo alteración de los niveles de glucosa en sangre, y los radiografía de tórax estaba clara en los cuatro recién nacidos vivos con malaria congénita. Opare describe fiebre e ictericia en gemelos portadores de malaria a P. falciparum (1). Enweronu-Laryea describe fiebre e ictericia (20). Carbajal Sánchez en Venezuela describe ocho recién nacidos con malaria congénita, con fiebre, palidez o ictericia, irritabilidad, convulsiones, hepatoesplenomegalia, anemia y plaquetopenia (16). Sánchez Hernández en Colombia describe un caso de malaria congénita en un neonato de 20 días con fiebre, irritabilidad e inapetencia. Posteriormente, presenta signos de dificultad respiratoria y presencia de exantema petequial generalizado (6600 plaquetas) (14). Mwaniki describe 18 casos con malaria congénita, observando fiebre, convulsiones, hipoglicemia y anemia (19).
En conclusión, la MC es una realidad epidemiológica en el Perú, sobre todo en áreas de alta endemicidad de malaria como Iquitos, con una proporción de MC de 9,6%, que resulta alta en comparación con las tasas de países vecinos de la zona amazónica de Latinoamérica. El diagnóstico oportuno de MC es posible buscando activamente los casos, en todo recién nacido hijo de gestante con malaria, mediante la prueba de gota gruesa. El cuadro clínico característico fue alza térmica, hipoactividad o irritabilidad y pobre succión, sin anemia ni trombocitopenia. Una caso de óbito por P. faliparum, indicaría la mayor virulencia del Plasmodium. Es necesario establecer que las gestantes con malaria deben ser referidas a hospitales, debiendo ser el recién nacido hospitalizado en un servicio de neonatología y sometido a estudio de gota gruesa para el diagnóstico de MC.
Fuentes de financiamiento: autofinanciado
Conflictos de interés: los autores declaran no tener conflictos de interés con el proyecto de investigación.
Referencias Bibliográficas
1. Opare DA. Congenital malaria in newborn twins . Ghana Med J. 2010 Jun;44(2):76-8. [ Links ]
2. Hashemzadeh A, Heydarian F. Congenital malaria in a neonate . Arch Iranian Med 2005;8(3):226-8. [ Links ]
3. Purizaca M. La malaria en la gestación. Rev Peru Ginecol y Obstet 2008;54:131-42. [ Links ]
4. Adegnika AA, Köhler C, Agnandji ST, Chai SK, Labuda L, Breitling LP, et al. Pregnancy-associated malaria affects toll-like receptor ligand-induced cytokine responses in cord blood . J Infect Dis. 2008 Sep 15;198(6):928-36. doi: 10.1086/591057. [ Links ]
5. Parekh FK, Davison BB, Gamboa D, Hernández J, Branch OH. Placental Histopatologic Changes Associated with Subclinical Malaria Infection and Its Impact on the fetal Enviroment . Am J Trop Med Hyg. 2010 Nov;83(5):973-80. doi: 10.4269/ajtmh.2010.09-0445. [ Links ]
6. Oróstegui-Pinilla D, Rodríguez-Morales AJ. Neonatal Plasmodium vivax malaria. Trop Biomed. 2011 Aug;28(2):339-42. [ Links ]
7. Falade C, Mokuolu O, Okafor H, Orogade A, Falade A, Adeodyin O, et al. Epidemiolgy of congenital malaria in Nigeria: a multi-centre study . Trop Med Int Health. 2007 Nov;12(11):1279-87. [ Links ]
8. 8.Celis J, Montenegro R, Castillo A, Che E, Muñoz A. Evolución de la malaria en la región Loreto . An Fac Med. 2003;64(4):261-6. [ Links ]
9. Concejo Nacional del Medio Ambiente. Plan “A limpiar el aire” de la Cuenca Atmosférica de Iquitos , Decreto Nº 011-2006-CONAM/CD (28 abril, 2006). [ Links ]
10. Ramal C, Pinedo P. Malaria en gestantes entre marzo del 2002 y julio del 2003: experiencia en el Hospital Regional de Loreto, Perú . Acta Med Per. 2008;25(4):220-3. [ Links ]
11. Parekh FK, Hernandez JN, Krogstad DJ, Casapia WM, Branch OH. Prevalence and risk of Plasmodium falciparum and P. vivax malaria among pregnant women living in the hypoendemic communities of the Peruvian Amazon . Am J Trop Med Hyg. 2007 Sep;77(3):451-7. [ Links ]
12. Carmona-Fonseca J, Maestre-B A. Incidencia de las Malarias Gestacional, Congénita y Placentaria en Urabá (Antioquia, Colombia), 2005 – 2007 . Rev Colomb Obstet Ginecol. 2009;60(1):19-33. [ Links ]
13. Oróstegui-Pinilla D, Rodríguez-Morales AJ. Neonatal Plasmodium vivax malaria . Trop Biomed. 2011 Aug;28(2):339-42. [ Links ]
14. Sánchez DP, Valencia DL, Uribe JE, Trujillo M, Bustamante C, Uribe A, et al. Malaria congénita por Plasmodium vivax: un caso incidental en contexto de sepsis neonatal . Bol Pediatr. 2012;52(219):33-6. [ Links ]
15. Agudelo O, Arango E, Maestre A, Carmona-Fonseca J. Prevalence of gestational, placental and congenital malaria in north-west Colombia . Malar J. 2013 Sep 23;12:341. doi: 10.1186/1475-2875-12-341. [ Links ]
16. Carvajal CA, Guerrero MJ, Hernández AV. Malaria congénita. Estudio retrospectivo 2000-2011. Hospital Menca de Leoni. Ciudad Guayana-Estado Bolívar . Arch Venez Puer Ped. 2012;75(4):96-9. [ Links ]
17. Marques H, Vallada M, Sakane P, Boulos M. Malária Congênita. Descripção de casos e breve revisão da literatura . J Pediat. 1996;72(2):103-5. [ Links ]
18. Alves MJ, Castor de Lima V, Rangel O, Pignatti M. Malária congênitta no municipio de Leme SP . J Pediat. 1995:71(3):163-5. [ Links ]
19. Mwaniki MK, Talbert AW, Mturi FN, Berkley JA, Kager P, Marsh K, et al. Congenital and neonatal malaria in a rural Kenyan district hospital: An eight.year analysis . Malar J. 2010 Nov 6;9:313. doi: 10.1186/1475-2875-9-313. [ Links ]
20. Enweronu-Laryea CC, Adjei GO, Mensah B, Duah N, Quashie NB. Prevalence of congenital malaria in high-risk Ghanaian newborns: a cross-sectional study . Malar J. 2013 Jan 11;12:17. doi: 10.1186/1475-2875-12-17. [ Links ]
21. Kalanda BF, van Buuren S, Verhoeff FH, Brabin BJ. Anthropometry of fetal growth in rural Malawi in relation to maternal malaria and HIV status . Arch Dis Child Fetal Neonatal. 2005;90:161-5. [ Links ]
Correspondencia: Hermann Silva
Dirección: Calle Brasil 343 Iquitos, Perú.
Celular: 965-613367.
Correo electrónico: silvahermann@hotmail.com
Recibido: 30-06-2014
Aprobado: 08-04-15