Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Revista Peruana de Medicina Experimental y Salud Publica
versión impresa ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.35 no.1 Lima ene./mar. 2018
http://dx.doi.org/10.17843/rpmesp.2018.351.3606
SECCIÓN ESPECIAL
Apuntes y recomendaciones para el establecimiento de programas de control de la teniasis / cisticercosis por Taenia solium en el Perú
Notes and recommendations for the establishment of control programs for taeniasis and cysticercosis due to Taenia solium in Peru
Héctor H. García1,2,3,a,b, Armando E. González1,4,c, Seth E. O’Neal5,a,d, Robert H. Gilman6,a,e, Grupo de Trabajo en Cisticercosis en Perú
1 Centro de Salud Global. Tumbes, Universidad Peruana Cayetano Heredia. Tumbes, Perú.
2 Departamento de Microbiología, Universidad Peruana Cayetano Heredia. Lima, Perú.
3 Unidad de Cisticercosis, Departamento de Neuropediatría y Enfermedades Transmisibles, Instituto Nacional de Ciencias Neurológicas. Lima, Perú.
4 Facultad de Medicina Veterinaria, Universidad Nacional Mayor de San Marcos. Lima, Perú.
5 Departamento de Salud Pública y Medicina Preventiva, Oregon Health & Science University. Portland, Oregon, EE. UU.
6 Departamento de Salud Internacional, Johns Hopkins University. Baltimore, Maryland, EE. UU.
a Médico cirujano b Doctor en salud internacional; c Médico veterinario, Doctor en epidemiología veterinaria; d Magíster en salud pública; e Diploma en medicina tropical.
RESUMEN
La neurocisticercosis es la infección del sistema nervioso por la larva (cisticerco) de la tenia del cerdo (Taenia solium). La neurocisticercosis es la mayor causa de epilepsia adquirida a nivel mundial y por ende un problema de salud pública global. De otro lado, la teniasis/cisticercosis por T. solium es una de las pocas infecciones consideradas potencialmente erradicables. Recientemente, un programa de eliminación de transmisión a gran escala en Tumbes, Perú, demostró la factibilidad de interrumpir la transmisión. Sobre la base de estos avances, se proponen una serie de lineamientos iniciales para poner las bases de programas de control regionales y nacionales de la teniasis/cisticercosis, partiendo de intervenciones simples y factibles a nivel local.
Palabras clave: Cisticercosis; Neurocisticercosis; Teniasis, Taenia solium; Epidemiología; Control de enfermedades transmisibles; Perú (fuente: DeCS BIREME).
ABSTRACT
Neurocysticercosis is a nervous system infection caused by the larvae (cysticercus) of the pork tapeworm (Taenia solium). Neurocysticercosis is the primary cause of acquired epilepsy worldwide and, therefore, a global public health problem. On the other hand, T. solium taeniasis/cysticercosis is one of very few infectious diseases considered to be potentially eradicable. Recently, a large-scale elimination program in Tumbes, Peru, demonstrated the feasibility of interrupting transmission. Based on these advances, a series of initial guidelines are proposed aimed at setting out the foundations for regional and national taeniasis/cysticercosis control programs, with simple and feasible local interventions as a starting point.
Keywords: Cysticercosis; Neurocysticercosis; Taeniasis; Taenia solium; Epidemiology; Communicable disease control; Peru (source: MeSH NLM).
INTRODUCCIÓN
La neurocisticercosis (NCC), infección del sistema nervioso humano por la larva (cisticerco) de la Taenia solium, es una causa importante de epilepsia en el Perú y en la mayoría de países en desarrollo (1). Se presenta también con cierta frecuencia en los países industrializados por causa de la migración desde regiones endémicas y es considerada un problema de salud pública global (2). La teniasis/cisticercosis (T/C) por T. solium es una de las pocas infecciones consideradas potencialmente erradicables (3), lo que hace aún más importante la búsqueda de intervenciones eficaces y plausibles para su control.
El diseño y aplicación de medidas de control en esta enfermedad requieren conocer la dinámica de transmisión del parásito y los factores que intervienen en ella. Para entender la epidemiología de la teniasis y la cisticercosis por T. solium, es crucial separar dos escenarios que son marcadamente diferentes: lo que ocurre en regiones endémicas (4), donde la transmisión es rampante y mucha gente y muchos cerdos se exponen al parásito; y lo que ocurre en regiones no endémicas, donde los casos son menos frecuentes y ocurren en relación a la inmigración o el turismo (5).
T. solium es endémica en gran parte de nuestro país (incluyendo la costa norte, toda la sierra, y la selva alta) (6). En estas zonas la exposición a T. solium es tan frecuente que en muchas comunidades rurales más de la mitad de los cerdos muestran anticuerpos al parásito. Sin embargo, solamente en algunos de estos (5% a 10% del total) se pueden encontrar quistes viables en la carcasa (4). Es probable que otro grupo de animales tengan infecciones con pocos quistes que la necropsia no logra detectar (la mayoría de cerdos con infecciones viables tienen menos de cinco quistes en toda su carcasa) (7), y otro grupo haya resuelto la infección espontáneamente.
La situación en la población humana en áreas endémicas es parecida, encontrándose también muchos individuos seropositivos (5-20%) y una proporción significativa de individuos infectados. De los escasos estudios epidemiológicos aplicando tomografía computarizada se sabe que una proporción de entre 10 y 20% de la población humana desarrolla NCC (8-10). La mayoría de estos individuos tienen calcificaciones cerebrales residuales y aparentemente no presentan síntomas neurológicos. A nivel poblacional, la proporción de individuos con epilepsia es pequeña (menor al 2%), y la NCC contribuye entre el 30 y 40% de casos (11). Sin embargo, cuando esa pequeña fracción de individuos con NCC sintomática se lleva al denominador poblacional, resulta en un número muy significativo de casos, que se concentran en busca de atención en hospitales y centros especializados. Cuando uno examina la información clínica de este tipo de centros, la proporción de individuos con infecciones cerebrales con quistes viables o en degeneración aumenta marcadamente (12-14).
En las regiones no endémicas, en cambio, no hay crianza doméstica de cerdos y los casos de NCC se encuentran en migrantes y con menor frecuencia en individuos con historia de viajes a zonas endémicas (5). Aquí prácticamente no existe transmisión activa. Los casos autóctonos son raros y están también en relación a un portador de tenia que por lo general es un inmigrante de una zona endémica (15).
CONTROL DE LA TENIASIS / CISTICERCOSIS
Existe una larga lista de estudios de transmisión y control en comunidades aisladas, destacándose el de Salama, en Honduras, donde se aplicó una intervención muy amplia enfocada a mejorar las condiciones de salud y las capacidades de atención, con énfasis en teniasis/cisticercosis, en una población de aproximadamente 7 000 personas (16). Esta intervención resultó en una disminución gradual de la transmisión y de la epilepsia. En nuestro país, durante los últimos 12 años, el Grupo de Trabajo en Cisticercosis en Perú llevó a cabo un programa de eliminación de transmisión en una población de 80 000 personas en Tumbes rural. En este programa se demostró la factibilidad de interrumpir la transmisión y que el efecto perdura por un año o más (17).
La demostración de que la eliminación es posible en vista de los resultados del programa arriba referido marca un hito hacia el avance en el control, eliminación y erradicación de la Taenia solium. Información como la seguridad de la administración de niclosamida en gran escala, la identificación de casos mediante la detección de coproantígenos, el uso masivo de oxfendazole y la vacuna TSOL18 en la población porcina, y las tasas de participación obtenidas, proveen caminos de utilidad para el diseño de futuros programas. De otro lado, el esquema de intervención utilizado fue complejo e involucró varias rondas de tratamiento masivo a la población humana y porcina, además de una vacuna para la población porcina.
También es evidente que se requiere una apropiada coordinación con las autoridades locales, la identificación de subgrupos poblacionales que pudieran ser reacios a participar y quedar como focos residuales de infección, y el diseño de sistemas de vigilancia posintervención. Nuestra percepción de la agenda futura es simplificar el esquema, proveer herramientas robustas y baratas, y ajustar los esquemas de intervención a diferentes realidades en estudios piloto. Es muy importante no lanzarse a intervenciones de control no planificadas y sin indicadores de medición de efecto porque el resultado podría ser contraproducente. La falla de un programa de control lleva al desánimo de la población y de las instituciones a cargo de la toma de decisiones.
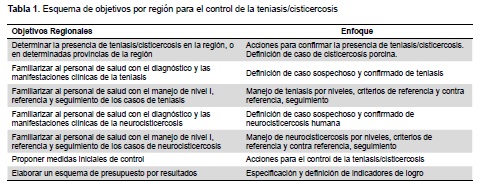
A continuación y partiendo de un concepto de organización por regiones ponemos a consideración algunos lineamientos que esperamos sean de utilidad en este camino, resumido en la Tabla 1 y detallado en las siguientes páginas.
MEDIDAS BASALES
Esta primera sección presenta un esquema básico de registro y un enfoque primario del manejo de los focos de transmisión y los casos de teniasis y cisticercosis, que se debería implementar independientemente de la presencia o no de un programa organizado de control/eliminación. Dependiendo del tipo de acción, se debe identificar una estructura local dependiente del Ministerio de Salud o del Ministerio de Agricultura (o un comité responsable) que tome responsabilidad por la acción y su registro. Los reportes deben centralizarse a nivel regional y nacional en las instancias correspondientes.
Confirmación de la presencia de T/C / Identificación de focos de cisticercosis porcina. El dato de mayor importancia, tanto para un programa de control o eliminación de la teniasis/cisticercosis, como para el manejo primario de los focos de transmisión y los casos de infección, es definir si existe transmisión local de T/C en cada provincia o por distritos, para definir áreas endémicas y no endémicas. Esto permitiría definir las áreas en las cuales se debe invertir tiempo y esfuerzo en implementar sistemas de diagnóstico y manejo de casos, y al mismo tiempo definir las áreas que requieren un programa activo de control/eliminación. La determinación exacta de los niveles de prevalencia no es contributoria en la práctica y en general no cambia la necesidad contributoria de actividades de control (6,18).
La evidencia epidemiológica sugiere que la T/C establece un nivel de endemicidad usual, con un rango de variación razonable, para mantener su transmisión (4,19). En este sentido, si el objetivo de un programa es la eliminación, como es nuestra opinión, el grado de endemicidad (el nivel exacto de prevalencia) es un dato de poca utilidad práctica dado que lo que se plantea es la eliminación de la transmisión expandiendo áreas geográficas libres de transmisión, que deben definirse desde los lugares más alejados de la migración y expandirse gradualmente a las zonas aledañas en una manera concéntrica, independiente de su grado de endemicidad (17).
De otro lado, uno podría sentirse tentado a estimar la prevalencia poblacional de teniasis, cisticercosis porcina, o neurocisticercosis, a fin de focalizar acciones de control. Esta posición asume dos conceptos: a) que las medidas de control a proponerse no son lo suficientemente prácticas y de bajo costo como para implementarse en todos los distritos endémicos (lo contrario discriminaría innecesariamente a los distritos de baja endemicidad, que igual tienen T/C; y b) que las medidas de control no apuntan hacia la eliminación (si se busca eliminación, hacerla en áreas no colindantes tiene poco sentido práctico y propiciaría el fracaso por reintroducción desde las zonas endémicas vecinas) (17). Aun si se considera el control más que la eliminación, el valor relativo de los estimados basales de prevalencia es muy limitado.
En este sentido, proponemos que las acciones iniciales para confirmar la presencia de la T/C se enfoquen en el hallazgo de cerdos con cisticercosis. A diferencia de la teniasis, la cisticercosis porcina es muy conocida por los pobladores, que la llaman "triquina". Si bien el hallazgo de una persona con teniasis por Taenia solium confirma un foco de transmisión, la población porcina es un indicador con mayor prevalencia y renovación poblacional rápida (18,20), lo que permitiría establecer un sistema más sensible. Se deben definir distritos con evidencia de transmisión activa de T/C y elaborar un mapa regional y nacional de áreas endémicas. Para esto, proponemos una definición de transmisión activa referida a la presencia en el último año de casos de cisticercosis porcina, la se puede definir inicialmente en base a reportes verbales utilizando un texto predefinido a ser preguntado a los agentes de salud locales. En una segunda etapa se podría pedir la recolección de quistes por distrito o caserío para su confirmación microscópica. Un sistema de reporte de cisticercosis porcina debe tener en cuenta los reglamentos sanitarios que indican el decomiso e incineración de la carcasa infectada, lo cual en la práctica anula la posibilidad de reporte de casos de parte de los campesinos por temor a perder la carne. Aquí proponemos las siguientes definiciones inclusivas:
CASO SOSPECHOSO
a) Cerdo en el que se hayan palpado o detectado por inspección visual nódulos en la base de la lengua.
b) Cerdo en el que al sacrificio se encuentran quistes sospechosos de cisticercosis (pequeños, blanquecinos).
CASO CONFIRMADO
Confirmación del diagnóstico por examen microscópico de un quiste preservado en alcohol o formol.
Para viabilizar este registro, lo primero a establecerse sería un registro de información epidemiológica (reporte de casos) en base a la red de centros de salud y/o promotores locales. Se debe informar a la población que la carne con cisticercosis no debe ser consumida, o en su defecto debe ser frita en pedazos muy pequeños. En una siguiente etapa se podría educar a la población para que traiga al centro de salud o a la instancia responsable en el sector veterinario, pedazos pequeños de tejido con lesiones sospechosas de ser quistes. Considerando la reticencia normal de los pobladores a reportar animales enfermos por el riesgo de confiscación u otras medidas punitivas, es posible que un programa de incentivos pudiera ser necesario para los reportes iniciales. De ser el caso, uno de los requerimientos debe incluir la confirmación del lugar de origen del cerdo infectado.
También es importante precisar las acciones subsiguientes al reporte de un caso de cisticercosis porcina. La evidencia existente, en adición al sentido común, sugieren el agrupamiento de la cisticercosis porcina alrededor de un humano con teniasis (21-23). Ante el reporte de un cerdo con cisticercosis, un esquema básico de intervención consistiría en dar oxfendazole (24-26) a todos los cerdos de la casa, y hacer un tamizaje para teniasis a todos los habitantes de la casa y posiblemente los de las casas vecinas. Esto debe incluir informar a la población de que los animales tratados con oxfendazole no deben ser sacrificados por al menos dos semanas luego del tratamiento, periodo en el que puede haber residuos del antiparasitario en la carne (27). Alternativamente se podría dar también tratamiento con niclosamida a los habitantes de la vivienda, en cuyo caso lo más aconsejable seria recolectar una muestra de heces inmediatamente postratamiento para identificar a las personas infectadas y confirmar su cura. No hay que olvidar también los aspectos de bioseguridad en el tratamiento de individuos sospechosos de ser portadores de T. solium. Quedaría por evaluar el costo-beneficio de hacer tamizaje de neurocisticercosis sintomática, dado el largo tiempo entre infección y presentación de los síntomas.
Definición de caso sospechoso y confirmado de teniasis. La teniasis por T. solium es raramente notada por los afectados, a diferencia de las infecciones por T. saginata (28). Es muy probable que un sistema de autoreporte resulte en detección de casos de T. saginata en su mayoría. Aquí proponemos la incorporación de definiciones de caso sospechoso y de caso confirmado. Esto se podría asumir inicialmente, al igual que el punto anterior, en base a reportes verbales utilizando un texto predefinido a ser preguntado a los agentes de salud locales, y debería coincidir con las áreas de endemicidad de la cisticercosis porcina. Una segunda etapa podría pedir la recolección de heces y/o material parasitario para confirmación microscópica en un centro de segundo nivel. Dado que la sensibilidad del examen microscópico de heces en el diagnóstico de teniasis por Taenia solium es muy pobre, un resultado negativo no excluye esta parasitosis. Idealmente se debería establecer el diagnóstico inmunológico mediante el examen de coproantígeno (29,30), al menos en las cabeceras de red. Los resultados de la prueba de coproantígeno deben interpretarse en relación al punto de corte de la prueba y muchas veces los positivos débiles no se correlacionan con infección activa por la tenia intestinal.
CASO SOSPECHOSO DE TENIASIS
a) Persona que refiera haber expulsado parásitos o pedazos de parásitos planos, blanquecinos o amarillentos.
b) Moradores de una casa donde se haya encontrado un cerdo con quistes vivos al sacrificio.
CASO CONFIRMADO DE TENIASIS
Examen de heces positivo en microscopía y detección de coproantígeno.
De acuerdo a lo descrito líneas arriba, las acciones sugeridas incluyen la recolección de heces de casos sospechosos, pre-procesamiento (fijación en buffer fosfato [PBS] formolado), y su envió a un centro local de confirmación para microscopía y coproantígeno. Si es positivo, se debe coordinar el tratamiento apropiado de acuerdo al punto siguiente.
Manejo de teniasis por niveles, criterios de referencia y contra referencia, seguimiento. El tratamiento de la teniasis es de extrema importancia para la prevención de casos de cisticercosis y para ayudar al control de la enfermedad. Hay que tener en cuenta también los aspectos de bioseguridad para el personal de salud, el paciente y su entorno dado que la manipulación de heces infectadas con T. solium puede resultar en cisticercosis o neurocisticercosis. Debe ser realizado bajo supervisión médica para prevenir o manejar efectos adversos de la purga o la medicación, y para evitar la contaminación por contacto con las heces infectivas (31).
La droga de elección es la niclosamida. El uso de praziquantel en el tratamiento de la teniasis podría generar crisis epilépticas en individuos que tengan NCC asintomática, por lo que no es recomendable mientras no se haya descartado NCC por neuroimagen (tomografía axial computarizada o resonancia magnética) y serología (1).
El paciente debe seguir una dieta blanda estricta por lo menos por dos días. En la mañana del día del tratamiento se debe administrar una purga ligera. Una vez que se obtienen deposiciones líquidas se debe dar la dosis correspondiente de niclosamida (2 gramos vía oral para adultos, 1 gramo en niños mayores de 6 años). Dos horas después de la niclosamida se administra una segunda purga (30,31). Todo el proceso debe ser acompañado de abundante hidratación oral, para evitar la deshidratación o trastornos electrolíticos y para facilitar la purga y eliminación del gusano. Desde el diagnóstico de teniasis, todas las heces deben ser colectadas en recipientes descartables y eliminadas con bioseguridad, lo que implica definir y establecer un sistema apropiado de eliminación. Sería recomendable referir a los pacientes a un centro de salud de nivel 2 o superior para el tratamiento y observación por algunas horas luego de la purga.
Cuando sea posible, una nueva muestra de heces debe ser colectada 15 días postratamiento y enviada para detección de coproantígenos en un laboratorio de referencia a fin de confirmar la cura del paciente (17,30). La confirmación de cura es muy importante porque en casos de falla terapéutica no detectados todos los esfuerzos hechos habrían sido enteramente inútiles.
Debe realizarse una buena historia clínica. Los pacientes con teniasis y una historia de crisis epilépticas u otros síntomas neurológicos deben ser referidos a un centro de nivel 3 o superior para diagnóstico de neurocisticercosis.
Definición de caso sospechoso y confirmado de neurocisticercosis humana. No existen definiciones operacionales para casos de cisticercosis a nivel de poblaciones endémicas. Las siguientes propuestas de definiciones se enmarcan en los cuadros más frecuentes asociados a la neurocisticercosis:
CASO SOSPECHOSO DE NEUROCISTICERCOSIS
a) Individuo con historia de eventos episódicos compatibles con crisis epilépticas: pérdida del conocimiento, movimientos involuntarios de manos, brazos o piernas, visión de luces, etc. Particularmente si estos se inician luego de los 15 años de edad.
b) Individuo con síntomas compatibles con aumento de la presión intracraneal: dolor de cabeza severo, mareos, vómitos.
c) Individuo con síntomas neurológicos y nódulos subcutáneos palpables.
CASO CONFIRMADO DE NEUROCISTICERCOSIS
Individuo con síntomas neurológicos y un examen de imagen cerebral (tomografía computarizada o resonancia magnética) demostrando lesiones compatibles con NCC, o con síntomas neurológicos y una prueba positiva de Western blot para anticuerpos a cisticercosis (32).
Manejo de NCC por niveles, criterios de referencia y contra referencia, seguimiento. En el caso de pacientes sospechosos de NCC (casos de epilepsia o hipertensión endocraneana en zonas endémicas) se debe seguir lo indicado en la guía de práctica clínica para el manejo de la cisticercosis publicada por el Instituto Nacional de Ciencias Neurológicas (33), tanto para el manejo por niveles como para su referencia, contra referencia y seguimiento.
ACCIONES PARA EL CONTROL Y ELIMINACIÓN DE LA TENIASIS/CISTICERCOSIS
En una etapa inicial, el control comunitario de la T/C debe enfocarse a la detección y tratamiento de casos de teniasis, tratamiento de cerdos sospechosos con oxfendazole, y la disminución de conductas de riesgo: no comer carne con cisticercosis, incentivar el lavado de manos y el uso de letrinas.
A pesar de que ya hemos demostrado que es factible eliminar la transmisión de T. solium (17,30), queda un camino muy largo por recorrer que incluye la simplificación del programa usado en Tumbes, la definición de sistemas de monitoreo y vigilancia posintervención, la adaptación de las intervenciones y monitoreo a diferentes realidades locales, etc. Están en curso programas de evaluación de las intervenciones de control utilizadas en Tumbes, que incluyen tratamiento masivo de la población humana con niclosamida, tratamiento masivo de la población porcina con oxfendazole, y vacunación de la población porcina, a fin de simplificar este esquema y poner las herramientas a disposición de las áreas endémicas. A la fecha, no existe aún una estrategia definida y probada para su aplicación práctica a gran escala. En este contexto, mientras no se haya definido un esquema óptimo, las acciones de control arriba descritas proveen una primera línea de acción hasta que exista un programa regional o nacional.
DEFINICIÓN DE INDICADORES DE LOGRO PARA LOS NIVELES I Y II
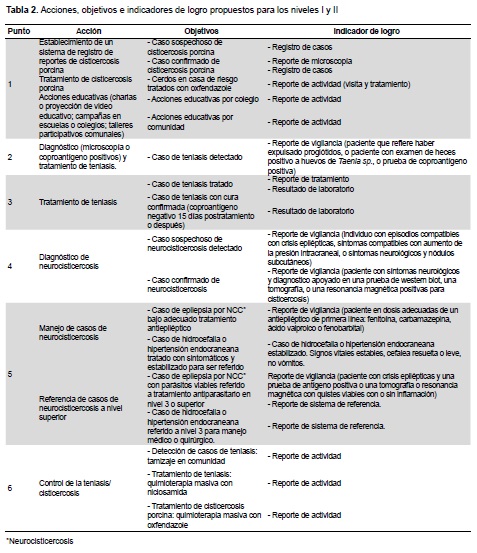
Dentro del esquema operacional de los organismos del estado, es clave definir indicadores apropiados para poder operacionalizar las acciones en teniasis/cisticercosis. La Tabla 2 presenta sugerencias para cada uno de los puntos discutidos en este manuscrito.
El objetivo final de la investigación biomédica es la mejora de las condiciones de salud y de vida de la sociedad, y dentro de este camino el rol de los grupos de investigación como el nuestro es proveer la evidencia e instrumentos para que los resultados investigacionales se conviertan en políticas de salud en los casos apropiados. A nivel nacional, el Ministerio de Salud y el Ministerio de Agricultura son los responsables de las acciones hacia el control de la teniasis/cisticercosis, en colaboración con las direcciones regionales de salud y la academia. Para cumplir lo pasos propuestos, es necesaria una organización a nivel local, regional y nacional en salud humana y veterinaria, en educación y a nivel social, con la debida asignación presupuestal que haga factible su funcionamiento.
El establecimiento de esta organización requiere la correspondiente toma de decisiones al nivel central o regional. La neurocisticercosis es un contribuyente mayor a la enfermedad neurológica en el Perú. Esperamos que los conceptos presentados líneas arriba sirvan de insumo para que se implementen actividades, inicialmente acciones basales y luego, eventualmente, programas de control regionales o un programa nacional.
Contribuciones de los autores: HG, AE, and RG participaron en la concepción y diseño del artículo; HG, AE y SO participaron en el análisis e interpretación de datos; HG, AE, RG y SO participaron en la redacción del artículo; Revisión crítica del artículo y la aprobación de la versión final.
Fuentes de financiamiento: autofinanciado.
Conflictos de interés: los autores manifiestan no tener conflictos de interés en la publicación del artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. Garcia HH, Nash TE, Del Brutto OH. Clinical symptoms, diagnosis, and treatment of neurocysticercosis. Lancet Neurol. 2014;13(12):1202-15. [ Links ]
2. Cantey PT, Coyle CM, Sorvillo FJ, Wilkins PP, Starr MC, Nash TE. Neglected parasitic infections in the United States: Cysticercosis. Am J Trop Med Hyg. 2014;90(5):805-9. [ Links ]
3. Schantz PM, Cruz M, Sarti E, Pawlowski Z. Potential eradicability of taeniasis and cysticercosis. Bulletin of the Pan American Health Organization. 1993;27(4):397-403. [ Links ]
4. Garcia HH, Gonzalez AE, Gilman RH, Moulton LH, Verastegui M, Rodriguez S, et al. Combined human and porcine mass chemotherapy for the control of T. solium. Am J Trop Med Hyg. 2006;74(5):850–5. [ Links ]
5. Giordani MT, Tamarozzi F, Cattaneo F, Brunetti E. Three cases of imported neurocysticercosis in Northern Italy. J Travel Med. 2014;21(1):17-23. [ Links ]
6. Garcia HH, Gonzalez AE, Rodriguez S, Gonzalvez G, Llanos-Zavalaga F, Tsang VC, et al. Epidemiologia y control de la cisticercosis en el Peru. Rev Peru Med Exp Salud Publica. 2010;27(4):592-7. [ Links ]
7. Sciutto E, Martinez JJ, Villalobos NM, Hernandez M, Jose MV, Beltran C, et al. Limitations of current diagnostic procedures for the diagnosis of Taenia solium cysticercosis in rural pigs. Vet Parasitol. 1998;79(4):299-313. [ Links ]
8. Montano SM, Villaran MV, Ylquimiche L, Figueroa JJ, Rodriguez S, Bautista CT, et al. Neurocysticercosis: association between seizures, serology, and brain CT in rural Peru. Neurology. 2005;65(2):229-33. [ Links ]
9. Del Brutto OH, Santibanez R, Idrovo L, Rodriguez S, Diaz-Calderon E, Navas C, et al. Epilepsy and neurocysticercosis in Atahualpa: a door-to-door survey in rural coastal Ecuador. Epilepsia. 2005;46(4):583-7. [ Links ]
10. Medina MT, Duron RM, Martinez L, Osorio JR, Estrada AL, Zuniga C, et al. Prevalence, incidence, and etiology of epilepsies in rural Honduras: the Salama Study. Epilepsia. 2005;46(1):124-31. [ Links ]
11. Moyano LM, Saito M, Montano SM, Gonzalvez G, Olaya S, Ayvar V, et al. Neurocysticercosis as a cause of epilepsy and seizures in two community-based studies in a cysticercosis-endemic region in Peru. PLoS Negl Trop Dis. 2014;8(2):e2692. [ Links ]
12. Takayanagui OM, Jardim E. [Clinical aspects of neurocysticercosis: analysis of 500 cases]. Arq Neuropsiquiatr. 1983;41(1):50-63 [ Links ]
13. Sotelo J, del Brutto OH, Penagos P, Escobedo F, Torres B, Rodriguez-Carbajal J, et al. Comparison of therapeutic regimen of anticysticercal drugs for parenchymal brain cysticercosis. J Neurol. 1990;237(2):69-72. [ Links ]
14. Garcia HH, Gilman RH, Tovar MA, Flores E, Jo R, Tsang VC, et al. Factors associated with Taenia solium cysticercosis: analysis of nine hundred forty-six Peruvian neurologic patients. Cysticercosis Working Group in Peru (CWG). Am J Trop Med Hyg. 1995;52(2):145-8. [ Links ]
15. Schantz PM, Moore AC, Munoz JL, Hartman BJ, Schaefer JA, Aron AM, et al. Neurocysticercosis in an Orthodox Jewish community in New York City. N Engl J Med 1992;327:692-695. [ Links ]
16. Medina MT, Aguilar-Estrada RL, Alvarez A, Duron RM, Martinez L, Dubon S, et al. Reduction in rate of epilepsy from neurocysticercosis by community interventions: the Salama, Honduras study. Epilepsia. 2011;52(6):1177-85. [ Links ]
17. Garcia HH, Gonzalez AE, Tsang VC, O’Neal SE, Llanos-Zavalaga F, Gonzalvez G, et al. Elimination of Taenia solium Transmission in Northern Peru. N Engl J Med 2016;375:1196-1197.
18. Garcia HH, Gonzalez AE, Del Brutto OH, Tsang VC, Llanos-Zavalaga F, Gonzalvez G, et al. Strategies for the elimination of taeniasis/cysticercosis. J Neurol Sci. 2007;262(1-2):153-7. [ Links ]
19. Coral-Almeida M, Gabriel S, Abatih EN, Praet N, Benitez W, Dorny P. Taenia solium Human Cysticercosis: A Systematic Review of Sero-epidemiological Data from Endemic Zones around the World. PLoS Negl Trop Dis. 2015;9(7):e0003919. [ Links ]
20. Gonzalez AE, Garcia HH, Gilman RH, Tsang VC. Control of Taenia solium. Acta Tropica. 2003;87(1):103-9. [ Links ]
21. Sarti-Gutierrez EJ, Schantz PM, Lara-Aguilera R, Gomez Dandoy H, Flisser A. Taenia solium taeniasis and cysticercosis in a Mexican village. Trop Med Parasitol. 1988;39(3):194-8. [ Links ]
22. Lescano AG, Garcia HH, Gilman RH, Guezala MC, Tsang VC, Gavidia CM, et al. Swine cysticercosis hotspots surrounding Taenia solium tapeworm carriers. Am J Trop Med Hyg. 2007;76(2):376-83. [ Links ]
23. O’Neal SE, Moyano LM, Ayvar V, Gonzalvez G, Diaz A, Rodriguez S, et al. Geographic correlation between tapeworm carriers and heavily infected cysticercotic pigs. PLoS Negl Trop Dis. 2012;6(12):e1953.
24. Gonzales AE, Garcia HH, Gilman RH, Gavidia CM, Tsang VC, Bernal T, et al. Effective, single-dose treatment or porcine cysticercosis with oxfendazole. Am J Trop Med Hyg. 1996;54(4):391-4. [ Links ]
25. Gonzalez AE, Falcon N, Gavidia C, Garcia HH, Tsang VC, Bernal T, et al. Treatment of porcine cysticercosis with oxfendazole: a dose-response trial. Veterinary Record. 1997;141(16):420-2. [ Links ]
26. Gonzalez AE, Falcon N, Gavidia C, Garcia HH, Tsang VC, Bernal T, et al. Time-response curve of oxfendazole in the treatment of swine cysticercosis. Am J Trop Med Hyg. 1998;59(5):832-6. [ Links ]
27. Moreno L, Lopez-Urbina MT, Farias C, Domingue G, Donadeu M, Dungu B, et al. A high oxfendazole dose to control porcine cysticercosis: pharmacokinetics and tissue residue profiles. Food Chem Toxicol. 2012;50(10):3819-25. [ Links ]
28. Flisser A, Vazquez-Mendoza A, Martinez-Ocana J, Gomez-Colin E, Leyva RS, Medina-Santillan R. Short report: evaluation of a self-detection tool for tapeworm carriers for use in public health. Am J Trop Med Hyg. 2005;72(5):510-2. [ Links ]
29. Allan JC, Avila G, Garcia Noval J, Flisser A, Craig PS. Immunodiagnosis of taeniasis by coproantigen detection. Parasitology. 1990;101 Pt 3:473-7.
30. Bustos JA, Rodriguez S, Jimenez JA, Moyano LM, Castillo Y, Ayvar V, et al. Detection of Taenia solium taeniasis coproantigen is an early indicator of treatment failure for taeniasis. Clin Vaccine Immunol. 2012;19(4):570-3. [ Links ]
31. Jeri C, Gilman RH, Lescano AG, Mayta H, Ramirez ME, Gonzalez AE, et al. Species identification after treatment for human taeniasis. Lancet. 2004;363(9413):949-50. [ Links ]
32. Tsang VC, Brand JA, Boyer AE. An enzyme-linked immunoelectrotransfer blot assay and glycoprotein antigens for diagnosing human cysticercosis (Taenia solium). J Infect Dis. 1989;159(1):50-9. [ Links ]
33. Instituto Nacional de Ciencias Neurologicas. Guia de práctica clínica de neurocisticercosis. Lima, Peru. 2014 [Citado el 21 de Octubre 2017] [ Links ].
Correspondencia: Hector H. Garcia
Dirección: Centro de Salud Global. Universidad Peruana Cayetano Heredia, Av. H. Delgado 430, SMP, Lima 31, Perú.
Teléfono: 3287360
Correo electrónico: hgarcia@jhsph.edu
Recibido: 27/10/2017
Aprobado: 17/01/2018
En línea: 05/04/2018