Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.35 no.1 Lima Jan./Mar. 2018
http://dx.doi.org/10.17843/rpmesp.2018.351.3607
CARTAS AL EDITOR
Alta resistencia antimicrobiana a fluoroquinolonas por Campylobacter en pacientes pediátricos de un hospital peruano
High-antimicrobial resistance to fluoroquinolones by Campylobacter in pediatric patients in a peruvian hospital
Jeel Moya-Salazar1,2,a, Alfonso Terán-Vásquez1,b,c,d, Richard Salazar-Hernández3,a
1 Servicio de Patología Clínica, Hospital Nacional Docente Madre Niño San Bartolomé. Lima, Perú.
2 Facultad de Ciencias de la Salud, Universidad Continental. Huancayo, Perú.
3 Hospital Nacional Guillermo Almenara Irigoyen. Lima, Perú.
a Tecnólogo médico; b Licenciado en educación física; c Técnico especializado en Laboratorio clínico; d Magíster en educación
Sr. Editor. En el año 2017 la Organización Mundial de la Salud publicó una lista de bacterias con alta resistencia a antimicrobianos e hizo un especial llamado para la búsqueda de nuevos fármacos para luchar contra la resistencia (1). En la lista, se incluye al Campylobacter como un patógeno de alta prioridad debido a su progresiva, alarmante y alta resistencia a fluoroquinolonas a nivel global.
Así también, en Perú se ha descrito este fenómeno de resistencia a fluoroquinolonas durante la década pasada (2), lo cual se constituye en un riesgo y preocupación para la salud. Asimismo, se debe tener en cuenta que la campylobacteriosis es la infección bacteriana más común a nivel mundial y se presenta cada vez mayor frecuencia de resistencia a drogas de uso frecuente (macrólidos y fluoroquinolonas) con implicancias en pediatría que son inconmensurables, por tratarse de una población crítica donde raramente se usan fluoroquinolonas y tretaciclinas como tratamiento (3).
Con la finalidad de determinar la sensibilidad antimicrobiana de Campylobacter aislados en pacientes pediátricos de un hospital de la ciudad de Lima, realizamos un estudio en el área de microbiología del Departamento de Ayuda al Diagnóstico del Hospital Nacional Docente Madre Niño San Bartolomé en dos periodos comprendidos entre noviembre de 2012 a febrero de 2013, y diciembre de 2014 a julio de 2015. Estos periodos fueron establecidos por la alta frecuencia de aislamientos de enteropatógenos durante los meses de verano y para evaluar la diferencia de susceptibilidad microbiana entre los años de estudio. Se incluyeron muestras de heces de pacientes sintomáticos (neonatos y hasta los 24 meses) colectadas, previo consentimiento informado, en consultorios externos y transportadas en viales estériles al área de microbiología del hospital, siendo incluidas en el estudio aquellas con reacción inflamatoria positiva.
Todas las muestras fecales fueron conservadas en el sistema de transporte BBL Culture Swab™ Plus (Le Pont de Claix, Francia) o en agar Amies (Oxoid, Wade Road, Inglaterra) a temperatura ambiente hasta su procesamiento. Las muestras fueron cultivadas en siete medios de cultivo, en agar Karmali (Merck, Darmstadt, Alemania), y agar sangre de carnero 5% con filtro de membrana Grid GN-6 Metricel® de 0,45μm, 47mm (Pall, Nueva York, EE. UU.) para el aislamiento de Campylobacter. Los aislamientos se verificaron por microscopia con tinción Gram interrumpido, y los agares se incubaron a 42±1 °C por 72 horas en microareofilia (5% O2, 10% CO2 y 85% N2) (4). Campylobacter jejuni subsp. jejuni ATCC 33291 fue empleado como control de calidad, y la identificación de especies se realizó por hidrólisis del hipurato.
Para el análisis de sensibilidad se utilizó discos de eritromicina y ciprofloxacino sobre el agar Mueller-Hinton suplementado con 5% de sangre de carnero bajo la normatividad de las guías M45 y M100S de la Clinical and Laboratory Standards Institute. El inóculo se ajustó a una densidad de 0,5 Mc Farland (~1,5×108 UFC/ml) e incubó a 42±1 °C durante 48 horas en condiciones de microaerofilia. Para determinar la concentración mínima inhibitoria (MIC) se extrapolaron los datos de inhibición del diámetro de los halos (obtenidos por el método de Kirby-Bauer) en la curva de regresión de cada antibiótico como se ha reportado previamente (5). Cabe precisar que como parte de los procesos de vigilancia, las cepas con resistencia son evaluadas periódicamente por el Instituto Nacional de Salud del Perú.
Se obtuvieron 150 aislamientos de Campylobacter, la especie con mayor frecuencia fue Campylobacter coli con 51%, seguido por 29,3% (44 cepas) de Campylobacter spp (cepas donde no se han determinado las especies), y 30% (44 cepas) fueron aislamientos fueron Campylobacter jejuni. De los cuales, 140 (93,3%) cepas presentaron resistencia, la resistencia relacionada con ciprofloxacino fue de 87% (en 131 cepas), y la resistencia para eritromicina fue de 7,3% (11 cepas). Cuando se analizaron las resistencia antimicrobiana con MIC se evidenció que la frecuencia de resistencia para ciprofloxacino disminuyó a 80,7% (121 cepas), y los resultados intermedios disminuyeron a 1,3% (dos cepas), tres veces menos que en su determinación por el método de disco difusión (Tabla 1).
Además, siete aislamientos presentaron resistencia a ambos antimicrobianos (tres fueron C. coli, dos C.jejuni, y dos fueron C. spp) que fueron obtenidos de muestras provenientes de pacientes menores de un año. Un total de 110 (73 %) pacientes fueron menores de un año, 80 (53,3 %) pacientes mostraron resistencia a ciprofloxacino. Dos (1,3 %) recién nacidos presentaron resistencia a ciprofloxacino, y el promedio de edad fue 9±4,7 meses. No se encontró diferencia significativa entre los años de estudio (p=0,710) ni entre la edad de los pacientes (p=0,801).
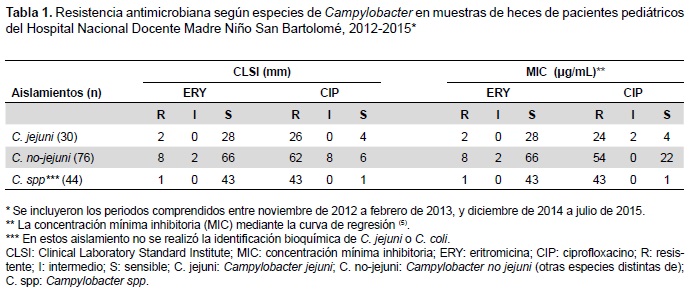
Los hallazgos del presente estudio muestran una alta resistencia antimicrobiana a fluoroquinolonas en menores de dos años, donde la especie más frecuentemente aislada fue Campylobacter coli. Esta situación refleja una tendencia similar que ha sido reportada en el mundo.
La mutación en el gen de regulación de girasa (gyrA) ocasiona resistencia a fluoroquinolonas, además se han relacionado gran parte de esta resistencia con el uso indiscriminado y masivo de fluoroquinolonas (suceso común en el Perú), y con el uso de antibióticos en la industria de comida animal y la agricultura (2,3,6). La resistencia a fluoroquinolonas es variable en el mundo entero con rangos de entre 14,3 a 1288,8 por cada 100 000 habitantes (3). Los resultados del presente estudio muestran una resistencia en 87% de los aislamientos de Campylobacter que concuerdan con reportes previos en varias regiones del Perú (Cusco 82,8% y Lima 89,8%) (2).
La resistencia a macrólidos en este estudio fue globalmente baja, coincidente con lo reportado por Fernández que indica una prevalencia de 17% (6). Esta baja tasa de resistencia refleja la baja frecuencia de mutación genética para estos medicamentes, y el poco uso de macrólidos en el tratamiento de campylobacteriosis.
En conclusión, reportamos una significativa frecuencia de resistencia a fluoroquinolonas y bajos aislamientos con resistencia a macrólidos. Esta actual situación refleja la necesidad de implementar programas de vigilancia en diversas regiones del Perú para la estimación real y ampliada de resistencia a estos fármacos, y para el uso apropiado de antimicrobianos.
Contribuciones de los autores: JMS, ATV y RSH realizaron la concepción y diseño del estudio, recogieron y analizaron las muestras, revisaron críticamente el manuscrito y aprobaron la versión final. JMS realizó la revisión bibliográfica, análisis de muestras y redacción del manuscrito. JMS y ATV participaron en el control de calidad de equipos. ATV desarrolló los protocolos de análisis. JMS y RSH realizaron el análisis de datos y elaboración de tablas y gráficos.
Fuentes de financiamiento: autofinanciado.
Conflicto de intereses: los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Organización Mundial de la Salud. La OMS publica la lista de las bacterias para las que se necesitan urgentemente nuevos antibióticos [Internet]. Geneva: WHO; 2017 [citado el 29 de noviembre de 2017] Disponible en: http://www.who.int/mediacentre/news/releases/2017/bacteria-antibiotics-needed/es/ [ Links ]
2. Pollett S, Rocha C, Zerpa R, Patiño L, Valencia A, Camiña M, et al. Campylobacter antimicrobial resistance in Peru: a ten-year observational study. BMC Infect Dis. 2012;12:193. doi: 10.1186/1471-2334-12-193. [ Links ]
3. Wang SM, Huang FH, Wu CH, Tang KS, Tao MM. Clinical significance of erythromycin-resistant Campylobacter jejuni in children. J Microbiol Immunol Infect. 2011;44(1):63-6. https://doi.org/10.1016/j.jmii.2011.01.012. [ Links ]
4. Moya-Salazar J, Pio-Dávila L, Terán-Vásquez A, Olivo LJ. Yield diagnosis of blood agar with filter against karmali agar for isolation of Campylobacter in stool culture. Horiz Med. 2016; 16(3):58-65. [ Links ]
5. Kahlmeter G, Brown DF, Goldstein FW, MacGowan AP, Mouton JW, Osterlund A, et al. European harmonization of MIC breakpoints for antimicrobial susceptibility testing of bacteria. J Antimicrob Chemother. 2003; 52(2):145-8. [ Links ]
6. Fernandez H. Campylobacter and campylobacteriosis: a view from South America. Rev Peru Med Exp Salud Publica. 2011;28(1):121-27. [ Links ]
Correspondencia: Jeel Moya Salazar
Dirección: Calle Pacífico 957, Urb. San Felipe, Lima 51001, Perú.
Teléfono: (+511) 986014954
Correo electrónico: jeel.moyasalazar@icloud.com
Recibido: 08/02/2018
Aprobado: 07/03/2018
En línea: 04/04/2018














