Serviços Personalizados
Journal
Artigo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares em
SciELO
Similares em
SciELO
Compartilhar
Revista Peruana de Medicina Experimental y Salud Publica
versão impressa ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.35 no.4 Lima out./dez. 2018
http://dx.doi.org/10.17843/rpmesp.2018.354.3532
ARTÍCULO ORIGINAL
Efecto analgésico, caracterización fitoquímica y análisis toxicológico del extracto etanólico de hojas de Pereskia lychnidiflora
Analgesic effect, phytochemical characterization and toxicological analysis of ethanolic extract of Pereskia lychnidiflora leaves
Rocío Guerra1,a, Luis Javier Gómez2,a, Ulises G. Castillo3,b, Gonzalo Toloza4,c, Juan Pablo Sánchez-Pérez3,b, Noel Avalos2,c, José Guillermo Mejía2,a, Marvin J. Núñez3,d, Miguel A. Moreno1,a
1 Escuela de Biología, Facultad de Ciencias Naturales y Matemáticas, Universidad de El Salvador. San Salvador, El Salvador.
2 Centro de Investigación y Desarrollo en Salud, Universidad de El Salvador. San Salvador, El Salvador.
3 Laboratorio de Investigación en Productos Naturales, Facultad de Química y Farmacia, Universidad de El Salvador. San Salvador, El Salvador.
4 Laboratorio Clínico, Hospital Nacional Rosales, Ministerio de Salud Pública. San Salvador, El Salvador.
a Licenciada en Biología; b licenciado en Química y Farmacia; c licenciado en Laboratorio Clínico; d doctor en Química Orgánica.
RESUMEN
Objetivo. Evaluar el efecto analgésico del extracto etanólico de las hojas de Pereskia lychnidiflora, la prospección de metabolitos secundarios y el análisis toxicológico. Materiales y métodos. La actividad analgésica fue evaluada mediante la prueba del ácido acético y la formalina en ratones NIH a una concentración de 30, 50 y 100 mg/kg de peso corporal, utilizando como control Ibuprofeno a 200 mg/kg y agua destilada como blanco. La prospección de metabolitos secundarios se realizó por el método de cromatografía de capa fina y la toxicidad del extracto fue evaluada in vivo según la dosis máxima de 2000 mg/kg de peso corporal. Resultados. La prospección fitoquímica determinó la presencia de alcaloides, taninos, triterpenos y esteroles como mayores constituyentes químicos. Se determinó que el extracto etanólico de Pereskia lychnidiflora posee una actividad analgésica similar al Ibuprofeno. No se observaron signos de toxicidad en los ratones de experimentación y se clasifica el extracto como no tóxico con una DL50 mayor de 2000 mg/kg. Conclusión. El extracto etanólico de Pereskia lychnidiflora tiene un efecto analgésico antiinflamatorio que podría estar condicionado por la presencia de alcaloides, taninos y esteroles (terpenoides) presentes en esta especie vegetal y puede ser clasificado como no tóxico.
Palabras clave: Plantas medicinales; Fitoterapia; Analgésicos; Pruebas de Toxicidad; Ratas; El Salvador (fuente: DeCS BIREME).
ABSTRACT
Objective. To evaluate the analgesic effect of the ethanolic extract of the leaves of Pereskia lychnidiflora, the prospection of secondary metabolites and the toxicologic analysis. Materials and Methods. Analgesic activity was evaluated by testing acetic acid and formalin in NIH mice at a concentration of 30, 50 and 100 mg/kg body weight, using Ibuprofen control at 200 mg/kg and distilled water as the target. Secondary metabolites were prospected using the thin layer chromatography method and the toxicity of the extract was evaluated in vivo according to the maximum dose of 2,000 mg/kg body weight. Results. Phytochemical prospecting determined the presence of alkaloids, tannins, triterpenes, and sterols as major chemical constituents. The ethanolic extract of Pereskia lychnidiflora was found to have an analgesic activity similar to ibuprofen. No signs of toxicity were observed in the experimental mice and the extract is classified as non-toxic with a DL50 greater than 2,000 mg/kg. Conclusions. The ethanolic extract of Pereskia lychnidiflora has an anti-inflammatory analgesic effect that could be conditioned by the presence of alkaloids, tannins, and sterols (terpenoids) present in this species and can be classified as non-toxic.
Keywords: Medicinal Plants; Phytotherapy; Analgesics; Toxicity Tests; Rats; El Salvador (source: MeSH NLM).
INTRODUCCIÓN
El tratamiento del dolor es un problema médico, social y económico de gran magnitud. En América, más de la mitad de consultas en atención primaria son por dolor moderado a severo, para el cual generalmente se prescriben antiinflamatorios no esteroideos (AINES) (1). Esto podría generar un control inadecuado del dolor, aumento en los efectos adversos del tratamiento, disminución en la calidad de vida, y un aumento de los costos para el sistema sanitario (1). En este sentido, el desarrollo de nuevos y mejores tratamiento para el dolor son una prioridad de investigación (2), y cada día se presta más atención al estudio de las plantas medicinales buscando nuevas opciones terapéuticas (3).
El género Pereskia (Cactaceae) está constituido por 17 especies ampliamente distribuidas en los bosques secos del Caribe, Centro y Sudamérica (4). Desde el punto de vista fitoquímico este género ha sido poco estudiado y entre las especies más investigadas se encuentran Pereskia aculeata, P. bleo y P. grandifolia, de las que se ha reportado la presencia de fitoesteroles (5), y terpenoides únicamente en P. aculeata y P. bleo (6,7). De manera similar, se han reportado compuestos fenólicos y alcaloides en P. grandiflora y P. bleo (6,7,8).
Algunas especies del género Pereskia han sido utilizadas en diversas partes del mundo por sus propiedades medicinales como antisifilítico, emoliente y para el tratamiento de enfermedades inflamatorias y de la piel (9). Asimismo, se han utilizado para tratar enfermedades relacionadas con el cáncer, dolor de cabeza, dolor de estómago, úlceras gástricas, hemorroides, dermatitis, diabetes, hipertensión, reumatismo, inflamaciones, y como un tónico para revitalizar el cuerpo, trastornos gastrointestinales (10), afecciones en la piel, dolor de oído y dolor muscular (11,12). Algunas investigaciones sugieren que este género presenta actividad analgésica en modelos animales de dolor agudo por estímulo químico con ácido acético y formalina (6,7), y en El Salvador, las hojas de Pereskia lychnidiflora conocidas como «matial» son utilizadas como analgésicos (13).
En el presente estudio tuvo como objetivo determinar la actividad analgésica, caracterización fitoquímica y análisis toxicológico en ratones de las hojas de P. lychnidiflora.
MATERIALES Y MÉTODOS
MATERIAL VEGETAL
Las hojas de Pereskia lychnidiflora DC fueron colectadas en el Cantón La Laguna, Lago de Coatepeque, Municipio de El Congo, (latitud 113º53’39.88’’ N; longitud 89º32’45.64’’ W), Departamento de Santa Ana, El Salvador, en junio de 2016 y fueron identificadas por la curadora del Herbario del Museo de Historia Natural de El Salvador. Las hojas se secaron a 40 °C por 48 horas en estufa de aire circulante y posteriormente fueron fraccionadas en un molino de cuchillas.
PREPARACIÓN DEL EXTRACTO
Las hojas secas y molidas de P. lychnidiflora (45,6 g) fueron extraídas con alcohol etílico 95º (2x300 mL) en un baño ultrasonido VWR (Modelo 97043-988) a temperatura ambiente (25 °C). Una parte del extracto (50 mL) fue almacenada para realizar el análisis fitoquímico y la otra fue concentrada utilizando un rotoevaporador (BUCHI R-200) a 40 °C, luego fue transferido a un desecador con gel de sílice hasta obtener el extracto seco (3,0535 g).

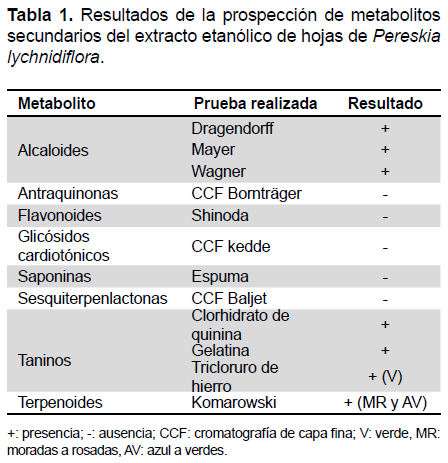
PROSPECCIÓN DE LOS METABOLITOS SECUNDARIOS
Identificación de alcaloides
Se llevaron a desecación 25 mL del extracto en baño maría, y se disolvió en 6 mL de HCl al 10%, posteriormente se filtró en papel Whatman N 42 (2,5 µm), el filtrado se dividió en tres tubos de ensayo, al primer tubo se le adicionó de cinco a diez gotas del reactivo de Wagner, al segundo tubo de cinco a diez gotas del reactivo de Mayer y al último tubo de cinco a diez gotas del reactivo de Dragendorff. La formación de precipitado color crema en Wagner y un precipitado anaranjado y café rojizo en la prueba de Dragendorff y Mayer, respectivamente, indican la presencia de alcaloides en el extracto vegetal (14).
Identificación de antraquinonas
Se realizó una cromatografía de capa delgada utilizando gel de sílice G UV254 y una fase móvil de n–hexano–acetato de etilo (1:1) como fase estacionaria y fase móvil respectivamente. Una vez secada la placa cromatográfica se asperjó con una solución al 10% de KOH en metanol. La aparición de manchas rojas indica la presencia de antraquinonas (14).
Identificación de flavonoides
Se tomaron 2 mL del extracto etanólico en un vidrio reloj y se agregó una pequeña tira de magnesio metálico (2x5 mm), luego, se adicionó gota a gota ácido clorhídrico concentrado. La aparición de una coloración rojiza indica la presencia de flavonoides (15).
Identificación de glicósidos cardiotónicos
Se preparó una cromatografía en capa delgada utilizando gel de sílice G UV254 como fase estacionaria y una fase móvil compuesta por una mezcla acetato de etilo-metanol-agua (8:1,5:0,5), se utilizó K-Strofantidina de testigo. Una vez seca la cromatoplaca se asperjó con una solución del reactivo de Kedde (volúmenes iguales de ácido 3,5-dinitrobenzoico al 2% en metanol y de KOH al 5,7% en agua). La aparición de manchas color violeta indican la presencia de glicósidos cardiotónicos.
Identificación de saponinas
Se utilizó la prueba de la espuma. Se colocó 1 mL del extracto en un tubo de ensayo y se le adicionó 9 mL de agua destilada, se agitó el tubo de ensayo en forma vigorosa (verticalmente) por 30 segundos, se dejó reposar por 15 minutos, si la espuma alcanza más de 0,5 cm de altura, es tomada como evidencia positiva (16).
Identificación de sesquiterpenlactonas
Utilizando gel de sílice G UV254 como fase estacionaria y una fase móvil de n-hexano-acetato de etilo (7:3) se llevó a cabo una cromatografía de capa delgada. Se utilizó la 2,3-epoxijuanislamina como testigo y el reactivo revelador de Baljet (volúmenes iguales de ácido pícrico al 1% en etanol 95° e hidróxido de sodio al 10%). Manchas de color anaranjado fueron tomadas como evidencia positiva.
Identificación de taninos
Se colocaron 2 mL del extracto etanólico en tres tubos de ensayo, al primer tubo se adicionaron cinco a diez gotas de gelatina al 10%, al segundo tubo de cinco a diez gotas de clorhidrato de quinina al 10% y al tubo restante se le adicionó una gota de FeCl3 al 5% en metanol. La aparición de un precipitado en los primeros dos tubos indica la presencia de taninos y en el tercer tubo una coloración azul corresponde a taninos hidrolizables o verde a taninos condensados (16).
Identificación de terpenoides
El extracto etanólico se sometió a cromatografía en capa delgada, empleando gel de sílice G UV254 como fase estacionaria y una fase móvil compuesta por una mezcla n-hexano-acetato de etilo (1:1). La cromatografía desarrollada se dejó secar antes de revelarla, se asperjó con el reactivo de Komarowski (solución compuesta por: 50 mL de 4-hidroxibenzaldehido al 2% en metanol y 5 mL de ácido sulfúrico al 50%) y se sometió a calentamiento (110 ºC) durante cinco a diez minutos. Se utilizó epifriedelanol y β-sitosterol como testigos para los núcleos triterpénicos y esteroidal, respectivamente. Manchas de color morado-rosado y azul-verde evidencian la presencia de triterpenos y esteroides.
Animales de experimentación
Las pruebas de analgesia se realizaron únicamente en ratones machos NIH, y para las pruebas de toxicidad se utilizaron ratones machos y hembras NIH en estado juvenil nulíparas y no grávidas, cuyo peso osciló entre 20 y 23 g. Todos los animales permanecieron a una temperatura de 22 ±2 ºC y humedad relativa entre 50-60%, con un ciclo luz-oscuridad de 12/12 horas, marcados con ácido pícrico para su identificación individual. Previamente, los animales fueron examinados clínicamente para certificar su estado de salud. La alimentación consistió en una dieta a base de concentrado peletizado para roedores y agua a voluntad.
TOXICIDAD AGUDA ORAL
Los animales empleados en el presente estudio fueron tratados conforme lo establecido en las guías Canadian Council on Animal Care (CCAC) para el cuidado y uso de animales de experimentación (17). El ensayo se llevó a cabo según lo establecido por la Organización para la Cooperación y el Desarrollo Económico (OECD) para este tipo de estudio (18). Se confeccionaron cuatro grupos experimentales (dos grupos hembras y dos grupos machos) a razón de cinco animales por grupo, de los cuales un grupo por sexo fue tratado con el extracto en estudio (grupos tratamiento) y los dos restantes sirvieron de controles a los que se les administro agua destilada.
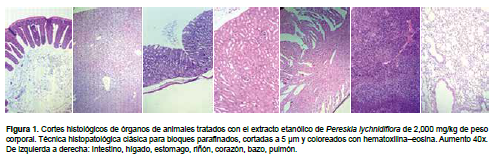
Se procedió a realizar el ensayo límite regulado por la OECD a la dosis máxima de 2000 mg/kg de peso corporal a un volumen de 0,2 mL. El extracto se administró a los animales en condiciones óptimas, todos y cada uno de los días, durante un período de 28 días. Diariamente se realizó la observación y chequeo clínico de los animales procurando determinar la aparición de síntomas compatibles con algunos parámetros de importancia toxicológica. Finalizados los 28 días del experimento, se procedió a la obtención de muestras sanguíneas del plexo ocular de cada uno de los animales. Posteriormente se procedió al sacrificio de los animales por dislocación cervical para efectuar la necropsia y la extracción de órganos internos (corazón, pulmón, hígado, estómago, bazo, intestino y riñón), los cuales fueron examinados macroscópicamente en cuanto a superficie, color, consistencia, tamaño y peso, para luego ser fijados en solución de formalina al 10% e incluidos en bloques parafinados, cortadas en 5 μm y coloreados con hematoxilina-eosina. Las muestras de sangre fueron utilizadas para realizar un hemograma completo y la determinación de algunos valores bioquímicos.
PRUEBA DEL ÁCIDO ACÉTICO
Se utilizaron cinco grupos, de ocho animales machos cada uno. Los grupos se distribuyeron de la siguiente manera y se les administraron los extractos por vía oral a un volumen de 10 mL/kg: Tres grupos se trataron con el extracto etanólico de P. lychnidiflora a concentraciones de 30, 50 y 100 mg/kg respectivamente. A un cuarto grupo se le administró Ibuprofreno 200 mg/kg como fármaco de referencia y al grupo restante agua destilada como control negativo.
Media hora después de la administración del extracto, se provocaron las contorsiones abdominales a todos los ratones por inyección vía intraperitoneal de una solución de ácido acético al 1%, en volumen de 0,1 mL a cada animal. El número de contorsiones realizadas se registraron en un periodo de 20 minutos.
PRUEBA DE FORMALINA
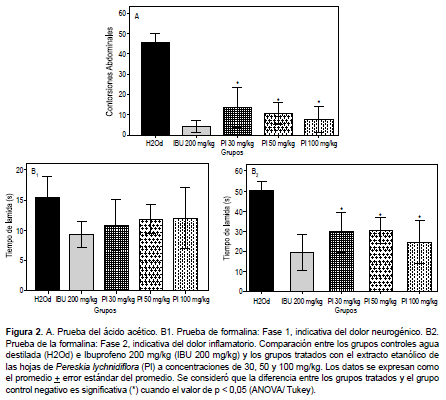
Para esta prueba se utilizó la misma metodología descrita anteriormente a nuevos grupos de animales machos. El estímulo doloroso se indujo por la inyección subplantar de 20 μL de formalina al 1%, en la pata trasera derecha del ratón. En la prueba se distinguieron dos fases: Fase 1, indicativa del dolor neurogénico; los primeros cinco minutos y Fase 2, indicativa del dolor inflamatorio; entre los 15 a 30 minutos después de la administración de la formalina (19). Para evaluar ambas fases, se midió el tiempo acumulado en segundos por medio de un cronómetro durante el cual, el animal se lame la pata.
ANÁLISIS ESTADÍSTICO
Todos los datos obtenidos fueron estadísticamente evaluados con los programas SPSS 21.0 y Statgraphics Centurion XVI.I, con apoyo de Microsoft Excel 2013. Se utilizó la prueba de Shapiro Wilk para las pruebas de normalidad. La prueba de hipótesis incluye para los datos generados del ensayo de toxicidad, el análisis T de Student para muestras independientes; y para los datos obtenidos de las pruebas de analgesia, la prueba de hipótesis incluye el análisis de varianza de una sola vía (ANOVA) seguido de un test de Tukey para comparaciones múltiples. Se consideró que la diferencia entre los grupos tratados y el grupo control es significativa con un valor de p<0,05. Todos los resultados son expresados como el promedio y la desviación estándar (ensayo de toxicidad) y como el promedio y error estándar del promedio (pruebas de analgesia) de los grupos experimentales.
RESULTADOS
ANÁLISIS DE LA PROSPECCIÓN DE LOS METABOLITOS SECUNDARIOS
Los resultados obtenidos en la prospección de los metabolitos secundarios son expresados en la Tabla 1. Este estudio revelo la presencia de alcaloides, taninos (condensados), triterpenos y esteroles como metabolitos mayoritarios.
TOXICIDAD AGUDA ORAL
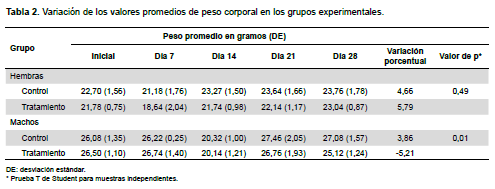
Durante los chequeos clínicos que se realizaron diariamente a los animales tratados con el extracto etanólico de P. lychnidiflora, no se observaron alteraciones en los diferentes sistemas estudiados: piel, ojos y membranas mucosas, sistema respiratorio, circulatorio, nervioso central y autónomo, actividad motora y patrones de comportamiento. En la Tabla 2, se observa que los grupos de hembras aumentaron de peso, no así el grupo machos tratados con el extracto, que mostraron una disminución del 5%.
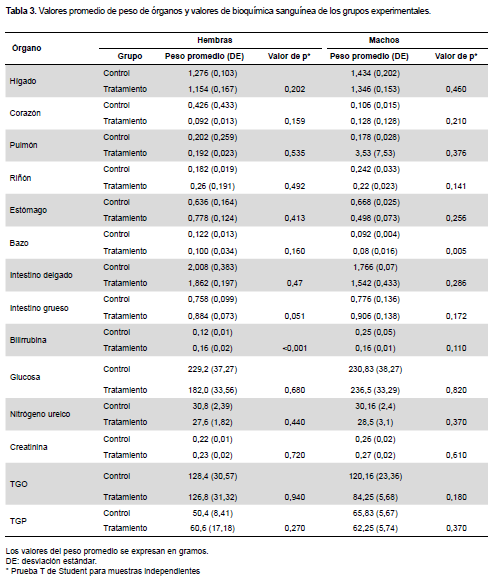
No se encontraron alteraciones macroscópicas (superficie, color, consistencia y tamaño) de los órganos de los grupos experimentales. Asimismo, no se encontraron diferencias significativas en el peso de órganos entre los grupos tratados y los controles de ambos sexos (Tabla 3); con excepción de una disminución estadísticamente significativa de los valores promedios de peso del bazo en machos tratados con el extracto en estudio respecto a sus controles. Además, en el examen histopatológico de órganos no se observaron alteraciones en ninguno de los casos (Figura 1).
En cuanto a los valores de bioquímica sanguínea, no existe diferencia estadísticamente significativa entre los grupos tratados con el extracto evaluado y sus respectivos controles, a excepción del aumento de los valores de bilirrubina del grupo hembras tratadas con el extracto etanólico de P. lychnidiflora (Tabla 3).
PRUEBA DEL ÁCIDO ACÉTICO
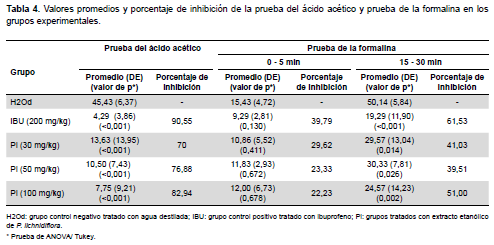
En la Tabla 4 y Figura 2A, se observa que la administración del extracto de P. lychnidiflora disminuyó el número de contorsiones abdominales en todos los grupos tratados con este extracto; con valores porcentuales de inhibición de 70%, 76,88% y 82,94% para las concentraciones de 30, 50 y 100 mg/kg respectivamente; frente a un 90,55% de inhibición observado en el grupo tratado con el fármaco de referencia (Ibuprofeno 200 mg/kg).
PRUEBA DE LA FORMALINA
De igual manera, en la Tabla 4 se aprecia una leve reducción del dolor neurogénico (durante los primeros cinco minutos) caracterizado por el comportamiento de «lamida de pata» inducida por la inyección subplantar de formalina, con valores de inhibición entre 22 y 30 % para las tres concentraciones del extracto de P. lychnidiflora, sin representar esto una diferencia estadísticamente significativa frente al dolor observado en el grupo de animales control negativo (Figura 2). No obstante, sí se observa una disminución estadísticamente significativa de los tiempos que los animales tratados con P. lychnidiflora gastan lamiéndose la pata durante la segunda fase medida entre los 15-30 minutos post inducción de dolor (Figura 2), con valores de inhibición muy similares al observado en el grupo tratado con el fármaco de referencia (IBU 200 mg/kg).
DISCUSIÓN
La prospección de los metabolitos secundarios obtenidos de P. lychnidiflora, concuerda con los reportados previamente en especies del género Pereskia, como esteroles, terpenoides, alcaloides y compuestos fenólicos (5,7,8), y se puede considerar como la primera prospección de metabolitos secundarios de esta especie vegetal.
En cuanto al estudio toxicológico, la ausencia de eventos mortales y acorde a la guía de la OECD (18), el extracto etanólico de las hojas de P. lychnidiflora se clasificaría en la categoría cinco de toxicidad que es equivalente a una DL50 mayor a 2000 mg/kg, pero menor a 5000 mg/kg de peso corporal, similar a lo reportado para otras especies de este género (20). La prueba de toxicidad aguda oral, es indispensable para la determinación del perfil tóxico de sustancias y los modelos animales son una herramienta para la predicción de eventos adversos a la salud humana (21), en tanto que ofrecen información toxicológica que no puede lograrse aún por métodos alternativos (22).
Los datos referentes al peso corporal poseen una gran sensibilidad para detectar alteraciones, incluso aquellas de baja toxicidad. Una disminución de más del 10% del peso corporal es considerada un indicador efectos adversos para la salud (23). En cuanto a la disminución del peso corporal observado en el grupo de machos tratados con el extracto etanólico de P. lychnidiflora, este no debe ser considerado como un signo toxicológico, al no alcanzar el límite mencionado.
Respecto de los órganos, los cambios en el tamaño, forma, superficie, color, consistencia y peso; determinan la presencia de daños toxicológicos (24). Además, el peso relativo de los órganos es fundamental para diagnosticar si el órgano fue expuesto a la lesión o no (25). En este sentido, la ausencia de alteraciones macroscópicas en las necropsias, así como microscópicas durante la evaluación de los cortes histológicos en los órganos de los animales expuestos al extracto de estudio, orientan a que el uso de las hojas de esta especie vegetal tiene un perfil de seguridad adecuado. Por otro lado, fuera de la disminución en el peso del bazo de animales tratados con el extracto de P. lychnidiflora, no hay otros indicios que enlazan los resultados a la seguridad.
Sobre el aumento de los valores promedio de bilirrubina en el grupo de animales expuesto al extracto vegetal, esto, podría ser un indicador de daño de la función hepática, pero al no estar acompañado por el incremento de las transaminasas y la disminución de glucosa en sangre, ni por alteraciones macroscópicas o microscópicas en hígado (26), dichos valores de bilirrubina probablemente no son evidencias del daño de la función hepática.
Respecto de la evaluación de la actividad nociceptiva, los resultados de la prueba del ácido acético demuestran el potencial analgésico de esta especie vegetal y concuerdan con la actividad analgésica reportada para otras especies de este género (6,27). Estos resultados indican además la actividad antiinflamatoria del extracto etanólico de hojas de P. lychnidiflora, en tanto que la prueba del ácido acético al dañar membranas celulares del peritoneo genera la liberación de prostaglandinas y otros mediadores de la inflamación (28), por lo que, la reducción de las contorsiones abdominales es indicativo de la reducción en la liberación de estos mediadores. Del mismo modo, los resultados de la segunda fase de la prueba de la formalina, son indicadores de un efecto analgésico contra un dolor de origen inflamatorio (29), en tanto que, en esta fase, la inyección de formalina está asociada a la liberación nuevamente de mediadores inflamatorios incluyendo prostaglandinas, histaminas, bradiquininas y serotonina (30).
El extracto actúa en ambas fases durante la prueba de la formalina; aunque con mayor efectividad en la fase del dolor central o inflamatorio, esto concuerda con otra investigación, en donde afirman que este tipo de analgésicos que actúan central y periféricamente son activos en ambas fases de la prueba de la formalina (31); pero, son más eficaces en la segunda fase en la que en general dosis más bajas son suficientes para causar el efecto antinociceptivo.
Los resultados apuntan a la actividad analgésica del extracto etanólico de P. lychnidiflora, actividad biológica que es apoyada por los resultados de la evaluación fitoquímica preliminar, donde se determinó la presencia de taninos, alcaloides y esteroles (terpenoides), familias químicas que han sido reportadas como responsables de la actividad analgésica de este género (6,32).
En conclusión, el estudio de toxicidad del presente trabajo, demuestra que el extracto etanólico de Pereskia lychnidiflora no tiene efectos graves a la salud en los animales de experimentación y puede clasificarse como de uso seguro. En cuanto a las pruebas analgésicas, el extracto evaluado tiene un efecto analgésico antiinflamatorio que podría estar condicionado por la presencia de alcaloides, taninos y esteroles (terpenoides) presentes en esta especie vegetal; apoyando de esta manera su uso tradicional como tratamiento alternativo para el dolor en El Salvador.
Contribuciones de los autores: RG, LJG, GT, NA, UGC, JPS, JGM, MJN y MAM han participado en la concepción del artículo, la recolección de datos, su redacción y aprobación de la versión final. Además, JGM realizó el análisis estadístico, y MJN y MAM obtuvieron el financiamiento.
Fuentes de financiamiento: Autofinanciado.
Conflictos de interés: Los autores declaran no tener conflictos de interés con la publicación de este artículo.
REFERENCIAS BIBLIOGRÁFICAS
1. International Association for Hospice and Palliative Care - IAHPC. Uso de Opioides en tratamiento del DOLOR - Manual para Latinoamérica. Primera edición. Caracas, Venezuela: TIPS Imagen y Comunicación 1967 C. A.; 2011.
2. Dworkin RH, Turk DC, Wyrwich KW, Beaton D, Cleeland CS, Farrar JT, et al. Interpreting the clinical importance of treatment outcomes in chronic pain clinical trials: IMMPACT recommendations. J Pain. 2008;9(2):105-21. [ Links ]
3. Beyra A, León María del Carmen, Iglesias E, Ferrándiz D, Herrera R, Volpato G, et al. Estudios etnobotánicos sobre plantas medicinales en la provincia de Camagüey (Cuba) Anales Jard Bot Madrid. 2004;61(2):185-203. doi: http://dx.doi.org/10.3989/ajbm.2004.v61.i2.44. [ Links ]
4. Edwards E, Nyffeler R, Donoghue M. Basal cactus phylogeny: implications of Pereskia (Cactaceae) paraphyly for the transition to the cactus life form. Am J Bot. 2005;92(7):1177-88. doi: 10.3732/ajb.92.7.1177. [ Links ]
5. Campos N, Scio E. The biological activities and chemical composition of Pereskia species (Cactaceae)--a review. Plant Foods Hum Nutr. 2014;69(3):189-95. doi: 10.1007/s11130-014-0423-z. [ Links ]
6. Pinto Nde C1, Duque AP, Pacheco NR, Mendes Rde F, Motta EV, Bellozi PM, et al. Pereskia aculeata: A plant food with antinociceptive activity. Phar Biol. 2015;53(12):1780-85. doi: 10.3109/13880209.2015.1008144.
7. Zareisedehizadeh S, Tan CH, Koh HL. A Review of botanical characteristics, traditional usage, chemical components, pharmacological activities, and safety of Pereskia bleo (Kunth) DC. Evid Based Complement Alternat Med. 2014;2014:326107. doi: 10.1155/2014/326107. [ Links ]
8. Doetsch PW, Cassady JM, McLaughlin JL. Cactus alkaloids: XL. Identification of mescaline and otrher β-phenethylamines in Pereskia, Pereskiopsis and Islaya by use of fluorescamine conjugates. J Chromatogr A. 1980;189(1):79-85. doi:10.1016/S0021-9673(00)82285-2. [ Links ]
9. Duarte, MR, Hayashi SS. Estudo anatómico de folha e caule de Pereskia aculeata Mill. (Cactaceae). Rev Bras Farmacogn. 2005;15(2):103-9. doi: https://dx.doi.org/10.1590/S0102-695X2005000200006. [ Links ]
10. Murilo E, Melendez Martinez AJ, Portugal F. Screening of vegetables and fruits from Panama for rich sources of lutein and zeaxanthin. Food Chem. 2010;122(1):167-72. doi: 10.1016/j.foodchem.2010.02.034. [ Links ]
11. Hajdu Z, Hohmann J. An ethnopharmacological survey of the traditional medicine utilized in the community of Porvenir, Bajo Paraguá Indian Reservation, Bolivia. J Ethnopharmacol. 2012;139(3):838-57. doi: 10.1016/j.jep.2011.12.029. [ Links ]
12. Quiroga R, Meneses L, Bussmann RW. Medical ethnobotany in Huacareta (Chuquisaca, Bolivia). J Ethnobiol Ethnomed. 2012;8(29):14. doi:10.1186/1746-4269-8-29. [ Links ]
13. González Ayala JC. Botánica Medicinal Popular (Etnobotánica Medicinal de El Salvador). Ed. 2. Vol. 2. San Salvador, El Salvador: Asociación Jardín Botánico La Laguna; 2002. [ Links ]
14. Arora EK, Sharma V, Khurana A, Manchanda A, Sahani DK, Abraham S, et al. Phytochemical analysis and evaluation of antioxidant potential of ethanol extract of Allium cepa and ultra-high homoeopathic dilutions available in the market: A comparative study. Indian J Res Homoeopathy. 2017;11(2):88-96. doi: 10.4103/ijrh.ijrh_13_17. [ Links ]
15. Mfotie Njoya E, Munvera AM, Mkounga P, Nkengfack AE, McGaw LJ. Phytochemical analysis with free radical scavenging, nitric oxide inhibition and antiproliferative activity of Sarcocephalus pobeguinii extracts. BMC Complement Altern Med. 2017;17(1):199. doi:10.1186/s12906-017-1712-5. [ Links ]
16. Hinojosa Dávalos J, Gutiérrez Lomeli M, Siller López F, Rodríguez Sahagún A, Morales Del Río JA, Guerrero Medina PJ, et al. Screening fitoquímico y capacidad antiinflamatoria de hojas de Tithonia tubaeformis. Biotecnia, 2013;15(2):53-60, doi: 10.18633/bt.v15i2.150. [ Links ]
17. Canadian Council on Animal Care - CCAC. Guide for the care and use of laboratory animals. Ottawa, Canada: Canadian Council on Animal Care; 1998. [ Links ]
18. Organization for Economic Cooperation and Development - OECD. Guidelines for Testing of Chemicals. Guideline 423: Acute Oral Toxicity-Acute Toxic Class Method [Internet]. Paris: OECD; 2001 [citado el 05 de enero de 2018]. Disponible en: https://www.oecd-ilibrary.org/environment/test-no-423-acute-oral-toxicity-acute-toxic-class-method_9789264071001-en
19. Hunskaar S, Hole K. The formalin test in mice: Dissociation between inflammatory and non-inflammatory pain. Pain. 1987;30(1):103-14. [ Links ]
20. Sim KS, Nurestri AMS, Sinniah SK,Kim KH, Norhanom AW. Acute oral toxicity of Pereskia bleo and Pereskia grandifolia in mice. Pharmacogn Mag. 2010;6(21):67-70. doi: 10.4103/0973-1296.59969. [ Links ]
21. Claude N. Are non-clinical studies predictive of adverse events in humans? Ann Pharm Fr. 2007;65(5):292-7. [ Links ]
22. Lilienblum W, Dekant W, Foth H, Gebel T, Hengstler JG, Kahl R, et al. Alternative methods to safety studies in experimental animals: role in the risk assessment of chemicals under the new European Chemicals Legislation (REACH). Arch Toxicol. 2008;82(4):211-36. doi: 10.1007/s00204-008-0279-9. [ Links ]
23. Mancebo A, Scull I, González Y, Arteaga ME, González BO, Fuentes D, et al. Ensayo de toxicidad a dosis repetidas (28 días) por vía oral del extracto acuoso de Morinda citrifolia en ratas Sprague Dawley. Rev. Toxicol. 2002;19(2):73-8. [ Links ]
24. Höfle U. Técnicas de diagnóstico post-mortem: necropsia y toma de muestras [Internet]. Sevilleja de la Jara: Centro de Estudios de Rapaces Ibéricas; 1998 [citado el 3 de marzo de 2018]. Disponible en: http://agenciabk.net/diagnostico.postmortem.pdf.
25. Dybing E, Doe J, Groten J, Kleiner J, O’Brien J. Hazard characterization of chemicals in food and diet: dose response, mechanism and extrapolation issues. Food Chem. Toxicol. 2002;40(2-3):237-82.
26. Rahman TM, Hodgson HJ. Animal models of acute hepatic failure. Int J Exp Pathol. 2000;81(2):145-57. doi:10.1046/j.1365-2613.2000.00144.x [ Links ]
27. Guilhon CC, Wahab IRA, Boylan F, Fernandes PD. Evaluation of antinociceptive activity of Pereskia bleo Kunth. Planta Med. 2012;78(11):PD116. doi: 10.1055/s-0032-1320474. [ Links ]
28. Le Bars D, Gozariu M, Cadden SW. Animal models of nociception. Pharmacol Rev. 2001;53(4):597-652. [ Links ]
29. Henriques Monteiro ÉM, Chibli LA, Yamamoto CH, Santana Pereira MC, Pinto Vilela FM, Rodarte MP, et al. Antinociceptive and anti-activities of the sesame oil and sesamin. Nutrients. 2014;6(5):1931-44. doi: 10.3390/nu6051931. [ Links ]
30. Ortega A, Roca A, Mico JA. Modelos animales de dolor: una visión crítica. Rev Soc Esp Dolor. 2002;9(7):447-53. [ Links ]
31. Shibata M, Ohkubo T, Takahashi H, Inoki R. Modified formalin test: Characteristic biphasic pain response. Pain. 1989;38(3):347-52. doi: 10.1016/0304-3959(89)90222-4. [ Links ]
32. Abdulmalik I., Sule M, Musa AM, Yaro AH, Abdullahi M, Abdulkadir M, Yusuf H. Evaluation of Analgesic and Anti-Inflammatory Effects of Ethanol Extract of Ficus Iteophylla Leaves in Rodents. Afr J Tradit Complement Altern Med. 2011;8(4):462-6.
Correspondencia: Miguel Angel Moreno Mendoza.
Dirección: Facultad de Ciencias Naturales y Matemática, Universidad de El Salvador, Ciudad Universitaria, Final Av. Mártires y Héroes del 30 julio, San Salvador, El Salvador.
Teléfono: (503) 2511-2000, extensión 5016.
Email: miguel.moreno@ues.edu.sv
Recibido: 08/03/2018
Aprobado: 28/11/2018
En línea: 21/12/2018