Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO
Share
Revista Peruana de Medicina Experimental y Salud Publica
Print version ISSN 1726-4634
Rev. perú. med. exp. salud publica vol.36 no.2 Lima June/Sep. 2019
http://dx.doi.org/10.17843/rpmesp.2019.362.4152
CARTAS AL EDITOR
Bacteriemia por Acinetobacter baumannii productor de oxacilinasa en hospitales de Lima, Perú
Bacteremia caused by oxacillinase-producing Acinetobacter baumannii in hospitals in Lima, Peru
Yanet Castillo 1,a, Cynthia Nieto 1,a, Lizeth Astocondor 1,a, Jan Jacobs 1,b, Coralith Garcia 1,2,b.
1 Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia, Lima, Perú
2 Hospital Cayetano Heredia, Lima, Perú.
3 Instituto de Medicina Tropical Amberes, Amberes, Bélgica.
a Licenciada en tecnología médica; b PhD
*Los resultados son parte de la Tesis para obtener el grado de tecnólogo médico de Cynthia Nieto Yaneth Castillo, «Detección molecular de los genes que confieren resistencia a carbapenémicos en Acinetobacter baumannii aislados de hemocultivos procedentes de hospitales de Lima durante el período 2008-2013».
Sr. Editor. Acinetobacter baumannii causa infecciones serias asociadas a los servicios de salud incluyendo bacteriemia y neumonía asociada a ventilador y suele ser resistente a múltiples antibióticos. Se realizó un estudio con el objetivo de describir el perfil de resistencia de aislamientos de Acinetobacter obtenidos de hemocultivos de cinco hospitales de Lima e identificar los mecanismos de resistencia enzimáticos a los carbapenems.
Se analizaron los aislamientos de Acinetobacter (uno por paciente) que fueron obtenidos a través del proyecto «Vigilancia de la Resistencia Antimicrobiana» el cual consistió en una vigilancia de la resistencia basada en aislamientos de hemocultivos en cinco hospitales de Lima (Hospital Guillermo Almenara, Hospital Nacional Cayetano Heredia, Hospital Edgardo Rebagliati Martins, Hospital Nacional Daniel Alcides Carrión, y Hospital Nacional Alberto Sabogal Sologuren) durante el periodo del 2008 al 2013. Las muestras eran recolectadas semanalmente de cada hospital y transportadas al Instituto de Medicina Tropical Alexander von Humboldt donde fueron analizadas posteriormente.
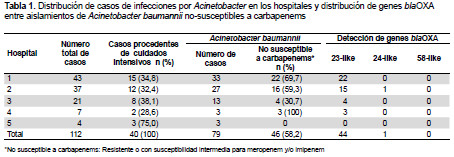
Un total de 112 aislamientos provenientes de hemocultivos fueron recolectados y confirmados como Acinetobacter a través del panel comercial MicroScan NC50 (Dade-Bering, West Sacramento, USA). De estos pacientes, 40 (35,7%) fueron hospitalizados en las unidades de cuidados intensivos (Tabla 1). Basado en la detección del gen blaOXA-51-like a través de PCR (1), 79 aislamientos (70,5%) fueron identificados como Acinetobacter baumannii. La susceptibilidad antimicrobiana fue evaluada a través de la concentración inhibitoria mínima (CIM) utilizando el panel comercial MicroScan NC50 (Dade-Bering, West Sacramento, USA). Los aislamientos que no fueron susceptibles a meropenem y/o imipenem fueron evaluados para la detección de carbapenemasas de la clase A (blaGES, blaIMI, y blaKPC), clase B (blaIMP, y blaVIM) y clase D (blaOXA-23-like, blaOXA-24-like y blaOXA-58-like) a través de tres PCRs multiplex para cada clase (2,3).
Mas del 50% de los aislamientos de Acinetobacter fueron resistentes a ciprofloxacina, ceftriaxona, cefepime, amikacina, gentamicina, piperacilina-tazobactam, imipenem y meropenem, pero sólo 10% fueron resistentes a tetraciclina. Cuarenta y seis de los 79 aislamientos de A. baumannii (58,2%) distribuidos en cuatro hospitales fueron no susceptibles a meropenem y/o imipenem (en el quinto hospital no se detectó ningún aislamiento no-susceptible, sin embargo, sólo se analizaron un total de tres aislamientos de Acinetobacter) (Tabla 1).
Entre los 46 aislamientos no susceptibles a carbapenems, 44 portaban el gen blaOXA-23-like y sólo un aislamiento portaba el gen blaOXA-24-like. Ningún aislamiento portaba los genes de las carbapenemasas de la clase A o B analizadas en este estudio. Casi todos los aislamientos OXA-23 fueron resistentes a todos los β-lactámicos y a ciprofloxacina, pero el único aislamiento portador de OXA-24 fue resistente a carbapenems pero susceptible a las cefalosporinas. Entre los 33 aislamientos de Acinetobacter no-baumannii, sólo seis mostraron resistencia o susceptibilidad intermedia a carbapenems (18,2%) pero ninguno portaba los genes para las carbapenemasas del tipo A, B y D analizadas.
Describimos que la mayoría de aislamientos de Acinetobacter baumannii resistentes a carbapenems fueron productores de OXA-23. Este tipo de carbapenemasa, llamada también oxacilinasa, fue reportada por primera vez en Escocia en 1985, desde allí ha sido reportado en diferentes países de Europa, Asia, Medio Oriente, Australia y América (4). En Latinoamérica las carbapenemasas predominantes en Acinetobacter son OXA-23, OXA-58, y OXA-143. A. baumannii productora de OXA-23 fue detectado inicialmente en Paraná, Brasil en el 2003, y desde allí se ha descrito en diferentes regiones del Brasil y posteriormente en otros países de Sudamérica (5). En el 2005, casi todas las Acinetobacter resistentes a carbapenem de varios hospitales de Colombia portaban OXA-23. En el Perú, los mecanismos moleculares asociada a la resistencia de carbapenem en Acinetobacter han sido poco estudiados.
Las limitaciones de este estudio incluyeron la falta de controles positivos para los genes blaSME, blaGIM, blaSPM y blaSIM; aunque si incluimos los primers para estos genes en la reacción de PCR no detectándose ninguna banda en los tamaños esperados. Otra limitación fue que no analizamos otros mecanismos de resistencia diferentes a la producción de carbapenemasas que hubiera sido importante sobre todo en los aislamientos de Acinetobacter no-baumannii.
Concluimos que Acinetobacter baumannii multidrogorresistente y productor de OXA-23 fue predominante en cuatro de los cinco hospitales evaluados en Lima durante el periodo de estudio. Medidas costo efectivas de control de infecciones deberán implementarse de modo que se limite la transmisión de estos microorganismos resistentes en el ambiente hospitalario.
Contribución de los autores: CG ha participado de la concepción, análisis de datos y redacción del artículo, YC y CN han participado de la concepción y diseño, recolección de resultados, y análisis de datos, LA ha participado en recolección de resultados, análisis de datos y redacción del artículo, y JJ participó en la concepción, y análisis de datos.
Agradecimientos: A la Dra. Aida Palacios (Hospital Nacional Cayetano Heredia), Dra. Elba Linares (Hospital Nacional Edgardo Rebagliati Martins), Dr. Rafael Ramírez (Hospital Nacional Guillermo Almenara Irigoyen), Dra. Verónica Medina (Hospital Nacional Alberto Sabogal Sologuren) y Dr. José María Guevara (Hospital Nacional Daniel Alcides Carrión) por su continua colaboración en el proceso de recolección de aislamientos.
Fuentes de financiamiento: Directorio General de la Cooperación para el Desarrollo de la Cooperación Belga (Acuerdo 3, proyecto 95502). estudio fue financiado por The Directorate General for Development Cooperation del Gobierno Belga (Proyecto 95502).
Conflicto de interés: Los autores declaran no tener conflictos de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Turton JF, Woodford N, Glover J, Yarde S, Kaufmann ME, Pitt TL. Identification of Acinetobacter baumannii by detection of the bla OXA-51-like carbapenemase gene intrinsic to this species. J Clin Microbiol. 2006;44(8):2974-6. [ Links ]
2. Hong S, Kim K, Huh J, Jung B, Kang M, Hong S. Multiplex PCR for rapid detection of genes encoding class A carbapenemases. Ann Lab Med. 2012;32(5):359-61. [ Links ]
3. Ellington M, Kistler J, Livermore D, Woodford N. Multiplex PCR for rapid detection of genes encoding acquired metallo-b-lactamases. J Antimicrob Chemother. 2007;59(2):321-2. [ Links ]
4. Mugnier PD, Poirel L, Naas T, Nordmann P. Worldwide dissemination of the blaOXA-23 Carbapenemase gene of Acinetobacter baumannii1. Emerg Infect Dis. 2010;16(1):35-40.
5. Labarca JA, Salles MJC, Seas C, Guzmán-Blanco M. Carbapenem resistance in Pseudomonas aeruginosa and Acinetobacter baumannii in the nosocomial setting in Latin America. Crit Rev Microbiol. 2014;7828:1-17. [ Links ]
Correspondencia: Coralith García
Dirección: Instituto de Medicina Tropical Alexander von Humboldt, Universidad Peruana Cayetano Heredia. Av. Honorio Delgado 430 San Martin de Porres Lima 31 Perú.
Teléfono: +51-1-3190000 Anexo 201320.
Correo electrónico: coralith.garcia@upch.pe
Recibido: 27/12/2018
Aprobado: 20/03/2019
En línea: 28/06/2019