INTRODUCCIÓN
[boxedtxt id="bx1"][sectitle]MENSAJES CLAVE[/sectitle]
[p]Motivación para realizar el estudio. Se evaluaron diferentes métodos de extracción de ADN a partir de quistes y trofozoítos de Giardia spp. ante la necesidad de implementar metodologías más sensibles para el diagnóstico y tipificación molecular de la giardiasis. [/p]
[p]Principales hallazgos. Los resultados indican que para optimizar la extracción de ADN parasitario a partir de quistes es necesario realizar pretratamientos mecánicos, enzimáticos y de choque térmico, para aumentar la concentración de ADN y detección molecular del agente. [/p]
[p]Implicancias. Este trabajo sirve de base para realizar estudios de caracterización y resistencia molecular de Giardia spp. en el país ya que es posible extraer ADN de la forma invasiva e infectante delparásito [/p][/boxedtxt]
Giardia spp. es uno de los principales parásitos que afecta al ser humano 1. Millones de personas alrededor del mundo padecen de anemia y desnutrición crónica a causa de este protozoario entérico 2, y en Perú se estima una prevalencia entre 15 y 18% 3. Presenta dos estadios evolutivos claramente diferenciados que se adaptan a distintas condiciones ambientales; el trofozoíto, forma invasiva responsable de los síntomas de la enfermedad; y el quiste, forma de resistencia, responsable de la transmisión de huésped a huésped 4.
El uso de técnicas moleculares en los estudios de parasitología como la reacción en cadena de la polimerasa (PCR) muestran una elevada sensibilidad para la detección de casos con bajos niveles de infección y para discriminar entre variantes genéticas de los aislados; en el caso de la giardiasis se ha reportado una sensibilidad de 80% a 100% 5 y especificidad del 100% al ser comparado con ADN procedente de muestras humanas con otros parásitos como Blastocystis hominis, Chilomastix mesnilii, y Entamoeba coli4,6.
Los métodos de extracción tradicionales in house utilizan solventes orgánicos para separar a las proteínas y lípidos del ADN a fin de aislarlo por precipitación con etanol. Estos métodos requieren preparar soluciones y la extracción puede durar varias horas 7. Los métodos comerciales son más rápidos 8, están basados en membrana de sílica, facilitando con ello la adsorción de la molécula de ADN a la membrana cargada positivamente para lograr el aislamiento de ADN integro con calidad y cantidad adecuadas, libre de contaminantes e inhibidores 9; garantizando el diagnóstico molecular, disminuyendo falsos negativos, y mejorando su sensibilidad.
En Perú, existe escasa información sobre métodos de extracción de ADN de parásitos como Giardia spp., lo que limita el conocimiento de la tipificación molecular de especies nativas circulantes, así como el estudio de la resistencia molecular frente a drogas. La selección del método de extracción es un paso fundamental en las técnicas moleculares y depende del organismo bajo estudio y del tipo de muestra; en el caso de Giardia spp. el quiste del parásito es el estadio más utilizado 4. Cabe resaltar que, su pared quística es gruesa, está compuesta por proteínas e hidratos de carbono, lo que le confiere resistencia a la degradación química, siendo necesaria la aplicación de diferentes pretratamientos como choque térmico, degradación enzimática, efecto mecánico o la combinación de estos para lograr su ruptura o degradación 10,11. Por lo tanto, es importante evaluar su utilidad e implicancia en la calidad de ADN y en el éxito de la amplificación por PCR.
Con el propósito de optimizar un método de extracción de ADN reproducible, óptimo y sencillo para la detección de Giardia spp. en cualquier estadio evolutivo se compararon diferentes métodos de extracción deADN a partir de quistes y trofozoítos del parásito mediante PCR semianidado usando dos marcadores moleculares, gen glutamato deshidrogenasa (gdh) y betagiardina (bg).
MATERIALES Y MÉTODOS
MUESTRAS FECALES
Se trabajó con 65 muestras fecales humanas positivas a Giardia spp. procedentes de tres hospitales de referencia nacional en Lima-Perú (Hospital Arzobispo Loayza, Hospital Cayetano Heredia y Hospital Nacional Sergio E. Bernales), obtenidas por muestreo de tipo no probabilístico intencionado durante el periodo de agosto 2017 a febrero de 2018. El criterio de inclusión para las muestras fue la presencia del parásito Giardia spp. en una carga parasitaria promedio de dos a cinco quistes por campo microscópico; asimismo, no deberían contener ningún fijador parasitológico. Las muestras fueron transportadas en un cooler y confirmadas por microscopía en el Laboratorio de Referencia Nacional de Enteroparásitos del Instituto Nacional de Salud, mediante examen parasitológico directo, luego fueron almacenadas a 4 °C hasta su proceso.
Los quistes fueron purificados y concentrados por el método de gradiente de sucrosa de dos fases 12-14. Las muestras de heces fueron emulsionadas con agua destilada y filtradas con gasa; previamente a un tubo de vidrio 16 x100 mm se colocó 3 mL de sucrosa 0,85 M, al que se le agregó igual volumen de la suspensión fecal y se centrifugó a 2300 rpm por cinco minutos; luego, se recuperó la fase sucrosa-agua y se realizaron tres lavados con agua destilada centrifugando a las mismas revoluciones descritas. Posteriormente, se preparó un tubo con gradiente de sucrosa 0,85 M a 0,4 M al que se le agregó cuidadosamente el sedimento lavado y se centrifugó a 2300 rpm durante diez minutos a 4 °C. Finalmente, los quistes purificados colectados de la interfase se lavaron nuevamente para eliminar la sucrosa y fueron resuspendidos en agua destilada siendo almacenados a -20 °C hasta ser procesados.
MUESTRAS DE CULTIVO
Se trabajó con un cultivo in vitro de Giardia intestinalis (ATCC® 30957™) obtenido de fase exponencial en medio TYI-S-33 modificado (Tripticasa, extracto de levadura, hierro y suero) enriquecido con suero bovino fetal (10%) basados en el método descrito por Keister 15, el cual permite un desarrollo adecuado del parásito.
Para lograr el desprendimiento de los mismos de la superficie del tubo, a los cultivos se les sometió a un baño de hielo por diez minutos, posteriormente diez inversiones y frotación entre las palmas de las manos, siendo luego centrifugados a 2500 rpm por cinco minutos a 4 °C. Asimismo, para estimar la carga parasitaria se empleó el recuento en cámara Neubauer. Las muestras se guardaron a -20 °C hasta ser procesadas.
EXTRACCIÓN DE ADN DE QUISTES
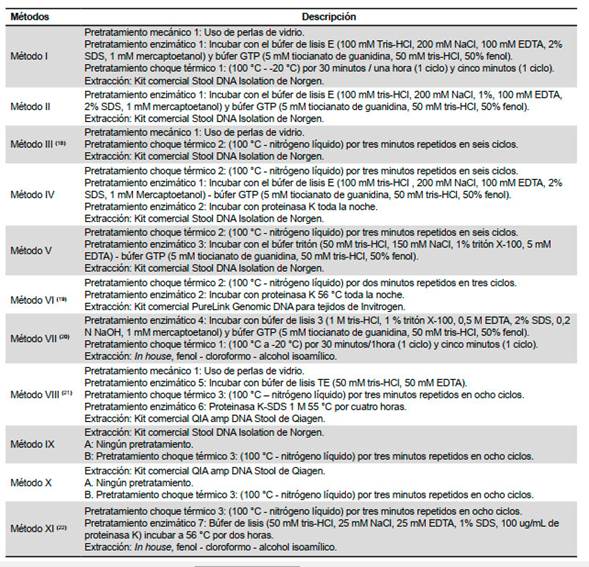
El ADN de los quistes fue extraído usando 11 métodos de extracción como se observa en la Tabla 1. Cada método tiene un pretratamiento o la combinación de estos. Los pretratamientos fueron físicos: choque térmico, con ciclos repetitivos de calentamiento (agua a 100 °C) y enfriamiento (nitrógeno líquido a -196 °C o -20 °C); enzimáticos, con incubación en diferentes búfer de lisis: búfer 3, búfer E, búfer tritón, búfer GTP e incubación con proteinasa K a diferentes tiempos; y mecánicos, con el uso de perlas de vidrio inmersas en búfer de lisis.
Posteriormente a los pretratamientos el aislamiento del ADN se realizó con el uso de kits comerciales, Stool DNA Isolation de Norgen, QIAamp DNA Stool de Qiagen, PureLink Genomic DNA de Invitrogen; y con aplicación del método tradicional de fenol-cloroformo. Las muestras de ADN extraídas fueron almacenadas a -20 °C.
EXTRACCIÓN DE ADN DE TROFOZOÍTOS
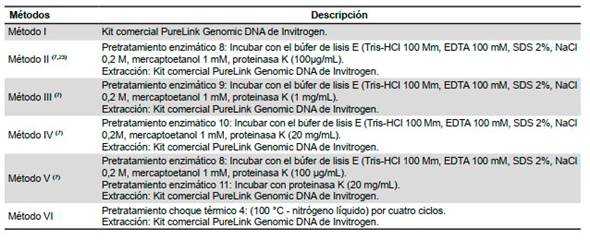
El ADN de los trofozoítos fue extraído usando seis métodos de extracción como se observa en la Tabla 2.
Los pretratamientos fueron físicos: choque térmico, con ciclos repetitivos de calentamiento (agua a 100 °C) y enfriamiento (nitrógeno líquido a -196 °C); enzimáticos con incubación de búfer de lisis E a diferentes concentraciones de proteinasa K. Posteriormente, se realizó la extracción con el kit PureLink Genomic DNA de Invitrogen. Las muestras de ADN extraídas fueron almacenadas a -20 °C.
CUANTIFICACIÓN DE ADN
La concentración y pureza de las muestras de ADN extraídas se midió mediante espectrofotometría. Las muestras fueron cuantificadas en una lectora EON Gen5 versión 2.04.11 (BioTek), cuyo coeficiente de extinción fue 0,020 (μg/mL)-1 cm-1 y la calidad del ADN se evaluó por la proporción entre las absorbancias 260 nm / 280 nm para cada método.
AMPLIFICACIÓN DEL PCR SEMIANIDADA
La región del gen glutamato deshidrogenasa (gdh) fue amplificada según Read 16. El método incluye las secuencias de los cebadores Internal Forward Primer GDHiF: CAG TAC AAC TCY GCT CTC GG y Reverse Primer GDHiR: GTT RTC CTT GCA CAT CTC C para el producto del PCR 1, mientras que para el PCR 2 el External Foward Primer fue GDHeF: TCA ACCG TYA AYC GYG GYT TCC GT.
El volumen total de la reacción fue 25 µL, contenía 1X PCR búfer con Mg+; 0,2 mM de dNTP; 0,2 µM de cada cebador, 0,1 U/µL de la enzima TAQ HotStart DNA y 3 µL de ADN. Las muestras fueron sujetas a una desnaturalización inicial a 94 °C por tres minutos, seguido de 35 ciclos de desnaturalización a 94 °C por 30 segundos, hibridación a 56 °C por 30 segundos y extensión a 72 °C por un minuto, terminando con una extensión final de a 72°C por cinco minutos.
En el caso del gen beta giardina las condiciones de amplificación fueron las descritas por Caccio 17. Los cebadores del PCR 1 fueron el primer forward G7: AAG CCC GAC GAC CTC ACC CGC AGT GC y el primer reverse G759: GAG GCC GCC CTG GAT CTT CGA GAC GAC y el forward para el PCR 2 fue el G376: GAT AAC GAC GCC ATC GCG GCT CTC AGG AA. El volumen total de la reacción y las concentraciones de reactivos fue igual al empleado en el gen gdh. Las muestras fueron sujetas a 35 ciclos 94 °C por 30 segundos, 65 °C por 30 segundos y 72 °C por un minuto con una extensión final a 72 °C por cinco minutos.
Ambas reacciones fueron realizadas en el Termociclador MultiGene OptiMax Termal Cycler version 1.1. El control negativo fue agua estéril y el control positivo de ADN genómico la cepa Giardia intestinalis (Lambl) Alexeieff (ATCC® 30888D™). Los productos del PCR fueron visualizados en geles de agarosa al 2% teñidos con colorante fluorescente Safe green ABM a 70V por 60 minutos.
ANÁLISIS DE DATOS
Para evaluar las diferencias en las concentraciones de ADN obtenidas de la cuantificación de los diferentes métodos de extracción se utilizó el análisis de varianza ANOVA con el estadístico HSD Tukey con un intervalo de confianza de 95% y un valor de p<0,05 como estadísticamente significativo. Los datos fueron procesados empleando el software IBM SPSS Statistics para Windows, versión 23 (IBM Corp., Armonk, N.Y., USA).
CONSIDERACIONES ÉTICAS
La aprobación ética para este estudio fue otorgada por el Comité Institucional de Ética en Investigación (CIEI) del Instituto Nacional de Salud de acuerdo con las normas éticas para la autorización de uso de material biológico para las investigaciones del Centro Nacional de Salud Pública.
RESULTADOS
EXTRACCIÓN, CUANTIFICACIÓN Y AMPLIFICACIÓN DE ADN DE QUISTES
Se analizaron 65 muestras de quistes de Giardia spp. con una carga parasitaria promedio de 5x104 quistes por muestra, realizando cinco extracciones por método evaluado. Inicialmente, se trabajó con metodologías referenciadas como es el caso de los métodos III, VI, VII, VIII y XI sin obtener resultados satisfactorios; motivo por el que se realizaron modificaciones a las metodologías, proponiendo los métodos I, II, IV, V, IX y X descritos en la Tabla 1.
Los pretratamientos enzimáticos evaluados fueron siete, los que incluían búfer de lisis con detergentes iónicos, como el SDS, no iónicos como el tritón X-100, agentes reductores como el mercaptoetanol, agentes caotrópicos como el tiocianato de guanidina, entre otros, teniendo mejor desempeño el pretratamiento E1 (método I, II y IV) al lograr el éxito en la amplificación del marcador bg (100% de amplificación). Asimismo, el pretratamiento mecánico con el uso perlas de vidrio en los métodos I y III fue combinado con pretratamientos de choque térmico para ayudar a romper la pared quística logrando la amplificación del marcador bg en 100% de las muestras.
Con respecto a la concentración de ADN, el método I permitió extraer la mayor cantidad de ácidos nucleicos (12,24 ng/µL), seguido de los métodos V, VII y II (11,67; 10,4 y 8,87 ng/µL), cabe resaltar que el método I mostró diferencias significativas comparado a los métodos II (p=0,039), III-IV, VI y IX (p˂0,001). Por otro lado, la pureza del ADN extraído de las muestras fue variable, no encontrando diferencias significativas entre los métodos comparados, mostrando que los 11 métodos evaluados no obtuvieron una calificación de pureza óptima para la relación de absorbancias A260/A280, ya que los valores obtenidos estaban entre 1,2 y 1,4 (métodos I-VII y IX), evidenciándose una presencia elevada de compuestos aromáticos; mientras que los métodos VIII, X y XI tenían un rango de 3,09-3,65; lo que indica una alta contaminación con RNA (Tabla 3).
Tabla 3 Comparación de concentración y calidad de ADN (ng/µL) generados por los diferentes métodos de extracción de ADN de Giardia spp. a partir de quistes.
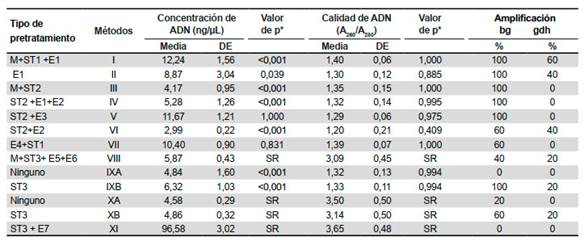
ST1:pretratamiento choque térmico 1; ST2: pretratamiento choque térmico 2; ST3: pretratamiento choque térmico 3; E1: pretratamiento enzimático 1; E2: pretratamiento enzimático 2; E3: pretratamiento enzimático 3; E4: pretratamiento enzimático 4; E5: pretratamiento enzimático 5; E6: pretratamiento enzimático 6; E7: pretratamiento enzimático 7; ng/µL: nanogramo por microlitro; A260/A280: relación de absorbancias 260 y 280; bg: gen de beta giardina; gdh: gen de glutamato deshidrogenasa; DE: desviación estándar; SR: sin resultado de valor de p al haberse excluido del análisis por la baja calidad de ADN. *Prueba HSD Tukey de la comparación de los métodos evaluados con el método I (mejor rendimiento)
Sin embargo, la variable de interés fue el éxito en la amplificación para evaluar el rendimiento de los métodos, observando que al realizar la amplificación por PCR semianidada, se evidenció que 100% de las muestras fueron detectadas con el marcador bg cuando se empleó los métodos I-V, IXB que incluían un pretratamiento con choque térmico, excepto en el método II; y extracción con el kit comercial STOOL DNA Isolation de Norgen, verificado con la visualización de banda de 384 pb (PCR2) en la electroforesis (Figura 1). En el caso del marcador gdh, al aplicar los métodos I,II y VI se logró amplificar entre 40 y 60% de las muestras, estas metodologías incluían al menos un pretratamiento enzimático y extracción con el kit comercial STOOL DNA Isolation de Norgen verificado con la visualización de banda de 432 pb (PCR2) (Figura 2).

Figura 1. (Electroforesis en agarosa al 2% de productos de PCR semianidada para el gen beta giardina (384 pb) extraído de quistes de Giardia spp.
Al evaluar la extracción sin aplicación de pretratamientos a la muestra, se extrajo escasa cantidad de ADN, inferior a 4,8 ng/µL, siendo el éxito de amplificación mínimo; sólo el 20% para el marcador bg y nulo para gdh; lo que fue evidenciado en los métodos IXA y XA; cabe resaltar que aplicar un pretratamiento de choque térmico (ST3) mejoró ligeramente los resultados, el kit comercial STOOL DNA Isolation de Norgen mostró mejor rendimiento, mientras que el uso de un método de extracción in house con solventes orgánicos no mostró buen rendimiento.
Los resultados indican que el gen bg presentó alto rendimiento en la detección de ADN parasitario extraído de quiste, amplificando al 100% de las muestras en al menos seis métodos y presentando mayor intensidad en las bandas de electroforesis (Figura 1); en comparación al marcador gdh, que alcanzó 60 % de detección al emplear el método I, observando bandas más tenues (Figura 2).
EXTRACCIÓN, CUANTIFICACIÓN Y AMPLIFICACIÓN DE ADN DE TROFOZOÍTOS
Se analizaron muestras de trofozoítos de Giardia intestinalis (ATCC® 30957™) con una carga parasitaria promedio de 5x106 trofozoítos por muestra. En relación a la concentración del ADN extraído, según las pruebas de ANOVA y de Tukey existe diferencia significativa entre los métodos evaluados (p<0,05), el método I extrajo mayor cantidad de ADN somático (26,56 ng/µL; p<0,001) comparado a los otros métodos (Tabla 4). Asimismo, en relación a la calidad de las muestras de ADN extraídas, se evidenció que los métodos I y III presentan valores de pureza óptima (relación A260 / A280 de 1,83-1,85) y los métodos II, IV-VI pureza aceptable (1,60 1,76). Cabe resaltar que no existió diferencia significativa al comparar la calidad de ADN entre las metodologías. Asimismo, al evaluar los marcadores moleculares ambos presentaron alto rendimiento 100% de amplificación.
Tabla 4 Comparaciones múltiples de acuerdo a la concentración y calidad de ADN generados por los diferentes métodos de extracción de ADN de Giardia spp. a partir de trofozoítos
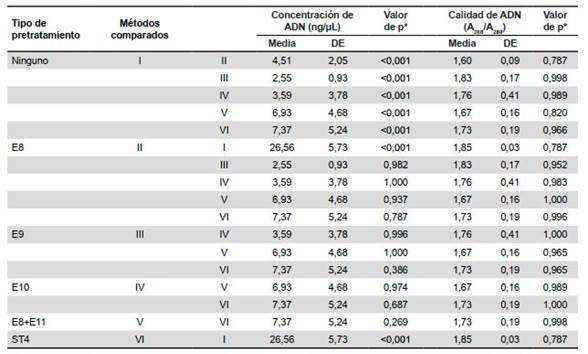
ST4: pretratamiento choque térmico 4; E8: pretratamiento enzimático 8; E9: pretratamiento enzimático 9; E10: pretratamiento enzimático 10; E11: pretratamiento enzimático 11; ng/µL: nanogramo por microlitro; A260/A280: relación de absorbancias 260 y 280; bg: gen de beta giardina; gdh: gen de glutamato deshidrogenasa; n: número de muestras analizadas; DE: desviación estándar. *Prueba HSD Tukey
DISCUSIÓN
En el presente estudio se compararon diferentes metodologías de extracción de ácidos nucleicos de Giardia spp., los resultados de las concentraciones de ADN obtenidas de la fase quística indican que con la aplicación de tres pretratamientos previos a la extracción del kit comercial Stool DNA Isolation de Norgen, descritos en el método I, se puede obtener una concentración de ADN de 12,24 ng/µL con pureza de 1,4 y lograr un alto rendimiento en la detección molecular de Giardia spp. Al usar el marcador bg (100% de amplificación) y con gdh (60%), en comparación a los otros métodos evaluados; cabe resaltar que esta combinación se basó en los métodos de Adamska 19, Rojas 20, Babaei 21 y Molina 24. Con respecto a la evaluación de métodos de extracción de trofozoítos indicamos que al someter a las muestras a pretratamientos (Métodos II-VI) no se logró mejorar la extracción de ADN somático del parásito, más bien se tuvo baja recuperación, contrario a lo reportado por Molina et al.7, cabe resaltar que en todos los casos la calidad de ADN fue óptima, motivo por el que no se sugiere realizar pretratamientos para este estadio evolutivo de Giardia spp. ya que reduce significativamente la extracción de ADN parasitario.
La tipificación molecular de agentes etiológicos es una prioridad en los laboratorios de salud pública, debido a las implicancias en abordaje terapéutico y distribución epidemiológica; los protocolos de extracción de ácidos nucleicos son variables dependiendo del tipo de muestra y del organismo a estudiar, sobre todo en los parásitos que presentan diferentes estadios evolutivos, por lo que es importante la elección de un método de extracción de alto rendimiento que sea sencillo, rápido y reproducible. Los genes de la enzima glutamato deshidrogenasa-gdh (16,25, 26) y de la beta giardina-bg 10,17,27 han sido ampliamente usados demostrando gran especificidad para la caracterización molecular de Giardia spp., razón por la que se emplearon para el rendimiento de los métodos evaluados.
La literatura reporta que es necesario separar los quistes de los detritos presentes en las muestras fecales empleando el método de concentración por gradiente de sucrosa de dos fases 12-14, para reducir la posible inhibición de la PCR ocasionada por los componentes de las muestras coprológicas como las sales biliares, proteínas, hemoglobina, lactoferrina, inmunoglobulinas, entre otros 9, y obtener ADN intacto para obtener métodos comparables. Otro punto importante, es eliminar las sustancias derivadas de los procesos de extracción, que según los estudios el uso de columnas procedentes de kits comerciales facilita la purificación de ADN, disminuyendo la presencia de inhibidores químicos, alcanzando mayores tasas de amplificación a las obtenidas empleando una metodología convencional basada en fenol/cloroformo 8,21. En este estudio se evidenció la inhibición de la detección del gen gdh y bg al evaluar los métodos VII y XI 22, cuyo proceso de extracción fue con el método in house, este último método presentó baja calidad de ADN (3,65 de relación A260/A280) con presencia de alta contaminación.
Por otro lado, al ejecutar los métodos IXA y XA, usando sólo kits comerciales, Stool DNAIsolation de Norgen y el QIAAmp DNA STOOL de Qiagen sin pretratamientos, se encontraron valores promedio de calidad y concentración de ADN de 1,32 / 4,84 ng/µL y 3,5 / 4,58 ng/µL, respectivamente, sin éxito en la amplificación para los marcadores estudiados, por lo que es necesario aplicar protocolos de pretratamiento a las muestras. Asimismo, se encontró que realizar un sólo pretratamiento de choque térmico (métodos IXB y XB) resultó insuficiente para lograr la amplificación de más del 20% del marcador gdh. En concordancia a lo reportado por Sepahvand et al. 18; quienes sugieren el uso de perlas de vidrio, para producir un efecto mecánico y mejorar la eficiencia del protocolo de extracción para recuperar mayor cantidad de ADN. Esto se evaluó al aplicar el método III, recuperando 4,17 ng/uL de ADN logrando una amplificación del 100% de las muestras para el marcador bg, pero con dificultades para detectar el marcador gdh, motivo por el que se consideró que es importante adicionar algún pretratamiento enzimático para mejorar la recuperación de ácidos nucleicos.
La evaluación del método II, con sólo un pretratamiento enzimático, mostró una concentración deADN de 8,87 ng/ml y una detección del 100% del marcador bg y 40% del gdh; el método IV, incluyó adicionalmente un pretratamiento de choque térmico y degradación enzimática por dos búfer de lisis (E-GTP) y la acción de la proteinasa K, amplificando solo al marcador bg; del mismo modo, se evaluó la acción del búfer tritón y se aplicó el método V obteniendo resultados similares al método IV.
En la mayoría de estudios previos, no se han mostrado protocolos de extracción con datos específicos de concentración de ADN extraído y resultados de medición por PCR, siendo importante conocer esta correlación. Al realizar el método VI se llevó a cabo la metodología de Adamska et al.19, quienes realizan pretratamientos de choque térmico (tres ciclos), enzimáticos (proteinasa K) y extracción con kit comercial reportando alta detección del gen bg por PCR. Del mismo modo, Molina et al.24; informan un 79% -80% de detección molecular por PCR detectando desde 15 quistes/µL, sin embargo, los resultados de este estudio no fueron comparables, alcanzando concentraciones de ADN ˂2,9 ng/µL y detección del gen bg sólo en 60% de las extracciones.
Otras metodologías incluían múltiples pretratamientos enzimáticos (búfer de lisis TE y proteinasa K), mecánicos (con perlas de vidrio) y de choque térmico como lo muestra Babei et al. 22; este protocolo fue evaluado en el método VIII recuperando 5,87 ng/µL de ADN logrando una amplificación de 40% y 20% para los marcadores bg y gdh, respectivamente. Este método no fue práctico ya que involucraba muchos pretratamientos de choque térmico (ocho ciclos con nitrógeno líquido) y requería el uso de proteinasa K, que es un insumo costoso. Sin embargo, el pretratamiento mecánico con el uso de perlas de vidrio fue una alternativa adecuada.
En nuestro país, Rojas en 2014 20, utilizó dos pretratamientos enzimáticos, el búfer de lisis 3 y el búfer GTP como alternativa al uso de proteinasa K y extracción con el método convencional reportando alta concentración y pureza de ADN (2156,2 ng/µL; 1,79-2,04), pero bajo porcentaje de amplificación al marcador bg (13,3%). No obstante, al evaluar el método VII no se logró obtener las grandes cantidades de ADN que reportó el autor, a pesar de usar mayor cantidad de quistes (5x104 quistes/muestra); adicionalmente, el porcentaje de amplificación fue de 60% para el gen bg y nulo para gdh, posiblemente atribuido a la metodología de extracción. En vista de los resultados obtenidos por las investigaciones previas, para aumentar el número de muestras amplificadas se propuso combinar diferentes pretratamientos incluyendo el mecánico, enzimático y de choque térmico.
Una de las limitaciones del estudio fue no incluir mayor número de muestras por cada método evaluado, a fin de mejorar la potencia estadística. Además, al comparar cargas parasitarias de diferentes pacientes existe el sesgo de no homogeneidad en las muestras. No obstante, para disminuir este sesgo se trabajó con la misma cantidad de quistes por método; consideramos que los resultados de este estudio son importantes, ya que evidencian que es posible extraer ADN de la fase quística del parásito a fin de llevar futuros estudios de genotipificación de cepas nativas en el país, y es el punto de inicio para determinar límites de detección de Giardia spp. para diferentes marcadores moleculares, y ser utilizados a partir de muestras coprológicas e implementar el diagnóstico molecular de esta parasitosis.
Se concluye que el método que obtiene los mejores resultados para la extracción de ácidos nucleicos a partir de quistes de Giardia spp. incluye la aplicación de tres pretratamientos: mecánicos, enzimáticos y de choque térmico; siendo el marcador molecular bg de mejor rendimiento para el estadio de quiste. Por su parte, el estadio de trofozoíto no requiere pretratamiento. Los resultados de este estudio permiten contar con una metodología reproducible para la detección molecular del parásito Giardia spp. en cualquier estadio evolutivo para posteriores estudios de genotipificación y/o resistencia parasitaria.