INTRODUCCIÓN
MENSAJES CLAVE
Motivación para realizar el estudio. La introducción del virus Zika en Perú resalta la necesidad de realizar pruebas de diagnóstico en punto de atención, o cerca de la ubicación del paciente.
Principales hallazgos. Se desarrolló un método de diagnóstico de bajo costo, alto rendimiento, viabilidad y confiabilidad para el diagnóstico rápido de Zika.
Implicancias. El método de diagnóstico propuesto podría ser una alternativa de gran utilidad en instalaciones de atención primaria de salud en Perú.
El Zika es una enfermedad febril causada por un flavivirus denominado el virus Zika (ZIKV) 1. La capacidad de este virus para adaptarse a nuevos vectores 2 y la influencia de otros factores tales como el cambio climático y la migración, pueden tener un gran impacto en su expansión geográfica.
El surgimiento, el resurgimiento y la rápida propagación de este virus son hoy en día un problema mundial de salud pública debido a las consecuencias clínicas que esta infección puede generar en grupos vulnerables. Desde 2015, América Latina se ha convertido en el punto de atención debido a la alta frecuencia de infecciones por ZIKV, a causa de su condición tropical 3. Se han hecho esfuerzos para prevenir, detectar y responder a la infección, desarrollándose varios métodos para la detección del ZIKV. Estos métodos se pueden agrupar en ensayos inmunoenzimáticos 4 como ELISA, aislamiento viral 5 y métodos moleculares como la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) 6. Sin embargo, cada uno de estos métodos presenta desventajas tales como baja especificidad/sensibilidad (ELISA), alta complejidad y tiempo (aislamiento viral), así como elevados costos (RT-PCR) 7. Además, todos estos métodos requieren condiciones especiales de laboratorio, dificultando su utilidad en la mayoría de las regiones donde prevalece la infección por ZIKV. Por tanto, es necesario encontrar una mejor alternativa, que incluya plataformas y tecnologías de diagnóstico de mayor accesibilidad que puedan identificar de manera rápida, precisa y sencilla enfermedades infecciosas emergentes en el punto de atención, así como contribuir a la detección y vigilancia.
2015, América Latina se ha convertido en el punto de atención debido a la alta frecuencia de infecciones por ZIKV, a causa de su condición tropical 3. Se han hecho esfuerzos para prevenir, detectar y responder a la infección, desarrollándose varios métodos para la detección del ZIKV. Estos métodos se pueden agrupar en ensayos inmunoenzimáticos 4 como ELISA, aislamiento viral 5 y métodos moleculares como la reacción en cadena de la polimerasa con transcriptasa inversa (RT-PCR) 6. Sin embargo, cada uno de estos métodos presenta desventajas tales como baja especificidad/sensibilidad (ELISA), alta complejidad y tiempo (aislamiento viral), así como elevados costos (RT-PCR) 7. Además, todos estos métodos requieren condiciones especiales de laboratorio, dificultando su utilidad en la mayoría de las regiones donde prevalece la infección por ZIKV. Por tanto, es necesario encontrar una mejor alternativa, que incluya plataformas y tecnologías de diagnóstico de mayor accesibilidad que puedan identificar de manera rápida, precisa y sencilla enfermedades infecciosas emergentes en el punto de atención, así como contribuir a la detección y vigilancia.
La amplificación isotérmica mediada en lazo, LAMP (por las siglas en inglés de Loop-mediated isothermal amplification) permite la detección en un solo paso de la amplificación génica a una sola temperatura8) y se ha informado que LAMP es más simple y sensible que los métodos tradicionales de PCR convencionales. Últimamente, el método LAMP se ha utilizado en un formato de retro transcriptasa (RT-LAMP) para detectar virus ARN en un solo paso 9. Además, el reactivo LAMP liofilizado no requiere condiciones especiales durante el almacenamiento, el transporte y la operación, por lo que puede usarse para detectar microorganismos patógenos incluso en países tropicales 10. Si el reactivo LAMP liofilizado es aplicable a la detección del ZIKV, sería muy útil en varias partes del mundo.
En este estudio se desarrolló y validó, usando muestras de suero, un método específico, sensible y fácil de usar para detectar ZIKV basado en RT-LAMP, que puede realizarse en cualquier parte del mundo requiriendo condiciones mínimas de laboratorio.
EL ESTUDIO
MUESTRAS DE SUERO
Se emplearon muestras de suero de diversas regiones del Perú, colectadas bajo el Sistema Nacional de Vigilancia del Laboratorio de Referencia Nacional de Metaxénicas Virales (LRNMV) del Instituto Nacional de Salud del Perú (INS).
Estas muestras correspondían a pacientes con cuadros clínicos febriles agudos. El tratamiento de los pacientes y las muestras se dieron de acuerdo a lo estipulado en el Protocolo de Investigación aprobado por el Comité Institucional de Ética en Investigación del INS.
IDENTIFICACIÓN DEL VIRUS
El LRNMV detectó ZIKV y otros arbovirus utilizando el método estándar de oro de reacción en cadena de la polimerasa con transcriptasa inversa (qRT-PCR), previamente descritos para Zika11 , Dengue12 , Chikungunya 13, fiebre amarilla 14, Oropouche 15 y Mayaro 16, y adaptados a los protocolos del INS.
DISEÑO DE LOS PRIMERS
Los nuevos primers ZIKV RT-LAMP se diseñaron basándose en la región del gen codificante de la enzima ARN polimerasa dependiente de ARN denominada NS5 (proteína no estructural 5) del genoma del ZIKV utilizando el software Primer Explorer V4 (Fujitsu System Solutions Ltd., Tokio, Japón). Las secuencias de nucleótidos conservadas dentro de la región NS5 se identificaron usando una alineación múltiple de 64 genomas completos del ZIKV disponibles de las bases de datos DDBJ / EMBL / GenBank (Tabla 1).
EXTRACCIÓN DE ARN
La extracción y purificación del ARN se realizaron utilizando el estuche comercial de purificación de ADN / ARN genómico GeneJET (Thermo Scientific, EE. UU.) de acuerdo con las instrucciones del fabricante. Los pasos opcionales o recomendados en el protocolo para eliminar los inhibidores de la reacción fueron seguidos.
El ARN se usó inmediatamente en la reacción de RTLAMP o se almacenó en alícuotas a -80 °C hasta su uso.
ENSAYO RT-LAMP UTILIZANDO REACTIVO LIOFILIZADO
Los microtubos que contienen el reactivo liofilizado fueron tomados de un estuche comercialmente disponible que se dirige al ácido nucleico mediante el método LAMP, el reactivo de amplificación de ARN/ADN Loopamp D (Eiken Chemical Co., Ltd., Tokio, Japón). Los microtubos fueron transportados, almacenados y rehidratados a temperatura ambiente. La reacción de RT-LAMP se llevó a cabo en un tubo de 0,2 ml, con un volumen de reacción total de 30 μL, 5 μL de solución de ARN, 1,3 μL de oligonucleotidos ZIKV RT-LAMP que contenían oligonucleótidos FIP y BIP (40 pmol), F y B (20 pmol), oligonucleotidos externos F3 y B3 (5 pmol), y 23,7 μL de agua destilada. La tapa se aseguró firmemente y el microtubo se invirtió durante 3 minutos para rehidratar el reactivo que se encuentra en la tapa del tubo.
El tubo se calentó a 65 °C durante 1 h y a 80 °C durante 5 min (inactivación enzimática). Los resultados de la reacción se determinaron visualmente por el cambio de color de marrón a verde en la solución de reacción. Considerándose negativo el tubo control en donde no se evidenció cambio de coloración.
PRUEBA PRELIMINAR
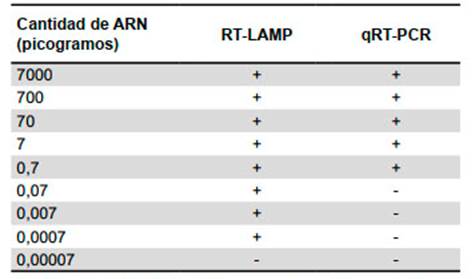
Se compararon siete muestras de suero que fueron previamente confirmadas como positivas para los siguientes agentes virales: ZIKV-1 (n=2), DENV-1 (n=1), DENV-2 (n=1), DENV-3 (n=1), DENV-4 (n=1) y CHIKV (n=1) usando las metodologías de qRT-PCR descritas para los virus mencionados. Luego se probó todas las muestras usando el ZIKV RT-LAMP para evaluar la especificidad. Además, una de las soluciones de ARN de ZIKV fue cuantificada y diluida en serie (10 veces) hasta 15 tubos. Luego, dichas diluciones fueron probadas por el ZIKV RT-LAMP y la qRT-PCR para evaluar la sensibilidad.
EXPERIMENTO DE VALIDACIÓN DIAGNÓSTICA
Se usaron un total de 300 muestras de suero para evaluar el rendimiento del ZIKV RT-LAMP. La mitad de ellos fueron muestras positivas de Zika. Las muestras de suero analizadas fueron recolectadas durante 2016-2017 en las regiones de Piura, Tumbes, Loreto, San Martín, Huánuco, Ucayali, Lima y Cajamarca. Las muestras se volvieron a evaluar primero mediante el método estándar de oro qRT-PCR. Finalmente, las muestras de suero fueron probadas usando el método ZIKV RT-LAMP como se describió anteriormente y los resultados fueron comparados.
HALLAZGOS
EVALUACIÓN INICIAL DE ZIK RT-LAMP
Los nuevos primers ZIKV RT-LAMP se evaluaron con las 7 muestras de suero descritas anteriormente. Los resultados se evidenciaron a simple vista (Figura 1A), notando que sólo los resultados positivos de la muestra para ZIKV mediante los métodos estándar de oro qRT-PCR fueron positivos con ZIKV RT-LAMP. Además, una solución de ARN de ZIKV fue cuantificada obteniendo un valor inicial de 7 ng, para luego ser diluida en serie y analizada. El resultado de las pruebas del ZIKV RT-LAMP se determinó también de manera visual (Figura 1B).
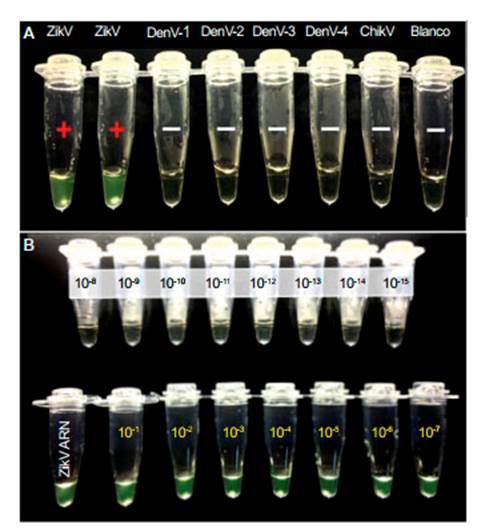
Figura 1 A. Especificidad del método para la detección del virus Zika por amplificación isotérmica mediada en lazo de transcriptasa inversa (ZIKV RT-LAMP), soluciones de ARN de ZIKV, DENV-1, DENV-2, DENV-3, DENV-4 y CHIKV reacción positiva (+) y negativa (+) LAMP juzgada visualmente. B. Sensibilidad del método ZIKV RT-LAMP, solución de ARN de ZIKV seguido por una serie de diluciones 10 veces
Los resultados comparativos mostraron que el ZIKV RTLAMP es 1000 veces más sensible que RT-PCR en tiempo real, revelando un límite de detección tan bajo como 0,0007 pg (Tabla 2).
VALIDACIÓN DE LABORATORIO DE ZIKV RT-LAMP
Se analizaron 300 muestras de suero mediante los métodos estándar de oro qRT-PCR y se determinó que 150 resultaron positivos a ZIKV, 15 a DENV-1, 15 a DENV-2, 15 a DENV-3, 15 a DENV-4, 20 a CHIKV, 10 a Fiebre Amarilla, 10 a Oropouche, 10 a Mayaro y 40 fueron negativos a los anteriores. Después, todas las muestras fueron analizadas con el método ZIKV RT-LAMP. Los resultados usando ambos métodos coincidieron perfectamente, excepto para una muestra que se reportó como positiva para ZIKV por el método estándar de oro qRT-PCR y negativa por el método ZIKV RT-LAMP (Tabla 3). Finalmente, se calculó la competencia del método ZIKV RT-LAMP con una sensibilidad del 99,3% (IC 95%: 97,7 -100,0), una especificidad del 100% (IC 95%: 99,7 - 100,0), un valor predictivo positivo del 100% (IC 95%: 99,7 -100,0) y un valor predictivo negativo del 99,3% (IC 95%: 97,7 - 100,0).
Tabla 3 Validación del método para la detección del virus Zika por amplificación isotérmica mediada en lazo de transcriptasa inversa (ZIKV RT-LAMP) utilizando muestras de otros arbovirus
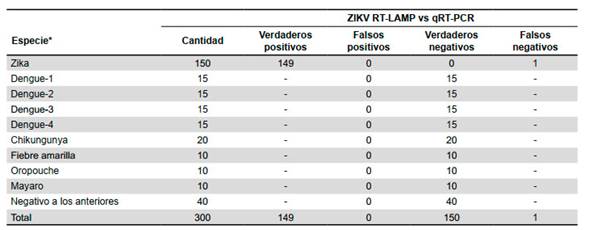
*La identificación de la especie fue previamente realizada por el método estándar de oro de reacción en cadena de la polimerasa con transcriptasa inversa (qRT-PCR) Guión: no aplica dato
DISCUSIÓN
Durante los últimos años, se han desarrollado varios métodos de amplificación de ARN para detectar ZIKV, como RT-PCR, SYBR Green en tiempo real RT-PCR y Taqman en qRT-PCR 7,11. Aunque estos métodos han demostrado ser muy confiables, requieren instalaciones de laboratorio estandarizadas, equipos sofisticados e instrumentos especiales. Además, se necesita personal bien capacitado para ejecutar los experimentos. Este estudio presenta un método novedoso y altamente específico de RT-LAMP para la detección de ZIKV. Este método proporciona ventajas con respecto al tiempo, la operación, la viabilidad y el costo. Algunos grupos de investigación han desarrollado antes métodos basados en RT-LAMP para detectar ZIKV mostrando muy buenos resultados.
Calvert et al. reportaron una RT-LAMP con un nivel de sensibilidad 10 veces mayor que qRT-PCR 17. No obstante, el método ZIKV RT-LAMP mostró un nivel de sensibilidad 1000 veces mayor que qRT-PCR. A diferencia de Wang et al. que reportaron un RT-LAMP probado en muestras clínicas simuladas mostrando una sensibilidad similar a qRT-PCR 18, nuestra ZIKV RTLAMP se probó usando 300 muestras clínicas, 150 de ellas fueron ZIKV.
Korosaki et al. informaron sobre otro RT-LAMP que muestra resultados muy interesantes, alta sensibilidad, alta especificidad y se analizó utilizando muestras de suero, plasma y orina 19. Sin embargo, el uso de reactivo líquido LAMP en la metodología puede ser muy problemático al momento de transportar y almacenar.
En el ZIKV RT-LAMP se solucionó este problema al introducir el uso del reactivo LAMP liofilizado. Song et al. reportaron un método RT-LAMP que es simple, fácil de usar, rentable y aplicable en punto de atención, o cerca de la ubicación del paciente 20. Parece tener la misma dirección que nuestro método, como la detección visual sin necesidad de equipo.
La ventaja del método ZIKV RT-LAMP es que ha probado también ser útil con muestras de suero obteniendo valores altos de sensibilidad y especificidad. Dichos valores responden principalmente al buen diseño de los primers y a la apropiada aplicación de la metodología. La única limitante es que la metodología LAMP no permite el diagnóstico diferencial en la misma reacción, aunque esto podría solucionarse diseñando primers para otros arbovirus y colocarlos en tubos adicionales.
En conclusión, el método ZIKV RT-LAMP desarrollado en este estudio permite una identificación rápida y confiable de ZIKV. Debido a su bajo costo, la practicidad y la operación simple pueden ser una buena alternativa para su utilización incluso en instalaciones de atención primaria de salud u hospitales locales sin equipo de laboratorio complejo.