INTRODUCCIÓN
Al 7 de abril de 2020, la Organización Mundial de la Salud (OMS) reportó en las Américas un total de 417 416 casos confirmados de infección por el virus SARS-CoV-2 (COVID-19) y 12 597 fallecidos, de estos 2954 infectados y 107 muertos correspondían a Perú 1.
El diagnóstico de infección por el virus SARS-CoV-2 se realiza mediante la prueba de reacción en cadena de la polimerasa con transcriptasa reversa en tiempo real (RT-PCR), la cual detecta la presencia del ARN viral. Esta prueba molecular (RT-PCR) es útil en las tres primeras semanas de infección y es actualmente el estándar de referencia recomendado por la OMS 2. Sin embargo, la prueba tiene algunos inconvenientes como: alto costo; dificultad para implementarse en escenarios de recursos limitados; sensibilidad variable dependiendo del tipo de muestra (93% en el lavado broncoalveolar, 72% en esputo, 63% en hisopado nasal y 32% en hisopado faríngeo) 3; y su baja sensibilidad a partir de la tercera semana de iniciados los síntomas 4.
Las pruebas inmunológicas pueden ser una ayuda diagnóstica complementaria y un apoyo importante en la vigilancia epidemiológica. Estas pruebas se basan en la detección de las inmunoglobulinas IgM e IgG contra SARS-CoV-2, las cuales aparecen a partir de la segunda semana de infección 5. Existen pruebas basadas en la detección de anticuerpos en sangre venosa y sangre capilar. Estas últimas denominadas «pruebas serológicas rápidas», que permiten obtener resultados en pocos minutos. Sin embargo, la sensibilidad parece ser dependiente del momento de toma de muestra y puede ser mayor al 90% a partir de la segunda semana de síntomas 6. Su uso podría contribuir de manera significativa al diagnóstico clínico, particularmente en pacientes hospitalizados, en quienes las pruebas moleculares hayan resultado negativas o no se hayan realizado 6.
En el Perú, hasta fines de marzo del 2020, el diagnóstico de COVID-19 solo se realizó a través de las pruebas moleculares (aproximadamente 800 pruebas diarias). En un escenario de incremento del número de casos, se podría generar un subregistro. En dicho contexto, el gobierno peruano adquirió más de un millón de pruebas serológicas rápidas. Sin embargo, antes de su aplicación a gran escala era necesario evaluar su utilidad comparándolas con la prueba molecular.
El objetivo del estudio fue evaluar en condiciones de campo la prueba serológica rápida para detección de anticuerpos IgM e IgG, a través del cálculo de su rendimiento diagnóstico adicional en comparación al RT-PCR para la detección de infección por SARS-CoV-2.
MENSAJES CLAVE
Motivación para realizar el estudio: En el Perú, el diagnóstico de COVID-19 se basa en la prueba de reacción en cadena de la polimerasa con transcriptasa reversa en tiempo real (RT-PCR); sin embargo, las «pruebas serológicas rápidas» pueden ser un apoyo al diagnóstico, tomando en cuenta la sencillez de su aplicación y que el resultado se obtiene en diez minutos. Sin embargo, se requiere evaluar el rendimiento de dichas pruebas en condiciones de campo.
Principales hallazgos: Las pruebas serológicas rápidas dan un rendimiento diagnóstico adicional de 56,8% en comparación con la prueba molecular y su sensibilidad aumenta con el tiempo de enfermedad.
Implicancias: Las pruebas serológicas rápidas son útiles como pruebas complementarias a la RT-PCR en el diagnóstico de COVID-19, su utilidad aumenta con el tiempo de enfermedad.
MATERIALES Y MÉTODOS
Participantes, tamaño muestral y muestreo
Se realizó una investigación operativa de diseño transversal mediante el cual se incluyó tres tipos de sujetos: a) pacientes hospitalizados, con diagnóstico clínico y radiológico de neumonía viral compatible con COVID-19 del Hospital Nacional Hipólito Unanue, Hospital Nacional Cayetano Heredia y Hospital Nacional Dos de Mayo; b) trabajadores de salud en permanente exposición a personas con diagnóstico confirmado de COVID-19 que se hubieran sometido a la prueba molecular en días previos al estudio; y c) personas que cumplían criterios de caso sospechoso según el Centro Nacional de Epidemiología, Prevención y Control de Enfermedades del Perú (persona sintomática con contacto directo con un caso confirmado de COVID-19 dentro de los 14 días previos al inicio de síntomas), evaluadas en sus casas por los equipos de alerta y respuesta.
Para evaluar la posibilidad de falsos positivos en otras condiciones febriles agudas, se realizó la prueba serológica rápida en 90 muestras de sueros almacenados en la seroteca de Biomedicina del Instituto Nacional de Salud (INS) de pacientes con diagnóstico confirmado de chikungunya, dengue, leptospira y zika (15 de cada una), de brucella, HBAsAg (+), hepatitis C (+) , HIV(+), Oropuche (cinco de cada una), hipertrigliceridemia (n=3) e hipercolesterolemia (n=2), que hubieran brindado consentimiento para el uso de sus sueros en contexto de investigación.
En el grupo de casos sospechosos se pudo obtener muestras simultáneas para la evaluación de la prueba molecular y serológica rápida. En los pacientes hospitalizados y trabajadores de salud que ya contaban con toma de muestra de hisopado nasofaríngeo en días previos a la toma de pruebas serológicas rápidas, no fue posible un remuestreo por aspectos éticos.
Se calculó el tamaño de muestra, mediante la fórmula para una proporción en una población infinita considerando un nivel de confianza del 95% y un rendimiento diagnóstico adicional del 50% (el estimado más conservador cuando no se conoce una proporción) de la serología con respecto al RT-PCR. Se consideró una precisión del 10%. La muestra requerida fue de 97 pacientes. Asumiendo un 10% de pérdidas o datos incompletos el tamaño final fue de 108. El cálculo fue realizado utilizando el software libre OpenEpi (http://www.openepi.com/SampleSize/SSPropor.htm). El tipo de muestreo empleado fue no probabilístico por conveniencia.
Procedimiento de RT-PCR
El procesamiento de las muestras mediante RT-PCR se realizó siguiendo las recomendaciones de la Organización Panamericana de la Salud 2, que permite detectar dos genes: al gen E (cuya presencia indica que pertenece a la familia de beta coronavirus) y RdRp (cuya presencia es específica para el SARS-CoV-2 y sirve como confirmación). Asimismo, se utilizó el gen RnaseP como control de inhibición. La prueba de RT-PCR fue realizada en muestras de hisopado nasal y faríngeo recolectadas mediante técnica estándar en medio de cultivo viral y transportadas al Laboratorio Nacional de Virus Respiratorios (LNVR) del INS en cadena de frío.
Procedimiento de prueba serológica rápida
La identificación de inmunoglobulinas IgG e IgM, se realizó de acuerdo a las recomendaciones del fabricante (COVID -19 IgG/ IgM Rapid Test Cassette (wholeblood/serum/Plasma. Zhejang Orient Gene, Biotech Co LTD, China) 7. La lectura requiere solo 10 minutos y que previamente se observe una primera banda (control) que indica que la prueba está bien realizada. La prueba serológica rápida se realizó mediante la obtención de sangre capilar por digito-punción de acuerdo a técnica estándar 8.
Análisis estadístico
El análisis de los datos se llevó a cabo con el programa estadístico Stata v15.1 (Stata Corporation, College Station, Texas, USA) con el cual se caracterizó la conformación de la muestra por grupo evaluado aplicando la prueba Chi Cuadrado de Pearson para identificar diferencias entre sexo. Se utilizó la prueba T de Student para muestras independientes (con y sin varianzas iguales) y U de Mann-Whitney para identificar diferencias en las medidas descriptivas de la edad entre hombres y mujeres por grupo de estudio. Dichos cálculos se realizaron para la muestra total, así como para los pacientes con registro de tiempo de enfermedad.
Se obtuvo el porcentaje de pruebas positivas por cada uno de los métodos. El rendimiento diagnóstico adicional se calculó dividiendo el número de casos adicionales diagnosticados por las pruebas rápidas sobre el número total de casos detectados por ambos métodos, expresado en porcentaje 9. Además, se realizó la estimación de la sensibilidad de la prueba serológica rápida usando el RT-PCR como estándar de referencia. Para la estimación de la especificidad se evaluó el porcentaje de pruebas serológicas negativas con respecto al total de muestras obtenidas a partir de las muestras de suero con positividad a otros patógenos. Todas los estimadores puntuales obtenidos fueron acompañados por su intervalo de confianza al 95% (IC 95%).
RESULTADOS
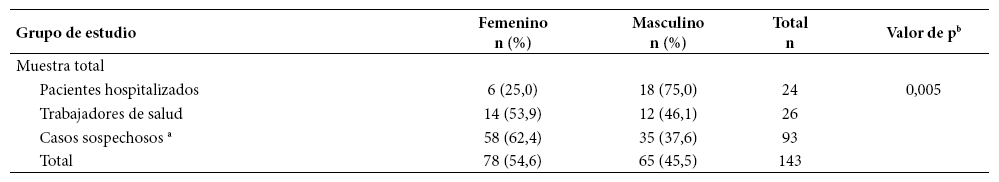
La evaluación se realizó del 30 al 31 de marzo del 2020. De las 144 personas incluidas en el estudio hubo un dato faltante sobre el sexo. La distribución por grupo evaluado mostró diferencias estadísticamente significativas entre hombres y mujeres (n=143) (Tabla 1).
Tabla 1 Características demográficas de la muestra de estudio.
a Hubo un dato faltante por ausencia de información recolectada por las brigadas.
b Prueba Chi Cuadrado de Pearson.
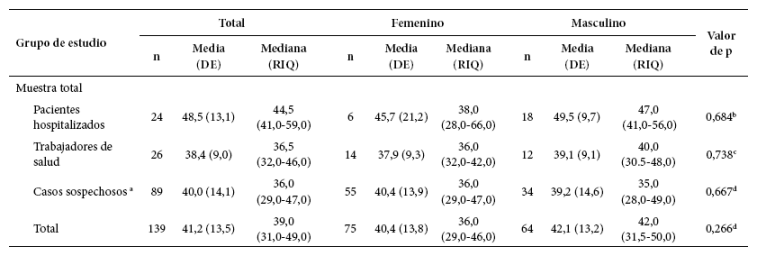
Para la evaluación de la edad se contó con información de 139 pacientes debido a la existencia de cinco datos faltantes en casos sospechosos, la edad promedio fue de 41,2 ± 13,5 años, el grupo con mayor edad fue el de pacientes hospitalizados, seguido de los casos sospechosos y finalmente los trabajadores de salud. En la muestral total, no se encontró diferencias estadísticamente significativas para la edad entre hombres y mujeres (p>0,05) (Tabla 2).
Tabla 2 Distribución de la edad en la muestra de estudio según sexo y grupo evaluado.
a Hubo cinco datos faltantes por ausencia de información recolectada por las brigadas.
b Prueba T de Student para muestras independientes con varianzas diferentes.
c Prueba T de Student para muestras independientes con varianzas iguales.
d Prueba U de Mann-Whitney.
DE: Desviación estándar, RIQ: Rango Intercuartil.
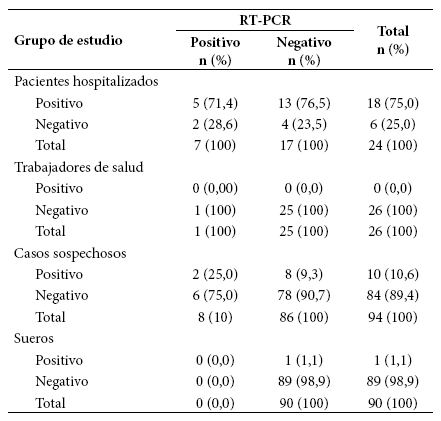
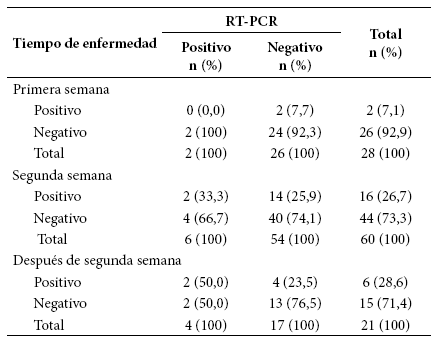
En el grupo de personas evaluadas (n=144), la prueba serológica rápida identificó 28 (19,4%) sujetos positivos, y la prueba molecular 16 (11,1%) (p=0,03). La prueba serológica rápida detectó 21 casos que habían resultado negativos por la molecular, dando un rendimiento diagnóstico adicional de 56,8%. En estos 21 casos, 13 fueron pacientes hospitalizados con criterio clínico y radiológico de neumonía viral compatible con COVID-19 y ocho fueron casos sospechosos con más de siete días de enfermedad (excepto uno que no tenía dato), ambos grupos con factores de riesgo (Tabla 3).
Tabla 3 Resultados de la prueba serológica en comparación con el RT-PCR según tiempo de enfermedad.
RT-PCR: Prueba de reacción en cadena de la polimerasa con transcriptasa reversa en tiempo real.
Evaluación por tiempo de enfermedad
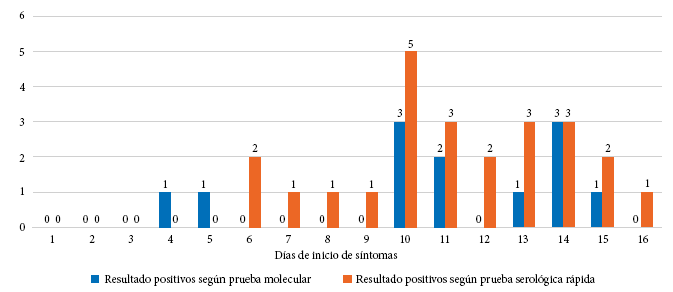
De los 144 sujetos incluidos, se identificó que 109 presentaban información de la fecha de inicio de síntomas (75,7%), con ello se estableció el tiempo promedio de enfermedad hasta el día de la evaluación diagnóstica (17,59 ± 4,1 días). Para los sujetos que días previos ya habían brindado muestras para la prueba molecular, se consideró como fecha de evaluación el día de la evaluación por prueba serológica rápida; con estos valores se categorizó el periodo de enfermedad según semana de manifestación clínica, identificándose que 60 (55,1%) cursaban la segunda semana de enfermedad, 28 (25,7%) la primera y 21 (19,3%) más de dos semanas (Tabla 3). La Figura 1 muestra las pruebas positivas mediante ambas pruebas de acuerdo al día de inicio de síntomas.
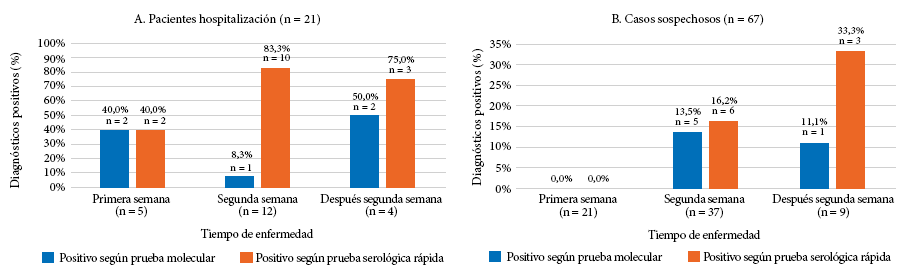
Durante la primera semana de síntomas, el rendimiento diagnóstico adicional de la prueba serológica rápida fue de 50% con respecto al RT-PCR. En la segunda semana, fue de 70% y luego de la segunda semana, el rendimiento diagnóstico adicional fue de 50% con respecto al RT-PCR (Tabla 3, Figura 2).
Evaluación por grupo de estudio
En los 94 pacientes evaluados de manera domiciliaria el rendimiento diagnóstico adicional fue de 50% con respecto al RT-PCR; en los 24 pacientes hospitalizados, el rendimiento diagnóstico adicional fue 65 % (Tabla 4, Figura 2).
Sensibilidad
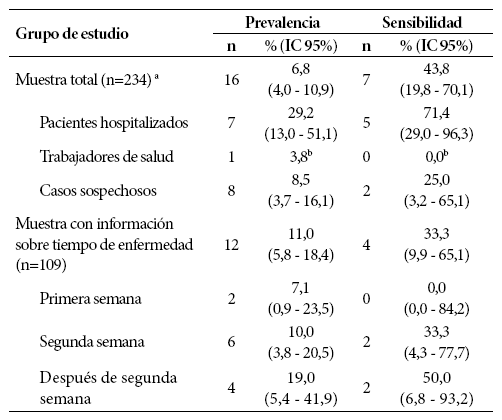
Al comparar los resultados de la prueba rápida con los resultados de la molecular, la prueba rápida mostró un 43,8% de sensibilidad (IC 95%: 19,8 - 70,1). Según semana de enfermedad, se encontró que la sensibilidad aumentaba gradualmente con el tiempo, identificándose 0% durante la primera semana, 33,3% en la segunda y 50,0% para después de la segunda semana. Según grupo evaluado, se encontró una mayor sensibilidad en pacientes hospitalizados (71,4%; IC 95% 29,0-96,3), seguido de los casos sospechosos (25,0%; IC 95%: 3,19-65,1) (Tabla 5).
Tabla 5 Sensibilidad de la prueba serológica rápida en comparación con el RT-PCR como prueba de referencia
a Considera a sujetos con y sin dato de tiempo de enfermedad.
b No se pudo calcular estimador ni intervalo de confianza por escasa cantidad de casos.
IC 95% = Intervalo de Confianza al 95%, RT-PCR: Prueba de reacción en cadena de la polimerasa con transcriptasa reversa en tiempo real.
DISCUSIÓN
Al comparar el rendimiento de la prueba molecular y de la prueba rápida, observamos que esta última identificó 56,8% casos adicionales. En la estratificación por grupo de estudio, la prueba rápida detectó 61,9% y 38,1% casos adicionales en pacientes hospitalizados y casos sospechosos visitados en el domicilio, respectivamente. De igual manera, cuando tomamos en cuenta el tiempo de enfermedad, observamos que se incrementa la cantidad de casos positivos conforme aumenta dicho tiempo.
El rendimiento diagnóstico de la prueba rápida fue superior a la prueba molecular a partir de la segunda semana de síntomas. Esto concuerda con lo reportado por Xie et al. 10 quien encontró que la prueba rápida identificó cinco casos positivos que habían tenido un RT-PCR inicial negativo en pacientes hospitalizados con neumonía clínica y radiológicamente compatible con COVID-19 y con contactos positivos, y que finalmente tuvieron un RT-PCR positivo después de múltiples muestras. Asimismo, es similar o lo reportado por Zhao y Gao, quienes observan que la presencia de anticuerpos aumenta conforme aumenta el tiempo de enfermedad, de 18,8% a 53,8% en la primera semana a 87,5% a 89,6% en la segunda semana. Según Liu la presencia de anticuerpos es de 91,3% a 100% después de los 15 días de enfermedad 4 , 6 , 10 , 11.
La prueba molecular puede resultar negativa en una persona infectada con el SARS-CoV-2 cuando: a) la extracción de la muestra, manejo, transporte o almacenamiento de la misma no fue realizada de manera adecuada; b) existe presencia de inhibidores del RT-PCR en la muestra de ARN extraídos; y c) cuando la cantidad de virus es insuficiente para ser detectada, lo cual ocurre en etapas muy tempranas o muy tardías de la infección. La carga viral es diferente dependiendo del estadio de la infección, de manera que cuando el sistema inmune produce los anticuerpos, el virus disminuye pudiendo no ser detectable por la prueba molecular 2 , 12.
La evaluación de la especificidad se realizó con 90 muestras de una colección de sueros obtenidos antes del inicio de la epidemia de COVID-19 en China, por lo que fueron consideradas como referencias negativas. Al aplicar la prueba rápida en estos sueros, solo se obtuvo un resultado positivo en un paciente con infección por VIH, resultando una especificidad de 98,9%. Esta forma de evaluación también fue realizada por Zang et al. quien realizó la prueba rápida en un grupo de pacientes con otras enfermedades diferentes a COVID-19 y encontró 99,1% de especificidad 13.
Los resultados sugieren que ambas pruebas son complementarias por su capacidad diagnóstica en función del tiempo de infección. Si se tiene un resultado positivo mediante cualquiera de las dos metodologías el diagnóstico está definido. Estos hallazgos son consistentes con lo encontrado por Gao Yaung et al. el cual reporta que en los siete primeros días la sensibilidad del RT-PCR era de 69,2%, disminuye a 25,0% a la segunda semana, y llega a 13,0% para después de la segunda semana, encontrando en contraparte un rendimiento diagnóstico ascendente de la prueba serológica 4.
Dentro de las limitaciones se encuentra el reducido tamaño muestral, si bien nos permitió evaluar el rendimiento diagnóstico adicional de la prueba rápida fue insuficiente para llegar a conclusiones en los subgrupos específicos, y por ende, tenemos intervalos de confianza muy amplios en las estimaciones e incluso en algunos casos no pudieron ser calculados. Adicional-mente, debemos señalar que nuestros estimados de sensibilidad y especificidad representan datos preliminares y que deben corroborarse en estudios de mayor tamaño muestral.
Otro factor importante es la falta de información clínica, incluso algunos pacientes no tenían información sobre el número de días de síntomas. Por otra parte, al considerar que la prueba rápida daba un diagnóstico adicional al haber identificado casos positivos que no habían sido identificados por la prueba molecular inicial, estamos asumiendo que los casos adicionales identificados por la prueba rápida corresponden a pacientes realmente infectados. Este supuesto se basa, en que los pacientes hospitalizados y ambulatorios que cumplían la definición de casos, tenían criterios clínicos y radiológicos de neumonía sugerente de infección por COVID-19.
Idealmente, se debería realizar un seguimiento longitudinal de estos pacientes para evaluar el momento en que tanto la prueba molecular como la rápida se vuelve o dejan de ser positivos. Otro factor importante es el poco número de positivos entre los trabajadores de salud, lo cual impide asumir conclusiones en este grupo en particular. Por último, no hemos ahondado en las diferencias entre las bandas IgM e IgG, puesto que, en esta evaluación, solo tres pacientes tuvieron bandas IgG aisladas, todos los otros positivos tuvieron ambas bandas. En el futuro y con más pruebas rápidas realizadas se podrá establecer la importancia de la diferencia entre estas bandas 12.
Por otro lado, esta evaluación constituye un primer abordaje a la utilidad de las pruebas rápidas para diagnóstico de infección por SARS-CoV-2. En medio de controversias mediáticas y a pesar de la falta de recomendaciones para su uso por parte de agencias internacionales, nuestros resultados aportan evidencia científica a favor de su uso en condiciones de campo, con la finalidad de fortalecer el diagnóstico tanto de pacientes hospitalizados como en casos sospechosos ambulatorios. Dicha aplicación sería relevante en la contención comunitaria de la epidemia al identificar zonas afectadas de novo, así como en el registro de casos severos y muertes.
En conclusión, las pruebas serológicas rápidas brindan un rendimiento diagnóstico adicional a las pruebas moleculares de manera particular a partir de la segunda semana del inicio de síntomas y en pacientes hospitalizados. En el contexto de la actual epidemia es recomendable su uso como prueba complementaria a la molecular, especialmente a partir de la segunda semana. Se recomienda realizar estudios en muestras mayores, y poder valorar adecuadamente el rendimiento diagnóstico de ambas pruebas en subgrupos específicos.











 texto en
texto en