INTRODUCCIÓN
Las manifestaciones del SARS-CoV-2 en niños son generalmente menos frecuentes y graves 1. Sin embargo, en abril del 2020 surgieron informes en Estados Unidos y Reino Unido, de un cuadro agudo inflamatorio multisistémico en niños que conducía a falla multiorgá nica y shock 2 , 3. Este cuadro presentaba similitudes con la Enfermedad de Kawasaki (EK) y el Síndrome de Shock Tóxico (SST), con sín tomas gastrointestinales, compromiso cardiaco y marcadores inflamatorios elevados consistentes con COVID-19 grave; esta condición ha sido denominada Síndrome Inflamatorio Multisistémico en niños (MIS-C) 4 - 6.
Riphagen et al. reportaron en Londres la primera serie; ocho niños con cuadro similar a EK, dos positivos a SARS-CoV-2. Todos desarrollaron shock y miocarditis, uno desarrolló aneurisma gigante coronario 3. Posteriormente Verdoni et al. describieron diez casos en Bérgamo, Italia, cinco cumplían criterios para EK clásica, 80% presentó serología para SARS-CoV-2, 50% presentó shock y dos desarrollaron aneurismas coronarios. Al compararlos con casos de EK prepandemia, encontraron que tenían edad media mayor (7,5 vs 3 años), mayor compromiso cardiaco, shock y Síndrome de Activación Macrófagica (SAM) 7. A estos estudios les siguieron Belhadjer et al. en Francia y Suiza con 35 casos, Whittaker et al. en Reino Unido con 58 casos, Toubiana et al. en Francia con 21 casos, y Cheung et al. en Nueva York con 17 casos8 - 11. Como la pandemia llegó más tarde a América Latina, aún no se han publicado datos respecto a este síndrome en la región.
La Organización Mundial de la Salud (OMS) define como caso a menores de 19 años con fiebre ≥ 3 días, marcadores inflamatorios elevados, evidencia de infección por SARS-CoV-2 y ninguna otra etiología microbiana; con afectación de al menos 2 sistemas: dermatológico (rash, conjuntivitis no exudativa, inflamación mucocutánea), hemodinámico (hipotensión, shock), cardiaco (disfunción de miocardio, pericardio, valvular o coronario), hematológico (coagulopatía), digestivo (vómitos, diarrea, dolor abdominal) 5. El Centro para el Control y la Prevención de Enfermedades (CDC) también ha planteado una definición de caso con criterios similares a los de la OMS, la definición del CDC difiere en el grupo de edad (menores de 21 años), duración de la fiebre (≥ 1 día) y la condición de severidad del paciente para requerir hospitalización 6.
El objetivo de este reporte es describir las características clínicas de una serie de ocho casos de niños peruanos con Síndrome Inflamatorio Multisistémico asociado a COVID-19.
REPORTE DE CASOS
Reportamos ocho pacientes con MIS-C que ingresaron al Instituto Nacional de Salud del Niño entre el 25 de mayo y 20 de junio del 2020. La descripción detallada de hallazgos clínicos, laboratoriales, tratamiento y evolución se presentan en Tablas 1 y 2.
La mediana de edad fue de 5,5 años, cinco eran varones, solo uno presentó como comorbilidad obesidad; a excepción del caso 5, todos tuvieron contacto con casos intradomiciliarios infectados por SARS-CoV-2.
Tabla 1 Descripción de características clínicas, tratamiento y evolución de pacientes con MIS-C asociado a COVID-19.
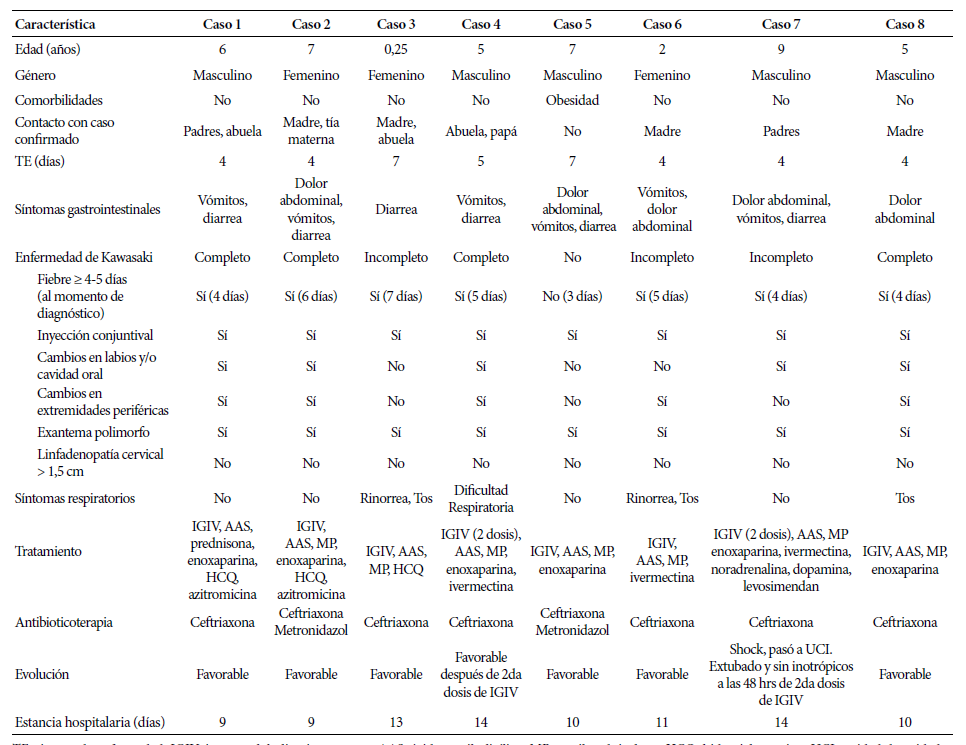
TE: tiempo de enfermedad, IGIV: inmunoglobulina intravenosa, AAS: ácido acetilsalicílico, MP: metilprednisolona, HCQ: hidroxicloroquina, UCI: unidad de cuidados intensivos, VM: ventilación mecánica.
Tabla 2 Hallazgos laboratoriales, microbiológicos y de imágenes en pacientes con MIS-C asociado a COVID-19.
| Variable | Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 |
|---|---|---|---|---|---|---|---|---|
| Hb (VR: ≥ 11,5 g/dL) | 10,1 | 11 | 9,9 | 10,2 | 9,6 | 11,2 | 11,3 | 11,4 |
| Leucocitos (VR: 4,5 - 13,5 x103/mm3) | 14,39 | 14,70 | 26,96 | 16,45 | 47,86 | 17,12 | 13,9 | 4,87 |
| Neutrófilos (VR: 1,5 - 8,0 x103/mm3) | 12,52 | 12,64 | 15,96 | 24,56 | 43,07 | 13,69 | 9,31 | 3,70 |
| Linfocitos (VR: 1,5 - 6,0 x103/mm3) | 0,86 | 1,91 | 7,00 | 0,82 | 2,87 | 3,25 | 0,55 | 0,39 |
| Plaquetas (VR: 150 - 350 x103/mm3) | 53 | 90 | 460 | 69 | 108 | 240 | 122 | 53 |
| PCR (VR: ≤ 0,5 mg/dL) | 37,03 | 24,47 | 11,05 | 26,1 | 43 | 20,83 | 16,65 | 11,79 |
| VSG (VR: ≤ 10 mm/h) | - | 60 | 54 | 43 | 67 | 54 | 50 | 18 |
| Ferritina (VR: 7 - 140 ng/mL) | 688 | 1382 | 607 | 710 | 557 | 216 | 495 | 909 |
| Dímero D (VR: <0,5 mg/L) | 3,85 | 6,25 | 1,27 | 2,09 | 2,42 | 1,42 | 3,68 | 7,47 |
| Fibrinógeno (VR: 160 - 369 mg/dL) | 693 | 630,4 | 607,8 | 505 | 751,9 | 661,8 | 710,9 | 342 |
| TP (VR: 11,68 - 14,21 s) | 12,1 | 12,3 | 13,3 | 11,6 | 12,9 | 12,8 | 11,8 | 13,3 |
| TTPA (VR: 27,12 - 44,21 s) | 59,2 | 40,7 | 41,2 | 36,9 | 40,7 | 48,5 | 47,6 | 36,5 |
| DHL (VR: 230 - 460 U/L) | 367 | 703 | 589 | 517 | 350 | 652 | 513 | 918 |
| TGP (VR: 0 - 39 U/L) | 34 | 139 | 74 | 77 | 140 | 24 | 24 | 102 |
| TGO (VR: 0 - 47 U/L) | 35 | 97 | 60 | 35 | 163 | 41 | 58 | 80 |
| Urea (VR: 10 - 38 mg/dL) | 23 | 92 | 14 | 102 | 60 | 27 | 16 | 31 |
| Creatinina (VR: 0,3 - 0,7 mg/dL) | 0,46 | 0,91 | 0,38 | 1,41 | 0,55 | 0,37 | 0,69 | 0,47 |
| Sodio (VR: 135 - 148 mmol/L) | 133 | 124 | 136 | 128 | 139 | 130 | 122 | 125 |
| Albúmina (VR: 3,2 - 5,2 g/dL) | - | 3 | 3,1 | 2,4 | 2,8 | 2,3 | 2,8 | 2,4 |
| Triglicéridos (VR: <150 mg/dL) | 216 | 363 | 168 | 158 | 154 | 162 | 80 | 246 |
| CK-MB (VR: 0 - 24 U/L) | 10,5 | 12 | 16 | 19 | 11 | 17 | 19 | 42 |
| RT-PCR COVID-19 | Negativo | Negativo | Positivo | Negativo | Negativo | Negativo | Negativo | Negativo |
| IgM/IgG COVID-19 | +/+ | +/+ | +/+ | +/+ | -/+ | +/+ | -/+ | -/+ |
| Hemocultivo | Negativo | Negativo | Negativo | Negativo | Negativo | Negativo | Negativo | Negativo |
| Coprocultivo | Negativo | Negativo | Negativo | - | Negativo | - | - | - |
| Radiografía de tórax | Normal | Infiltrado intersticial, cardiomegalia | Normal | Infiltrado intersticial | Infiltrado intersticial, cisuritis | Normal | Normal | Normal |
| Ecografía abdominal | - | Liquido libre 200 cc en hemiabdo men inferior | - | - | Proceso inflamatorio fosa iliaca derecha | - | - | Hepato-esplenomegalia leve |
| Electrocardiograma | Normal | BIRD | Normal | Normal | Normal | Normal | Normal | Normal |
| Ecocardiograma | Normal | FSVI levemente deprimida, efusión pericár dica leve. | Normal | Normal | Normal | Normal | Pericardio hiperrefringente, dilatación leve del VI, insufi ciencia mitral leve | Normal |
Hb: hemoglobina, VR: valores de referencia, PCR: proteína C reactiva, VSG: velocidad de sedimentación globular, TP: tiempo de protrombina, TTPA: tiempo parcial de tromboplastina activada, DHL: lactato deshidrogenasa, TGP: alanina aminotransferasa, TGO: aspartato aminotransferasa, CK-MB: creatina quinasa-MB¸ COVID-19: enfermedad por coronavirus 2019, BIRD: bloqueo incompleto de rama derecha, FSVI: función sistólica ventricular izquierda, VI: ventrículo izquierdo.
La mediana del tiempo de enfermedad al momento de hospitalización fue de 4 días (rango: 4 a 7 días). Todos cursaron con fiebre, síntomas gastrointestinales, inyección conjuntival y exantema; cinco presentaron compromiso en cavidad oral y extremidades (Figura 1). La mediana de duración de la fiebre al momento del diagnóstico fue de 4,5 días (rango: 3 a 7 días). Cuatro presentaron criterios para EK completo y tres para EK incompleto. Cuatro cursaron con síntomas respiratorios, uno de ellos con distrés que requirió oxígeno suplementario (caso 4) (Tabla1).
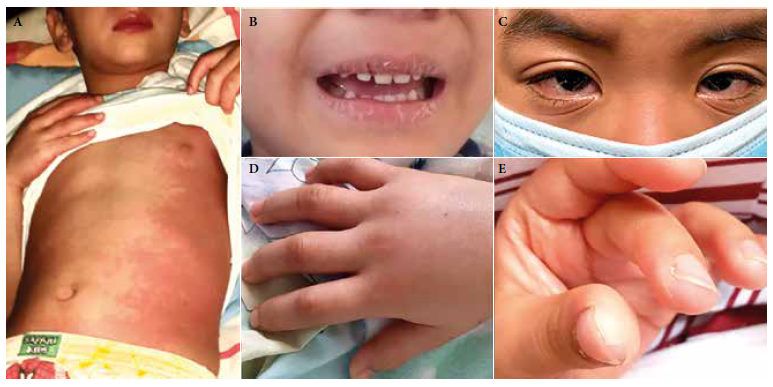
Figura 1 A. Rash maculopapular difuso, eritema y edema de manos, labios eritematosos (caso 1). B. Sequedad y fisura de labios (caso 4). C. Inyección conjuntival (caso 8). D. Edema en dorso de mano y dedos (caso 2). E. Descamación de pulpejos de dedos (caso 1). (Imágenes compartidas con autorización de los padres).
Mayormente el diagnóstico fue al momento de la hospitalización. El caso 2 tuvo diagnóstico al ingreso de sepsis por apendicitis probable, el caso 6 por deshidratación e intoxicación alimentaria, en ambos el compromiso ocular y mucocutáneo apareció al tercer día de hospitalización completando criterios para MIS-C. El caso 5 estuvo hospitalizado en otro nosocomio por apendicitis probable, al ingreso a nuestra institución se evidenció que cumplía criterios para MIS-C.
Antes de iniciar tratamiento, a todos se les realizó prueba molecular y detección de anticuerpos mediante prueba rápida.Todos presentaron anticuerpos para SARS-CoV-2: cinco tenían IgM e IgG, y tres tenían solo IgG; solamente el caso 3 tuvo prueba molecular positiva (Tabla 2). Las alteraciones en el hemograma fueron frecuentes: todos cursaron con anemia, siete presentaron leucocitosis y neutrofilia, cuatro linfopenia, seis trombocitopenia y uno trombocitosis. Todos presentaron proteína C reactiva, velocidad de sedimentación globular, ferritina y dímero D elevados. Siete tuvieron hiperfibrinogenemia, hipoalbuminemia e hipertrigliceridemia. Seis presentaron lactato deshidrogenasa elevada e hiponatremia. Cinco presentaron hipertransaminasemia y tres retención nitrogenada. Tres tuvieron tiempo parcial de tromboplastina activada prolongado. Solo uno presentó creatina quinasa-MB elevada. Cuatro pacientes cumplieron criterios laboratoriales para SAM (Tabla 3). Tres tenían radiografía torácica y ecografía abdominal patológica respectivamente, dos presentaron ecocardiograma patológico (Tabla 2).
Tabla 3 Riesgo de resistencia a inmunoglobulina intravenosa según puntaje de Kobayashi y criterios laboratoriales para Síndrome de Activación Macrofágica en pacientes con MIS-C asociado a COVID-19 15 - 16.
| Variable | Caso 1 | Caso 2 | Caso 3 | Caso 4 | Caso 5 | Caso 6 | Caso 7 | Caso 8 |
|---|---|---|---|---|---|---|---|---|
| Kobayasahi ≥ 5 | Sí | Sí | No | Sí | Sí | Sí | Sí | Sí |
| < 12 meses (1pto) | No | No | Sí | No | No | No | No | No |
| PCR ≥ 10 mg/dL (1pto) | Sí (37) | Sí (24,47) | Sí (11,05) | Sí (26,1) | Sí (43) | Sí (20,83) | Sí (16,65) | Sí (11,79) |
| Neutrófilos ≥ 80% (2ptos) | Sí (87%) | Sí (86%) | No (59%) | Sí (89%) | Sí (90%) | Sí (80%) | No (67%) | No (76%) |
| Plaquetas ≤ 300x103/mm3 (1pto) | Sí (53) | Sí (90) | No (460) | Sí (69) | Sí (108) | Sí (240) | Sí (122) | Sí (53) |
| Sodio ≤ 133 mmol/L (2ptos) | No (133) | Sí (124) | No (136) | Sí (128) | No (139) | Sí (130) | Sí (122) | Sí (125) |
| TGO ≥ 100 U/L (2ptos) | No (35) | No (97) | No (60) | No (35) | Sí (140) | No (41) | No (58) | No (80) |
| ≤ 4 días de enfermedad al momento de iniciar IGIV (2ptos) | Sí | No | No | No | No | No | Sí | Sí |
| SAM | Sí | Sí | No | Sí | No | No | No | Sí |
| Ferritina > 684 ng/ml y 2 de los siguientes: | Sí (688) | Sí (1382) | No (589) | Sí (710) | No (557) | No (216) | No (495) | Sí (909) |
| Plaquetas ≤ 181 x103/mm3 | Sí (53) | Sí (90) | No (460) | Sí (69) | Sí (108) | No (240) | Sí (122) | Sí (53) |
| TGO > 48 U/L | No (35) | Sí (97) | Sí (60) | No (35) | Sí (140) | No (41) | Sí (56) | Sí (70) |
| Triglicéridos ≥ 156 mg/dL | Sí (216) | Sí (363) | Sí (168) | Sí (158) | No (154) | Sí (162) | No (80) | Sí (246) |
| Fibrinógeno ≤ 360 mg/dL | No (693) | No (630,4) | No (607,8) | No (505) | Sí (751,9) | No (661,8) | No (710,9) | Sí (342) |
SAM: Síndrome de Activación Macrofágica
Como tratamiento inicial todos recibieron inmunoglobulina intravenosa (IGIV) a 2 gr/kg/dosis (dosis máxima: 70gr), ácido acetilsalicílico (AAS) (inicialmente a 50-80 mg/kg/día y luego a 5 mg/kg/día tras 48 horas afebril), y corticoides (prednisona o metilprednisona) a 2 mg/kg/día por 5 días (luego disminución progresiva completando 2 semanas). La necesidad de corticoides se determinó mediante evaluación del riesgo de resistencia a la IGIV: score de Kobayashi (SK) ≥ 5 y/o presencia de MAS y/o edad ≤ 12 meses. Siete pacientes tenían un SK≥5, cuatro cumplían criterios de MAS (Tabla 3), uno era menor de 12 meses, por lo que todos fueron tratados concomitantemente con corticoides. Los casos 4 y 7 requirieron segunda dosis de IGIV. Seis recibieron enoxaparina a dosis profiláctica debido a las alteraciones significativas en las pruebas de coagulación (dímero D: 4-15 veces su valor basal, hiperfibrinogenemia). Todos iniciaron antibioticoterapia empírica que fue suspendida tras cultivos negativos. Solo uno requirió vasopresores (Tabla 1).
En cuanto a la respuesta al tratamiento y evolución, el caso 4 persistió febril y con distrés 48 horas después de iniciada IGIV, por lo que se indicó segunda dosis con respuesta favorable a las veinticuatro horas. El caso 7 presentó shock refractario a fluidos e inició vasopresores, tras 36 horas no hubo mejoría clínica indicándose segunda dosis de IGIV, e ingresó a cuidados intensivos (UCI) requiriendo ventilación mecánica. El paciente fue extubado y se suspendieron los vasopresores 48 horas después de la segunda dosis de IGIV, permaneció 8 días en UCI. El resto de pacientes respondieron favorablemente al tratamiento inicial, la fiebre cedió 24-36 horas después de iniciar tratamiento, mientras que los síntomas gastrointestinales y mucocutáneos resolvieron máximo al cuarto día. Ningún paciente presentó efectos adversos al tratamiento recibido. Todos los pacientes fueron finalmente dados de alta, con indicación de continuar con AAS a 5mg/kg/día por al menos 4 semanas y reducción progresiva de corticoides. La mediana de la estancia hospitalaria fue de 10,5 días (rango: 9 a 14 días).
DISCUSIÓN
Se desconoce la fisiopatología del MIS-C, se sugiere sería resultado de una respuesta inmune anormal al virus por similitudes con EK, SST y SAM 4 , 5. El pico de casos se daría 2-4 semanas después del pico de casos de COVID-19 en la comunidad, coincidiendo con el momento de la inmunidad adquirida y sugiriendo que se presentaría como complicación posinfecciosa 7 , 9 - 11.
En investigaciones previas los casos de MIS-C se presentaron en un periodo de 10-54 días 3 , 7 - 11. En este reporte, los 8 casos se presentaron en un periodo de 26 días. En el Perú, La Torre realizó un estudio en nuestra institución, encontrando 17 casos de EK en un periodo de 8 años 12, Culqui et al. reportaron 42 casos de EK en 12 años en dos hospitales del seguro social de Lima 13.
La edad promedio fue 5,1 años, pero el 75% tenía 5 años o más. Investigaciones previas han reportado edades medias entre 6,5 a 8 años 3 , 7 - 11, lo cual difiere de EK que afecta principalmente a menores de 5 años 7 , 14. En Lima, Culqui et al. encontraron que 50% de sus casos de EK eran menores de 2 años 13. Se ha descrito preponderancia de raza negra e hispana en MIS-C 3 , 10 , 11, en contraste la EK es más frecuente en asiáticos 14, ninguno de nuestros pacientes tenía ascendencia asiática. Algunos reportes describen comorbilidades en 12 a 28% de casos, principalmente asma y obesidad 8 , 9 , 11, uno de nuestros pacientes presentaba obesidad.
Respecto al cuadro clínico, coincidimos con lo descrito en estudios previos que reportan fiebre en 100% de casos, síntomas gastrointestinales en 80 a 100%, grados variables de compromiso ocular y mucocutáneo en 30 a 80%, y 42 a 82% de casos que cumplían criterios de EK completo 3 , 7 - 11. Se observó que los síntomas gastrointestinales precedieron al compromiso dermatológico, hecho ya resaltado previamente en otros estudios 9 , 10. Menos del 30% de casos previamente reportados presentaron síntomas respiratorios y/o neurológicos 7 , 9 - 11, lo cual difiere de nuestro estudio donde el 50% presentaron síntomas respiratorios y ninguno síntomas neurológicos. Como se describió, en dos de nuestros casos (casos 2 y 5) inicialmente se sospechó de apendicitis; Belhadjer et al. describieron también dos casos que incluso requirieron cirugía y resultaron ser adenitis mesentérica 8.
Nuestros hallazgos laboratoriales coinciden con las investigaciones previas 3 , 7 - 11, y es evidencia del marcado estado inflamatorio y compromiso multisistémico del MIS-C. Usualmente la EK cursa con anemia, leucocitosis, trombocitosis y marcadores inflamatorios elevados; en contraste, la presencia de linfopenia, trombocitopenia, compromiso renal, hepático y pruebas de coagulación alteradas son hallazgos menos frecuentes en EK 14, pero se han descrito ampliamente en MIS-C 3 , 7 - 11. Solo un paciente presentó alteración de enzimas cardiacas, en estudios previos más del 50% de casos presentaron dicha alteración 7 - 11. Se ha descrito SAM en menos del 2% de casos de EK 15, Verdoni et al. lo reportaron en 50% de sus casos de MIS-C 7, la mitad de nuestros pacientes tenían SAM.
Todos nuestros pacientes tuvieron serología positiva para SARS-CoV-2, el 100% fueron IgG positivo y el 62,5% eran también IgM positivo. Estudios previos reportan que 80 a 90 % de sus pacientes tuvieron serología positiva: 50-90% a IgG, 6-30% a IgG e IgM; además el 20 a 40% tenían PCR positivo 7 , 9 - 11. Estos hallazgos evidenciarían infección previa por SARS-CoV-2 en los pacientes que desarrollan MIS-C, lo que apoya una posible asociación temporal.
Estudios previos describen alteraciones en la radiografía de tórax en 50% de casos, principalmente efusión pleural 3 , 7 , 10, en nuestra serie tres pacientes presentaron infiltrados intersticiales bilaterales. Solo dos presentaron ecocardiograma patológico, pero no aneurismas coronarios. Reportes previos describen alteraciones ecocardiográficas en 38-100% de pacientes (principalmente disfunción ventricular izquierda y efusión pericárdica), menos del 20% presentaron aneurismas coronarios 3 , 7 - 11.
Debido a las similitudes de este nuevo síndrome con EK, ha sido tendencia emplear el tratamiento estándar para EK que incluye principalmente IGIV y AAS, y corticoides en casos de alto riesgo de resistencia a la IGIV (3, 7-11,14). En reportes previos el 70-100% de casos recibieron IGIV, el 33-88% corticoides 3 , 7 - 11. El uso de AAS fue más variable; 75% de casos reportados por Riphagen et al. y 100% de casos de Verdoni et al, recibieron AAS a dosis antiinflamatorias (30-80 mg/kg/día) 3 , 7. Estudios posteriores no reportan el uso de AAS 8 , 9. Toubiana et al. reportan su uso en 100% de sus pacientes, pero solo a dosis antiagregantes (3-5mg/kg/día) 10. Todos nuestros pacientes recibieron IGIV, corticoides y AAS. La necesidad de corticoide se determinó valorando el riesgo de resistencia a IGIV con la edad del paciente, el SK 16, y la presencia de SAM 15. Verdoni et al. reportaron que 70% de sus pacientes con MIS-C tuvieron alto riesgo de resistencia a IGIV 7, en nuestro estudio el 100% de casos lo presentaba. Esto explicaría la mayor necesidad de corticoides en MIS-C 3 , 7 - 11, en contraste con EK donde generalmente menos del 20% de casos presentan resistencia a la IGIV y requieren corticoides 14 , 16.
Solo dos de nuestros casos (25%) requirieron segunda dosis de IGIV, Toubiana et al. reportaron necesidad de segunda dosis en el 24% de sus pacientes 10. El 75% de nuestros pacientes recibieron anticoagulación profiláctica, Belhadjer et al. reportaron que el 65% de sus pacientes recibieron dosis terapéuticas de heparina 8, Cheung et al.describen el uso de enoxaparina profiláctica en el 59% de sus pacientes 11. Sin embargo, no existe aún evidencia para inicio de anticoagulación profiláctica en MIS-C.
Solo un paciente presentó miocarditis, shock, y requirió soporte ventilatorio, lo cual difiere marcadamente de estudios previos donde el 50-100% de casos presentaron miocarditis y shock, e ingresaron a UCI y el 40-80% requirieron soporte ventilatorio 3 , 7 - 10. La estancia hospitalaria fue más prolongada que las reportadas en estudios anteriores (estancias hospitalarias medias entre 7,1-10 días, rango 3-18 días) 8 , 10 , 11. Como ya se mencionó, la mayoría de nuestros pacientes respondieron con éxito al tratamiento inicial; la estancia hospitalaria prolongada se debió principalmente a demoras en la realización de los estudios ecocardiográficos por razones logísticas. No reportamos ningún deceso, solo dos estudios previos reportaron un fallecido respectivamente 3 , 9.
En conclusión, el MIS-C sería una forma grave del COVID-19 en niños. No está clara aún la relación etiológica, pero su presentación coincidente en el tiempo con la pandemia y la preponderancia de serología para SARS-CoV-2 (principalmente IgG) en los pacientes afectados, avalarían una posible asociación. Como hemos descrito, a pesar de sus similitudes clínicas y laboratoriales con otras patologías (principalmente EK), se han ido estableciendo algunas características que lo diferencian como la edad de presentación, raza, síntomas gastrointestinales preponderantes, mayor compromiso multisistémico, marcadores inflamatorios marcadamente alterados, mayor frecuencia de miocarditis, shock y SAM y mayor necesidad de uso de corticoides. Sin embargo, se ha observado que su espectro clínico es amplio y varía entre un síndrome febril persistente con evidencia de inflamación, una presentación similar a EK, SAM y una forma más severa con shock, miocarditis y falla multiorgánica. Debido a su potencial gravedad es recomendable que, frente a todo niño con fiebre, síntomas gastrointestinales y mucocutáneos, asociado a exposición al SARS-CoV-2, debe investigarse compromiso multisistémico para diagnóstico precoz y tratamiento oportuno que mejore el pronóstico.















