INTRODUCCIÓN
La diseminación mundial de bacterias gramnegativas multidrogorresistentes (MDR) y extremadamente resistentes a los antimicrobianos (XDR), incluidos los enterobacterales productores de carbapenemasas (EPC), ha llevado a la reinserción de colistina como terapia de último recurso; este antibiótico interactúa directamente con el lipopolisacárido de la membrana externa 1. Los principales mecanismos de resistencia implican la modificación del lípido A, mediados por mutaciones en genes del sistema regulador PhoPQ-PmrAB, incluso durante el tratamiento en microorganismos clínicamente relevantes como Klebsiella pneumoniae 2 , 3. En 2015, se describió un mecanismo de resistencia a la colistina mediada por plásmidos (PMCR, por sus siglas en inglés), relacionado con el gen mcr-1 (Mobile Colistin Resistance) entre enterobacterales aislados de animales y humanos en China 4, este codifica una fosfoetanolamina transferasa que modifica el blanco de colistina, mediante la adición de fosfoetanolamina, lo que reduce la afinidad por la colistina 5.
Diversos estudios han demostrado una distribución mundial de mcr1, especialmente en Escherichia coli, y una presencia ocasional en otras especies bacterianas 6. Al igual que con otros genes de resistencia, se han detectado diferentes variantes alélicas de mcr-1 (mcr-2, mcr-3, mcr-4, mcr-5, mcr-6, mcr-7, mcr-8, mcr-9 y mcr-10) (5, 6). En América del Sur, se ha reportado la presencia de genes mcr-1 en varios países, a partir de aislamientos de humanos, animales y alimentos 7 - 9. En 2016, la Organización Mundial de la Salud (OMS) recomendó implementar y fortalecer la vigilancia e investigación epidemiológica de la PMCR ( 10. En el Perú, hasta el momento se ha informado la presencia de mcr-1 en aislamientos de E. coli de origen clínico 11 , 12.
En ese sentido, como parte del proyecto «Vigilancia epidemiológica de bacterias resistentes en infecciones asociadas a la atención en salud», se plantea este estudio con el objetivo de conocer los enterobacterales productores de betalactamasa de espectro extendido (EP-BLEE) portadores del gen mcr-1 en el Instituto Nacional de Enfermedades Neoplásicas (INEN) del Perú.
MENSAJES CLAVE
Motivación para realizar el estudio: La resistencia a los fármacos considerados de última línea frente a bacterias multidrogorresistentes (MDR) es motivo de preocupación. Es necesario investigar la resistencia a la colistina en enterobacterales productores de betalactamasa de espectro extendido (EP-BLEE) para conocer la realidad de este tipo de microrganismos en nuestro medio.
Principales hallazgos: De los aislamientos de EP-BLEE, el 15,2% fueron positivos para el gen mcr-1, presentaron resistencia acompañante a fluoroquinolonas y gentamicina, y permanecieron sensibles a la amikacina; dos de estos aislamientos eran productores de metalocarbapenemasas.
Implicancias: Los resultados de este estudio muestran la importancia del relevamiento de datos sobre la resistencia a la colistina mediada por plásmidos en MDR, lo cual respalda la necesidad de la implementación de estudios de epidemiología molecular para su control y se evite su diseminación en el ámbito hospitalario.
EL ESTUDIO
Se realizó un estudio descriptivo. Entre enero y diciembre de 2017, se recolectaron 165 aislamientos consecutivos únicos de EP-BLEE, entre Escherichia coli (112), Klebsiella pneumoniae (41), Enterobacter cloacae (5), Proteus mirabilis (4), Klebsiella oxytoca (2) y Klebsiella ozaneae (1), recuperados de muestras de sangre (40), orina (57), secreciones respiratorias bajas (12) e hisopados rectales (56) de pacientes hospitalizados en el INEN.
La identificación y susceptibilidad antimicrobiana se realizó con el sistema automatizado Phoenix M50 y la confirmación de BLEE con el sistema BD-Expert (BD Diagnostics, Sparks, MD), la interpretación se realizó siguiendo las recomendaciones del Clinical and Laboratory Standards Institute (CLSI) 13. La detección de la resistencia a la colistina se realizó por el método de tamizaje Colistin Agar-Spot (CAS) (Agar Mueller-Hinton [Merck, Alemania]; sulfato de colistina sulfato [Sigma-Aldrich, Alemania]), desarrollado por el Servicio de Antimicrobianos, INEI ANLIS «Dr. Carlos G. Malbrán» 14. Además, se realizó el método fenotípico de predifusión de colistina e inhibición con el ácido etilendiaminotetraacético (EDTA) (CPD-E) (Agar Mueller-Hinton [Merck, Alemania]; discos de colistina 10 µg [Oxoid, Inglaterra]; discos de EDTA/SMA 372/900 µg [Britania, Argentina]), descrito por Yauri et al. 15, para la detección del gen mcr.
Se usó ADN bacteriano total como molde para la detección molecular, y esta se llevó a cabo en el laboratorio de Epidemiología Molecular y Genética del Instituto de Medicina Tropical «Daniel A. Carrión» del Centro de Investigaciones Tecnológicas, Biomédicas y Medioambientales - CITBM, de la Universidad Nacional Mayor de San Marcos. Para la identificación de la presencia de genes de resistencia (mcr-1, bla CTX-M, bla NDM, y bla KPC) se utilizó la reacción en cadena de la polimerasa (PCR, por sus siglas en inglés) como se ha descrito anteriormente 4 , 16 , 17 (Figura 1).
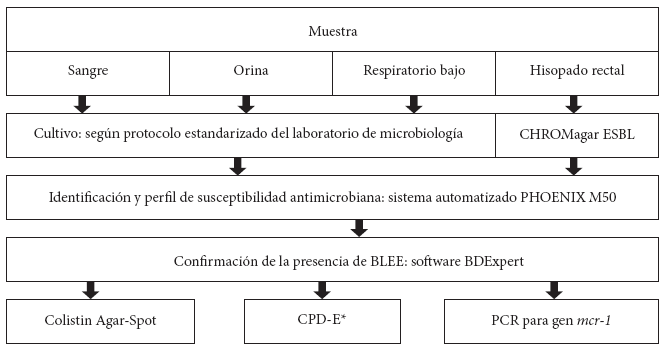
Figura 1 Flujograma de la detección de enterobacterales productoras de betalactamasas de espectro extendido portadoras del gen mcr-1.
El presente reporte se ha desarrollado como parte del estudio de los Círculos de Investigación en Ciencia y Tecnología del Fondo Nacional de Desarrollo Científico, Tecnológico y de Innovación Tecnológica (FONDECYT), aprobado por el Departamento de Investigación del INEN. El estudio sigue los lineamientos de las buenas prácticas y la ética en investigación biomédica. Se reportan frecuencias absolutas y relativas de las variables de interés. Se utilizó el programa Microsoft Excel para el análisis descriptivo.
HALLAZGOS
De los 165 aislamientos de EP-BLEE, 25 (15,2%) dieron positivo por el gen mcr-1; 20 (12,1%) fueron resistentes a la colistina por el método de tamizaje CAS. La detección fenotípica del mcr con el método CPD-E tuvo 100% de correlación con el método genotípico (25 positivos). La presencia del gen mcr-1, según especie, se dio de la manera siguiente: E. coli (18), K. pneumoniae (4), E. cloacae (2) y K. oxytoca (1). Según el tipo de muestra, el mcr-1 se detectó más en los aislamientos provenientes de hisopados rectales (11/25) y en la sangre (9/25) (Tabla 1).
Tabla 1 Distribución de aislamientos de enterobacterales productores de betalactamasas de espectro extendido portadoras del gen mcr-1 por tipo de muestra y procedencia.
| Procedencia | Tipo de muestra | ||||
|---|---|---|---|---|---|
| Sangre | Orina | Secreciones respiratorias bajas | Hisopado rectal | Total | |
| Abdomen | 1 | 1 | 1 | - | 3 |
| Ginecología | - | 1 | - | - | 1 |
| Medicina oncológica | 3 | 1 | - | 10 | 14 |
| Pediatría oncológica | 4 | 1 | - | - | 5 |
| Tórax y mama | - | - | - | 1 | 1 |
| Urología | 1 | - | - | - | 1 |
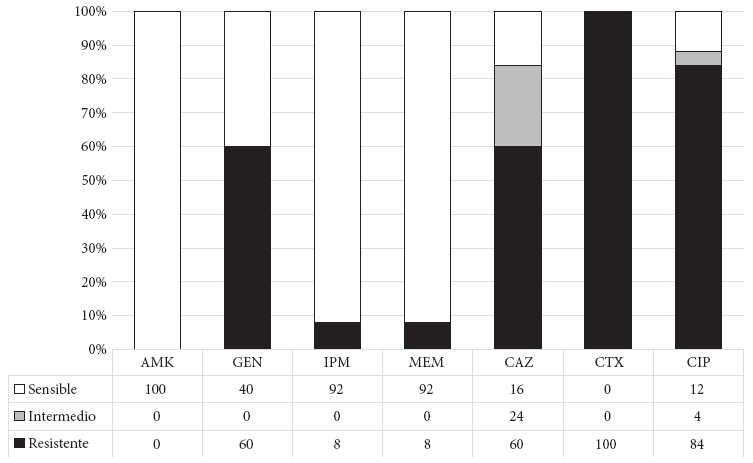
Además, el perfil de susceptibilidad de las EP-BLEE portadoras del gen mcr-1 mostraron resistencia a las fluoroquinolonas y a la gentamicina, y permanecieron sensibles a la amikacina. Cabe resaltar que dos aislamientos de K. pneumoniae presentaron resistencia a los carbapenémicos por la presencia de metalocarbapenemasas (Nueva Delhi Metalo beta-lactamasa [NDM, por sus siglas en inglés]) (Figura 2).
DISCUSIÓN
La presencia de PMCR a causa del gen mcr-1 está ampliamente distribuida en todo el mundo y en algunos casos se encuentra relacionado con otros marcadores de resistencia, como las betalactamasas (BLEE o carbapenemasas) 2 , 7 , 11 , 18 - 20. En nuestro estudio, la presencia del gen mcr-1 en EP-BLEE fue del 15,2% de aislamientos recuperados de diferentes tipos de muestra de infecciones y colonizaciones (portadores) en pacientes hospitalizados. En 2017, Ugarte et al. 12 realizaron el primer reporte en el Perú sobre mcr-1 en siete aislamientos de E. coli recuperados a partir de cultivos de orina de pacientes comunitarios. En 2019, Deshpande et al. 11 informaron tres aislamientos de E. coli productores de mcr-1 a partir de infecciones de sangre y piel recuperados en 2016 en nuestro país, uno de los aislamientos era productor de BLEE (bla CTX-M-55).
La presencia de enterobacterales productores de betalactamasas portadores del gen mcr-1 se encuentran en aumento en la región 18 - 20, no solo coproductores de BLEE, sino también de carbapenemasas, como se observó en dos de nuestros aislamientos de K. pneumoniae MDR, con resistencias que van desde los betalactámicos (CTX-M, NDM), fluoroquinolonas, gentamicina e incluso colistina, que es considerada un antibiótico de último recurso frente a bacterias MDR, quedando solo la amikacina como alternativa terapéutica.
El método de tamizaje CAS presenta una concordancia del 99,5% comparada con el método microdilución en caldo, considerado como el método de referencia para la determinación de resistencia a la colistina. En nuestro estudio, se pudo detectar resistencia a la colistina en 17/25 aislamientos productores de mcr-1, probablemente debido a que estos aislamientos presentaban una concentración mínima inhibitoria (CMI) <3 µg/mL, que es la concentración de colistina que utiliza el método de tamizaje CAS 14.
Un aislamiento de K. pneumoniae catalogado como resistente a la colistina no portaba el gen mcr-1; esta resistencia a la colistina podría estar relacionada con mutaciones en genes del sistema regulador PhoPQ-PmrAB 2 , 3; o a la presencia de variantes alélicas del gen mcr no investigadas en este estudio 5 , 6. Un dato que nos parece importante mencionar es que desde 2020, el CLSI cambió los puntos de corte para la interpretación de colistina en enterobacterales, Pseudomonas aeruginosa y Acinetobacter spp. quedando solo las categorías de intermedio (≤2 µg/mL) y resistente (≥4 µg/mL); y dejando como metodologías aceptables la Microdilución en clado para colistina (BMD), prueba de colistina en agar (CAT, por sus siglas en inglés) y elución de disco de colistina en caldo (CBDE, por sus siglas en inglés) 13.
El método CPD-E 15, basado en la característica de la metaloproteína dependiente de zinc de la enzima fosfoetanolamina transferasa codificada por el gen mcr-1, que le permite ser inhibida por quelantes como el EDTA, tuvo una excelente correlación con los aislamientos portadores del gen mcr-1, demostrando ser una buena alternativa fenotípica para la detección de productores de MCR.
La presencia del gen mcr-1 en aislamientos clínicos MDR causantes de infecciones es preocupante, ya se ha demostrado la presencia gastrointestinal de bacterias con este gen en el ambiente hospitalario o comunitario 10. En nuestro estudio, la frecuencia de colonizados con EP-BLEE portadores del gen mcr-1 fue del 44%; esta colonización es muy peligrosa, ya que existe el riesgo de que pueda diseminarse, a través de plásmidos, a otras cepas virulentas o clones epidémicos 10.
Este estudio presenta algunas limitaciones que debemos mencionar. Los resultados obtenidos corresponden a una colección de aislamientos MDR (productores de BLEE) de una institución de salud especializada; no se pueden extrapolar los resultados a otras instituciones. Es necesario evaluar la presencia del gen mcr-1 con un número mayor de aislamientos no MDR de diferentes centros hospitalarios para conocer el impacto real de este marcador de resistencia en nuestro país. Además, no se analizaron variantes alélicas distintas del gen mcr-1 y otras causas de resistencia a colistina, como mutaciones en los genes del sistema regulador del lípido A de la membrana bacteriana.
En conclusión, la recolección de datos sobre resistencia bacteriana a los antimicrobianos considerados de última línea es crucial para establecer medidas acordes a la realidad local y compararlas a nivel regional y mundial. A pesar de que nuestros resultados muestran el panorama de un solo centro, la aparición de aislamientos MDR con resistencia a la colistina, respalda la necesidad de implementar estudios de epidemiología molecular para prevenir el establecimiento de infecciones asociadas a la atención en salud por este tipo de microorganismos.











 text in
text in