INTRODUCCIÓN
La resistencia a los antimicrobianos continúa siendo uno de los principales problemas en la salud a nivel mundial, donde los países en desarrollo presentan altos niveles de resistencia a los antimicrobianos 1. América Latina no es ajena a esta problemática y la diseminación creciente de bacterias resistentes amenaza con el incremento de fallos terapéuticos, incluso a antimicrobianos de última línea 2 , 3. Cada vez son más las bacterias resistentes a múltiples antimicrobianos que han sido asociadas con las enfermedades infecciosas en humanos. La Organización Mundial de la Salud (OMS) destaca Klebsiella pneumoniae como una de las bacterias multidrogorresistentes de alta prioridad para la investigación 1 debido a su capacidad para acumular y diseminar genes de resistencia a los antimicrobianos, y a su elevada carga plasmídica y amplia variabilidad del contenido de guanina + citosina (G+C) 4. Debido a la disminución de antimicrobianos efectivos para las infecciones causadas por microorganismos multirresistentes, se considera a las polimixinas (polimixina B y polimixina E, llamada también colistina) como tratamientos de última línea, especialmente en infecciones graves por K. pneumoniae, resistente a los carbapenémicos. La colistina se utiliza a menudo en combinación con otros antibióticos, como tigeciclina, meropenem, gentamicina o fosfomicina para mejorar su espectro y efectividad 5.
Sin embargo, en los últimos años, están aumentando los reportes de K. pneumoniae con sensibilidad disminuida a la colistina en todo el mundo 6. Los mecanismos de resistencia se producen debido a las modificaciones en la integridad de la membrana celular y afectan el anclaje con la bacteria, ya sea a nivel del lipopolisacárido o por alteración iónica de la misma membrana (por cambios en el Mg+ y Ca++) 7. Estas modificaciones pueden deberse tanto por las mutaciones en los genes cromosomales 6 , 7 y en los genes de resistencia móviles transmisibles a través de plásmido (mcr) 8.
A pesar de que en 2016 la Organización Panamericana de Salud (OPS) dio alerta del aumento de la prevalencia de resistencia a colistina (a partir de los primeros reportes de la presencia del gen mcr-1 en 2015 y de la importancia de su vigilancia) 8, aún son pocos los estudios que han evaluado la prevalencia de los mecanismos moleculares de esta resistencia y su relevancia clínica en el Perú.
El objetivo de presente estudio fue evaluar los niveles y mecanismos de resistencia a la colistina y a los carbapenémicos en cepas de K. pneumoniae multidrogorresistente aisladas durante el periodo 2015-2018 en el Instituto Nacional Materno Perinatal de Lima.
MENSAJES CLAVE
Motivación para realizar el estudio: La colistina es uno de los antibióticos de última línea para tratar infecciones causadas por bacterias multidrogorresistentes. Los estudios de epidemiología de resistencia a la colistina en el Perú son escasos.
Principales hallazgos: Se analizaron cepas de Klebsiella pneumoniae multidrogorresistentes (2015-2018). Las cinco cepas resistentes a la colistina se recolectaron en el 2018 y se encontraron diferentes grupos clonales, indicando, posiblemente, una selección de cepas resistentes a la colistina por uso de este antimicrobiano.
Implicancias: La presencia de cepas resistentes a la colistina en cepas multidrogorresistentes dificulta la elección de un tratamiento. Pone en evidencia la necesidad de sistemas de vigilancia de la resistencia a la colistina en los centros de salud.
EL ESTUDIO
Estudio descriptivo de tipo transversal en el cual se analizaron aislamientos de K. pneumoniae, procedentes de muestras biológicas, como sangre, líquido cefalorraquídeo, aspirado bronquial y coprocultivos, obtenidas de pacientes admitidos en el Instituto Nacional Materno Perinatal.
Se incluyeron en el estudio 36 aislados clínicos de K. pneumoniae de diferentes pacientes. Estos aislados fueron seleccionados de una colección de bacterias del Laboratorio de Microbiología del Instituto Nacional Materno Perinatal. Solo se consideraron aquellos que presentaron un perfil de sensibilidad con multidrogorresistencia (MDR), es decir, que sean resistentes al menos a tres familias de antimicrobianos diferentes, determinadas por pruebas de difusión en disco. Estos aislados se recolectaron entre 2015 y 2018 9.
Las pruebas de sensibilidad antimicrobiana se realizaron mediante pruebas de difusión en disco. Esta categoría de resistencia se interpretó de acuerdo con la guía del Clinical and Laboratory Standard Institute (CLSI) 10. La evaluación de la resistencia a la colistina se realizó mediante microdilución para determinar la concentración mínima inhibitoria (CMI), según lo recomendado por el Grupo de Trabajo conjunto CLSI-European Committee on Antimicrobial Susceptibility Testing (EUCAST) sobre puntos de corte de la polimixina 11.
Se preparó un inóculo a 0,5 McFarland, del cual se hizo una dilución 1/1000 en caldo Mueller Hinton II (MHII). La solución del antibiótico debe prepararse en una concentración que cuadruplique la deseada de manera que, al realizar las diluciones seriadas y se agregue el inóculo bacteriano (50 µL) y 50 µL de medio MHII, la concentración sea la deseada. Cada muestra debe incluir un pocillo de control de crecimiento (sin antibiótico) y un control negativo (MHII sin el inóculo bacteriano). Todas las cepas se almacenaron a -70 °C hasta que se realizaron los ensayos. Se utilizó una CMI de, al menos, 4 mg/mL como punto de corte para determinar las cepas resistentes. Se utilizaron las cepas Escherichia coli ATCC 25922 y Serratia spp. como control de la técnica.
Se utilizó la definición de MDR, como no susceptible a, al menos, un agente antimicrobiano de tres grupos de antimicrobianos no relacionados entre ellos.
Para definir la clonalidad entre los aislados de K. pneumoniae, se utilizó la técnica de la electroforesis de campo pulsado (PFGE, por sus siglas en inglés) reportada previamente 9. Para la definición de clones se definieron cepas con un nivel de identidad del 100%, como aquellas pertenecientes a un mismo clon y las que presentaron una identidad mayor del 80% se consideraron como clonalmente relacionadas 12.
En aquellas muestras que presentaban sensibilidad disminuida a los carbapenémicos, se estableció la presencia de genes codificantes de carbapenemasas mediante la prueba de reacción en cadena de la polimerasa múltiple (PCR Multiplex) para los genes bla NDM, bla VIM, bla IMP, bla KPC, y bla OXA-48 13. Para la presencia de genes plasmídicos de resistencia a la colistina, se realizó una PCR para determinar los genes mcr-1 a mcr-5 14.
El Comité Científico Institucional de la Universidad Científica del Sur y el Comité Científico del Instituto Nacional Materno Perinatal revisaron y aprobaron el presente estudio.
HALLAZGOS
Características de la población
Se incluyeron 36 aislados de K. pneumoniae MDR. Según el origen de la muestra, se aislaron 23 cepas (63,9%) de hemocultivos; 9 (25%), de secreciones; y 4 (11,1%), de coprocultivos.
Sensibilidad a los antimicrobianos
Se reportó un 97% de aislados con sensibilidad disminuida a cotrimoxazol. Con relación a los betalactámicos, se detectaron 26 (72,2%) con sensibilidad disminuida al aztreonam, 23 (63,8%) a ceftazidima y 32 (88,8%) a cefotaxime. Asimismo, 24 aislados (66,6%) presentaron resistencia elevada a gentamicina y 20 (55,5%) a amoxicilina/ácido clavulánico. El nivel de resistencia a las quinolonas fue de 36% y 47% para levofloxacino y norfloxacino, respectivamente. Los niveles fueron cercanos al 25% para imipenem, cloranfenicol, piperacilina-tazobactam y nitrofurantoina. Hay que destacar que solo para la amikacina, el valor fue menor a 15%.
Un 78% de las cepas resultaron positivas en la detección de la presencia de betalactamasas de espectro extendido (BLEE). De los aislados estudiados, 5 cepas (13,8%) fueron resistentes a la colistina durante el periodo 2015-2018. Si tenemos en cuenta solo el 2018, la frecuencia fue del 33,3% de las cepas evaluadas. Las mencionadas cepas resistentes presentaron una CMI superior a 2 mg/L, en un rango de 8 mg/L a 64 mg/L y se aislaron de hemocultivos (3/5) y secreciones (2/5).
Análisis molecular de resistencia a carbapenémicos y colistina
En las cepas que presentaban sensibilidad disminuida a carbapenémicos, se detectaron dos genes (bla KPC y bla NDM). Una cepa fue aislada de coprocultivo (código K80), y otra de secreciones (K81), respectivamente, siendo ambas de 2018 (Figura 1).
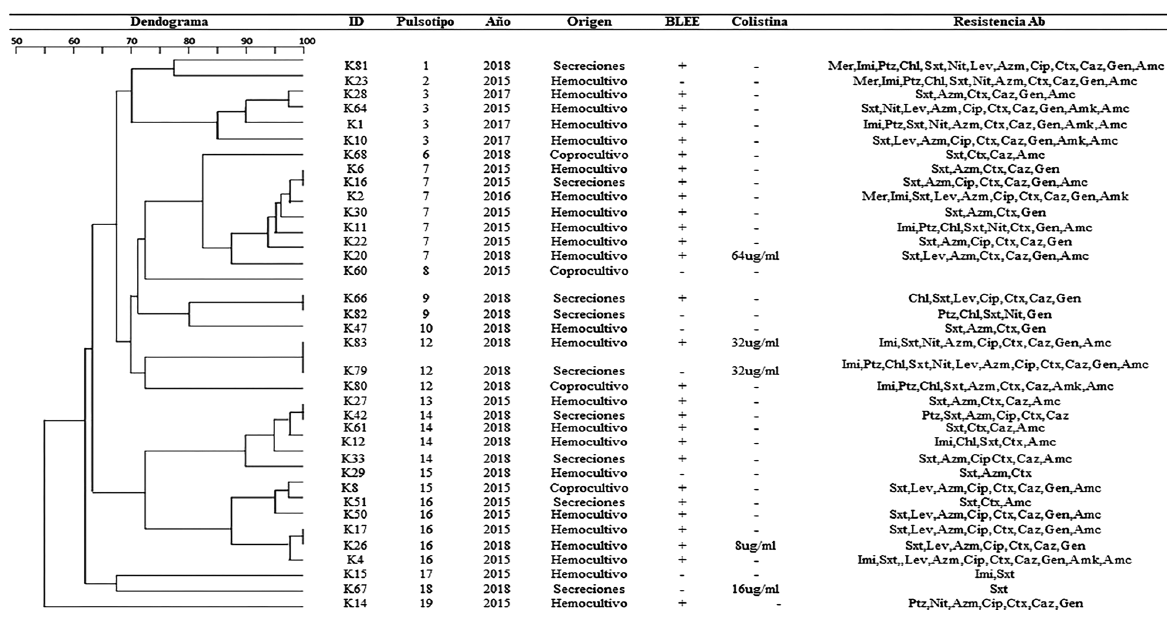
Figura 1 Dendograma de la relación clonal y perfil de sensibilidad a antimicrobianos de las cepas de Klebsiella pneumoniae analizadas en el estudio.
Con relación a las cepas resistentes a la colistina, la PCR no mostró la presencia de ningún gen mcr.
Análisis de clonalidad
Las cepas analizadas pertenecían a 16 pulsotipos diferentes reportados previamente 14. Es importante destacar que las cepas que presentaron niveles de resistencia a colistina pertenecieron a cuatro clones diferentes según el análisis de PFGE y todas fueron encontradas en 2018 (Figura 1).
DISCUSIÓN
El presente estudio evidencia la presencia de cepas de K. pneumoniae multirresistentes que son resistentes a la colistina aisladas en pacientes del Instituto Materno Perinatal durante 2018, y se descarta que se deba a genes plasmídicos (mcr), al menos del mcr1-5.
En general, las tasas de resistencia a los antimicrobianos entre los patógenos comunes en los hospitales de Lima son elevados 15. La presencia de brotes hospitalarios de Klebsiella productoras de BLEE, así como de enterobacterias en general, ha ido en constante aumento en América Latina. En el Perú, se ha descrito recientemente una elevada presencia de BLEE (50%) en cepas aisladas de bacteriemia en pacientes hospitalizados. Y los datos en la comunidad no difieren mucho, ya que están cercanos al 40% 15, lo que sugiere según los hallazgos reportados, que la presencia de BLEE en la población es elevada 15. Se debe destacar que, entre los diferentes patógenos reportados, Klebsiella spp. lidera la resistencia a las cefalosporinas de tercera generación en la región, con valores reportados de hasta un 75% de resistencia 16.
La resistencia a los carbapenémicos está emergiendo entre las enterobacterias en el Perú, en concordancia con la situación creciente reportada en todo el mundo 17 - 18. En las cepas del estudio se ha encontrado el gen bla KPC, reportado por primera vez en el Perú en 2013 en una cepa de Klebsiella 17 y un aislado con presencia de bla NDM , de creciente reporte en el Perú 18.
Respecto de la colistina, no se han reportado cepas resistentes en el periodo 2015-2017, pero sí se encontraron 5 aislados que se clasificaron en 4 clones/pulsotipos no relacionados entre sí, en 2018. Estos resultados se alinean con el mayor uso de este antimicrobiano en el hospital, y alertan que las cepas resistentes ya están circulando por la institución. Estudios previos en el Perú reportan niveles del 5% de resistencia a este antimicrobiano 7, y ya se han descrito brotes de cepas de Klebsiella productoras de bla KPC y resistentes a la colistina en la región 19.
Generalmente, la resistencia a la colistina se correlaciona con la disminución de la afinidad del grupo de lípidos A de lipopolisacáridos con los antibióticos de polimixina. En este estudio, no se han encontrado genes de resistencia a la colistina asociados a los plásmidos, al menos los testeados del mcr-1 al 5, lo que se sugiere que la resistencia a la colistina se debe a las mutaciones cromosómicas asociadas a cambios en los dos componentes (pmrAB y phoPQ) y su regulador mgrB 20. En el Perú, hay un estudio en el que se detectó el gen mcr-1 en cepas de E. coli procedentes de urocultivos, pero su frecuencia fue baja en 2018 20, sin embargo, se sugiere vigilar los mecanismos plasmídicos por su capacidad de diseminarse entre las diferentes especies bacterianas. Actualmente, no todos los hospitales públicos vigilan la resistencia a la colistina, así que parece probable que los niveles de resistencia en el Perú estén subestimados.
Aunque el estudio contiene un tamaño reducido de muestras y de una sola institución, su importancia reside en describir la presencia de cepas resistentes a la colistina no por mecanismos transferibles, sino como sugiere el estudio de clonalidad que han surgido por presión de uso del antimicrobiano. Recientemente, el Ministerio de Agricultura y Riego del Perú ha prohibido el uso, importación, comercialización, fabricación o elaboración de productos veterinarios que contengan colistina (polimixina E) para evitar la presión selectiva sobre este antimicrobiano, debido a que es de máxima prioridad para el uso en la práctica médica.
En conclusión, se encontró un alto porcentaje de cepas resistentes a la colistina, no relacionadas clonalmente, teniendo en cuenta que este antimicrobiano forma parte de las últimas alternativas de tratamiento. Es urgente establecer sistemas de cribado y vigilancia epidemiológica de resistencia a la colistina en todos los centros hospitalarios del país.











 texto en
texto en 



