INTRODUCCIÓN
Desde que se inició la pandemia del SARS-CoV-2, diversos equipos de investigación a nivel mundial comenzaron el desarrollo de vacunas contra la COVID-19, principalmente de virus inactivado, proteínas recombinantes, vectorizadas y vacunas de ARN, dirigidas especialmente a generar anticuerpos frente a las proteínas de la espiga (S) del SARS-CoV-2 1 - 6. Estas vacunas han demostrado una eficacia que está en el rango de 70 a 95% 7 - 10, mostrando una inmunogenicidad comparable a la desarrollada por pacientes convalecientes 1 , 3 , 6 , 11 , 12.
Las diferentes pruebas de anticuerpos son una herramienta útil para la identificación de sujetos que han tenido una exposición previa a la COVID-19 13, estos títulos de anticuerpos varían por varios factores (edad, sexo, gravedad de la enfermedad por COVID-19, y días desde la infección) 14 y podrían disminuir sustancialmente con el tiempo 15 - 17. Informes elaborados por Manisty et al., y Long et al., han asociado la gravedad clínica de la infección con la magnitud de las respuestas iniciales de anticuerpos y la duración de los títulos de anticuerpos circulantes 14 , 18, esto explicaría los niveles sostenidos de anticuerpos en pacientes hospitalizados durante 3 a 6 meses 19 - 21.
Los anticuerpos neutralizantes son considerados un buen marcador para la medición de las respuestas humorales 22. El estándar de referencia actual para su realización es el método de reducción en placa 23. Sin embargo, esta metodología es costosa y requiere condiciones de infraestructura y bioseguridad, inaccesibles para la mayoría de los establecimientos de salud. Una metodología útil para cuantificar los anticuerpos neutralizantes es con la medición de anticuerpos frente al dominio de unión al receptor (RBD por sus siglas en inglés) de la proteína de la espícula (S) del virión. Esta determinación de anticuerpos ha demostrado una buena correlación con el método de reducción en placa considerado actualmente como el estándar de referencia 24 - 26.
En Perú se reportó una alta mortalidad en el personal de salud durante la pandemia, debido a la falta de materiales de bioseguridad y al hacinamiento 27; hasta el 14 de julio fallecieron 502 médicos por complicaciones de la COVID-19 28 , 29, por lo que este grupo poblacional fue considerado en la primera fase de vacunación nacional, el cual se inició en febrero; para esta fase de vacunación se utilizó la vacuna de virus inactivado BBIBP-CorV del laboratorio Sinopharm, vacuna con una eficacia reportada del 86% 10. Al 30 de junio más del 85% de médicos recibieron la segunda dosis 30.
Aunque los ensayos clínicos de fase II de la vacuna BBIB-CorV publicados muestran la producción de anticuerpos neutralizantes en el 99% de casos 5, existen dudas sobre la inmunogenicidad en población peruana, esto motivó a las autoridades sanitarias del país a modificar el esquema de vacunación contra la COVID-19, implementando la dosis de refuerzo con la vacuna elaborada por el laboratorio Pfizer/BioNTech, a fin de una mejor respuesta inmune.
El objetivo del estudio fue evaluar la respuesta humoral determinada mediante el título de anticuerpos frente al dominio de unión al receptor (RBD) de la proteína espiga (S) en el personal de salud, entre la 4.ª y 12.ª semana luego de haber recibido la vacuna BBIBP-CorV (Sinopharm) como indicador de la respuesta inmunitaria adquirida posterior a la vacunación.
MENSAJES CLAVE
Motivación para realizar el estudio: una de las prioridades en esta pandemia, es asegurar la eficacia de las medidas preventivas utilizadas para disminuir el contagio, por lo que debemos conocer las respuestas inmunológicas obtenidas posterior a la vacunación, lo cual es importante para una adecuada toma de decisiones. Este trabajo es un paso para conocer las complejas relaciones entre el virus y el sistema inmune, que debería ser estudiado posteriormente con mayor profundidad.
Principales hallazgos: la vacunación brinda una adecuada inmunogenicidad de la vacuna BBIBP-CorV (Sinopharm).
Implicancias: se debe realizar más estudios a fin de conocer mejor el comportamiento del sistema inmune frente a la vacunación.
MATERIALES Y MÉTODOS
Población de estudio y muestra
Personal de salud de los hospitales nacionales Hipólito Unanue y Carlos Lanfranco La Hoz, que recibió la segunda dosis de vacuna contra la COVID-19, con y sin antecedente de diagnóstico previo de dicha enfermedad. Basados en un nivel de confianza del 95%, una proporción de 50+/-10% de positividad a anticuerpos neutralizantes, se calculó un tamaño muestral de 97 participantes. Se incluyeron trabajadores de salud que recibieron la segunda dosis de vacuna BBIBP-CorV (Sinopharm) frente al SARS CoV-2, que aceptaron ser parte del estudio y firmaron el consentimiento informado. Se excluyeron participantes con diagnóstico de COVID-19 posterior a la vacunación y previo al dosaje de anticuerpos, VIH/SIDA, cáncer, enfermedades autoinmunes o asociadas a inmunosupresión y gestación.
Procedimientos
Luego de la aprobación del estudio por el Comité de Ética Institucional del Hospital Nacional Hipólito Unanue y obtener el visto bueno del Hospital Nacional Carlos Lanfranco La Hoz, entre el 26 y 30 de mayo se enrolaron como participantes a trabajadores de salud de las diferentes áreas del Hospital Nacional Hipólito Unanue, y el 21 de abril a participantes de las áreas del Hospital Nacional Carlos Lanfranco La Hoz, previo consentimiento informado, que tuvieron la segunda dosis de la vacuna BBIBP-CorV (Sinopharm) entre la 4.ª y 12.ª semana posvacunación. Se llenó una ficha de estudio incluyendo información sobre edad, sexo, profesión, fecha de la vacunación y antecedente de COVID-19.
Extracción de sangre venosa
La sangre se obtuvo de una vena periférica, en tubos de muestra de 5 mL con activador de coagulación para la obtención de suero. Una vez obtenidos los sueros por centrifugación, fueron conservados a 20 °C hasta su procesamiento. Los sueros que no se procesaron el mismo día, fueron conservados a +5 °C (+/- 3 °C) dentro de las dos primeras horas, hasta su procesamiento dentro de los 14 días de obtenida la muestra, según recomienda el fabricante del reactivo.
Verificación de método
Previo al análisis de las muestras, se realizó la verificación de la precisión del procedimiento de medida, siguiendo las recomendaciones de la directriz para la verificación de los procedimientos de análisis cuantitativo del Instituto Nacional de la Calidad (INACAL); se obtuvo un coeficiente de variación (CV) del laboratorio menor al CV del fabricante del reactivo, por lo que el resultado fue aceptado.
Análisis
Se analizaron las muestras que cumplieron los criterios de aceptación, mediante la prueba Elecsys® Anti-SARS-CoV-2 S, un inmunoensayo para la detección cuantitativa in vitro de anticuerpos frente el dominio de unión al receptor (RBD) de la proteína de la espícula (S) del SARS-CoV-2 en suero y plasma humanos. La medición fue realizada en el analizador automatizado cobas® e601, que utiliza el método de electroquimioluminiscencia. El ensayo emplea una proteína recombinante que representa el RBD del antígeno S en un formato de ensayo sándwich de doble antígeno, que detecta anticuerpos de alta afinidad contra el SARS-CoV-2. Los títulos de anticuerpos detectados mostraron buena correlación con anticuerpos neutralizantes en ensayos de neutralización 24 - 26; sin embargo, durante la ejecución de este artículo el método de electroquimioluminiscencia para la detección cuantitativa in vitro de anticuerpos frente al dominio de unión al receptor (RBD) de la proteína de la espícula (S) del SARS-CoV-2 solo contaba con aprobación de uso de emergencia por parte de la Administración de Medicamentos y Alimentos de los Estados Unidos (FDA). El rango lineal es de 0,4 a 250 U/mL. Un resultado por encima de 0,8 U/mL se interpreta como reactivo 31 , 32, no obstante, no se ha podido determinar puntos de corte adecuados, debido a que los valores por encima de 250 U/mL no han podido ser considerados para el análisis estadístico. El control de calidad interno fue efectuado con Preci Control Anti-SARS-CoV-2 S.
Las pruebas fueron realizadas en el laboratorio del Hospital Nacional Hipólito Unanue para los participantes procedentes de dicho establecimiento y en el Instituto Nacional de Salud para los participantes provenientes del Hospital Carlos Lanfranco La Hoz.
Análisis estadístico
Las fichas fueron ingresadas en una base de datos elaborada en el programa Microsoft Excel y exportadas posteriormente a un archivo dta. El procesamiento de datos y el análisis fue realizado en el programa estadístico Stata v16.0 (Stata Corporation, College Station, Texas, USA). Las variables numéricas se presentan con las medidas de tendencia central y dispersión adecuadas, de acuerdo con su distribución. Se evaluó la normalidad mediante el uso de histogramas y pruebas formales. Las variables categóricas se presentan como frecuencias y porcentajes. Se evaluaron los títulos de anticuerpos presentando sus medidas de tendencia central y de dispersión de acuerdo con su distribución. La concentración media geométrica se usa para los títulos de anticuerpos porque los datos del título generalmente no se ajustan a una escala lineal. Cuando los datos están sesgados y no se distribuyen normalmente, se recomienda calcular la media geométrica en lugar de la media aritmética que puede no brindar una buena representación de los resultados 33. Se consideró un intervalo de confianza del 95% y un valor de p menor a 0,05 como significativo. Para la comparación de los títulos de anticuerpos frente a variables numéricas se utilizó la correlación de Spearman mientras que para la comparación con variables categóricas se utilizó la prueba de Mann Whitney o Kruskall Wallis. Debido a los diferentes momentos de vacunación y toma de muestras en los dos hospitales, un grupo de participantes se realizó el dosaje de anticuerpos entre las 4 y 6 semanas posvacunación mientras otro grupo de participantes presentó el dosaje entre las 8 y 12 semanas posvacunación. La diferencia en los tiempos de vacunación fue considerada como variable adicional. Se realizó un análisis multivariado utilizando el método de regresión lineal robusta incluyendo como variables independientes la edad, el sexo, el antecedente de COVID-19 y el momento de la vacunación. No se pudo hacer la recolección de sueros prevacunales a fin de comparar el aumento de estos en las personas estudiadas.
Consideraciones éticas
El estudio respetó los principios éticos en investigación según las Normas de Helsinki: autonomía, no maleficencia, justicia y beneficencia. El estudio cuenta con la autorización de los comités de ética del Hospitales nacional Hipólito Unanue (038-2021-CIEI-HNHU) y del Hospital Carlos Lanfranco La Hoz. Para participar en el estudio, los pacientes firmaron voluntariamente un consentimiento informado. El protocolo del presente artículo ha sido ingresado en el Registro de Proyectos de Investigación en Salud (PRISA) mediante el código: EI00000001792.
RESULTADOS
Se incluyeron 168 participantes, 108 correspondieron al Hospital Nacional Hipólito Unanue y 60 correspondientes al Hospital Lanfranco La Hoz. La mayoría de los participantes (60,1%) correspondieron al sexo femenino. La ocupación predominante fue la de médico (Tabla 1). Ninguno de los participantes desarrolló COVID-19 durante el seguimiento de hasta 3 meses luego del dosaje de anticuerpos.
Tabla 1 Ocupación de los participantes y sintomatología posterior a la vacunación.
| Ocupación | n | % | Síntomas luego de vacunación | |||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Cefalea | Cansancio | Dolor en brazo | Incremento de sueño | Mareos | Nauseas | Fiebre | Otros síntomas | |||
| 31 (18,5%) | 22 (13,1%) | 9 (5,7%) | 6 (3,6%) | 4 (2,4%) | 6 (3,6%) | (1,2%) | 6 (3,7%) | |||
| Médico | 67 | 39,8 | 13 (19,4) | 10 (14,9) | 5 (7,5) | 2 (3,0) | 3 (4,5) | 1 (1,5) | 0 (0,0) | 1 (1,5) |
| Administrativo | 33 | 19,6 | 5 (15,2) | 4 (12,1) | 1 (3,0) | 2 (6,1) | 0 (0,0) | 2 (6,1) | 0 (0,0) | 0 (0,0) |
| Tec. enfermería | 28 | 16,7 | 7 (25,0) | 3 (10,7) | 0 (0,0) | 1 (3,6) | 0 (0,0) | 1 (3,6) | 1 (3,6) | 3 (10,7) |
| Tecnólogo | 17 | 10,1 | 2 (11,8) | 1 (5,9) | 2 (11,8) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 1 (5,9) | 1 (5,9) |
| Enfermera(o) | 13 | 7,7 | 2 (15,4) | 3 (23,1) | 0 (0,0) | 1 (7,7) | 1 (7,7) | 2 (15,4) | 0 (0,0) | 1 (7,7) |
| Obstetra | 8 | 4,7 | 2 (25,0) | 1 (12,5) | 1 (12,5) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
| Tec. farmacia | 2 | 1,2 | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) | 0 (0,0) |
Títulos de anticuerpos frente al dominio de unión de receptor (RBD) de la proteína S del SARS CoV-2
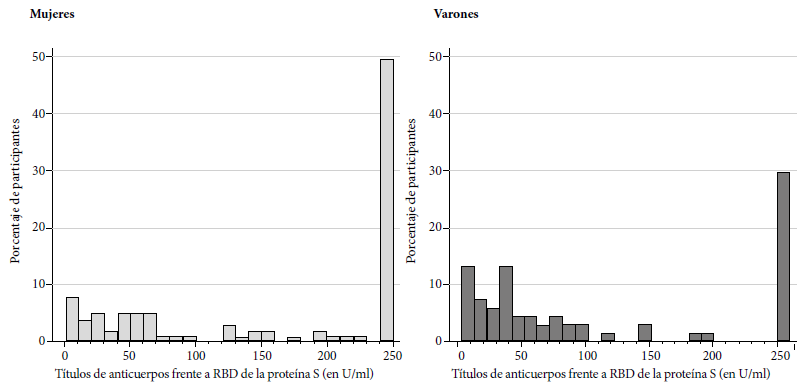
Todos los participantes desarrollaron anticuerpos frente al dominio RBD. La mediana fue de 137,05 con un rango intercuartil entre 40,04 y 250. El valor mínimo fue de 1,78 U/mL. Diecisiete participantes (10,1%) presentaron niveles por debajo de 10 U/mL y en 70 (41,7%) se encontraron niveles iguales o por encima de 250, nivel máximo de anticuerpos determinado por la prueba. La media geométrica fue de 82,6 (IC 95% 67,8-100,6). Entre los pacientes con antecedente de COVID-19 la media geométrica fue de 219,51 (IC 95%195,04-247,06). Todos los pacientes con antecedente de hospitalización por COVID-19 tuvieron valores mayores o iguales a 250 U/mL. La distribución de anticuerpos en formal global y según sexo se puede observar en la Figura 1 y 2.
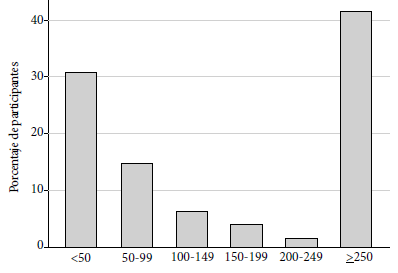
Figura 1 Distribución de títulos de anticuerpos frente al dominio de unión al receptor de la proteína S en U/L en personal de salud de dos hospitales generales. Lima, Perú.
Análisis bivariado
Las mujeres presentaron un mayor nivel (p=0,04) de anticuerpos (media geométrica de 100,97; IC95%: 81,11-125,70) que los varones (media geométrica de 60,54; IC95% 41,90-87,48). El grupo de participantes en los que se midieron anticuerpos entre las semanas 4 y 6 posvacunación mostró niveles de anticuerpos significativamente mayores (media geométrica de 129 U/mL; IC95% 100,93-166,78) que los pacientes cuyas determinaciones fueron realizadas entre las 8 y 12 semanas posvacunación (media geométrica de 62,23 U/mL; IC95% 47,46-81,59). Los pacientes con antecedente de COVID presentaron niveles significativamente mayores (media geométrica 219,51; IC95% 195,03-247,06) que aquellos sin antecedente de COVID (media geométrica 38,97; IC95% 30,39-49,96). Entre los pacientes con antecedente de COVID, los niveles de anticuerpos se encontraron en cifras iguales o por encima de 250 U/mL en el 88% de casos en comparación con 6% entre aquellos sin antecedente de COVID (p<0,001). No se encontró asociación entre la edad y los títulos de anticuerpos (coeficiente de correlación de Spearman -0,04; p=0,56). Se incluyeron 14 participantes mayores de 60 años. La media geométrica de este grupo de participantes fue de 53,44 (IC95% 21,29-134,16), en comparación con 86,11 (IC95% 70,28-105,49) sin diferencia estadísticamente significativa (p=0,28). No se encontró asociación entre trabajar en área COVID-19 o el desarrollo de síntomas posvacunación con el título de anticuerpos. El detalle de las comparaciones se muestra en la Tabla 2.
Tabla 2 Medianas y medias geométricas de niveles de anticuerpos frente al dominio de unión al receptor de la proteína S en U/L en personal de salud de dos hospitales generales. Lima, Perú.
| n = 168 | % | Media geométrica (IC95%) | Mediana (RIC) | Valor de p a | |
|---|---|---|---|---|---|
| Sexo | |||||
| Femenino | 102 | 60,7 | 100,97 (81,11-125,70) | 150,30 (51,06 - 250) | 0,04 |
| Masculino | 66 | 39,3 | 60,54 (41,90-87,48) | 77,22 (22,74 -250) | |
| Diabetes mellitus | |||||
| No | 162 | 96,4 | 82,11 (67,50-99,88) | 122,95 (39,88-250) | 0,27 |
| Sí | 6 | 3,6 | 96,80 (9,31-1007,00) | 250 (206,50-250) | |
| Hipertensión arterial | |||||
| No | 158 | 94,0 | 79,83 (65,03- 98,00) | 121,40 (39,88-250) | 0,18 |
| Sí | 10 | 6,0 | 141,35 (63,46- 314,83) | 250 (206,50-250) | |
| Asma | |||||
| No | 160 | 95,2 | 84,00 (68,68- 102,72) | 143,75 (40,04-250) | 0,43 |
| Sí | 8 | 4,8 | 58,96 (16,21-214,44) | 83,91 (24,66-233,5) | |
| Trabaja en área COVID-19 | |||||
| No | 92 | 54,8 | 89,75 (68,28-117,97) | 195,90 (45,08-250) | 0,23 |
| Sí | 76 | 45,2 | 74,68 (55,82-99,92) | 104,39 (31,22-150) | |
| Antecedente COVID-19 | |||||
| No | 95 | 56,5 | 38,97 (30,39-49,96) | 47,45(20,52-90,39) | <0,001 |
| Sí | 73 | 43,5 | 219,51 (195,04-247,06) | 250 (250-250) | |
| Tiempo entre segunda dosis y determinación de anticuerpos | |||||
| 4 a 7 semanas | 62 | 36,9 | 129,74 (100,93-166,78) | 250 (62,30-250) | <0,001 |
| 10 a 12 semanas | 106 | 63,1 | 62,23 (47,46-81,59) | 72,38 (24,09-250) | |
| Síntomas luego de segunda dosis de vacuna | |||||
| No | 90 | 53,6 | 88,36 (68,56-113,88) | 143,75 (41,98-250) | 0,77 |
| Sí | 78 | 46,4 | 76,40 (55,76-104,69) | 122,90 (34,83-250) |
a Prueba U de Mann Whitney para evaluar las diferencias de medianas
RIC: rango intercuartil; IC95%: intervalos de confianza al 95%.
Análisis multivariado
En el modelo multivariado (Tabla 3) el antecedente de COVID-19 tuvo una asociación significativa con un mayor título de anticuerpos (coeficiente beta=213,87). Ello puede interpretarse como la diferencia (ajustada al sexo y tiempo desde la segunda dosis) en el título de anticuerpos entre aquellos participantes con antecedente de COVID-19 en comparación con aquellos sin dicho antecedente. El sexo masculino se asoció con un menor título de anticuerpos (coeficiente beta=-8,37). Asimismo, el tiempo entre la segunda dosis y la medición de los títulos de anticuerpos también se asoció con la presencia de menores títulos de anticuerpos (coeficiente beta=-6,67).
Tabla 3 Modelo de regresión robusta para niveles de anticuerpos frente al dominio de unión al receptor de la proteína S en U/L en personal de salud de dos hospitales generales. Lima, Perú.
| Variable | Coeficiente beta | IC95% | Valor de p |
|---|---|---|---|
| Antecedente de COVID-19 | 213,87 | 208,24; 219,49 | <0,001 |
| Sexo masculino | -8,37 | -14,09; -2,65 | 0,004 |
| Dosaje de 10 a 12 semanas posvacunación a | -6,67 | -12,51; -0,82 | 0,026 |
a En comparación con aquellos vacunados entre 4 a 7 semanas.
IC95%: intervalos de confianza al 95%.
DISCUSIÓN
Nuestro estudio evidenció la presencia de respuestas de anticuerpos en la totalidad de participantes. Esto corrobora los datos evaluados en otros estudios y confirman una adecuada inmunogenicidad en la respuesta humoral. Nuestros datos son concordantes con el ensayo clínico publicado por Xia et al. quienes encontraron respuestas inmunológicas adecuadas en una población de 143 vacunados, en donde el 100% de participantes aumentó los títulos de anticuerpos neutralizantes comparado con el basal previo a la inmunización 5. Asimismo, recientemente un estudio realizado por el Instituto Nacional de Salud brinda información bastante parecida a nuestros hallazgos, en él se evaluó a 95 personas sin antecedente de infección y 34 personas con antecedente de infección por SARS-CoV-2; del primer grupo, 21 días posteriores a la primera inmunización, 31% generó anticuerpos IgG para el linaje B.1.1, y 15% anticuerpos IgG contra la variante Gamma (P.1), pero luego de 21 días, posterior a la segunda dosis con la vacuna BBIBP-Cor-V, estos porcentajes aumentan a 99 y 96%, respectivamente para cada linaje, mientras que en el grupo con antecedente de infección por SARS-CoV-2 tras 21 días de la primera dosis 82% generó anticuerpos IgG para el linaje B.1.1 y el 77% anticuerpos IgG contra la variante Gamma (P.1), y luego de 21 días de la segunda dosis el 100% generó anticuerpos IgG contra el linaje B.1.1 y la variante Gamma 34.
Entre los factores asociados a un mayor título de anticuerpos resalta claramente el antecedente de COVID-19. Esto es predecible y hasta cierto punto una limitante, dado que no es posible distinguir las respuestas inmunológicas frente a la vacunación de las originadas por la propia infección por SARS CoV-2. En todo caso, nuestros datos son consistentes con una mayor producción de anticuerpos en aquellas personas con antecedente de COVID-19. Ello ha sido también evidenciado por un estudio el publicado por Xiangyu Chen et al., en el que observaron que los títulos de anticuerpos neutralizantes mostraban una relación positiva al antecedente de la enfermedad y a la gravedad de esta, siendo mayor en aquellos pacientes con enfermedad severa 22.
La respuesta inmunogénica mediada por células T parece ser más intensa en mujeres, mientras que los niveles de varias quimiocinas y citoquinas inmunes innatas parece ser más alta en pacientes masculinos. Se sabe que la severidad del cuadro de COVID-19 es menor en el sexo femenino 35, y estas diferencias en la respuesta inmunológica entre mujeres y varones podría explicar las diferencias existentes en la severidad de la enfermedad.
Aunque la muestra es escasa, no parece existir una disminución de la inmunogenicidad con la edad. Sin embargo, se requieren estudios con mayor población para determinar si existen diferencias significativas al respecto. En tal sentido, es importante señalar que los datos en personas con más de 60 años son escasos y se suele interpretar de manera equivocada como inefectividad de la vacuna en esta población. Sin embargo, se ha encontrado en estudios publicados que en el grupo mayor de 60 años seroconvertían en un 100%, dependiendo de las dosis empleadas en la vacuna 34.
Por otro lado, el antecedente de COVID-19 se asocia con mayores respuestas inmunológicas. Se ha planteado que en pacientes con antecedentes de COVID-19 y un sistema inmune adecuado, podría ser necesario una sola vacuna 36. Sin embargo, existe un número apreciable de pacientes que no presentan niveles de anticuerpos elevados, por lo cual no podríamos hacer una recomendación al respecto. Queda como interrogante la correlación entre los títulos y la capacidad de protección frente a infección por SARS-CoV-2.
Nuestro estudio presenta como limitación el no haber determinado la presencia de anticuerpos neutralizantes de manera directa, por lo que no podemos, necesariamente, inferir que las respuestas inmunológicas evidenciadas impliquen necesariamente una protección desde el punto de vista clínico; asimismo, la prueba utilizada para la detección de anticuerpos frente al dominio de unión al receptor (RBD) de la proteína de la espícula (S) cuenta solamente con la aprobación para su uso de emergencia, sin embargo, se ha visto una buena correlación con las pruebas de neutralización por reducción de placas. Otra limitación encontrada es tener puntos de corte demasiado amplios, no pudiendo comparar los valores por encima de 250 U/mL, no obstante, el estudio busca medir la seroconversión encontrándose que todos los participantes logran seroconvertir independientemente de los títulos hallados También se ha presentado como limitación el no contar con sueros prevacunales a fin de comparar el incremento proporcionado por la vacuna, sin embargo, para fines de este estudio esta limitación no ha interferido en las conclusiones. Por otro lado, la respuesta frente a las nuevas variantes puede ser diferente, tal como ha sido evidenciado en la menor capacidad neutralizante de la vacuna BBIBP-CorV frente a la variante B.1.351 37.
Considerando que la vacuna utilizada se basa en un virus inactivado, es razonable hipotetizar que la protección pueda ser por un tiempo limitado, dado que la inmunidad natural en el caso de COVID-19 parece diluirse al cabo de algunos meses tal como lo sugieren las experiencias de Manaos donde pese a haberse obtenido prevalencias de más del 70% (y por ende postulado la inmunidad de rebaño), se evidenció una segunda ola de proporciones significativas. En virtud de ello, puede ser razonable considerar una dosis de refuerzo al cabo de algunos meses, en personal de salud, particularmente en trabajadores de primera línea, de acuerdo con las recomendaciones emitidas por instituciones reguladoras como el Centro para el Control y Prevención de Enfermedades y la Organización Mundial de la Salud, priorizando siempre la salud colectiva. Sin embargo, consideramos erróneo afirmar que la vacuna utilizada no tenga utilidad, lo cual puede motivar la renuencia a la vacunación, tal como ha venido sucediendo con la negativa del gremio de profesores de zonas rurales a quienes se les viene ofreciendo la vacunación con BBIBP-CorV.
En conclusión, nuestros datos evidencian una adecuada inmunogenicidad de la vacuna BBIBP-CorV (Sinopharm) evaluada mediante los anticuerpos frente al RBD. Sin embargo, es necesario evaluar la correlación entre la magnitud de los títulos y la protección frente a COVID-19 y el tiempo de protección conferido por la vacuna.











 texto em
texto em