INTRODUCCIÓN
La toxoplasmosis congénita (TC) es una enfermedad causada por T. gondii, un parásito protozoo que constituye un problema de salud pública aún desatendido en diversos países, incluyendo al Perú 1; siendo una causa prevenible de daño neurológico y ceguera congénita 1 , 2.
Se estima que más de un tercio de la población mundial está infectada por este parásito; no obstante, si la infección ocurre durante el embarazo puede provocar daño en el sistema nervioso central del recién nacido 3. A nivel mundial, la incidencia estimada de la infección congénita es de 400 a 4000 nuevos casos cada año 4, y la carga de la enfermedad por TC establecida en años de vida ajustados a discapacidad (AVAD) es de 1,20 millones por año 5. Algunos reportes indican que los casos de TC son más severos en países de Latinoamérica, debido a una probable exposición a cepas más virulentas (tipo I) 6.
En Perú, los reportes sobre TC son escasos y aislados 7. Por tanto, el objetivo del presente estudio fue describir las características epidemiológicas, clínicas y terapéuticas en pacientes con diagnóstico de TC con compromiso encefálico, ocular y/o auditivo en un instituto pediátrico de referencia nacional en Lima, Perú.
EL ESTUDIO
Lugar de estudio
El INSN-SB es un centro hospitalario pediátrico de referencia para manejo quirúrgico y especializado de alta complejidad.
Población de estudio y criterios de selección
Se incluyeron pacientes menores de 1 año con diagnóstico serológico de TC atendidos en el INSN-SB de Lima, Perú, durante el período comprendido entre enero del 2015 a diciembre del 2019. Se definió como paciente con diagnóstico de TC aquellos con presencia de anticuerpos IgM para T. gondii con un valor mayor de 350 UI/mL, mediante la técnica de inmunoensayo enzimático (ELISA), kit comercial Euroimmun; y de acuerdo con la clasificación de TC por Desmonts and Couvreur se consideraron solo a los niños con enfermedad neurológica severa 8. Se excluyeron los casos de TC sin compromiso neurológico y con datos incompletos en la historia clínica para las variables analizadas.
Variables de estudio
Se registraron variables demográficas como edad, sexo (masculino, femenino), lugar de nacimiento, comorbilidad, edad gestacional y peso al nacimiento en gramos La edad gestacional se categorizó y definió como prematuridad aquellos con edad gestacional al nacimiento menor de 37 semanas. El peso al nacimiento se categorizó en muy bajo peso al nacer (< 1500 g), bajo peso al nacer (< 2500 g), y adecuado peso (entre 2500 y 3999 g). Los hallazgos correspondientes al compromiso cerebral como calcificaciones intracraneales, hidrocefalia, microcefalia, agenesia/disgenesia del cuerpo calloso e hipoplasia cerebelosa fueron establecidos mediante ecografía transfontanelar, tomografía y/o resonancia magnética cerebral. Mientras que el compromiso ocular fue determinado mediante la evaluación del fondo de ojo realizada por un médico oftalmólogo, quien determinó la presencia de coriorretinitis u otra alteración ocular. Además, se realizaron potenciales evocados auditivos y visuales por el servicio de neurofisiología del INSN-SB, como estudio complementario para establecer la presencia y grado de hipoacusia y disminución de la agudeza visual, respectivamente. Se registró el tratamiento antiparasitario sistémico e intraocular, de acuerdo con el caso, así como el uso de corticoterapia adyuvante.
Análisis estadístico
Se utilizó el software estadístico Stata® v16 (Stata Corporation, College Station, Texas, USA) para la estadística descriptiva. Las variables cuantitativas fueron representadas por medianas y rango intercuartílico (RIC), de acuerdo con el análisis de la distribución de los datos, mientras que las variables cualitativas se resumen usando frecuencias y porcentajes.
HALLAZGOS
Durante el periodo de estudio se identificaron 79 pacientes con serología IgM positiva para T. gondii en el INSN-SB, de los cuales 33 fueron pacientes menores de 1 año (casos de TC), 21 (63,6%) de ellos fueron incluidos por presentar manifestaciones clínicas de TC con enfermedad neurológica severa. Las principales características epidemiológicas y clínicas se detallan en la Tabla 1, y las imágenes de las lesiones cerebrales más representativas de los casos se muestran en la Figura 1.
Tabla 1 Características clínico-epidemiológicas de los pacientes con TC y enfermedad neurológica severa (n=21).
| Características | N | % |
|---|---|---|
| Sexo Femenino | 12 | 57,1 |
| Edad (meses)a | 3,13 | (1,7-7,3) |
| Prematuridad (n=20) | 10 | 50,0 |
| Peso al nacimiento en gramosa | 2905 | (1805-3545) |
| BPN | 8 | 40,0 |
| MBPN | 2 | 10,0 |
| Manifestaciones del sistema nervioso central (n=21) | ||
| Hidrocefalia | 16 | 76,2 |
| Calcificaciones intracraneales | 11 | 52,4 |
| Microcefalia | 9 | 42,9 |
| Convulsiones | 6 | 25,6 |
| Disgenesia del cuerpo calloso | 4 | 19,1 |
| Hipoplasia cerebelosa | 2 | 9,5 |
| Diabetes insípida central | 2 | 9,5 |
| Trigonocefalia | 1 | 4,8 |
| Craneosinostosis | 1 | 4,8 |
| Manifestaciones oculares (n=16) | ||
| Coriorretinitis | 8 | 38,1 |
| Vitreitis | 4 | 19,0 |
| Desprendimiento de retina | 4 | 19,0 |
| Catarata | 4 | 19,0 |
| Uveítis posterior | 1 | 4,8 |
| Coroiditis | 1 | 4,8 |
| Exoftalmos | 1 | 4,8 |
| Cicatriz macular | 1 | 4,8 |
| Potenciales evocados auditivos (n=10) | ||
| Hipoacusia neurosensorial leve | 6 | 60,0 |
| Hipoacusia neurosensorial profunda | 4 | 40,0 |
| Bilateral | 10 | 100,0 |
| Potenciales evocados visuales (n=15) | ||
| Disfunción de las vías visuales | 6 | 40,0 |
| Ausencia de las vías visuales | 9 | 60,0 |
| Unilateral | 3 | 20,0 |
| Bilateral | 12 | 80,0 |
a Mediana (rango intercuartílico)
BPN: bajo peso al nacer. MBPN: muy bajo peso al nacer.
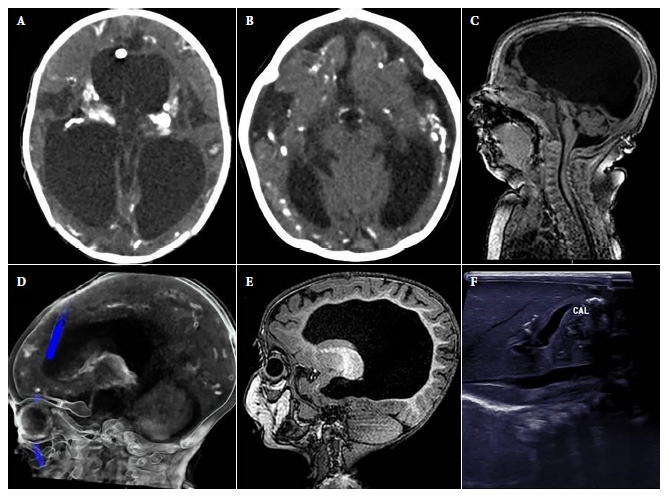
Figura 1 Hallazgos anormales en imágenes de los casos. A). hidrocefalia y calcificaciones intracraneales en corte transversal de tomografía cerebral. b). disminución del volumen del parénquima cerebral con dilatación ventricular, microcefalia y calcificaciones intracraneales en corte transversal de tomografía cerebral. c). hipoplasia cerebelosa en corte sagital de RMN cerebral. D). calcificaciones intracraneales en corte sagital de tomografía cerebral. E). disgenesia del cuerpo calloso en corte sagital de RMN cerebral. F). calcificaciones hepáticas en ecografía abdominal.
La mediana de edad al momento del diagnóstico de los pacientes fue 3,1 meses (RIC: 1,7-7,3), y solo 3/21 fueron diagnosticados durante el primer mes de vida. Ninguna madre conocía el diagnóstico de TC ni recibió tratamiento durante la gestación. El 19,1% eran procedentes de Lima (4/21), mientras que 81% de provincia (total 17/21; Ancash (3), Ayacucho (2), Piura (2), Huánuco (2), Amazonas (1), Arequipa (1), Cusco (1), Huancavelica (1), Junín (1), Lambayeque (1), San Martín (1) y Ucayali (1)). Las comorbilidades registradas en 10/21 pacientes fueron cardiopatía congénita (5), espina bífida (2), mielomeningocele (1), atresia esofágica (1) y displasia broncopulmonar (1). Además, 19,1% (4/21) presentó visceromegalia y se identificó presencia de calcificaciones hepáticas en un caso mediante estudio ecográfico (Figura 1).
Los análisis de laboratorio mostraron una mediana de hemoglobina de 11,4 g/dL (RIC: 9,8-12,4), recuento de plaquetas de 293000 (RIC: 212000-536000), eosinófilos 290 (RIC: 120-520), alanina-aminotransferasa (ALT) 28 U/L (RIC: 14-44), bilirrubina total 2,095 mg/dL (RIC: 0,2-5). El análisis citoquímico del líquido cefalorraquídeo (LCR) fue realizado en 9/21 pacientes y se encontró como media del recuento celular 30,2 (DE: 19,2) células/mm3 (polimorfonucleares 21,5, DE: 17,9; mononucleares 78,5, DE: 17,9), glucorraquia 29,3 mg/dL (DE: 17,4), proteinorraquia 484 mg/dL (RIC: 109-589), y adenosina deaminasa (ADA) 15 U/L (RIC: 11-75). El tratamiento antiparasitario fue empleado en 13/21 pacientes y solo tres recibieron la combinación de pirimetamina más sulfadiazina, otros detalles de los regímenes de tratamiento que recibieron se muestran en la Tabla 2.
Tabla 2 Características de los pacientes con TC que recibieron tratamiento antiparasitario (n=13).
| N.° | Edad/ Sexo | Características al nacimiento | Manifestaciones | Régimen terapéutico | Corticoterapia adyuvante | |||
|---|---|---|---|---|---|---|---|---|
| Prematuridad | Peso | Oculares | Auditivas | Cerebrales | ||||
| 1 | 27 días / F | Sí | BPN | Coriorretinitis PEV: disfunción bilateral | PEA: NR | No | TMP-SMX + clindamicina | No |
| 2 | 1 mes / F | No | AP | Coriorretinitis PEV: NR | PEA: NR. | Hidrocefalia, calcificaciones intracraneales, convulsiones | TMP-SMX | No |
| 3 | 26 días / M | Sí | BPN | Vitreitis, desprendimiento de retina PEV: NR | PEA: NR | Hidrocefalia, calcificaciones intracraneales, microcefalia | Pirimetamina + sulfadiazina | Sí |
| 4 | 1 mes /F | Sí | BPN | Catarata PEV: NR | PEA: NR | Hidrocefalia, calcificaciones intracraneales | Pirimetamina + sulfadiazina | No |
| 5 | 2 meses / M | No | AP | PEV: ausencia bilateral | PEA: Hipoacusia bilateral leve | Hidrocefalia, convulsiones | Pirimetamina + sulfadiazina à TMP-SMX + clindamicina à TMP-SMX | No |
| 6 | 4 meses /F | No | BPN | Coriorretinitis PEV: ausencia bilateral | PEA: NR | Hidrocefalia, calcificaciones intracraneales | TMP-SMX + clindamicina | Sí |
| 7 | 2 meses / M | No | AP | Coriorretinitis. PEV: ausencia bilateral | PEA: Hipoacusia bilateral leve | Hidrocefalia, convulsiones, diabetes insípida | TMP-SMX + clindamicina | Sí |
| 8 | 8 días / F | Sí | BPN | Vitreitis, uveítis posterior, desprendimiento de retina PEV: ausencia bilateral | PEA: Hipoacusia bilateral leve | Hidrocefalia, calcificaciones intracraneales, disgenesia del cuerpo calloso | Azitromicina + clindamicina à TMP-SMX + clindamicina à TMP-SMX * Tratamiento intraocular | Sí |
| 9 | 7 meses / F | Sí | MBPN | Coriorretinitis, desprendimiento de retina PEV: NR | PEA: NR | Hidrocefalia, calcificaciones intracraneales, convulsiones | TMP-SMX + azitromicina à TMP-SMX + clindamicina à TMP-SMX | Sí |
| 10 | 2 meses / F | No | BPN | Coriorretinitis PEV: disfunción unilateral | PEA: NR | Calcificaciones intracraneales, microcefalia | TMP-SMX + azitromicina à TMP-SMX | Sí |
| 11 | 7 meses / F | No | AP | Coriorretinitis. PEV: disfunción unilateral | PEA: NR | Hidrocefalia, calcificaciones intracraneales, microcefalia | TMP-SMX | Sí |
| 12 | 5 meses / M | ND | ND | Coriorretinitis. PEV: ausencia bilateral | PEA: Hipoacusia bilateral leve | Calcificaciones intracraneales, microcefalia, convulsiones | TMP-SMX | No |
| 13 | 1 mes / F | Sí | BPN | Vitreitis PEV: ausencia bilateral | PEA: Hipoacusia bilateral profunda | Hidrocefalia, calcificaciones, microcefalia, hipoplasia cerebelosa, diabetes insípida | Pirimetamina + clindamicina à TMP-SMX * Tratamiento intraocular | Sí |
AP: adecuado peso. BPN: bajo peso al nacer. MBPN: muy bajo peso al nacer. ND: no documentado. NR: no realizado. PEA: potenciales evocados auditivos. PEV: potenciales evocados visuales. TMP-SMX: trimetoprim-sulfametoxazol.
DISCUSIÓN
El presente estudio muestra un alto porcentaje de casos de TC con enfermedad neurológica severa (64%) y describe el mayor número de pacientes con este diagnóstico, realizado en una sola institución de Perú y durante un periodo de cinco años. No obstante, son escasos y aislados los reportes publicados de TC con enfermedad neurológica severa en Perú 7, a pesar de existir una alta seroprevalencia de toxoplasmosis en gestantes, que varía entre 32,5 y 94,5% 9.
Se han reconocido diferentes vías de transmisión de TC: 1) infección primaria durante o poco antes del embarazo; 2) reactivación de T. gondii en una madre infectada por VIH u otro tipo de alteración inmune, y 3) secundaria a la infección por un genotipo atípico de T. gondii en una gestante inmune a un genotipo típico 10. La mayoría de casos de TC son asintomáticos, la severidad del daño fetal por T. gondii ocurre principalmente cuando la infección materna se da en etapas tempranas del embarazo (durante el primer trimestre); sin embargo, la permeabilidad de la barrera placentaria que permite el pasaje parasitario de T. gondii al feto, es menor en el primer trimestre (equivalente al 10%), mientras que durante el segundo y tercer trimestre la permeabilidad alcanza un 30 y 70%, respectivamente, siendo en estos casos mayor el riesgo de infección fetal, pero con menos posibilidad de provocar daño neurológico 11.
Por otro lado, se ha reportado que el riesgo de TC con enfermedad neurológica severa, con manifestaciones clínicas incluidas en la clásica triada de Sabin y Pinkerton (hidrocefalia o microcefalia, calcificaciones intracraneales y coriorretinitis), es mayor en países de Sudamérica (según datos de Brasil y Colombia) comparado con países de Europa, siendo el riesgo comparativo en lesiones oculares de 47% versus 14%, y lesiones intracraneales de 53% versus 9% 12. Asimismo, Olariu et al. identificaron que 85% de los casos con sospecha clínica y confirmación laboratorial de TC presentaron manifestaciones de enfermedad neurológica severa en Estados Unidos 13, mientras que en nuestro estudio fue de 64%; cabe mencionar que el INSN-SB es un hospital de referencia que recibe pacientes con enfermedades que requieren manejo neuroquirúrgico (como hidrocefalia). En otra serie de casos de TC en Perú, reportó 16 casos durante un periodo de 15 años, dos pacientes presentaron hidrocefalia (12,5%), cuatro con microcefalia (25%) y en ninguno se reportó calcificaciones intracraneales ni compromiso ocular 14. Además, en la literatura se han reportado pocos casos de diabetes insípida central secundaria a TC, en nuestro estudio se encontró dos pacientes con esta entidad clínica que compromete el eje hipotálamo-pituitario 15. La pérdida auditiva neurosensorial asociada a TC es otra manifestación clínica que debe ser evaluada, su prevalencia es variable y puede alcanzar hasta 26% de los casos, siendo recomendado el monitoreo y evaluaciones audiométricas periódicas en aquellos pacientes con diagnóstico de TC 16.
Los regímenes de tratamiento para TC incluyen un abordaje prenatal, con el propósito de prevenir la infección del feto y en caso de la infección ofrecer un tratamiento temprano durante la gestación, mientras que el abordaje posnatal se enfoca en tratar la infección y prevenir las secuelas 17. El tratamiento de elección para la TC posnatal se basa en la combinación de pirimetamina y sulfadiazina durante un periodo de 12 meses, ambos medicamentos poseen acción antiparasitaria contra las formas de taquizoito de T. gondii; no obstante, estos medicamentos no han mostrado efectividad para eliminar las formas quísticas (bradizoito) del parásito, especialmente del sistema nervioso central y ocular 17 , 18. Como alternativas al tratamiento también se han descrito el uso de otros medicamentos usados solos o en combinación con pirimetamina, como son la sulfadoxina, clindamicina, cotrimoxazol, atovaquone y azitromicina 17, debido a la falta de disponibilidad y acceso de pirimetamina y sulfadiazina. La corticoterapia adyuvante se emplea en los casos con compromiso ocular activo, como coriorretinitis, y en casos con LCR patológico con proteinorraquia mayor de 1 g/dL 19.
En prevención es importante fortalecer la educación pública, sobre todo en gestantes, la información debe ser detallada y práctica para permitir una clara comunicación entre el médico y el paciente, con la finalidad de mejorar la adhesión a las medidas y hábitos, fundamentalmente de higiene, que reducen la exposición a T. gondii 1 , 4. Además, países como Francia cuenta con un programa de tamizaje gestacional y tratamiento temprano efectivo ha demostrado reducir la prevalencia y severidad de la TC; sin embargo, otros países con características sociodemográficas similares a la nuestra, como Marruecos y Colombia, que realizan el tamizaje de TC en gestantes han evidenciado dificultades en el seguimiento y tratamiento de los casos diagnosticados 20.
El estudio tuvo limitación en la selección de casos que fueron recolectados en una sola institución, por lo cual, no reflejan la casuística real de la TC en el país. Asimismo, se incluyó solo pacientes con enfermedad neurológica severa y con diagnóstico realizado posnatal, debido que INSN-SB, al ser un establecimiento de salud de referencia, está enfocado en manejo de patologías quirúrgicas en pacientes pediátricos y no brinda atención a gestantes.
En conclusión, nuestro estudio demostró un alto porcentaje de casos de TC con enfermedad neurológica severa principalmente hidrocefalia, calcificaciones intracraneales, microcefalia, y coriorretinitis. La mayoría fue diagnosticada después del mes de vida y recibieron regímenes de tratamiento alternativo. Es importante mencionar que en el Perú, existe un subregistro de TC y otras infecciones congénitas, por lo que puede considerarse desatendida; por lo cual, se requiere de vigilancia e investigación a nivel nacional, que visualice las reales implicancias y repercusiones de la TC en la población peruana, que permita elaborar guías con estrategias apropiadas en prevención, diagnóstico temprano y tratamiento oportuno durante la gestación y también en el recién nacido, con acceso y disponibilidad a métodos diagnósticos y medicamentos de elección.











 texto en
texto en 



