INTRODUCCIÓN
Los extractos vegetales son ampliamente usados en el tratamiento de enfermedades, particularmente como antifúngicos. Actualmente, las investigaciones enfocadas en sus componentes biológicos activos son prometedoras; asimismo, la Organización Mundial de la Salud (OMS) ha propuesto que se considere la inclusión de la medicina tradicional en el sistema de atención de la salud 1.
Las dermatomicosis constituyen una de las enfermedades cutáneas más frecuentes, los estudios epidemiológicos en nuestro país sobre la incidencia en la población son numerosos 2. La resistencia a los fármacos, los fracasos terapéuticos, los efectos adversos y la toxicidad que existe con el uso de antimicóticos convencionales representan un problema, por lo que es necesario buscar nuevas alternativas para el tratamiento 3. La medicina tradicional representa una opción importante, sin embargo, necesita ser validada científicamente hacia la medicina convencional.
La familia Solanaceae es una de las más diversas y el género Solanum está ampliamente distribuido en el Perú; Solanum hispidum Pers se encuentra entre 2500 a 3500 m de altitud 4. Esta planta crece abundantemente en Carhuaz, donde se le conoce como ñahui pashta y es tradicionalmente usada por la población local para el tratamiento de micosis de los pies mediante aplicación tópica del contenido de los frutos ( 5.
Estudios previos han demostrado la actividad antifúngica in vitro de varias especies del género Solanum, como Solanum crysotrichum para patógenos como Trichophyton mentagrophytes, Trichophyton rubrum y Trichophyton gypseum 6. Posteriormente, se realizaron estudios clínicos en una crema derivada del extracto metanólico de sus hojas, la cual mostró efectividad en Tinea pedís ( 7. Solanum melongena demostró actividad antifúngica contra Trichophyton mentagrophytes, Trichophyton rubrum, Trichopyton tonsurans, Candida albicans y Trichosporon beigeii 8. Además, se evidenció que Solanum xanthocarpum inhibe el crecimiento de Aspergillus fumigatus, Aspergillus flavus y Aspergillus niger 9, otros estudios recientes demostraron también la actividad antifúngica frente a Candida albicans 10. La especie Solanum nigrum L posee actividad antifúngica contra Trichophyton rubrum, Trichophyton tonsurans, Trichophyton mentagrophytes, Microsporum gypseum y Candida albicans 11; y entre sus compuestos fitoquímicos se encontraron alcaloides, flavonoides, cumarinas, taninos y saponinas 12.
Las hojas de Solanum hispidum Pers son usadas como antimicótico en la medicina folclórica mexicana, y se demostró su actividad antifúngica contra Trichophyton mentagrophytes, Trichophyton rubrum, Aspergillus niger y Candida albicans; las cepas que mostraron mayor sensibilidad fueron Trichophyton mentagrophytes y Trichophyton rubrum; además, se determinaron y aislaron saponinas esteroidales 13. Por otra parte, el estudio reciente de Retamozo 14 reportó la abundancia de glicoalcaloides esteroidales como principales metabolitos secundarios en hojas y frutos de esta especie. Sin embargo, no existe ningún estudio en Perú sobre la evaluación de sus propiedades frente a agentes fúngicos. Por lo tanto, el presente estudio tiene como objetivo el análisis fitoquímico preliminar y actividad antifúngica del extracto etanólico de las hojas de Solanum hispidum Pers.
MATERIALES Y MÉTODOS
Colección del material vegetal
Se colectaron al azar hojas frescas de Solanum hispidum Pers de diferentes ejemplares distribuidos en el departamento de Ancash, provincia de Carhuaz, distrito de Acopampa, localidad de Obraje. Ubicada a una altitud de 2750 m de altitud (Figura 1).
La especie fue identificada taxonómicamente y certificada por el herbario San Marcos del Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos (código: 053-USM-2017).
Obtención del extracto etanólico de la planta
Las hojas de Solanum hispidum Pers fueron lavadas con agua destilada e inicialmente secadas a temperatura ambiente durante siete días, luego se completó el secado a 40 °C en estufa con aire circulante por cinco días; posteriormente, las hojas se trituraron y molieron hasta obtener un polvo fino uniforme 15.
El polvo fue mezclado con etanol al 90% en una proporción 1:10 en un frasco de vidrio ámbar el cual se mantuvo a temperatura ambiente durante siete días con agitación manual frecuente. Luego, el extracto fue filtrado empleando una gasa y papel filtro de celulosa 20 µm; posteriormente, el solvente se evaporó bajo presión reducida en un rotaevaporador® (Buchi- R-100) a 40 °C y 60 rpm 15 , 16. El extracto seco se almacenó en refrigeración entre 2 a 8 ºC hasta su uso.
Prueba de solubilidad
Se colocó 20 mg del extracto etanólico estabilizado de Solanum hispidum Pers y se agregó 1 mL de cada uno de los siguientes solventes: agua destilada, etanol, metanol, acetato de etilo, cloroformo, éter dietílico y n-hexano. Luego se agitó cada tubo y se procedió a observar los resultados por un máximo de 10 min 17.
Análisis fitoquímico
Para determinar la presencia o ausencia de los principales metabolitos secundarios se realizaron las pruebas cualitativas de coloración y precipitación mediante los métodos químicos estándar descritos por Lock 18.
Microorganismos
Se emplearon cepas de Candida albicans ATCC 10231, Trichophyton mentagrophytes ATCC 9533 y Aspergillus brasilensis ATCC 16404 provistos por el Cepario del Laboratorio de Microbiología y Biológicos del Instituto Nacional de Salud.
Las cepas de T. mentagrophytes y A. brasilensis fueron cultivados en agar dextrosa Sabouraud (ADS) durante 7 y 10 días, respectivamente. C. albicans se incubó en caldo dextrosa Sabouraud por 48 h, la temperatura de incubación fue 20 a 25 ºC. Las cepas se suspendieron y ajustaron con un espectofotómetro hasta lograr una concentración de 1 x 106 UFC/mL para C. albicans y 1 x 105 UFC/mL para T. mentagrophytes y A. brasiliensis, respectivamente 19.
Actividad antifúngica in vitro
La actividad antifúngica del extracto etanólico de las hojas de Solanum hispidum Pers se realizó utilizando el método de difusión en pozos de agar 19.
Se inoculó en 20 mL de agar dextrosa Sabouraud (ADS) 1 mL de la suspensión fúngica (0,5 x 105 UFC/mL para C. albicans y 0,5 x 104 UFC/mL para T. mentagrophytes y A. brasiliensis). Se mezcló uniformemente y se vertió homogéneamente en placas Petri, luego cuando la superficie se solidificó se perforó pozos de 11 mm de diámetro con un perforador de acero inoxidable estéril; se agregó 100 µL del extracto etanólico (25 mg/mL) a cada un pozo 19. Posteriormente, las placas se incubaron a 37 °C por 24 h para C. albicans, 72 h para A. brasiliensis y siete días para T. mentagrophytes; como control negativo se empleó dimetilsulfóxido (DMSO) y agua destilada 20 , 21.
Al finalizar el tiempo de incubación, se evaluó la actividad antifúngica midiendo el diámetro de la zona de inhibición en mm. La actividad antifúngica del extracto fue evaluada comparando las zonas de inhibición con antifúngicos estándar para cada microorganismo (nistatina a 0,2 mg/mL ketoconazol a 0,2 mg/mL y fluconazol a 0,2 mg/mL) 19. Se realizaron ocho réplicas por cada cepa.
Determinación de la concentración mínima inhibitoria (CMI)
Para la determinación de la concentración mínima inhibitoria (CMI) se utilizó el método de microdilución colorimétrico en microplaca siguiendo los protocolos del Instituto de Estándares Clínicos y de Laboratorio (CLSI) 22 , 23 modificado por Liu 24 y Fernández 20.
Se obtuvieron suspensiones en RPMI 1640 (Sigma-Aldrich) con resazurina para cada cepa: rangos de 0,5 - 2,5 x 103 UFC/mL para C. albicans y rangos de 0,6 a 3 x 104 UFC/mL para A. brasiliensis y T. mentagrophytes. Además, se prepararon diluciones seriadas del extracto etanólico de las hojas de Solanum hispidum Pers en medio RPMI 1640 (sigma-Aldrich) con resazurina, las concentraciones evaluadas estuvieron en rangos de 3,91 a 2000 µg/mL. Cada ensayo fue realizado por triplicado para cada cepa. Las placas se incubaron aeróbicamente a 37 ºC por 24 h para C. albicans, cinco días para A. brasiliensis y siete días para T. mentagrophytes. Culminado el tiempo de incubación se realizó la evaluación visual, cuando existe inhibición de la actividad biológica se reduce marcadamente el color original 24.
En todos los ensayos se emplearon como controles positivos los antifúngicos ketoconazol y fluconazol en medio RPMI 22 , 23 con resazurina 0,05 mg/mL y controles de esterilidad que contenían el medio de cultivo con resazurina 0,05 mg/mL sin el microorganismo 21.
Para la interpretación de la actividad antifúngica se empleó los criterios cualitativos descritos por Holets et al. (2002) 25, es decir: CMI < 100 µg/Ml (buena), 100 a < 500 µg/mL (moderada), 500 a 1000 µg/mL (débil).
Análisis estadístico
Los datos obtenidos fueron analizados a través del software de MINITAB 19. Se realizó análisis estadístico descriptivo de las variables.
Aspectos éticos
Este proyecto fue aprobado por el Comité institucional de ética en investigación del Instituto Nacional de Salud (CIEI -INS), RD N.º 533-2019 OGITT/INS. Se utilizó cepas de la (ATCC) mantenidas en el Laboratorio de Microbiología y Biológicos del Instituto Nacional de Salud a -70 ºC. En este estudio no se involucraron pacientes.
RESULTADOS
Prueba de solubilidad
Las pruebas de solubilidad describen los resultados en la Tabla 1, en la cual se evidencia que el extracto etanólico estabilizado de las hojas de Solanum hispidum Pers resultó poco soluble (+) en el solvente n-hexano; soluble (++) en agua destilada, acetato de etilo, cloroformo, éter dietílico; muy solube (+++) en solventes alcohólicos como el etanol y metanol. La disminución de la solubilidad fue directamente proporcional al índice de polaridad del solvente de prueba.
Tabla 1 Solubilidad del extracto etanólico estabilizado de Solanum hispidum Pers.
| Solvente | Índice de polaridad | Resultado |
| Agua destilada | 9,0 | ++ |
| Etanol | 5,2 | +++ |
| Metanol | 5,1 | +++ |
| Acetato de etilo | 4,4 | ++ |
| Cloroformo | 4,1 | ++ |
| Éter dietílico | 2,8 | ++ |
| n-hexano | 0,0 | + |
-: Insoluble; +: poco soluble; ++: soluble; +++: muy soluble
Análisis fitoquímico preliminar
El extracto etanólico obtenido a partir de hojas de Solanum hispidum Pers presentó una variedad de metabolitos secundarios; se logró identificar compuestos fenólicos, taninos, flavonoides, esteroides, alcaloides y saponinas (Tabla 2).
Tabla 2 Metabolitos secundarios identificados en el extracto etanólico de Solanum hispidum Pers.
| Metabolito | Test | Resultado |
|---|---|---|
| Compuestos fenólicos | Tricloruro férrico | + |
| Taninos | Gelatina - NaCl | + |
| Flavonoides | Shinoda | + |
| Pews | + | |
| Hidróxido de sodio | + | |
| Esteroides | Ácido Tricloroacético | + |
| Liebermann-Burchard | + | |
| Rosenthaler | + | |
| Salkowski | + | |
| Alcaloides | Draggendorf | + |
| Mayer | + | |
| Bouchardat | + | |
| Sonneschein | + | |
| Saponinas | Espuma | + |
| Cumarinas | Hidroxilamina | - |
| Naftoquinonas | Bornträger | - |
| Antraquinonas | Bornträger | - |
| Glucósidos cardiotónicos | Kedde | - |
| Sesquiterpenlactonas | Bajlet | - |
| Leucoantocianinas | Rosenheim | - |
- : ausencia del metabolito, +: presencia del metabolito
Las cumarinas, naftoquinonas, antraquinonas, glucósidos cardiotónicos, sesquiterpenlactonas y leucoantocianinas no se encontraron en el extracto etanólico.
Actividad antifúngica in vitro
Se evaluó la actividad antifúngica in vitro mediante el método de difusión en cultivo de agar frente a microorganismos Candida albicans ATCC 10231, Aspergillus brasiliensis ATCC 16404 y Trichophyton mentagrophytes ATCC 9533 y se demostró la actividad a través de los halos de inhibición. (Figura 2).
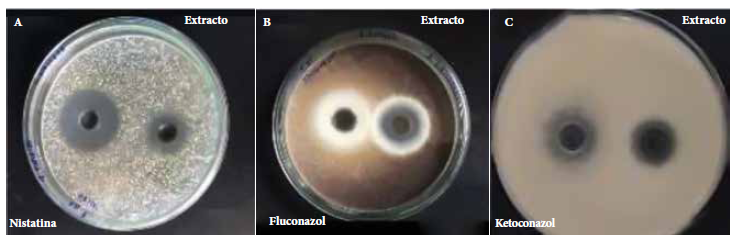
Figura 2 Experimento representativo que muestra la comparación de los halos de inhibición de cada microorganismo: A) Candida albicans ATCC 10231, B) Aspergillus brasiliensis ATCC 16404 y C) Trichophyton mentagrophytes ATCC 9533 frente al extracto etanólico de las hojas de Solanum hispidum Pers y los antifúngicos estándar (controles positivos)
La Tabla 3, presenta los resultados de la actividad antifúngica de las hojas Solanum hispidum Pers. El ensayo demostró que para C. albicans el halo de inhibición fue de 26 mm (± 0,38), para A. brasiliensis se obtuvo un halo de 23 mm (± 0,53) y T. mentagrophytes reveló un halo de inhibición de 25 mm (± 1,31). De todos ellos, el extracto etanólico de las hojas de Solanum hispidum Pers presentó mayor actividad para C. albicans, sin embargo, su control positivo (nistatina) presentó un halo mayor (30 mm) en comparación al extracto etanólico.
Tabla 3 Actividad antifúngica del extracto etanólico de las hojas de Solanum hispidum Pers frente a los microorganismos.
| Microorganismo | Extracto etanólico (mg/mL) | Diámetro del halo de inhibición mm ±DS |
|---|---|---|
| Candida albicans ATCC 10231 | 25 mg/mL Nistatina (2mg/mL) | 26 ± 0,38 30 ± 0,38 |
| Aspergillus brasiliensis ATCC 16404 | 25 mg/mL Fluconazol (2mg/mL) | 23 ± 0,53 15 ± 0,53 |
| Trichophyton mentagrophytes ATCC 9533 | 25 mg/mL Ketonazol (2mg/mL) | 25 ± 1,31 24 ± 0,76 |
DS: desviación estándar
Determinación de la concentración mínima inhibitoria (CMI)
Posterior a la demostración de actividad antifúngica, se realizó la CMI. Los resultados muestran que la concentración más baja del extracto etanólico de las hojas de Solanum hispidum Pers que inhibe completamente el crecimiento para C. albicans fue de 125 µg/mL; para A. brasiliensis fue de 250 µg/mL y para T. mentagrophytes fue de 125 µg/mL; en base al criterio de actividad antifúngica, todas ellas demostraron actividad moderada (Tabla 4).
Tabla 4 Valores de la concentración mínima inhibitoria (CMI) (µg/mL) del extracto etanólico de las hojas de Solanum hispidum Pers frente a los microorganismos.
| Microorganismo | Concentración mínima inhibitoria (µg/mL) | Criterio de actividad antifúngica |
|---|---|---|
| Candida albicans ATCC 10231 | 125 | Moderada |
| Aspergillus brasiliensis ATCC 16404 | 250 | Moderada |
| Trichophyton mentagrophytes ATCC 9533 | 125 | Moderada |
DISCUSIÓN
El presente estudio determinó que el extracto etanólico estabilizado de las hojas de Solanum hispidum Pers presenta una mayor solubilidad frente a etanol y metanol, es decir, con tendencia a solventes polares, ambos son usados ampliamente; sin embargo, en este estudio se continuó con etanol debido a la disponibilidad, considerando, además, que la mayoría de metabolitos con actividad antifúngica poseen polaridad intermedia y pueden concentrarse fácilmente en este tipo de solventes 26. Nuestros resultados son concordantes con otros estudios realizados en extractos crudos 24.
Los análisis cualitativos fueron desarrollados para detectar los metabolitos presentes en el extracto etanólico de las hojas de Solanum hispidum Pers, los resultaron evidenciaron la presencia de múltiples metabolitos como compuestos fenólicos, taninos, flavonoides, esteroides, alcaloides y saponinas; además, para asegurar su presencia inequívoca se usaron cuatro pruebas diferentes para alcaloides y cuatro pruebas diferenciales para esteroides con respecto a los triterpenoides 18, demostrando así la confiabilidad de los resultados.
En este sentido, se ha reportado que el género Solanum presenta abundancia de alcaloides y esteroides tal es el caso se Solanum chrysotrichum 6 , 7 , Solanum xanthocarpum 27 , Solanum nigrum 11 , Solanum surattense 28 y Solanum quitoense 29. Retamozo 14 ) logró identificar glicoalcaloides esteroidales a través de pruebas cualicuantitativas en la misma especie Solanum hispidum Pers; además, analizó el contenido en hojas y frutos, demostrando un mayor contenido en el fruto a comparación de las hojas; también se explica que la variabilidad del contenido está influenciada por diferentes factores como estado vegetativo, época de colecta, procedencia, etc. Por lo tanto, se confirma la presencia de alcaloides y esteroides como componentes del extracto de las hojas de Solanum hispidum Pers.
Se empleó la concentración del extracto a 25 mg/mL en DMSO, en base a estudios previos de tamizaje de extractos etanólicos de plantas peruanas con actividad antifúngica; Rojas et al. 19 y Quiroz 21 ) obtuvieron resultados favorables utilizando esa concentración en 24 y 8 plantas medicinales, respectivamente,
Respecto a la actividad antifúngica, el extracto etanolico de las hojas Solanum hispidum Pers mostró un efecto inhibitorio sobre el crecimiento de C. albicans, A. brasiliensis y T. mentagrophytes con zonas de inhibición entre 23 a 26 mm. En este sentido, Rojas et al. ( 19 mencionaron que la actividad antifúngica con halos de inhibición superiores a 18 mm, utilizando el método de difusión en pozo de agar, es un indicador del buen desempeño como potencial agente terapéutico.
La investigación realizada por Das et al. 8 demostró halos de 18 mm contra el patógeno C. albicans empleando Solanum melongena; por su parte Shubha et al. 27 ), reportaron halos de 12 mm empleando extracto de Solanum xantocarpum; ambas especies pertenecen de la familia Solanaceae. En estudios previos, las especies Solanum nigrum y Solanum Xanthocarpum también demostraron actividad frente a C. albicans mediante el método de difusión en disco 26. Además, un estudio de tamizaje de plantas peruanas reveló que una especie de la familia Solanaceae demostró mayor actividad, evidenciando zonas de inhibición de 19 mm con el método de difusión en pozo de agar 19. Los resultados de esta investigación evidencian halos superiores de inhibición (≥ 23 mm) en comparación a los estudios frente a otras especies del género Solanum (8, 19, 26, 27).
Así también, el presente estudio demostró una actividad antifúngica moderada para C. albicans con valores de 125 µg/mL, estos valores son menores a lo reportado en la especie de Solanum mammosum con valores de 256 µg/mL 30. También se ha reportado actividad antifúngica frente a otras especies fúngicas como Aspergillus sp; como Solanum xantocarpum contra A. niger 10, mostrando actividad antifúngica con CMI de 250 µg/mL, estos valores también han sido hallados en nuestro estudio (250 µg/mL) frente a A. brasiliensis. Para el caso de Trichophyton mentagrophytes se evidenció la CMI de 125 µg/mL, resultados similares se reportaron con Solanum mammosum con valores de 256 µg/mL 30 para T. mentagrofphytes.
Muchas especies de la familia Solanaceae como Solanum chrysotrichum 6 , 7 , Solanum melogena 8, Solanum nigrum 11, Solanum xanthocarpum 23 y Solanum mammosum 30 también demostraron actividad antifúngica, es posible que esta se deba a la presencia de saponinas, alcaloides, esteroides y/o flavonoides, los cuales pueden actuar de manera individual o sinérgica por un mecanismo de acción aún desconocido.
Tanto los esteroides como los alcaloides presentan alta actividad biológica y son un grupo de compuestos cíclicos que han sido estudiados debido a sus efectos antimicrobianos, esto ha sido reafirmado a través del aislamiento de compuestos bioactivos con potente actividad antifúngica in vitro 30.
Una de las limitaciones de nuestro estudio es que se utilizó exclusivamente las hojas y no los frutos, que también son usados en las zonas aledañas donde se recolectaron los especímenes. Esto se debe a que no son renovables y se prefirió no afectar su crecimiento natural y habitual; no obstante, se plantea en una siguiente etapa complementar con el fraccionamiento y la caracterización de los compuestos bioactivos de estos frutos, complementando así el estudio.
El presente estudio in vitro presenta un análisis fitoquímico preliminar del extracto de Solanum hispidum Pers., durante el cual se logró identificar los metabolitos secundarios principales, información no conocida previamente, además se demostró la actividad moderada antifúngica in vitro del extracto etanólico de las hojas de Solanum hispidum Pers.











 text in
text in