INTRODUCCIÓN
La diabetes mellitus es una enfermedad crónica que afecta a una gran cantidad de personas en todo el mundo, y su impacto en la salud pública es significativo 1,2. Ante esta situación, se busca encontrar soluciones accesibles y efectivas que contribuyan a optimizar la calidad de vida de las personas afectadas. En este entorno, algunos cultivos domesticados y compartidos a lo largo del continente sudamericano, han surgido como una fuente prometedora de componentes bioactivos con posibles efectos hipoglucemiantes 3-5, lo que crea oportunidades a futuro para el desarrollo de estrategias de salud que incluyan estos cultivos en la dieta de la población. A pesar de haber encontrado revisiones sistemáticas y ensayos clínicos relacionados al efecto hipoglucemiante de ciertos cultivos andinos, la realización de una revisión de alcance sigue siendo relevante, debido a que la evidencia científica en esta área está en constante evolución, por lo que nuevos estudios podrían haberse publicado desde la última revisión, proporcionando resultados más actualizados y recientes acerca de la eficacia de estos cultivos en el control de la glucosa en sangre.
Asimismo, la presente revisión de alcance no solo incorpora estudios específicos sobre el tema, sino que también incluye información de calidad de diversas fuentes, como revistas especializadas, bases de datos de alto impacto y documentos científicos. Este enfoque más amplio permite identificar la evidencia existente de la literatura científica y los posibles vacíos en el conocimiento actual. Por lo tanto, esto podría inspirar a nuevos investigadores a llevar a cabo estudios y ensayos clínicos enfocados en los cultivos andinos y sus efectos favorables sobre la glucemia, lo que, en última instancia, enriquecería la comprensión actual sobre lo que ya se sabe.
Esta revisión se efectuó para explorar y sintetizar la evidencia existente en la literatura científica sobre el efecto hipoglucemiante de los cultivos andinos y sus componentes bioactivos. Se planteó la siguiente pregunta de investigación: ¿Cuál es la extensión de la evidencia disponible y cuáles son las conclusiones que se pueden obtener de los cultivos andinos con efecto hipoglucemiante y sus componentes bioactivos?.
MATERIALES Y MÉTODOS
Esta revisión se notificó según los elementos de informes preferidos para revisiones sistemáticas y extensión de los metaanálisis para revisiones de alcance (PRISMA-ScR, por sus siglas en inglés) 6.
Criterios de elegibilidad
Esta revisión incluyó todo tipo de estudios primarios disponibles al momento de la búsqueda que hayan evaluado el efecto hipoglucemiante de los cultivos andinos domesticados y/o compartidos a lo largo del continente sudamericano. Fueron excluidos los estudios secundarios en la síntesis de la evidencia, pero fueron usados para identificar información y comparar los resultados.
Cultivos andinos
Se definen como cultivos andinos, a aquellos cultivos alimenticios que según sus características botánicas pueden clasificarse en tubérculos, raíces, granos y frutales 7. Respecto a la cordillera de los Andes, esta se conforma por cadenas montañosas que se localizan en la costa occidental de Sudamérica y comparte el territorio con siete países a lo largo de su extensión, estos incluyen a: Argentina, Bolivia, Chile, Colombia, Ecuador, Perú y Venezuela 8. En base a ello y en función a estudios preliminares in vitro9-19, en esta revisión de alcance se consideró 10 cultivos andinos, a fin de explorar y sintetizar la evidencia disponible sobre su efecto hipoglucemiante, además de sus componentes bioactivos (Tabla 1).
Tabla 1 Cultivos andinos incluidos en la revisión.
| N.º | Cultivo | Tipo | Nombre científico | Familia botánica |
|---|---|---|---|---|
| 1 | Cañihua 7 | Granos | Chenopodium pallidicaule | Quenopodiácea |
| 2 | Kiwicha 7 | Granos | Amaranthus caudatus | Amarantácea |
| 3 | Maca 7 | Raíces | Lepidium meyenii | Crucífera |
| 4 | Quinua 7 | Granos | Chenopodium quinoa | Quenopodiácea |
| 5 | Yacón 7 | Raíces | Smallanthus sonchifolius | Asterácea |
| 6 | Tarwi 7 | Leguminosas | Lupinus mutabilis | Fabácea |
| 7 | Aguaymanto 7 | Frutales | Physalis peruviana | Solanácea |
| 8 | Maíz morado 54 | Granos | Zea mays L. | Poacea |
| 9 | Papa 7 | Tubérculo | Solanum tuberosum | Solanácea |
| 10 | Lúcuma 7 | Frutales | Pouteria lucuma | Sapotácea |
Fuentes de información
La búsqueda se realizó en tres bases de datos (Scopus, PubMed y Web of Science) desde el 10 hasta el 24 de junio de 2023. No hubo restricciones de año, idioma o estado de publicación.
Búsqueda
La estrategia de búsqueda incluyó lenguaje controlado y no controlado según la estrategia PICO 20 (Tabla suplementaria 1). La estrategia de búsqueda completa esta disponible en la tabla suplementaria 2.
Selección de estudios
Se importó los estudios encontrados al gestor de referencia Zotero (v.6.0.26) para la eliminación de los registros duplicados, luego se exportaron al software Rayyan 21 para su revisión; cuando no se encontró la versión completa de un artículo, se contactó al autor corresponsal a través de correo electrónico. La revisión por título y resumen estuvo a cargo de dos revisores y se realizó por separado (DDN y BRT). Estos mismos revisores examinaron los estudios seleccionados por texto completo y justificaron la razón de cualquier exclusión. Los desacuerdos sobre la selección de los estudios se resolvieron por consenso.
Proceso de extracción de datos
Dos revisores (DDN y BRT) extrajeron por separado los datos con la ayuda de un formulario de extracción de datos estandarizado que se probó anteriormente. Cuando se necesitó algún dato adicional, se contactó con el autor corresponsal por correo electrónico. Cualquier desacuerdo se resolvió por consenso.
Ítems de datos
Se extrajeron los siguientes datos: primer autor, año de publicación, país, tipo de estudio, diseño, cultivo andino evaluado, concentración/dosis, indicador estimado, grupos comparados, tamaño del efecto, componente bioactivo y valor de p. En los estudios in vitro se cambió grupos comparados por concentración experimental y tamaño del efecto por respuesta inhibitoria efectiva. Los demás datos y versión completa del formulario están disponibles en las tablas suplementarias (3, 4 y 5).
RESULTADOS
Selección de estudios
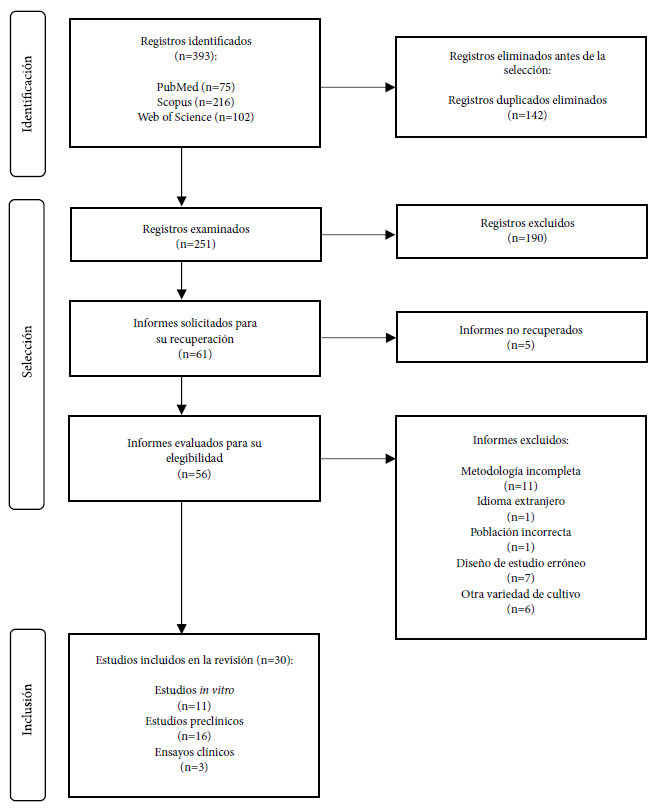
De los estudios encontrados (n=393) se eliminó a los registros duplicados (n=142), del restante se excluyó otros al ser revisados por título y resumen (n=190). La cantidad sobrante fue revisada por texto completo (n=61), pero no todos se recuperaron (n=5) y otros fueron eliminados por presentar una metodología incompleta (n=11), idioma extranjero no disponible en inglés (n=1), población incorrecta (n=1), diseño del estudio erróneo (n=7) y otra variedad de cultivo (n=6). Finalmente, fueron incluidos 30 estudios en esta revisión (Figura 1).
Características de los estudios
Las principales características de los estudios incluidos son mostradas en la tabla 2. Respecto a la columna cultivo andino evaluado y concentración/dosis, solo se consideró a aquellos cultivos escogidos en esta revisión y que mostraron el mejor efecto hipoglucémico, esto también se aplicó a la concentración/dosis. Sin embargo, las características completas y adicionales se describen en las tablas suplementarias (3, 4 y 5). Conforme a los 30 estudios revisados, se identificaron 11 estudios in vitro9-19, 16 estudios preclínicos 22-37) y tres ensayos clínicos 38-40.
Tabla 2 Características de los estudios incluidos.
| N.º | Primer autor | Año | País | Tipo de estudio | Diseño | Cultivo andino evaluado | Concentración / dosis |
|---|---|---|---|---|---|---|---|
| 1 | Zambrana 22 | 2018 | Bolivia | Preclínico | EPEC a | Amaranthus caudatus | 1000 mg/kg/pc |
| 2 | Girija 23 | 2011 | India | Preclínico | EPECFA b | Amaranthus caudatus | 400 mg/kg/pc |
| 3 | Strugala 24 | 2019 | Polonia | Preclínico | EPEC a | Solanum tuberosum | 165 mg/kg/pc |
| 4 | Asokan 25 | 2019 | Vietnam | Preclínico | EPECFAA c | Solanum tuberosum | 50 mg/kg/pc |
| 5 | Widowati 9 | 2021 | Indonesia | In vitro | EIEIV d | Smallanthus sonchifolius | 6,25-200 μg/ml |
| 6 | Herowati 26 | 2018 | Indonesia | Preclínico | EPECFA b | Smallanthus sonchifolius | 150 mg/kg/pc |
| 7 | Singh 27 | 2005 | India | Preclínico | EPEC a | Solanum tuberosum | 10 % p/p i |
| 8 | Dionisio 28 | 2015 | Brasil | Preclínico | EPEC a | Smallanthus sonchifolius y Anacardium occidentale L. | 100 mg/kg/pc |
| 9 | Fuentealba 10 | 2016 | Chile | In vitro | EIEIV d | Pouteria lucuma | 40 μg (FH j)/2 mg (FL k) |
| 10 | Fornasini 38 | 2019 | Ecuador | Ensayo clínico | ECCC e | Lupinus mutabilis | 10 y 20 g |
| 11 | Pinto 11 | 2009 | Brasil | In vitro | EIEIV d | Pouteria lucuma | 50 mg/ml |
| 12 | Russo 12 | 2015 | Italia | In vitro | EIEIV d | Smallanthus sonchifolius | 0-8 mg/ml |
| 13 | Ranilla 13 | 2009 | Brasil | In vitro | EIEIV d | Zea mays L. | 5 mg |
| 14 | Valderrama 29 | 2022 | Colombia | Preclínico | EPECFAA c | Physalis peruviana | 100 mg/kg/pc |
| 15 | Gopika 30 | 2021 | India | Preclínico | EPECFA b | Chenopodium quinoa | 250 mg/kg/pc |
| 16 | Genta 31 | 2010 | Argentina | Preclínico | EPECA f | Smallanthus sonchifolius | 10 mg/kg/pc |
| 17 | Baldeón 39 | 2012 | Ecuador | Ensayo clínico | ECAFII g | Lupinus mutabilis | 2,5 mg/kg/pc |
| 18 | Fornasini 40 | 2012 | Ecuador | Ensayo clínico | ECAFIICP h | Lupinus mutabilis | 3,1 mg/kg/pc |
| 19 | Vargas 32 | 2020 | Perú | Preclínico | EPECFAA c | Smallanthus sonchifolius | 140 mg/kg/pc |
| 20 | Park 33 | 2009 | Corea del sur | Preclínico | EPEC a | Smallanthus sonchifolius | 200 y 10 mg/kg/pc |
| 21 | Oliveira 34 | 2013 | Brasil | Preclínico | EPECA f | Smallanthus sonchifolius | 760 mg/kg/pc |
| 22 | Kalita (14 | 2018 | EE. UU. | In vitro | EIEIV d | Solanum tuberosum | 10-200 μg/ml |
| 23 | Coronado 15 | 2021 | Perú | In vitro | EIEIV d | Chenopodium quinoa y Chenopodium pallidicaule | 50-500 μg/ml |
| 24 | Zambrana 35 | 2018 | Bolivia | Preclínico | EPEC a | Lupinus mutabilis | 1000 mg/kg/pc |
| 25 | Chirinos 16 | 2020 | Perú | In vitro | EIEIV d | Lupinus mutabilis | 1-6 mg proteína/ml |
| 26 | Ranilla 17 | 2010 | Chile | In vitro | EIEIV d | Lepidium meyenii | 2,5 mg |
| 27 | Ezzat 36 | 2021 | Egipto | Preclínico | EPECFA b | Physalis peruviana | 100 mg/kg/pc |
| 28 | Tan 18 | 2020 | China | In vitro | EIEIV d | Chenopodium quinoa | No especificado |
| 29 | Zhang 19 | 2019 | EE. UU. | In vitro | EIEIV d | Zea mays L. | 0,05-1,0 mg/ml |
| 30 | Dos Santos 37 | 2017 | Brasil | Preclínico | EPECA f | Smallanthus sonchifolius | 100 mg/kg/pc |
pc: peso corporal.
a EPEC: estudio preclínico experimental controlado; b EPECFA: estudio preclínico experimental controlado con fármaco antidiabético; c EPECFAA: estudio preclínico experimental controlado con fármaco antidiabético y aleatorizado; d EIEIV: estudio de inhibición enzimática in vitro; f EPECA: estudio preclínico experimental controlado y aleatorizado; g ECAFII: ensayo clínico aleatorizado de fase II; h ECAFIICP: ensayo clínico aleatorizado de fase II controlado con placebo.
Resultados individuales de los estudios
En las tablas 3, 4 y 5 se presentan los resultados para cada fuente de evidencia incluida, en relación con los cultivos andinos que mostraron tener efecto hipoglucemiante y sus componentes bioactivos. El efecto analizado fue calculado a través del cambio del indicador en los estudios longitudinales y la diferencia de medias en los estudios transversales. En los estudios in vitro no fueron presentados los grupos comparados, ni tampoco el efecto analizado, sino que fueron cambiados por concentración experimental y respuesta inhibitoria efectiva, respectivamente.
Tabla 3 Evidencia sobre cultivos andinos con efecto hipoglucemiante y sus componentes bioactivos en estudios in vitro.
| N.º | Primer autor | Indicador estimado | Concentración experimental | Respuesta inhibitoria efectiva | Componente bioactivo |
|---|---|---|---|---|---|
| 1 | Widowati 9 | Inhibición enzimática α-amilasa | 6,25-200 μg/ml | IC50 37,86 μg/ml | Flavonoides |
| 2 | Fuentealba 10 | Inhibición enzimática α-glucosidasa | 40 μg (FH)/2 mg (FL) | 95,9 ± 2,8% | No especificado |
| 3 | Pinto 11 | Inhibición enzimática α-glucosidasa | 50 mg/ml | 80% | Fenoles desconocidos |
| 4 | Russo 12 | Inhibición enzimática α-amilasa | 0-8 mg/ml | IC50 0,26 ± 0,02 mg/ml | 4,5-di-O-CQA a y 3,5-di-O-CQA b |
| 5 | Ranilla 13 | Inhibición enzimática α-glucosidasa | 5 mg | 51% | Fenoles |
| 6 | Kalita 14 | Inhibición enzimática α-amilasa | 10-200 μg/ml | IC50 25,52 ± 0,79 μg/ml | Fenoles y antocianinas |
| 7 | Coronado 15 | Inhibición enzimática α-amilasa | 50-500 μg/ml | IC50 8,30 ± 0,27 mg/ml | Ácido gálico y clorogénico |
| 8 | Chirinos 16 | Inhibición enzimática DPP-IV | 1-6 mg proteína/ml | IC50 2,13 ± 0,02 mg proteína/ml | Hidrolizados proteicos |
| 9 | Ranilla 17 | Inhibición enzimática α-glucosidasa | 2,5 mg | 34,7% | Ácido gálico |
| 10 | Tan 18 | Inhibición enzimática α-glucosidasa | No especificado | IC50 48,67 ± 0,65 mg/ml | Polisacáridos |
| 11 | Zhang 19 | Inhibición enzimática DPP-IV | 0,05-1,0 mg/ml | IC50 65,5 μg/ml | Quercetina, luteolina y rutina |
DPP-IV: dipeptidil peptidasa-IV; FH: fracción hidrofílica; FL: fracción lipofílica; IC50: concentración inhibitoria del 50%.
a 4,5-di-O-CQA: ácido 4,5-di-O-cafeilquínico; b 3,5-di-O-CQA: ácido 3,5-di-O-cafeilquínico.
Tabla 4 Evidencia sobre cultivos andinos con efecto hipoglucemiante y sus componentes bioactivos en estudios preclínicos.
| N.º | Primer autor | Indicador estimado | Grupos comparados | Efecto analizado | Componente bioactivo | Valor de p |
|---|---|---|---|---|---|---|
| 1 | Zambrana 22 | Glucosa en ayunas | Control (+): 9,5 mmol/L Tratamiento (+): 8 mmol/L | -1,5 mmol/L (15,8%) | Polifenoles | < 0,01 |
| 2 | Girija 23 | Glucosa en sangre | Tratamiento (Pre) (+): 350 mg/dl Tratamiento (Pos) (+): 156,6 mg/dl | -193,4 mg/dl (55,2%) | Flavonoides | < 0,01 |
| 3 | Strugala 24 | Hemoglobina glicosilada | Control (+): 8,6% Tratamiento (+): 7,9% | -0,7% (8,1%) | Antocianinas | < 0,01 |
| 4 | Asokan 25 | Glucosa en sangre | Control (+): 436 mg/dl Tratamiento (+): 74 mg/dl | -362 mg/dl (83%) | HPPA a y DIKTNKPVIF b | < 0,001 |
| 5 | Herowati 26 | Glucosa en sangre | Control (+): 215,64 ± 7,19 mg/dl Tratamiento (+): 182,36 ± 1,98 mg/dl | -33,28 mg/dl (15,4%) | Flavonoides y polifenoles | < 0,05 |
| 6 | Singh 27 | Glucosa en plasma | Control (+): 320 mg/dl Tratamiento (+): 213 mg/dl | -107 mg/dl (33,4%) | Fibra dietética y polifenoles | < 0,05 |
| 7 | Dionisio 28 | Glucosa en plasma | Control (+): 414 mg/dl Tratamiento (+): 220 mg/dl | -194 mg/dl (46,9%) | Fenoles y FOS c | < 0,05 |
| 8 | Valderrama 29 | Glucosa en sangre | Control (+): 429 mg/dl Tratamiento (+): 290 mg/dl | -139 mg/dl (32,4%) | Flavonoide rutina | < 0,001 |
| 9 | Gopika 30 | Glucosa en sangre | Tratamiento (Pre) (+): 380 ± 86,87 mg/dl Tratamiento (Pos) (+): 126,66 ± 28,12 mg/dl | -253.34 mg/dl (66,6%) | No especificado | - |
| 10 | Genta 31 | Glucosa en sangre | Tratamiento (Pre) (+): 366 mg/dl Tratamiento (Pos) (+): 148 mg/dl | -218 mg/dl (59,5%) | Compuestos fenólicos | - |
| 11 | Vargas 32 | Glucemia | Tratamiento (Pre) (+): 398 mg/dl Tratamiento (Pos) (+): 116,5 mg/dl | -281,5 mg/dl (70,7%) | Polifenoles | 0,002 |
| 12 | Park 33 | Glucosa en plasma en ayunas | Control (+): 318 mg/dl Tratamiento (+): 271 mg/dl | -47 mg/dl (14,8%) | Ácido clorogénico | < 0,05 |
| 13 | Oliveira 34 | Glucemia | Control (+): 373,51 ± 45,05 mg/dl Tratamiento (+): 230,22 ± 18,80 mg/dl | -143,29 mg/dl (38,4%) | Fructanos | < 0,05 |
| 14 | Zambrana 35 | Glucosa en ayunas | Control (+): 10 mmol/L Tratamiento (+): 8 mmol/L | -2 mmol/L (20%) | Alcaloides | < 0,001 |
| 15 | Ezzat 36 | Glucosa en suero | Control (+): 388 mg/dl Tratamiento (+): 147 mg/dl | -241 mg/dl (62,1%) | Ácido gálico | < 0,05 |
| 16 | Dos Santos 37 | Glucemia | Control (+): 300 mg/dl Tratamiento (+): 105 mg/dl | -195 mg/dl (65%) | Ácidos fenólicos y flavonoides | < 0,001 |
(+): animales diabéticos inducidos.
a HPPA: hidrolizado de proteína de papa generado por alcalasa; b DIKTNKPVIF: decapéptido derivado de hidrolizado de proteína de papa generado por alcalasa; c FOS: fructooligosacáridos.
Tabla 5 Evidencia sobre cultivos andinos con efecto hipoglucemiante y sus componentes bioactivos en ensayos clínicos.
| N.º | Primer autor | Indicador estimado | Grupos comparados | Efecto analizado | Componente bioactivo | Valor de p |
|---|---|---|---|---|---|---|
| 1 | Fornasini 38 | Hemoglobina glicosilada | Tratamiento (Pre) (+): 6,5 ± 0,6% Tratamiento (Pos) (+): 6,3 ± 0,7% | -0,2% (3%) | Hidrolizados | <0,050 |
| 2 | Baldeón 39 | Glucosa en sangre | Tratamiento (Pre) (+): 114,4 ± 27,2 mg/dl Tratamiento (Pos) (+): 98,1 ± 21,6 mg/dl | -16,3 mg/dl (14,2%) | Alcaloides | <0,001 |
| 3 | Fornasini 40 | Glucosa en sangre | Tratamiento (Pre) (DG): 114,2 ± 11,6 mg/dl Tratamiento (Pos) (DG): 105,4 ± 5,6 mg/dl | -8,8 mg/dl (7,7%) | Alcaloides | <0,001 |
(+): pacientes diabéticos; (DG): pacientes con desequilibrio glucémico ≥ 100 mg/dl.
Síntesis de los resultados
Durante la revisión, se observó que los estudios incluidos abarcaron un rango de publicación que se extendió desde el 2005 hasta el 2022. Se corroboró que los años con mayor producción científica fueron 2018 14,22,26,35, 2019 19,24,25,38 y 2021 9,15,30,36. En particular, en 2018 y 2019 se reconoció una mayor cantidad de estudios preclínicos (n=3 y n=2, respectivamente), mientras que en 2021 hubo una distribución equitativa entre estudios preclínicos e in vitro (n=2, en ambos estudios). Según los países que llevaron a cabo estos estudios, Brasil (n=5) lideró con la mayor cantidad de investigaciones 11,13,28,34,37, seguido de Perú 15,16,32, India 23,27,30 y Ecuador 38-40 (n=3, para cada país). En relación al tipo de documento, se observó que la gran mayoría de los estudios fueron publicados como artículos (29/30), mientras que solo uno se presentó en formato de documento de conferencia 26.
De acuerdo a los cultivos andinos seleccionados, el más empleado fue Smallanthus sonchifolius o yacón, con un total de nueve menciones 9,12,26,28,31-34,37. En segundo lugar, con un total de 5 reportes se halló Lupinus mutabilis o tarwi 16,35,38-40. En tercer lugar, fue encontrado Solanum tuberosum o papa, con un registro total de cuatro menciones 14,24,25,27. Por último, fue identificado Chenopodium quinoa o quinua, con un total de tres reportes 15,18,30.
Cultivos andinos con efecto hipoglucemiante
Los 30 estudios incluidos evidenciaron efecto hipoglucemiante con los distintos cultivos andinos seleccionados en esta revisión. No obstante, debido a su heterogeneidad, no fue conveniente la presentación de los datos de manera general. Por consiguiente, a fin de mejorar la comprensión de los resultados, la información es expuesta por separado en esta sección y se amplía en detalle en las tablas suplementarias 3, 4 y 5.
En los estudios in vitro, se verificó el efecto hipoglucémico a través de la inhibición enzimática en todos los casos. Las enzimas identificadas fueron α-amilasa, α-glucosidasa y dipeptidil peptidasa IV (DPP-IV), destacándose la α-glucosidasa (5/11) como la más efectiva 10,11,13,17,18. Respecto a los resultados, se presentaron mediante la concentración inhibitoria media (IC50) y el porcentaje de reducción de la actividad enzimática. En cada estudio, fue atribuido el efecto hipoglucemiante a un cultivo andino seleccionado en esta revisión, resaltando como los más empleados Pouteria lucuma10,11, Smallanthus sonchifolius9,12 y Chenopodium quinoa15,18 (2/11, para cada cultivo). Según las concentraciones, un estudio no especificó este dato 18. El resto notificaron este efecto hipoglucémico, mediante el porcentaje de reducción con la concentración más alta 10,11,13,17.
En los estudios preclínicos, se verificó el efecto hipoglucémico a través de pruebas de laboratorio, como la glucosa en ayunas, glucosa en sangre, glucosa en plasma, glucosa en suero, glucemia y hemoglobina glicosilada (A1C), siendo la prueba glucosa en ayunas la que más se utilizó (6/16) 23,25,26,29-31. Gran parte de los estudios preclínicos confirmaron el efecto hipoglucémico por medio de la significancia estadística (p<0,05), esto mediante los grupos comparados y el tamaño del efecto de cada estudio. En cuanto a los grupos comparados, la mayoría indicaron la presencia de un grupo control y experimental (12/16), no obstante, en algunos casos se tuvo un solo grupo en los cuales se efectuó la comparación mediante mediciones antes y después de la intervención 23,30-32. En todos los grupos y medidas comparadas los animales presentaban diabetes inducida. En cuanto a los cultivos andinos, se evidenció la mayor frecuencia con Smallanthus sonchifolius (7/16), dentro de los cuales un informe reportó la combinación de este cultivo andino elegido con Anacardium occidentale L. (anacardo) en la creación de una bebida funcional 28. Finalmente, se observaron efectos hipoglucemiantes en respuesta a diferentes dosis, donde la mayoría informó haber utilizado una dosis única (9/16). En otros casos, se notificaron estos efectos con las dosis más altas (4/16), medias (2/16), y solo un informe mencionó el efecto deseado con la dosis más baja 28.
En cuanto a los ensayos clínicos, las pruebas de laboratorio que se usaron para verificar el efecto hipoglucémico fueron la A1C y glucosa en sangre, siendo esta última la más utilizada (2/3) 39,40. Al igual que en los estudios preclínicos, fue corroborado el efecto hipoglucemiante a través de la significancia estadística con valores de p menores a 0,05. En base a ello, se compararon grupos y se estimó el tamaño del efecto. Es importante señalar que, al comparar los distintos grupos, se informó en uno de ellos la formación de grupos de control específicos para cada población 40. Sin embargo, la evaluación del efecto analizado se llevó a cabo mediante la toma de medidas repetidas en un mismo grupo, tanto antes como después del tratamiento. La mayoría de estos estudios evaluaron a pacientes diabéticos 38,39, mientras que en uno se incluyeron a pacientes con desequilibrio glucémico ≥ 100 mg/dl 40. El cultivo andino seleccionado en todos los ensayos clínicos fue Lupinus mutabilis. De los cuales, en uno de ellos se comunicó el efecto hipoglucemiante a través del uso de dos dosis diferentes: 10 g durante las primeras 14 semanas y 20 g después de las siguientes 14 semanas de intervención 38. El resto de estudios indicaron las dosis usadas en miligramos por kilogramo de peso corporal (mg/kg/pc) con una dosis única 39,40.
Componentes bioactivos de los cultivos andinos
En esta revisión, se han identificado diversos fitoquímicos en los cultivos andinos seleccionados. Entre ellos, se destacan los polifenoles, incluyendo los flavonoides y antocianinas. Asimismo, en uno de los estudios revisados se señaló la presencia de fenoles desconocidos en el cultivo andino analizado. También se encontró hidrolizados, polisacáridos como los fructooligosacáridos (FOS) y fructanos, alcaloides y fibra dietética. Estos fitoquímicos se catalogan como componentes bioactivos, debido a sus efectos favorables para la salud humana y a su capacidad para interactuar con los procesos biológicos del cuerpo 41.
En cuanto a los polifenoles 13,14,22,26-28,31,32,37, se observó también subclases de ácidos fenólicos, como 4,5-di-O-CQA y 3,5-di-O-CQA 12, el ácido clorogénico 15,33 y el ácido gálico 15,17,36. Pese a ello, en uno se detectó fenoles desconocidos 11. Dentro de los polifenoles, se encontró además a los flavonoides 9,19,23,26,29,37 y a las antocianinas 14,24.
De la misma manera, se identificaron hidrolizados, como la proteína de Solanum tuberosum y de su decapeptido derivado 25. Igualmente, se determinaron hidrolizados de Lupinus mutabilis16,38. En cuanto a los polisacáridos 18, se observaron algunos tipos, como FOS 28 y fructanos 34. Por último, se encontró a los alcaloides 35,39,40 y la fibra dietética 27. No obstante, fueron reportados dos estudios en los cuales el componente bioactivo no fue especificado 10,30.
DISCUSIÓN
Esta revisión de alcance identificó 30 estudios primarios que evaluaron el efecto hipoglucemiante de los cultivos andinos seleccionados hasta junio de 2023.
A pesar de haber encontrado revisiones sistemáticas y en algunos casos metanálisis que evaluaron el efecto hipoglucemiante de distintos cultivos andinos en los últimos años, se identificó que estas revisiones se centraron en otros cultivos que no fueron seleccionados en esta revisión. Entre estos se halló Ipomea batatas (camote) en 2021 42, Cuminum cyminum (comino) en 2021 43, Sesamum indicum (sésamo) en 2022 44, y Morus alba (morera) en 2023 45. De igual manera, se encontró una revisión reciente sobre el cultivo Moringa oleifera (moringa) 46, que también fue utilizado como complemento en uno de los estudios seleccionados 32, pero que esta revisión fue publicada justo después de que se completará dicho estudio. Este suceso ejemplifica la continua evolución de nuevas investigaciones en este campo, y existe la posibilidad de que otros estudios relevantes hayan continuado explorando estos temas o hayan proporcionado resultados más actuales sobre la eficacia de los cultivos andinos en el control de la glucemia.
Se encontró que Smallanthus sonchifolius fue el cultivo con la mejor evidencia acerca del efecto hipoglucemiante (9/30), y se describió a las hojas como la parte con mayor utilidad 9,12,26,31,32,37. Además, se observó que el rango de publicación fue del 2009 hasta el 2021. En función al país que abordó más estas investigaciones con el cultivo descrito fue Brasil (3/9) 28,34,37. Con respecto al tipo de estudio, se comprobó que la mayoría fueron preclínicos (7/9) 26,28,31-34,37. En cuanto a sus componentes bioactivos, los polifenoles 26,28,31,32,37) y subclases de ácidos fenólicos 12,33 se observaron en varios estudios, así como también se constató la presencia de flavonoides 9,26,37 y fructanos 28,34.
En segundo lugar, se posicionó Lupinus mutabilis (5/30) y fue el grano entero el que más se usó 16,38-40. El año de publicación comprendió entre 2012 y 2020, observándose una mayor cantidad de producción científica en el 2012 39,40. El país que llevo a cabo estos estudios con mayor constancia fue Ecuador 38-40. En todos estos estudios, se atribuyó este efecto a varios componentes bioactivos presentes en este cultivo, siendo los alcaloides 35,39,40 los más recurrentes, y en menor medida se informaron sobre los hidrolizados 16,38.
El tercer cultivo más popular fue Solanum tuberosum (4/30), y fue el mismo cultivo el que mostró ser más eficaz contra la hiperglucemia 14,24,25. El año de publicación estuvo comprendido desde el 2005 hasta el 2019, siendo este último en el que más estudios se realizó 24,25. En cuanto a los países que llevaron a cabo estos estudios, no se identificó una consistencia o repetición en los mismos. No obstante, el tipo de estudio más habitual fue el preclínico 24,25,27. En cada estudio se asignó las propiedades bioactivas a los distintos componentes identificados, habiendo algunos que estuvieron presentes en varios reportes e incluyeron a las antocianinas 14,24, la fibra dietética y polifenoles 14,27, además de los hidrolizados de proteína 25.
Concerniente con los mecanismos de acción, a través de los cuales se espera que estos cultivos muestren efectos hipoglucemiantes, se ha evidenciado la relación de algunos componentes con este resultado. Por ejemplo, el cultivo andino Smallanthus sonchifolius ha sido objeto de estudio debido a la presencia de FOS, y se propuso una posible explicación para este fenómeno basada en la fermentación de los FOS en el intestino grueso por los lactobacilos. Esta condición provoca la producción de ácidos grasos de cadena corta y gases beneficiosos para la salud. Igualmente, la presencia de FOS y la actividad de los lactobacilos estimulan la producción de unas hormonas intestinales, como el péptido GLP-1, que también contribuye al efecto hipoglucemiante. Estudios in vitro47 como in vivo48,49 utilizando modelos de ratones y cobayos respaldan estos hallazgos.
Además, en otra investigación, se ha informado que los flavonoides y sus subclases que también fueron identificados en los cultivos andinos seleccionados en esta revisión, han demostrado ser eficaces en la reducción de la glucosa, cuyo mecanismo de acción que explicaría este hecho fue que mantienen la supervivencia y la función de las células β pancreáticas mediante mecanismos moleculares que implican la reducción del estrés oxidativo, aumento en la expresión de algunos genes antiapoptóticos, reducción de la expresión de genes proapoptóticos, así como también del daño en el ADN, por lo que, todas estas acciones conjuntas protegen estas células pancreáticas contra la autofagia, apoptosis, necroptosis y el daño celular en situaciones de hiperglucemia 50.
Otro componente bioactivo que se evidenció en varios de los cultivos andinos analizados fueron los polifenoles, y la explicación de su mecanismo fue abordado por un estudio de revisión, donde se encontró que los metabolitos fenólicos derivados de los fenoles, y los ácidos fenólicos, pueden ayudar a disminuir los niveles de especies reactivas de oxígeno (ROS, por sus siglas en inglés), la inflamación, la glicación de proteínas, la inhibición de enzimas clave en el metabolismo de los carbohidratos en la diabetes tipo 2, incrementar la expresión del transportador de glucosa GLUT4 y activar las vías responsables de señalización y secreción de insulina, lo que en conjunto mejora los niveles de glucosa en sangre 51.
Igualmente, se halló un estudio que explicó el mecanismo por el cual los alcaloides ejercen efecto hipoglucémico, de manera especial este informe se enfocó en el alcaloide berberina encontrado en varias plantas, y se apreció que este alcaloide mejora la actividad enzimática de la Hexoquinasa y la Fosfofructoquinasa, lo que significa que estas enzimas funcionan de manera más eficiente para llevar a cabo sus reacciones específicas en el metabolismo de la glucosa 52. Por último, en otro informe 34, se reportaron a los fructanos como compuestos no digeribles capaces de mejorar la condición de hiperglucemia, al modificar la velocidad de absorción de los monosacáridos 53.
Desde otro punto de vista, los resultados encontrados en esta revisión han sido congruentes con otros estudios que analizaron el efecto hipoglucémico de distintos cultivos, entre ellos se reportó al sésamo 44, cuyo efecto favorable fue observado sobre los niveles de glucemia en una revisión sistemática y metanálisis de ensayos clínicos controlados. En otro estudio también se informó 45 sobre este efecto, pero de manera específica sobre los rasgos glucémicos de la hoja de morera, en donde se precisó que estas propiedades antidiabéticas se atribuyeron a algunos fitoquímicos que también fueron reportados en esta revisión, como los polisacáridos en Chenopodium quinoa18, flavonoides en Smallanthus sonchifolius9,26,37 y fenoles en Solanum tuberosum14,27.
Del mismo modo, una revisión sistemática documentó los efectos potenciales encontrados en el camote sobre la hiperglucemia y la dislipidemia en el contexto de la retinopatía diabética 42. Otro estudio detalló la capacidad de la moringa para mejorar el control de la glucosa a fin de prevenir la diabetes y alteraciones metabólicas relacionadas, mediante la revisión exhaustiva de estudios en animales y humanos 46. Por último, se halló una revisión sistemática y metanálisis a partir de ensayos clínicos controlados, que analizaron la efectividad sobre los parámetros glucémicos del comino 43, concluyendo que esta especie herbácea tuvo efectos de mejora sobre la glucosa en sangre en ayunas, hemoglobina A1C, evaluación del modelo homeostático para la función de las células β (HOMA-β, por sus siglas en inglés) y sobre el índice de verificación de sensibilidad a la insulina cuantitativa (QUICKI, por sus siglas en inglés).
Volviendo al análisis de los resultados encontrados en nuestra revisión, solo se identificaron tres ensayos clínicos con distintos tipo de diseño, donde solo dos señalaron haber sido aleatorizados y de fase II 39,40. Por este motivo, los vacíos en el conocimiento actual sobre el tema en cuestión son significativos y podrían afectar la interpretación y generalización de los resultados en función a los ensayos clínicos, debido a su escaso número, limitada cantidad de participantes evaluados, ausencia de fases más avanzadas, comparación con otros tratamientos y la falta de seguimiento a largo plazo.
Basado en lo anterior, es importante destacar que a pesar de que existen revisiones sistemáticas y en algunos casos metanálisis, muy pocos de ellos han analizado los cultivos andinos que fueron seleccionados en esta revisión, pese a haber demostrado efectos hipoglucemiantes en diversos tipos de estudios llevados a cabo. Por consiguiente, estos hallazgos podrían servir de inspiración para nuevos investigadores en el desarrollo de más estudios, a fin de enriquecer la comprensión actual y ofrecer información valiosa que beneficie a la comunidad científica y a las personas que buscan opciones naturales y efectivas para el manejo de la glucosa en sangre.
Conforme a los alentadores hallazgos de la presente revisión, se identificaron algunas soluciones accesibles y efectivas que contribuirían a mejorar la calidad de vida de las personas con diabetes, esto debido a que los cultivos andinos elegidos son una fuente de recursos naturales que se han utilizado tradicionalmente en la región durante años, es decir están ampliamente disponibles para la comunidad local, lo que en un futuro «previa investigación» facilitaría su implementación en la dieta de personas diabéticas. Asimismo, aparte de haber encontrado que los componentes bioactivos presentes en los cultivos andinos fueron responsables del efecto hipoglucemiante, también fueron evidenciados múltiples beneficios para la salud, como propiedades antioxidantes y antiinflamatorias que abrirían nuevas posibilidades para mejorar la salud de estas personas y sus complicaciones relacionadas.
Por último, pero no menos importante, es necesario mencionar algunas perspectivas futuras para el desarrollo de las estrategias en salud vinculadas a este problema, como es el caso del acceso a tratamientos más económicos, diversificación de opciones terapéuticas, potencial reducción de efectos secundarios, estimulación de la investigación, promoción de una alimentación saludable e impulso a la sostenibilidad agrícola.
Existe la posibilidad de que algunos cultivos andinos no hayan sido incluidos en la revisión, pero como se explicó líneas atrás, el criterio de selección fue según la revisión conceptual de la literatura científica, por tanto, se incluyeron los cultivos andinos domesticados y compartidos a lo largo del continente sudamericano más usados en la evaluación de la efectividad hipoglucémica. Además, la heterogeneidad de los estudios revisados complicó la obtención de conclusiones que pudieran aplicarse de manera general, porque no se encontró ciertos datos para algunas variables, debido al diseño y metodología diferente. Otra limitante es la exclusión de otras fuentes de información, como la literatura gris, lo que probablemente haya omitido algunos estudios relevantes para esta revisión. Finalmente, a raíz de que no se valoró críticamente los estudios incluidos, esta cantidad disminuiría al realizar una revisión sistemática.
Esta revisión de alcance sobre la evidencia de cultivos andinos con efecto hipoglucemiante revela resultados alentadores debido a su notoria inhibición in vitro, así como a la significativa reducción de los niveles de glucosa observada en estudios preclínicos y ensayos clínicos. A pesar de haber identificado variedades más efectivas y dosis óptimas, estos cultivos demuestran ser recursos naturales prometedores para el manejo de la glucosa y tratamiento de la diabetes. Los diversos componentes bioactivos hallados, como polifenoles, ácidos fenólicos, hidrolizados, polisacáridos, alcaloides y fibra dietética, han sido asignados a este efecto hipoglucemiante. Sin embargo, para que estos resultados se consideren tratamientos seguros y efectivos, se requieren investigaciones adicionales que profundicen en los mecanismos de acción, comparen su eficacia con tratamientos convencionales y evalúen su seguridad a largo plazo.











 texto en
texto en