Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Horizonte Médico (Lima)
versión impresa ISSN 1727-558X
Horiz. Med. vol.15 no.2 Lima abr./jun. 2015
ORIGINAL BREVE
Perspectiva sobre el perfil microbiológico de las neumonías asociadas a ventilación mecánica en hospitales de alta complejidad en Latinoamérica
Perspective on the microbiological profile of pneumonia associated with mechanical ventilation in high complexity hospitals in Latin America
David Rebellón Sánchez 1, Tania Parra Morales1, Karen Quintero Guerrero 1, Rafael Méndez Fandiño2
1. Escuela de Medicina de la Universidad Pedagógica y Tecnológica de Colombia (UPTC), Semillero de Investigación del Grupo de Análisis de Resistencia Bacteriana de Boyacá (GRAB), Miembro adscrito a la Asociación Científica de estudiantes de Medicina de la UPTC (ACEMED- UPTC), Miembro adscrito a la Asociación de Sociedades Científicas de Estudiantes de Medicina de Colombia (ASCEMCOL).
2. M.D - UPTC. Médico Internista - Universidad del Rosario (Colombia). Maestría en Investigación Clínica - Universidad Miguel Hernández (Valencia-España). Director del GRAB. Coordinador del área de Medicina Interna de la Escuela de Medicina de la UPTC.
RESUMEN
La prevalencia de infección es elevada en hospitales de alta complejidad y es una de las causas más importantes de mortalidad a nivel mundial. Dentro de las infecciones intrahospitalarias más comunes y con una de las tasas de mortalidad más elevadas se encuentra la neumonía asociada a ventilación mecánica (NAVM), infección pulmonar que se desarrolla 48 horas o más después de un proceso de intubación traqueal sin evidencia previa de incubación microbiana del tracto respiratorio. La evidencia actual sugiere que la NAVM se relaciona con un incremento de la mortalidad, una prolongación de la estancia en unidades de cuidados intensivos y mayores costos de hospitalización. El objetivo de este artículo es describir las características patogénicas y los factores de riesgo que impactan en la mortalidad y supervivencia de los pacientes que desarrollan NAVM en hospitales de alta complejidad en Latinoamérica con el fin de facilitar la toma de decisiones por parte del médico tratante al momento de enfrentar esta patología. (Horiz Med 2015; 15(2): 56-65)
Palabras clave: Neumonía, Unidades de Cuidados Intensivos, Ventilación Mecánica, Latinoamérica, Mortalidad, Resistencia a Múltiples Drogas, Fenotipo de Resistencia. (Fuente: DeCS BIREME).
ABSTRACT
The prevalence of infection is higher in hospitals of high complexity and is one of the most important causes of mortality worldwide. Ventilator associated pneumonia (VAP) is one of the most common infection and have one of the highest mortality rates of nosocomial infections. VAP is defined like a lung infection that develops 48 hours or more after tracheal intubation process without prior evidence of microbial incubation in the respiratory tract. Current evidence suggests that VAP is associated with increased mortality, prolonged Intensive Care Unit stay and higher hospitalization costs. The aim of this article is to describe the pathogenic characteristics and risk factors that impact on mortality and survival of patients who develop VAP in major hospitals in Latin America in order to facilitate decision-making by the treating physician in this disease. (Horiz Med 2015; 15(2): 56-65)
Key words: Pneumonia, intensive care units, mechanical ventilation, Latin America, mortality, multiple drug resistance, resistance phenotype. (Source: MeSH NLM)
INTRODUCCIÓN
Un hospital de alta complejidad puede definirse como aquel hospital de nivel terciario en el cual hay personal y equipos técnicos altamente especializados para el diagnóstico y tratamiento del paciente, por ejemplo servicios especializados de imagen o unidades de cuidados intensivos (UCI).
La prevalencia de infección es elevada en hospitales de alta complejidad, especialmente en las UCI y es una de las causas más importantes de mortalidad en éstas, en la mayoría de los casos la afección ocurre a nivel respiratorio y se debe a patógenos resistentes a múltiples drogas (RMD), término asignado a aquellos microorganismos resistentes a tres o más agentes antimicrobianos.
A esto se adiciona la escases de nuevos antibióticos que sirvan como alternativas para el tratamiento de estas complicaciones, convirtiéndose en una amenaza para las UCI donde se encuentran las mayores tasas de RMD.
Dentro de las infecciones más comunes de este grupo se encuentra la neumonía asociada a ventilación mecánica (NAVM) definida como:
1. La infección pulmonar que se desarrolla 48 horas o más después de un proceso de intubación traqueal sin evidencia previa de incubación microbiana del tracto respiratorio; o
2. El diagnóstico de una nueva infección pulmonar si la admisión inicial a la UCI se debió a una neumonía.
La evidencia actual sugiere que la NAVM se relaciona con incrementos en la tasa de mortalidad, una prolongación en la estancia en UCI y mayores costos de hospitalización.
Se estima que la mortalidad en NAVM ocurre en aproximadamente el 13% de los pacientes (4), sin embargo esta cifra puede aumentar a más del 70% cuando la infección es causada por RMD. Varios factores pueden explicar la rápida propagación de los RMD en ambientes con pacientes críticos, por ejemplo: mutaciones nuevas y selección de cepas resistentes, la prescripción innecesaria de antibióticos al confundir una colonización bacteriana con un estado infeccioso, la ausencia de nuevos test para NAVM, entre otros.
El gold estándar para el diagnóstico de NAVM es el cultivo por fibrobroncoscopia con lavado alveolar y cepillo protegido, tomándose como valores diagnósticos las cifras>106 UFC/ml y >104 UFC/ml respectivamente.
Los microorganismos asociados a peor pronóstico se relacionan con 3 factores: son de difícil tratamiento, requieren estancias hospitalarias más prolongadas y se asocian con una mortalidad elevada; dentro de los organismos relacionados a estas variables se encuentran: Acinetobacter spp, Pseudomonas aeruginosa y Staphylococcus aureus meticilino resistente (SAMR).
De estas, la bacteriemia causada por Acinetobacter baumannii tiene mayor incidencia de resistencia a los antibióticos (p <0,05), mortalidad (p <0,001) y estancias hospitalarias más prolongadas (p <0,01).
El objetivo de este estudio fué describir las características patogénicas y los factores de riesgo que impactan en la mortalidad y supervivencia de los pacientes que desarrollan NAVM en hospitales de alta complejidad en Latinoamérica.
MATERIAL Y MÉTODOS
Se realizó una búsqueda de la información en el periodo septiembre de 2014 y febrero de 2015 utilizando los buscadores médicos The Cochrane Library, Pubmed, Embase, Scielo y Lilacs con los criterios de búsqueda: artículos en Inglés, Español, Portugués y Francés publicados entre 2005 y 2014 que incluyeran los términos "Mechanism AND Multi Drug Resistance (MDR)", "Ventilator associated pneumonia (VAP) AND Epidemiology", "VAP AND Risk Factors AND Morbility OR Mortality", "VAP AND Resistance phenotype" y sus respectivas traducciones en los buscadores médicos en español.
Se encontraron 18,498 artículos en Cochrane, 423.228 en Pubmed, 916.478 en Embase, 1374 en Scielo y 59 en Lilacs. Posteriormente, se descartaron los artículos que no cumplieron con alguna de las siguientes características: Meta análisis, Artículo original o Revisiones de Tema realizadas de acuerdo a las recomendaciones del grupo Cochrane.
Se seleccionaron 220 artículos, de los cuales se descartaron 171 que contenían información no relevante para las preguntas de investigación o contenían información desactualizada.
Adicionalmente se incluyó una referencia clásica de la década de 1990 dado que su información se considera de relevancia para la investigación y no había información más actualizada sobre la temática. Finalmente, se seleccionaron un total de 63 artículos para establecer el marco teórico.
La información se distribuyó en seis apartados: Introducción, Epidemiología, Mecanismos de Resistencia en microorganismos causantes de NAVM, Factores de Riesgo asociados a resistencia bacteriana, Fenotipos de Resistencia y Conclusiones.
La información se distribuyó en seis apartados: Introducción, Epidemiología, Mecanismos de Resistencia en microorganismos causantes de NAVM, Factores de Riesgo asociados a resistencia bacteriana, Fenotipos de Resistencia y Conclusiones.
EPIDEMIOLOGÍA
Se estima que la incidencia de las Neumonías asociadas a la hospitalización en Asia durante el año 2008 osciló entre 5 y 20 casos por cada 1000 admisiones hospitalarias y en Estados Unidos son la segunda causa de infección intrahospitalaria, relacionándose con el 60% de la mortalidad por infecciones nosocomiales.
Cerca de un tercio de estas neumonías son adquiridas en las UCIs, y de estas un 90% pertenece a las NAVM1. Los organismos gramnegativos son la principal causa de NAVM en general, las cepas resistentes pueden estar presentes en la mitad de los casos y se relacionan con un incremento de la mortalidad. Los patógenos más comunes son: Staphylococcus aureus, Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli y Acinetobacter baumannii (Ver Tabla 1).
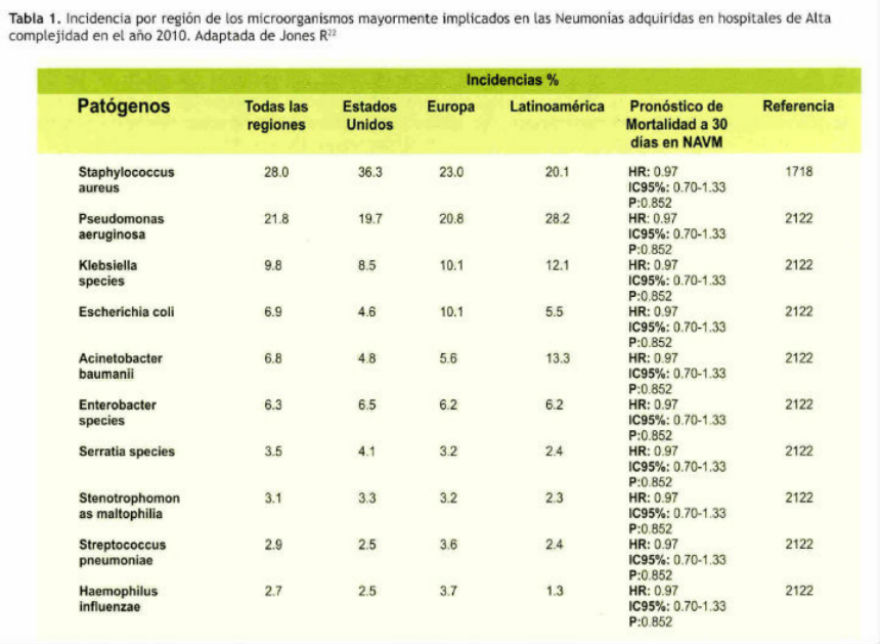
Panorama epidemiológico en Latinoamérica
Los informes de la Comunicad Científica Internacional de Control de Infecciones Nosocomiales (INICC) estiman una incidencia de 16 casos de NAVM por cada 1000 días de uso del dispositivo de ventilación. Sin embargo, estas cifras pueden variar en los diferentes países. Algunos estudios realizados en hospitales públicos y privados de alta complejidad en Latinoamérica obtuvieron los siguientes resultados:
En México datos reportados en el 2012 estiman que las NAVM ocupan el segundo lugar en cuanto a infecciones nosocomiales con una incidencia aproximada de 14,8 casos / 1000 días ventilador, no obstante este valor puede variar de acuerdo al tipo de hospital y complejidad del mismo, en un contexto general se estima que la incidencia en Unidades Médicas de Alta Especialidad es de 12 a 25 casos / 1000 días ventilador.
En Cuba, un estudio descriptivo retrospectivo transversal realizado en el periodo de enero a diciembre del año 2007 identificó la NAVM como la infección del tracto respiratorio más prevalente, encontrándose asociada con mayor frecuencia a las siguientes bacterias gram negativas: Enterobacterias 57.4 %, Acinetobacter ssp con 19.2%, Pseudomonas aeruginosa con 17.6% y en menor medida Staphylococcus aureus con el 5.8%.
En Honduras, si bien existe poca información reportada sobre esta temática, un estudio llevado a cabo en el Hospital de Especialidades Tegucigalpa, reportó una incidencia del 5.4% de NAVM durante el periodo 2007-2012, sin embargo no se dieron a conocer los agentes etiológicos implicados con mayor o menor frecuencia. Situación similar a la de Brasil, donde existe un estudio prospectivo que describe una incidencia del 25.6%, pero que ignora la prevalencia de los agentes infecciosos implicados en esta patología.
En Colombia se evidenció que los microorganismos aislados con mayor frecuencia fueron Escherichia coli (18,6%), Staphylococcus aureus (11,4%), Klebsiella pneumoniae (13,8%), Pseudomonas aeruginosa (8,6%) y Enterobacter sp (5,7%). Los resultados más importantes del único estudio realizado sobre incidencia de NAVM en Colombia reportaron que el 22,2% de los pacientes ingresados en UCI desarrolló una neumonía de este tipo y que el género femenino se asocia con una reducción del 57% de riesgo de neumonía (HR: 0,43 con un IC 95%: 0,19-0,96); los microorganismos aislados en este estudio fueron S. aureus, K. pneumoniae, Stenotrophomonas maltophilia, Serratia marcencsens, A. baumannii y Citrobacter freundii, lamentablemente estos resultados no expresan el porcentaje exacto de aislamientos por microorganismo ya que no se realizó test de broncoscopia y lavado broncoalveolar a todos los pacientes con la neumonía.
En Perú existe poca información respecto a la incidencia de las NAVM, no obstante una investigación reciente de tipo observacional descriptiva retrospectiva llevada a cabo en la UCI del Hospital Nacional Cayetano Heredia entre enero de 2010 y octubre de 2012 reporta que la infección intrahospitalaria que se presenta con mayor frecuencia es la NAVM, con una incidencia de 26,8 casos / 1000 días ventilador. Respecto a los agentes más frecuentes se pudo concluir que Pseudomonas sp. con el 32,3% de los casos es el agente causante de NAV más prevalente, seguido por Acinetobacter sp. con un aislamiento del 29,3% de los casos.
A pesar de que las cifras del INICC expresan una incidencia de 16 casos / 1000 días ventilador en Bolivia, en un estudio cuantitativo, retrospectivo y descriptivo realizado en la UCI del Hospital Clínico Viedma de Cochabamba entre enero y diciembre del 2010 se observó una incidencia de esta patología superior al 85% en los pacientes que fueron intervenidos, las cepas aisladas correspondieron a Klebsiella pneumoniae con el 32,5% de los casos, seguido de Acinetobacter baumannii y Staphylococcus aureus ambos con el 25% y Pseudomonas aeruginosa con el 20% de los casos .
En los estudios de vigilancia epidemiológica de Chile la prevalencia de NAVM en hospitales de mayor complejidad es del 4%, encontrándose Acinetobacter baumannii en el 27,37% de los casos, Staphylococcus aureus en el 21,59%, Pseudomonas aeruginosa en el 21,38%, Klebsiella pneumoniae en el 11,63% y otros agentes en el 18%.
A pesar de que no se discrimina la prevalencia de los microorganismos implicados en las NAVM, otros estudios realizados en Latinoamérica pueden servir de guía para analizar el panorama general de esta patología en países como Uruguay, Argentina o Ecuador.
Es así como el centro de infecciones de Uruguay en el año 2013 notificó una tasa de 9,6 casos x 1000 días ventilador de NAVM. El programa nacional de vigilancia de infecciones hospitalarias de Argentina para el 2010 reportó una incidencia de las NAVM en el 15.1% de los pacientes hospitalizados, situación similar a la del informe del 2011 presentado por el Hospital Eugenio Espejo de Ecuador en el cual se muestra una incidencia del 15%.
En Venezuela no aparecen reportes respecto a la incidencia de las NAVM, no obstante en un artículo publicado recientemente citan los informes la INICC, estimando un valor aproximado de 16 casos por cada 1000 días de ventilador, cifra que también puede ser atribuible a otros países latinoamericanos como Puerto Rico, Costa Rica, Paraguay, El Salvador o Panamá.
MECANISMOS DE RESISTENCIA EN AGENTES MICROBIANOS CAUSANTES DE NAVM
Existen variados mecanismos mediante los cuales las bacterias desarrollan resistencia hacia las diferentes clases de antimicrobianos, dentro de los más representativos se incluyen:
1. la producción de enzimas inactivadoras (Ejm: B-lactamasas, ADN girasas, carbapenemasas, cefalosporinasas),
2. la expresión de bombas de multirresistencia que expulsan el fármaco del espacio intracelular (Ejm: Bombas de eflujo),
3. la inactivación mediada por procesos químicos de los componentes activos del antibiótico (Ejm: fosforilación, adenilisación),
4. Alteración de la permeabilidad de la membrana mediante la formación de biofilms ya que se incrementa la producción de matriz extracelular.
En la (Tabla 2) se resumen los microorganismos de mayor prevalencia en las NAVM, su fenotipo de resistencia y los principales mecanismos por los cuales generan esta resistencia.

FACTORES DE RIESGO ASOCIADOS A RESISTENCIA BACTERIANA
La evidencia actual propone que la resistencia bacteriana es favorecida por múltiples factores tales como: hospitalizaciones previas en el último año, estancias hospitalarias prolongadas, intervenciones invasivas como cirugías o ventilación mecánica, edad avanzada, infecciones asociadas al cuidado de la salud, infección concomitante con VIH y especialmente el mal uso de los antibióticos (incluyendo aminoglucósidos, quinolonas, carbapenémicos).
Adicionalmente, un reciente estudio en Colombia encontró una relación con el ingreso a la UCI en la noche (OR= 6,02 (IC95%: 1,76-20,57)); intubación en urgencias OR= 3,79 (IC95% 1,11-12,99); más de una intubación OR= 5,81 (IC95%: 1,36-24,91); y transporte fuera de la UCI OR= 5,13 (IC95%: 1,72- 15,26).
En la tabla 3 se resumen los factores de riesgo asociados a los principales microorganismos implicados en las NAVM.

FENOTIPOS DE RESISTENCIA DESCRITOS EN LA LITERATURA (Ver Tabla 1)
Pseudomonas aeruginosa: Se han descrito al menos 10 sistemas de bombas de expulsión activa que favorecen la resistencia de este microorganismo. Se estima que en la NAVM causada por Pseudomonas aeruginosa el 40% de las cepas tienen sensibilidad intermedia o resistencia a al menos un carbapenémico, el 39% de las cepas son susceptibles de manera intermedia o resistentes a imipenem, el 34% tienen sensibilidad intermedia o resistencia a meropenem y 30% presentan sensibilidad intermedia o resistencia a doripenem. En Colombia el porcentaje de resistencia a imipenem en muestras de pacientes en UCI para el año 2009 de Pseudomonas aeruginosa fue del 24% (18).
Estudios in vivo de resistencia a los antimicrobianos en cepas de Pseudomonas aeruginosa aisladas de pacientes con NAVM en UCI reportan que la prevalencia global de cepas no sensibles a piperacilina/tazobactam (TZP) es del 25%, sin embargo en Latinoamérica esta cifra puede llegar a ascender hasta un 37,2%.
Así mismo, el Comité Europeo de Pruebas de Susceptibilidad Antimicrobiana (EUCAST) reporta que la resistencia superó el 25% para cefepime y ceftazidima, fue de aproximadamente del 20% para meropenem y ciprofloxacino y fue del 8% para amikacina. Además, existe un alto nivel de resistencia cruzada entre TZP y ceftazidima y cefepima.
Acinetobacter baumannii: Se caracterizan primordialmente por la resistencia a carbapenémicos (Imipenem y meropenem especialmente) y la susceptibilidad a aminoglucósidos. En Asia se ha reportado una cepa con un fenotipo de resistencia a la Colistina, sin embargo dicha resistencia no es muy frecuente en otros continentes. En estudios recientes realizados en Colombia, Acinetobacter baumannii presentó un 62,2% de resistencia a imipenem en 764 aislamientos de pacientes en unidades de cuidados intensivos (18).
Klebsiella pneumoniae: La evidencia sobre Klebsiella ha demostrado sensibilidad intermedia o resistencia a quinolonas (fluoroquinolonas) y betalactámicos, encontrándose estudios en Colombia en los que el 100% de las cepas aisladas eran resistentes a Imipenem, cuando hasta hace algunos años esta era una de las alternativas de última línea. Adicionalmente, estudios actuales han encontrado un incremento considerable en la resistencia a las cefalosporinas de tercera generación en cepas de Klebsiella aisladas de NAVM.
Staphylococcus aureus: En la actualidad Staphylococcus aureus ha demostrado resistencia a múltiples antibióticos, dentro de su fenotipo clásico de resistencia se encuentran: Oxacilina (51%), Fluoroquinolonas (48%) y Gentamicina (22%) 22.
En unidades de cuidados intensivos de Colombia Staphylococcus aureus presentó un 28,1% de resistencia a oxacilina en el año 2009 (18). Adicionalmente, el incremento en la prevalencia del SARM es un problema de salud pública a nivel mundial ya que es uno principales patógenos asociados a infecciones hospitalarias, por ejemplo, en Colombia se ha encontrado que la prevalencia de SARM en el ámbito hospitalario está por encima de 40%.
Finalmente, existe preocupación por una posible emergencia de Staphylococcus aureus vancomicino resistente, recientemente se reportó el primer caso en Latinoamérica y algunos estudios han encontrado una asociación entre la coinfección de Enterococcus faecalis y S. aureus con la resistencia a la vancomicina.
En conclusión, la NAVM es un problema de salud pública importante en Latinoamérica, que ha cobrado relevancia en los últimos años debido al aumento en el número de pacientes críticos con soporte ventilatorio que desarrollan esta infección, tanto en unidades de cuidado intensivo, como en servicios de urgencias y unidades de cuidado crónico. Paralelamente, la resistencia bacteriana en los hospitales de alta complejidad viene en ascenso.
Es necesario elaborar un perfil microbiológico en cada institución para tratar con mayor eficacia a los pacientes con NAVM y de esta manera, lograr la disminución de la morbimortalidad atribuible a este tipo de infección.
REFERENCIAS BIBLIOGRÁFICAS
1. Hensher M, Price M, Adomakoh S. Referral Hospitals. In: Jamison DT, Breman JG, Measham AR, et al., editors. Disease Control Priorities in Developing Countries. 2nd edition. Washington (DC): World Bank; 2006. Chapter 66. Available from: http://www.ncbi.nlm.nih.gov/books/NBK11737/
2. Vincent JL, Rello J, Marshall J, Silva E, Anzueto A, Martin C, et al. International Study of the Prevalence and Outcomes of Infection in Intensive Care Units. JAMA 2009; 302(21):2323-2329.
3. Arias CA, Murray BE. Antibiotic-Resistant Bugs in the 21st Century - A Clinical Super-Challenge. N Engl J Med 2009; 360: 439-443.
4. Drees M, Pineles L, Harris A, Morgan D. Variation in Definitions and Isolation Procedures for Multidrug-Resistant Gram-Negative Bacteria: A Survey of the Society for Healthcare Epidemiology of America Research Network. Infection Control and Hospital Epidemiology 2014; 35(4): 362-366
5. Brusselaers N, Vogelaers D, Blot S. The rising problem of antimicrobial resistance in the intensive care unit. Ann Intensive Care 2011; 1: 47
6. American Thoracic Society. Guidelines for the management of adults with hospital-acquired pneumonia, ventilator-associated pneumonia, and healthcare-associated pneumonia. Am J Respir Crit Care Med 2005; 17:388-416
7. Melsen W.G, Rovers M.M, Groenwold R.HH, Bergmans D.CJJ, Camus C, Bauer T.T, et al. Attributable mortality of ventilator- associated pneumonia: A meta-analysis of individual patient data from randomized prevention. Lancet Infectious Diseases 2013; 13(8): 665-671
8. Kollef M, Hamilton C, Ernst F. Economic Impact of Ventilator- Associated Pneumonia in a Large Matched cohort. Infect Control Hosp Epidemiol 2012; 33(3):250-256.
9. Heyland DK, Cook DJ, Griffith L, Keenan S, Brun-Buisson C. The Attributable Morbidity and Mortality of Ventilator-Associated Pneumonia in the Critically Ill Patient. Am J Respir Crit Care Med 1999; 159: 1249-1256.
10. Loeches I.M, Díaz E, Vallés J. Risk for multidrug-resistant pathogens in the ICU. Curr Opin Crit Care 2014, 20:516-524.
11. Gibbs K, Holzman R. Endotracheal tube: Friend or foe? Bacteria, the endotracheal tube, and the Impact of Colonization and Infection. Semin Perinatol 2014; 36:454-461.
12. Rea-Neto A, Youssef N, Tuche F, Brunkhorst f, Ranieri M, Reinhart K et al. Diagnosis of ventilator-associated pneumonia: a systematic review of the literature. Critical care 2008; 12(1):1-14
13. Clinical and Laboratory Standars Institute (CLSI). Perfomance Standars for Antimicrobial Susceptibility Testing; twenty - fifth Informational Suplement. M100-S25 (ISBN 1-56238-989-0 [Print]; ISBN 1-56238-990-4 [Electronic]). Clinical and Laboratory Standars Institute, West Valley Road, Suite 2500, Wayne, Pennsylvania 19087 USA, 2015.
14. Hanberger H, Antonelli M, Holmbom M, Lipman J, Pickkers P, Leone M, et al. Infections, antibiotic treatment and mortality in patients admitted to ICUs in countries considered to have high levels of antibiotic resistance compared to those with low levels. BMC Infectious Diseases 2014; 14:513-21.
15. Teng S, Yen M, Ou T, Chen F, Yu F, Lee W. Comparison of pneumonia- and non-pneumonia-related Acinetobacter baumannii bacteremia: Impact on empiric therapy and antibiotic resistance. J Microbiol Immunol Infect 2014. Disponible en http://www.e-jmii.com/article/S1684-1182(14)00122-4/fulltext consultado el 9 de octubre de 2014.
16. Ózgür E, Horasan E, Karaca K, Ersoz G, Atis S, Kaya A. Ventilator- associated pneumonia due to extensive drug-resistant Acinetobacter baumannii: Risk factors, clinical features, and outcomes. American Journal of Infection Control 2014; 42: 206-8
17. Chawla R. Epidemiology, etiology, and diagnosis of hospital-acquired pneumonia and ventilator-associated pneumonia in Asian countries. Am J infect control 2008; 36 (4): 93-100.
18. Torres A., El-Ebiary M., Rañó A. Respiratory infectious complications in the intensive care unit. Clin Chest Med. 2010; 20:287-301.
19. Forel JM, Voillet F, Pulina D, Gacouin A, Perrin G, Barrau K, et al. Ventilator-associated pneumonia and ICU mortality in severe ARDS patients ventilated according to a lung-protective strategy. Critical Care 2012; 16:R65
20. Chittawatanarat K, Jaipakdee W, Chotirosniramit N, Chandacham K, Jirapongcharoenlap T. Microbiology, resistance patterns, and risk factors of mortality in ventilator-associated bacterial pneumonia in a northern Thai tertiary-care university based general surgical intensive care unit. Infection and Drug Resistance 2014; 7(1): 203- 210
21. Barbier F, Andremont A, Wolff M, Bouadma L. Hospital Acquired pneumonia and ventilator-associated pneumonia: recent advances in epidemiology and manegement. Curr Opin Pulm Med 2013, 19:216-228.
22. Jones R. Microbial Etiologies of Hospital-Acquired Bacterial Pneumonia and Ventilator-Associated Bacterial Pneumonia 2010. Clinical Infectious Diseases 2010; 51(S1):S81-S87
23. Inchai J, Pothirat C, Liwsrisakun C, Deesomchok A, Kositsakulchai W, Chalermpanchai N. Ventilator-associated pneumonia: epidemiology and prognostic factors of 30-day mortality. Japanese Journal of Infectious Diseases 2014. Aceptado para publicación. DOI: 10.7883/yoken.JJID.2014.282
24. Comunidad Científica Internacional de Control de Infecciones Nosocomiales [en línea]. Buenos Aires; 2013. Datos de Vigilancia de INICC. Disponible en: http://www.inicc.org/espanol/esp_index.php
25. Instituto mexicano del seguro social (IMSS). Guia de Práctica Clínica: Prevención, Diagnóstico y Tratamiento de la Neumonía Asociada A Ventilación Mecánica. México: Secretaria de salud, 2013.
26. Castro M, Tartabull K, Nicolau E. Microorganismos aislados en pacientes con infecciones asociadas a la ventilación mecánica en los servicios de atención al grave. Archivo Médico de Camagüey. 2010;14(4).
27. Padgett D, Luque M, Rivera D, Zepeda L, Hernandez A. Vigilancia de infecciones nosocomiales: Experiencia en Hospital de especialidades del Instituto Hondureño de Seguridad Social, 2006-2012. Rev med hondur. 2013; 81: 2-4.
28. Oliveira AC, Kovner CT, Silva RS. Infec<ao hospitalar em unidade de tratamento intensivo de um hospital universitário brasileiro. Rev. Latino-Am. Enfermagem.2010; 18(2):233-9. Disponible en http://www.scielo.br/pdf/rlae/v18n2/pt_14.pdf
29. Rodríguez A, Ortega M, Garzón L, Vargas S, Iguarán D, Botero M, et al. Tendencias de los fenotipos de resistencia bacteriana en hospitales públicos y privados de alta complejidad de Colombia. Rev Panam Salud Pública 2011; 30(6):627
30. Jaimes F, De la Rosa G, Gómez E, Múnera P, Ramírez J, Castrillon S. Incidence and risk factors for ventilttor associated pneumonia in a developing country: Where is the difference?. Respiratory Medicine 2007; 101:762-67.
31. Chincha O, Cornelio E, Valverde V, Acevedo M. Infecciones intrahospitalarias asociadas a dispositivos invasivos en unidades de cuidados intensivos de un hospital nacional de Lima, Perú. Rev. perú. med. exp. salud pública. 2013;30(4)
32. Quintanilla J, Orellana R, Alfaro C. Perfil Microbiológico de Infecciones Nosocomiales en la Unidad de Terapia Intensiva del Hospital Clínico Viedma. Gac Med Bol. 2011;34(1) 37-39.
33. Otaiza F, Bustamente R, Sanchez P. Informe de Vigilancia de Infecciones Asociadas a la Atención en Salud 2012. Ministerio salud Chile. 2012.
34. Ministerio de Salud Pública de Uruguay. Control de infecciones hospitalarias. 2013. Disponible en: http://www.msp.gub.uy/sites/default/files/archivos_adjuntos/INDICADORES%20URU%20UCI%20 NAR%202013.pdf.
35. Programa nacional de vigilancia de infecciones hospitalarias de Argentina. "Infecciones hospitalarias" Una afección endemoepidémica grave de alcance mundial. Ministerio de Salud. 2010.
36. Servicio de epidemiologia HEE. Infecciones intrahospitalarias. Ministerio de salud pública Ecuador. 2011. Disponible en: http://www.hee.gob.ec/descargas/SIVICEIN_ANALISIS_TOTAL_2007-2011.pdf
37. López Diana, Aurenty Lisbeth, Nexans-Navas Miguelángel, Goncalves María Elena, Rosales Tamara, Quines María et al. Etiología y mortalidad por neumonía asociada a los cuidados de la salud en pediatría. Arch Venez Puer Ped. 2014; 77(1): 9-14. [citado 2015 Feb 11] Disponible en: http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S0004-06492014000100003&lng=es.
38. Van Acker H, Van Dijck P, Coenye T. Molecular mechanisms of antimicrobial tolerance and resistance in bacterial and fungal biofilms. Trends in Microbiology 2014; 22 (6): 326-33.
39. Vega N, Gore J. Collective antibiotic resistance: mechanisms and implications. Current Opinion in Microbiology 2014; 21:28-34.
40. Pop-Vicas A, Opal SM. The clinical impact of multidrug-resistant gram-negative bacilli in the management of septic shock. Virulence. 2014 Jan 1;5(1):206-12.
41. Fraimow H, Nahra R. Resistant Gram-Negative Infections. Crit Care Clin 2013; 29: 895-921.
42. Ascioglu S, Samore M, Lipsitch M. A New Approach to the Analysis of Antibiotic Resistance Data from Hospitals. Microb Drug Resist; 2014; 00.
43. Da Silva Winter J, Pires dos Santos R, Azambuja A, Bauer Cechinel A, Zubaran L. Microbiologic isolates and risk factors associated with antimicrobial resistance in patients admitted to the intensive care unit in a tertiary care hospital. American Journal of Infection Control 2013; 41: 846-848.
44. Villalobos A, Barrero L, Rivera S, Ovalle M. Vigilancia de infecciones asociadas a la atención en salud, resistencia bacteriana y consumo de antibióticos en hospitales de alta complejidad, Colombia, 2011. Biomédica 2014; 34(1): 67-80.
45. Neiva M, Gómez C, Montaño S, Pérez N, Prieto F, Castro A. Factores relacionados con neumonía asociada a ventilación mecánica en una unidad de cuidados intensivos de la Orinoquía Colombiana. Acta Med Colomb 2009; 34: 164-168.
46. Luyt C, Aubry A, Lu Q, Micaelo M, Bréchot N, Brossier F, et al. Imipenem, Meropenem, or Doripenem To Treat Patients with Pseudomonas aeruginosa Ventilator-Associated Pneumonia. Antimicrobial Agents and Chemotherapy 2014;58: 1372-1380.
47. Parker C, Kutsogiannis J, Muscedere J, Cook D, Dodek P, Day A. Ventilator-associated pneumonia caused by multidrug-resistant organisms or Pseudomonas aeruginosa: Prevalence, incidence, risk factors, and outcomes. Journal of Critical Care 2008; 23: 18-26.
48. Combes A, Luyt C, Fagon J, Wolff M, Trouillet J, Chastre J. Impact of piperacillin resistance on the outcome of Pseudomonas ventilator- associated pneumonia. Intensive Care Med 2006; 32: 1970-1978.
49. Mantzarlis K, Makris D, Manoulakas E, Karvouniaris M, Zakynthinos E. Risk Factors for the First Episode of Klebsiella pneumonia Resistant to Carbapenems Infection in Critically Ill Patients: A Prospective Study. BioMed Research International 2013;1-8. Disponible en: http://dx.doi.org/10.1155/2013/850547
50. Moreira M, Cardoso R, Almeida A, Gontijo P. Risk Factors and Evolution of Ventilator-Associated Pneumonia by Staphylococcus aureus Sensitive or Resistant to Oxacillin in Patients at the Intensive Care Unit of a Brazilian University Hospital. BJID 2008; 12: 499-503
51. Chastre J , Blasi F, Masterton R, Rello J, Torres A, Welte T. European perspective and update on the management of nosocomial pneumonia due to methicillin-resistant Staphylococcus aureus after more than 10 years of experience with linezolid. Clin Micro biol Infect 2014; 20 (Suppl. 4): 19-36.
52. Philip D. Lister, Daniel J. Wolter. Antibacterial-Resistant Pseudomonas aeruginosa: Clinical Impact and Complex Regulation of Chromosomally Encoded Resistance Mechanisms. Clin Microbiol Rev 2009; 22(4): 582-610.
53. Zilberberg M, Chen J, Mody S, Ramsey A, Shorr A. Imipenem resistance of Pseudomonas in pneumonia: a systematic literature review. BMC Pulmonary Medicine 2010; 10:45.
54. Jones RN, Stilwell MG, Rhomberg PR, Sader HS. Anti pseudomonal activity of piperacillin/tazobactam: more than a decade of experience from the SENTRY Antimicrobial Surveillance Program (1997-2007).Diagn Microbiol Infect Dis. 2009;65(3):331-4.
55. Riou M, Carbonnelle S, Avrain L, Mesaros N, Pirnay J, Bilocq F, et al. In vivo development of antimicrobial resistance in Pseudomonas aeruginosa strains isolated from the lower respiratory tract of Intensive Care Unit patients with nosocomial pneumonia and receiving antipseudomonal therapy. International Journal of Antimicrobial Agents 2010; 36: 513.
56. Torres H, Vasquez G. Yagüe G, Gómez J. Acinetobacter baumanii multirresistente: situación clínica actual y nuevas perspectivas. Rev Esp Quimioter 2010;23(1):12-19.
57. Diancourt L et al. The population structure of Acinetobacter baumannii: expanding multiresistant clones from an ancestral susceptible genetic pool. PLoS One. 2010; 5: e10034
58. Chung DR, Song JH, Kim SH, Thamlikitkul V, Huang S, Wang H. High Prevalence of Multidrug-Resistant Nonfermenters in Hospital- acquired Pneumonia in Asia. American journal of respiratory and critical care medicine 2011; 184: 1409-17.
59. Villegas MV, Correa A, Perez F, Zuluaga T, Radice M, Gutkind G, et al. CTX-M-12 beta-lactamase in a Klebsiella pneumoniae clinical isolate in Colombia. Antimicrob Agents Chemother 2004; 48(2):629-31.
60. Villegas MV, Lolans K, Correa A, Suarez CJ, Lopez JA, Vallejo M, et al. First detection of the plasmid-mediated class A carbapenemase KPC-2 in clinical isolates of Klebsiella pneumoniae from South America. Antimicrob Agents Chemother. 2006;50(8):2880-82.
61. Hawkey P, Jones A. The changing epidemiology of resistance. Journal of Antimicrobial Chemotherapy 2009; 64(1): i3-i10
62. Guzman-Bianco M, Mejia C, Isturiz R, Alvarez C,Bavestrello L, Gotuzzo E, et al. Epidemiology of meticillin resistant Staphyiococcusaureus(MRSA) in Latin America. Int J Antimicrob Agents. 2009:34;304-8.
63. Arias C, Rincón S, Chowdhury S, Martínez E, CoronelW, Reyes J, et al. MRSA USA300 clone and vancomycin resistant Enterococcus faecalis: a United States.-Colombian connection?. N Eng J Med2008; 359:2177-79.
Fuentes de financiamiento
El estudio ha sido autofinanciado por el autor.
Conflictos de interés
El autor declara no tener ningún conflicto de interés
Correspondencia:
David Esteban Rebellón Sánchez Dirección: Hospital Regional de Duitama,
Av. Américas, Carrera 35, Duitama Boyacá.
Teléfono: 7626210 - 7626212.
Recibido: 24 de Noviembre de 2014
Aprobado: 13 de Marzo de 2015














