Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Horizonte Médico (Lima)
versión impresa ISSN 1727-558X
Horiz. Med. vol.16 no.3 Lima jul./set. 2016
ARTÍCULO ORIGINAL
Características clínicas y epidemiológicas de la infección respiratoria aguda grave por virus sincitial respiratorio en menores de 5 años
Clinical and epidemiological characteristics of severe acute respiratory infection due to respiratory syncytial virus in children under 5 years
Hugo Antonio Mezarina Esquivel1,a; Aurea Rosa Rojas Medina2,a; Carlos Alfonso Bada Mancilla3,a; Ruth Elizabeth Castañeda Campozano4; José Raphael Carhuancho Aguilar5,a
1. Médico pediatra. Doctor en Salud Pública. Oficina de Epidemiología del Hospital de Emergencias Pediátricas.
2. Médico Intensivista Pediatra. Servicio de Cuidados Críticos del Niño y del Adolescente del Hospital Docente Madre Niño San Bartolomé.
3. Médico Pediatra. Servicio de Medicina Pediátrica del Hospital de Emergencias Pediátricas. Doctor en medicina.
4. Licenciada en Enfermería. Oficina de Epidemiología del Hospital de Emergencias Pediátricas.
5. Médico Cirujano. Maestro en Educación.
a. Docente de la Universidad de San Martín de Porres.
RESUMEN
Objetivo: Comparar las características clínicas y epidemiológicas de la infección respiratoria aguda grave en menores de 5 años con y sin infección por virus sincitial respiratorio. Material y métodos: Estudio retrospectivo en una muestra de 65 casos y 65 controles en menores de 5 años con infección respiratoria aguda grave (IRAG) atendidos en el Hospital de Emergencias Pediátricas durante el año 2014. El diagnóstico de VSR se realizó a través del test de inmufluorescencia directa (IFD) en muestras nasales y faríngeas (D3 Ultra 8 DFA Respiratory Virus Screening & ID Kit). Los resultados fueron expresados en cifras absolutas y relativas, el análisis se realizó a través de medidas de tendencia central, ji cuadrado, t de Student y U de Mann Withney. Resultados: Se encontró diferencias significativas entre los casos y los controles en la media de edad, en el mes de infección, en la media de la frecuencia respiratoria, en el uso de ventilación mecánica, en el tratamiento antibiótico y en el diagnóstico de bronquiolitis al alta. Conclusiones: Los resultados muestran que existen diferencias clínicas y epidemiológicas entre los casos y los controles
Palabras clave: virus sincitial respiratorio, infección del tracto respiratorio, epidemiología.
ABSTRACT
Objective: To compare the clinical and epidemiological characteristics of severe acute respiratory infection in children under 5 years old with and without infection due to respiratory syncytial virus. Material and methods: Retrospective study in a sample of 65 cases and 65 controls in children under 5 years old with acute respiratory infection (SARI) treated at the Pediatric Emergency Hospital during 2014. The diagnosis of RSV test was performed using direct inmufluorescencia (IFD) in nasal and throat samples (D3 Ultra DFA Respiratory Virus 8 Screening & ID Kit). The results were expressed in absolute and relative terms; the analysis was performed by measures of central tendency, chi-square, t Student and Mann Whitney tests. Results: Significant differences were found between cases and controls in the average age in the month of infection, the average respiratory rate, use of mechanical ventilation in antibiotic treatment and diagnosis of bronchiolitis at medical discharge. Conclusions: The results show that there are clinical and epidemiological differences between the cases and controls
Key words: respiratory syncytial virus, respiratory tract infection, epidemiology.
INTRODUCCIÓN
El Virus Sincitial Respiratorio (VSR) es un virus ARN de cadena simple y polaridad negativa, clasificada dentro del Orden Mononegavirales y perteneciente a la Familia Paramyxoviridae, Género Pneumovirus(1). Este virus causa enfermedad aguda del tracto respiratorio en personas de todas las edades. La manifestaciones clínicas varían con la edad y si la infección es primaria o secundaria.
Virus Sincitial Respiratorio (VSR) causa brotes estacionales a través del mundo. En el hemisferio norte, estos ocurren usualmente de noviembre a abril, con un pico en enero o febrero(2,3). En el hemisferio sur, se producen epidemias invernales de mayo a setiembre, con picos en mayo, junio o julio. En los climas tropicales y semitropicales, los brotes estacionales generalmente están asociados con la temporada de lluvias. Los picos epidémicos no son tan agudos como en los climas templados, y en algunos escenarios los VSR pueden aislarse hasta por un máximo de ocho meses del año(4,5).
El Virus Sincitial Respiratorio es la causa más común de infección del tracto respiratorio bajo (ITRB) en personas de todas las edades. Casi todos los niños son infectados dentro de los dos años de edad y la reinfección es común(6).
El Virus Sincitial Respiratorio es la causa más común de infección del tracto respiratorio inferior (ITRI) en niños menores de un año(2). Cada año en los Estados Unidos, se asocia con un estimado de 132 mil a 172 mil hospitalizaciones pediátricas entre los niños menores de cinco años y está aumentando en frecuencia(7,8). Aunque la tasa de hospitalización es mayor en los niños menores de tres meses de edad, cerca del 50 por ciento del total de hospitalizaciones en el grupo de menores de cinco años ocurren en niños mayores de seis meses. A nivel mundial, se estima que el VSR causa cerca de 34 millones de episodios de infecciones respiratorias agudas bajas en niños menores de cinco años, lo que resulta en alrededor de 3,4 millones de hospitalizaciones por año(9).
En el Perú los datos de la vigilancia nacional de los año 2014 y 2015 reportan que casi un tercio de los pacientes atendidos en nuestro país con infección respiratoria aguda tuvieron etiología viral y entre las muestra positivas predominó el Virus Sincitial Respiratorio (VSR)(10).
En los datos recopilados por los centros para el control de enfermedades, la neumonía por VSR ha sido responsable de un promedio de 2.700 muertes cada año entre adultos y niños(11). A nivel mundial, se estima que VSR causa tanto como 2.3 por ciento de las muertes de recién nacidos de 0 a 27 días de edad, el 6,7 por ciento de las muertes entre los niños 28 a 364 días de edad y 1.6 por ciento de las muertes entre los niños de uno a cuatro años de edad(12). Entre los niños de 28 a 364 días de edad, se estima que VSR causa más muertes que cualquier otro agente infeccioso solo con la excepción de la malaria(12).
Las manifestaciones clínicas varían dependiendo de la edad del paciente y el estado de salud. Los lactantes y los niños pequeños con infecciones primarias por lo general se presentan con la infección del tracto respiratorio inferior (ITRI) bronquiolitis o neumonía(13), mientras que los niños mayores y los adultos suelen tener síntomas del tracto respiratorio superior(14) o traqueobronquitis.
Con respecto a la prevención, el éxito en el desarrollo de vacunas contra el VSR ha sido difícil de lograr, en 1960 se elaboró la primera vacuna inactivada que fracasó(15).
En el año 1996 la FDA aprobó la administración por vía parenteral de la IgG policlonales humanas (RespiGam) para prematuros y con displasia broncopulmonar, con la finalidad de disminuir la severidad de la enfermedad y evitar la hospitalización(16).
Debido a las limitaciones de los Ac policolonales humanizados se comenzó con el desarrollo de Ac Monoclonales humanizado, entre los que se tiene en la actualidad al Polimizumab aprobado por la FDA en 1998, para niños con enfermedad de alto riesgo, el cual es costoso y su uso ha provocado la aparición de cepas virales resistentes(17).
En relación al tratamiento con broncodilatadores inhalados no sugieren su uso rutinario para niños con bronquiolitis por Virus Sincitial Respiratorio. Meta - análisis de ensayos aleatorios y revisiones sistemáticas sugieren que los broncodilatadores pueden proporcionar una mejoría clínica modesta a corto plazo, pero no afectan el resultado general; pueden tener efectos adversos, y aumentar el costo de la atención(18,19).
Los corticosteroides tienen el potencial de disminuir la inflamación bronquiolar y obstrucción de las vías respiratorias a través de sus efectos antiinflamatorios, sin embargo, en los ensayos aleatorios(20,21), los meta-análisis(22) y las revisiones sistemáticas(23,24), no han demostrado ser beneficioso para el tratamiento de la bronquiolitis.
Los datos son limitados sobre el uso de corticosteroides en pacientes con bronquiolitis que requieren ventilación mecánica.
Los antibióticos no debería ser prescritos en infecciones comprobadamente virales, pero en la práctica diaria su empleo puede llegar a ser muy frecuente(25); cuando se conoce la etiología de la infección respiratoria en pacientes hospitalizados es más frecuente la suspensión del uso de antibióticos ante la confirmación de la etiología viral(26). La revisión sistemática sobre el uso de antibióticos para la bronquiolitis no encontró pruebas suficientes para apoyar su uso(27).
El objetivo principal del presente estudio es comparar las características epidemiológicas y las manifestaciones clínicas en dos grupos de niños menores de 5 años con infección respiratoria aguda grave, teniendo como base la detección del Virus Sincitial Respiratorio.
MATERIAL Y MÉTODOS
Se realizó un estudio observacional retrospectivo de casos y controles en menores de 5 años atendidos en el 2014 por infección respiratoria aguda grave (IRAG)(28) en el Hospital de Emergencias Pediátricas, seleccionados de 204 niños que fueron evaluados por el test de inmufluorescencia directa (IFD) en muestras nasales y faríngeas (D3 Ultra 8 DFA Respiratory Virus Screening & ID Kit) tomadas dentro de las 24 horas del ingreso, conservadas en un medio de transporte viral y procesadas en el laboratorio del hospital que cuenta con certificación por el Instituto Nacional de Salud. El método permite la detección cualitativa y la identificación de los siguientes virus: Adenovirus, Influenza A y B, Parainfluenza 1, 2 y 3, Virus Sincitial Respiratorio y Metapneumovirus.
Se definió IRAG a la presencia de fiebre de 38.5ºC o más, tos y dificultad respiratoria que requiriera hospitalización por más de 24 horas y un tiempo de enfermedad de 7 días o menos(29).
El paciente con IRAG e IFD positivo a Virus Sincical Respiratorio (VSR) fue considerado como caso y aquel con IRAG e IFD negativo a cualquier virus respiratorio como control.
Se excluyeron aquellos niños menores de 5 años que presentaron IRAG estando hospitalizados o que tuvieron un tiempo de enfermedad mayor de 7 días y aquellos que tuvieron resultado positivo a otros virus. Los pacientes con historia clínica incompleta fueron eliminados.
La información de los 65 casos y de los 65 controles fue recolectada entre junio y julio del 2014 a través de un formulario ad hoc estandarizado, el que incluyó datos demográficos, clínicos, diagnósticos, de tratamiento y de laboratorio. Se compararon las características epidemiológicas, clínicas y laboratoriales de los casos y los controles.
La información recolectada fue ingresada en una base de datos previamente diseñada, usando para su procesamiento y análisis el paquete estadístico SPSS 21,0 (Statistical Package for Social Sciences) para Windows. Los resultados fueron expresados como frecuencias relativas y absolutas, el análisis se realizó a través de medidas de tendencia central, ji cuadrado, t de Student y U de Mann Withney.
Las consideraciones éticas estuvieron circunscritas al anonimato y confidencialidad de los datos.
RESULTADOS
En los casos el 58.41% fue de sexo masculino y en los controles el 41.53% (p>0.05), la media de edad en los casos fue menor que en los controles (p<0.05), en el 67.69% de los casos y en el 44.61% de los controles la edad fue menor a 6 meses.
Los casos procedieron principalmente del Distrito de San Juan de Lurigancho (27.69%) al igual que los controles (30.77%), no habiendo diferencias significativas.
El 20% de los casos se presentó en el mes de junio a diferencia de los controles que solo el 4.63% se presentó en dicho mes (p<0.05).
La media del tiempo de enfermedad y la media de tiempo de hospitalización no mostraron diferencias entre los casos y los controles (p>0.05) (Tabla 1).
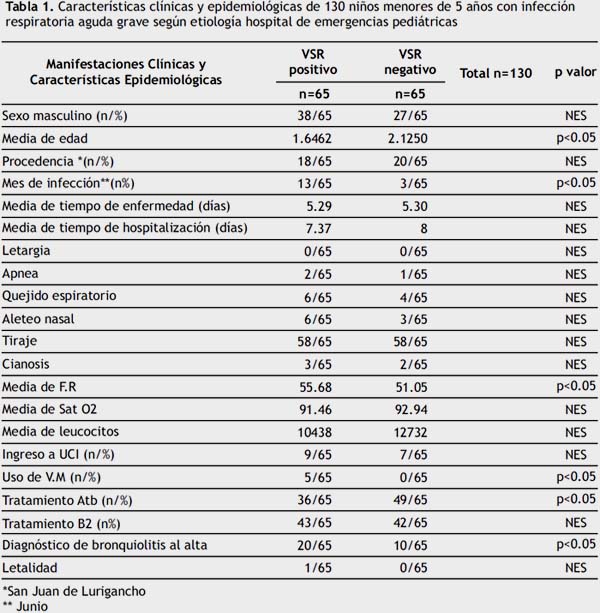
En relación a las manifestaciones clínicas previas al ingreso se presentó letargia en 0% de los caso y de los controles, apnea en el 3.08% de los casos y en el 1.58% de los controles, quejido en el 9.23% de los casos y 6.18% de los controles, aleteo nasal en el 9.23% de los casos y 4.61% de los controles, tiraje en el 89.23% de los casos y de los controles y cianosis en el 4.61% de los casos y 3.08% de los controles.
La media de la frecuencia respiratoria al ingreso fue mayor en los casos que en los controles (p<0.05), para la media de la saturación de oxígeno y de leucocitos no hubo diferencias significativas entre los casos y los controles (p>0.05).
El 13.83% de los casos y el 10.77% de los controles ingresó a la Unidad de Cuidados Intensivos (UCI) (p>0.05), de los que ingresaron a la UCI 5 casos (7.69%) y ningún control (0%) requirió ventilación mecánica (p<0.05).
El 55.38% (36/65) de los casos y el 75.38% (49/65) de los controles recibió antibióticos (p<0.05), mientras que el 63.15% (43/65) de los caso y el 64.62% de los controles (42/65) broncodilatadores (p>0.05).
En el 30.77% (20/65) de los casos y en el 15.38% (10/65) de los controles el diagnóstico al alta fue bronquiolitis (p<0.05).
No hubo diferencias significativas entre la letalidad de los casos y los controles.
DISCUSIÓN
En el estudio no hubo diferencias significativas en cuanto al sexo entre los casos y los controles, la mayoría de los casos tuvo menos de 6 meses de edad, comparado con los controles(3,9).
En cuanto al lugar de procedencia no hubo diferencias entre los casos y los controles, esto probablemente reflejaría la demanda del hospital que atiende población de recursos limitados.
El mes de infección más frecuente para los casos fue junio en comparación con los controles, situación similar a lo que se reporta en la literatura para el hemisferio sur, donde la infección por VSR presenta picos en mayo, junio o julio(4,5).
El tiempo de enfermedad y el tiempo de hospitalización fueron similares para los casos y los controles, así como la presencia de letargia, apnea, quejido, aleteo nasal, tiraje, cianosis y la saturación del oxígeno al momento del ingreso; lo que indicaría que la historia natural de la enfermedad fue similar.
La frecuencia respiratoria al ingreso fue mayor en los casos que en los controles lo que podría explicarse por la edad de los casos y porque probablemente la infección por VSR fue primaria(13).
En relación al ingreso a la Unidad de Cuidados Intensivos no hubo diferencias entre los casos y los controles, lo que se observó es que los casos requirieron el uso de ventilación mecánica más frecuentemente que los controles lo que tendría que ver con la gravedad de la infección por VSR(13,14).
En los casos el empleo de antibióticos fue menor en comparación con los controles, esto se debería a que una vez que se conoce el diagnóstico etiológico el médico se siente más seguro para no prescribir antibióticos(25,26,27), en relación al tratamiento con broncodilatadores se prescribió en más de la mitad de los casos y los controles, pese a que su uso rutinario no está indicado debido a que como se sabe dan una mejoría clínica modesta a corto plazo, y no afectan el resultado general y además pueden tener efectos adversos y aumentar el costo de la atención(18,19).
La bronquiolitis fue la presentación clínica más frecuente en los casos que en los controles lo que se relaciona con lo mencionado por otros autores(13), en cuanto a la letalidad no hubo diferencias entre los casos y los controles, pese a que es conocido que el VSR es una causa importante de mortalidad(11,12).
En conclusión, existen diferencias entre los casos y los controles en ciertas características epidemiológicas como la edad, el mes de infección y ciertas características clínicas como la frecuencia respiratoria, el uso de ventilación mecánica y de antibióticos y en el diagnóstico de bronquiolitis al alta.
Las limitaciones del estudio estuvieron dadas porque se trató de un estudio retrospectivo y se utilizó una fuente secundaria de datos, así como por el uso de IFD para la identificación del Virus Sincitial Respiratorio.
Se recomienda ahondar sobre el tema realizando estudios prospectivos y haciendo uso de PCR para la identificación del Virus Sincitial Respiratorio.
REFERENCIAS BIBLIOGRÁFICAS
1. Valdés-Ramírez O, Corzo-López M, El virus sincitial respiratorio humano: una panorámica. Revista CENIC. Ciencias Biológicas 2013 44. Disponible en: http://www.redalyc.org/articulo.oa?id=181227534005 [ Links ]
2. Respiratory syncytial virus activity--United States, 1999-2000 season. Centers for Disease Control and Prevention (CDC) MMWR Morb Mortal Wkly Rep. 2000;49(48):1091.
3. Hall CB, Weinberg GA, Iwane MK, Blumkin AK, Edwards KM, Staat MA, et. all. The burden of respiratory syncytial virus infection in young children. N Engl J Med. 2009;360(6):588. [ Links ]
4. Spence L, Barratt N. Respiratory syncytial virus associated with acute respiratory infections in Trinidadian patients. Am J Epidemiol. 1968;88(2):257. [ Links ]
5. Staat MA, Henrickson K, Elhefni H, Groothuis J, Makari D. Prevalence of respiratory syncytial virus-associated lower respiratory infection and apnea in infants presenting to the emergency department. Pediatr Infect Dis J. 2013;32(8):911. [ Links ]
6. American Academy of Pediatrics. Respiratory syncytial virus. In: Red Book: 2012 Report of the Committee on Infectious Diseases, 29th, Pickering LK (Ed), American Academy of Pediatrics, Elk Grove Village, IL 2012. p.609. [ Links ]
7. Shay DK, Holman RC, Newman RD, Liu LL, Stout JW, Anderson LJ Bronchiolitis-associated hospitalizations among US children, 1980-1996. JAMA. 1999;282(15):1440. [ Links ]
8. Stockman LJ, Curns AT, Anderson LJ, Fischer-Langley G Respiratory syncytial virus-associated hospitalizations among infants and young children in the United States, 1997-2006. Pediatr Infect Dis J. 2012;31(1):5. [ Links ]
9. Nair H, Nokes DJ, Gessner BD, Dherani M, Madhi SA, Singleton RJ, et all. Global burden of acute lower respiratory infections due to respiratory syncytial virus in young children: a systematic review and meta-analysis. Lancet. 2010; 375(9725):1545. [ Links ]
10. Instituto Nacional de Salud. Informe de la vigilancia de influenza y otros virus respiratorios basada en laboratorio. Lima-Perú: 2015. [ Links ]
11. Thompson WW, Shay DK, Weintraub E, Brammer L, Cox N, Anderson LJ, Fukuda K. Mortality associated with influenza and respiratory syncytial virus in the United States. JAMA. 2003;289(2):179. [ Links ]
12. Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et. all. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 2012 Dec;380(9859):2095-128. [ Links ]
13. Glezen WP, Taber LH, Frank AL, Kasel JA. Risk of primary infection and reinfection with respiratory syncytial virus. Am J Dis Child. 1986;140(6):543. [ Links ]
14. Hall CB, Long CE, Schnabel KC. Respiratory syncytial virus infections in previously healthy working adults. Clin Infect Dis. 2001;33(6):792. [ Links ]
15. Openshaw PJ, Culley FJ, Olszewska W. Immunopathogenesis of vaccine-enhanced RSV disease.Vaccine.2001;20(1): 27-31. [ Links ]
16. Weisman LE;. Respiratory syncytial virus prevention and treatment: past,present, and future. CardiovascHematol Agents. Med Chem. 2009;7:223-33. [ Links ]
17. Shadman KA, Wald ER. A review of palivizumab and emerging therapies for respiratory syncytial virus. Expert Opin Biol Ther. 2011;11(11):1455-67. [ Links ]
18. Hartling L, Bialy LM, Vandermeer B, Tjosvold L, Johnson DW, Plint AC, et al. Epinephrine for bronchiolitis. Cochrane Database Syst Rev. 2011 Jun 15;(6). [ Links ]
19. Gadomski AM, Scribani MB. Bronchodilators for bronchiolitis. Cochrane Database Syst Rev. 2014 Jun 17;6. [ Links ]
20. Cade A, Brownlee KG, Conway SP, Haigh D, Short A, Brown J, et al. Randomised placebo controlled trial of nebulised corticosteroids in acute respiratory syncytial viral bronchiolitis. Arch Dis Child. 2000 Feb; 82(2): 126–130. [ Links ]
21. Van Woensel JB, Vyas H, STAR Trial Group. Dexamethasone in children mechanically ventilated for lower respiratory tract infection caused by respiratory syncytial virus: a randomized controlled trial. Crit Care Med. 2011 Jul;39(7):1779-83. [ Links ]
22. Patel H, Platt R, Lozano JM, Wang EE. Glucocorticoids for acute viral bronchiolitis in infants and young children. Cochrane Database Syst Rev. 2004;(3). [ Links ]
23. Lozano JM. Bronchiolitis. Clin Evid. 2004; Department of Paediatrics and Clinical Epidemiology Unit, School of Medicine, Universidad Javeriana, BogotáDC, Colombia. [ Links ]
24. King VJ, Viswanathan M, Bordley WC, Jackman AM, Sutton SF, Lohr KN, Carey TS. Pharmacologic treatment of bronchiolitis in infants and children: a systematic review. Arch Pediatr Adolesc Med. 2004 Feb; 158(2):127-37. [ Links ]
25. Spurling G, Doust J, Del Mar C. Eriksson L Antibiotics for bronchiolitis in children. Cochrane Database Syst Rev. 2011 Jun 15;(6):CD005189. [ Links ]
26. Collard M, Moreno L, Bujedo E, Marquez I, Mosca L, Ferreira P, et all. Prescripción de antibióticos en lactantes hospitalizados con neumonía por virus Sincitial respiratorio. Arch Argent Pediatr 2008; 106(6):515-517. [ Links ]
27. Farley R, Spurling GKP, Eriksson L, Del Mar CB. Antibiotics for bronchiolitis in children under two years of age. Cochrane Database of Systematic Reviews 2014, Issue 10. Art. No.: CD005189. [ Links ]
28. Directiva Sanitaria para la Vigilancia Epidemiológica de Influenza, de Otros Virus Respiratorios (OVR) e Infecciones Respiratorias Agudas Graves (IRAG) en el Perú. MINSA–DGE v01 2012.
29. Directiva Sanitaria para la Vigilancia de lãs Infecciones Respiratorias Agudas MINSA-DGE v01 2014.
Fuentes de financiamiento Este artículo ha sido financiado por los autores.
Conflictos de interés Los autores declaran no tener ningún conflicto de interés.
Correspondencia Hugo Antonio Mezarina Esquivel Dirección: Rodrigo de Triana 121 – 01 Santa Patricia La Molina Teléfono: 051-3494412 Correo electrónico: huanmes@yahoo.es
Recibido: 25 de junio de 2016
Aprobado: 26 de julio de 2016













