Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Horizonte Médico (Lima)
versión impresa ISSN 1727-558X
Horiz. Med. vol.18 no.3 Lima jul./set. 2018
http://dx.doi.org/10.24265/horizmed.2018.v18n3.04
ARTÍCULO ORIGINAL
Biopelículas y genes icaA e icaD en estafilococos coagulasa negativos aislados de catéter endovenoso central en Unidad de Cuidados Intensivos de un Hospital Nivel III en Lima, Perú
Biofilms and icaA and icaD genes in coagulase-negative staphylococci isolated from central venous catheters from the intensive care unit of a level III hospital in Lima, Peru
María E Salazar1 ORCID iD: https://orcid.org/0000-0002-5661-4752, Víctor Crispín1 ORCID iD: https://orcid.org/0000-0003-3863-2698
1. Universidad Nacional Mayor de San Marcos, Facultad de Farmacia y Bioquímica, Instituto de Investigación en Química Biológica, Microbiología y Biotecnología "Marco Antonio Garrido Malo". Lima, Perú.
RESUMEN
Objetivo: Determinar la presencia de los genes icaA e icaD en estafilococos coagulasa negativos (SCoN) formadores de biopelículas aislados de catéteres venosos centrales (CVC) provenientes de UCI del Hospital Nacional Guillermo Almenara Irigoyen (HNGAI). Materiales y métodos: Se colectaron 151 CVC del HNGAI de Lima. Para el análisis microbiológico, se seleccionaron en forma aleatoria, 30 para el método de Maki y 121 para el método de Donlan. Se obtuvo en total, 73 aislados de SCoN, a los que se evaluó la capacidad de formar biopelículas utilizando agar rojo de Congo (ARC). A los aislados ARC positivos se les determinó la presencia de los genes icaA e icaD mediante la reacción en cadena de la polimerasa (PCR). Resultados: De 27 SCoN aislados del exterior de los CVC, 81 % (22/30) fueron ARC positivas, de los cuales 13,6 % (3/22) presentaron ambos genes; de los 46 SCoN aislados del interior de los CVC, 48 % (22/46) fueron ARC positivas, de los que 22,7 % (5/22) presentaron ambos genes. Conclusiones: 13,6 % y 22,7 % de los SCoN formadores de biopelículas y aislados del exterior e interior de CVC respectivamente, fueron portadores de ambos genes icaA e icaD.
Palabras clave: Estafilocoagulasa; Biopelículas; Operón; Unidades de cuidados intensivos; Catéteres venosos centrales (Fuente: DeCS BIREME).
ABSTRACT
Objective: To determine the presence of icaA and icaD genes in biofilm-forming coagulase-negative staphylococci (CoNS) isolated from central venous catheters (CVCs) from the intensive care unit of the Hospital Nacional Guillermo Almenara Irigoyen (HNGAI). Materials and methods: One hundred fifty-one (151) CVCs were collected from the HNGAI in Lima. For the microbiological analysis, 30 CVCs were randomly selected for the Maki method and 121 for the Donlan method. A total of 73 CoNS isolates were obtained and their ability to form biofilms was evaluated using Congo red agar (CRA). CRA-positive isolates showed the presence of icaA and icaD genes by polymerase chain reaction (PCR). Results: Out of the 27 CoNS isolated from the external surface of the CVCs, 81 % (22/30) were CRA positive, of which 13.6 % (3/22) presented both genes. Out of the 46 CoNS isolated from the internal surface of the CVCs, 48 % (22/46) were CRA positive, of which 22.7 % (5/22) showed both genes. Conclusions: Thirteen point six percent (13.6 %) and 22.7 % of the biofilm-forming CoNS isolated from the external and internal surfaces of the CVCs, respectively, were carriers of both icaA and icaD genes.
Keywords: Coagulase; Biofilms; Operon; Intensive care units; Central venous catheters (Source: MeSH NLM).
INTRODUCCIÓN
Las infecciones intrahospitalarias (IIH) constituyen un importante problema de salud pública, presentan elevada morbimortalidad, causan un fuerte impacto en la economía de los países y son la causa más prevenible de eventos adversos graves en pacientes hospitalizados (1). En el Perú, el Centro Nacional de Epidemiología, Prevención y Control de Enfermedades, identifica la Unidad de Cuidados Intensivos como uno de los servicios hospitalarios para la vigilancia de las IIH, siendo el catéter venoso central (CVC) el factor asociado a las infecciones del torrente sanguíneo (2). Entre las bacterias multirresistentes que pueden colonizar con mayor frecuencia a pacientes que ingresan a áreas críticas se puede mencionar Pseudomonas aeruginosa, Staphylococcus aureus, Escherichia coli, Klebsiella pneumoniae, Acinetobacter baumannii, sin dejar de mencionar que el personal de salud presenta en su mayoría una colonización por cocos gram positivos del género Staphylococcus, principalmente coagulasa negativos (3), por lo que puede constituir un reservorio para las IIH que afectan principalmente a los pacientes inmunocomprometidos, particularmente aquellos que necesitan el uso de dispositivos médicos.
La emergencia de los estafilococos coagulasa negativos (SCoN) como patógenos oportunistas posiblemente esté relacionada a su capacidad de formación de biopelículas. Este proceso de formación está dividido por lo menos en tres fases: la adherencia reversible de la bacteria a una superficie, la adherencia irreversible y la fase acumulativa cuando la bacteria inicia el establecimiento de una arquitectura tridimensional, multicelular y multicapas, en la que muchas bacterias no tienen contacto directo con la superficie, y desde la cual pueden desprenderse para poder colonizar otros lugares (4).
Definitivamente, podría afirmarse que la adherencia es crítica en el establecimiento de la biopelícula, y para los SCoN la producción de una adhesina intercelular polisacárida (PIA) es la responsable. PIA es sintetizada a partir de la UDP-N-acetilglucosamina por la N-acetilglucosamina transferasa (5) codificada particularmente por icaA en el operón de genes de adhesión intercelular (ica) (6), aunque parecería que icaD también tendría un rol importante. Las bacterias inmersas en estas biopelículas maduras están protegidas de la acción del sistema inmune y son más tolerantes a los antibióticos que aquellas de crecimiento plactónico, y las IIH causadas por ellas y asociadas al uso de dispositivos médicos, a menudo son persistentes y reincidentes.
Por ello, se planteó como objetivo determinar la presencia de los genes icaA e icaD en aislados de SCoN formadores de biopelículas provenientes de CVC de pacientes de UCI de un Hospital Nivel III.
MATERIALES Y MÉTODOS
El estudio observacional, descriptivo y prospectivo fue realizado en el Instituto de Investigación en Química Biológica, Microbiología y Biotecnología "Marco Antonio Garrido Malo" de la Facultad de Farmacia y Bioquímica de la Universidad Nacional Mayor de San Marcos.
Muestra y procesamiento
Se recolectaron 151 catéteres endovenosos centrales procedentes de pacientes de UCI del Hospital Nacional Guillermo Almenara Irigoyen del departamento de Lima, fueron transportados a 4°C y procesados dentro de las 24 horas. Para el análisis microbiológico de la parte externa (según el método semicuantitativo de Maki (7)) e interna (según el protocolo de Donlan et al. (8)) de los CVC, se seleccionaron en forma aleatoria, 30 y 121 respectivamente. Control negativo: S. epidermidis ATCC 12228 no formador de biopelícula; y control positivo S. epidermidis ATCC 35984 formador de biopelícula.
El método recomendado por Maki et al. (7), consiste en el rodamiento en cuatro direcciones del extremo del catéter sobre agar sangre, incubación a 37 °C por 24 horas y luego se procede al recuento de unidades formadoras de colonias (UFC). Un recuento mayor a 15 UFC podría dar indicios de una infección asociada al catéter. En este trabajo, se seleccionaron las colonias sospechosas de ser estafilococos. Para el procesamiento de la parte interna del catéter (8), se procedió a la desinfección de la parte externa con lejía comercial 10 % y luego se neutralizó. Se colocó el catéter en PBS llevándose a sonicación (42 kHz) para finalmente homogenizar mediante vórtex. La siembra se realizó por estrías en agar tripticasa de soya y agar manitol sal, se incubó a 37 °C por 24 horas.
Identificación microbiológica
Se procedió según las especificaciones del Manual de procedimientos de laboratorio en infecciones intrahospitalarias del Instituto Nacional de Salud (9), seleccionando los estafilococos coagulasa negativos.
Capacidad de formación de biopelículas (10)
Se cultivó cada aislado en agar rojo de Congo (ARC), incubación a 37 °C por 24 horas y después a 20 °C por 24 horas adicionales. Se consideran formadores de biopelículas aquellos que presentan colonias negras, secas y cristalinas, los no formadores desarrollan colonias rojas.
Reacción en cadena de la polimerasa
Para la extracción de ADN se sembró una colonia en caldo BHI, después de la incubación de 24 horas a 37 °C se centrifugó 100 µL de cultivo, las células se resuspendieron en 45 µL de agua, y se añadió 5 µL de lisostafina incubándose a 37 °C. Después de 10 minutos se adicionó 5 µL de proteinasa K y 150 µL de Tris-HCl (pH 7,5) y se continuó la incubación por 10 minutos adicionales. Luego se sometieron a ebullición por 5 minutos. Se realizó PCR simple: para la detección del gen icaA se usaron los cebadores: 5’-TCTCTTGCAGGAGCAATCAA-3’ y 5’-TCAGGCACTAACATCCAGCA-3’, los cuales amplifican una región de 188 pb. Para la detección de icaD se usó, 5’-ATGGTCAAGCCCAGACAGAG-3’ y 5’-CGTGTTTTCAACATTTAATGCAA-3’, para una región de 198 pb. Las reacciones se realizaron en un volumen final de 25 µL; 1 µM de cada cebador, 150 ng de ADN, 100 µM de dATP, dCTP, dGTP y dTTP, 1U de Taq polimerasa y buffer (10mM Tris-HCl pH 9,0, 50 mM KCl, 0,1 % Tritón X-100 y 2,5 mM de MgCl2). El programa de temperaturas para ambos genes fue desnaturalización inicial 94 °C por 5 minutos, luego 50X: 94 °C por 30 segundos para desnaturalización, 55,5 °C por 30 segundos para el alineamiento y 72 °C por 30 segundos de extensión, finalizando con 72 °C por 1 minuto. Después de los primeros 30 ciclos, se añadió 1 U de Taq polimerasa. Luego de la amplificación, 10 µL de los productos amplificados fueron analizados mediante electroforesis en gel de agarosa 2 % en TBE 1X. Para visualizar los productos amplificados se utilizó bromuro de etidio (11).
RESULTADOS
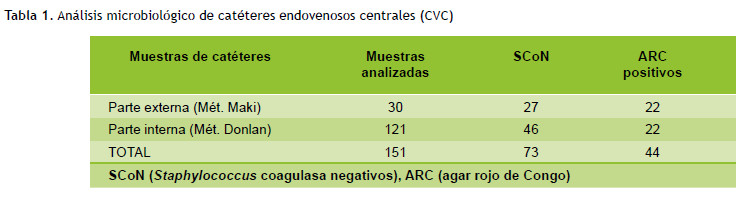
Los 151 CVC se analizaron microbiológicamente, de un grupo de 30 muestras evaluadas por el método de Maki (aislamiento del exterior del catéter) se obtuvieron 27 SCoN, del grupo que incluía 121 CVC y evaluado por el método de Donlan et al. (aislamiento del interior del catéter), se aislaron 46 SCoN. A los aislados de ambos grupos se les evaluó la capacidad de formar biopelículas observando las características de las colonias en el agar rojo de Congo, y los positivos (Figura 1) a esta prueba fueron 81 % (22/27) y 48 % (22/46) de los aislados provenientes de la parte externa e interna respectivamente (Tabla 1).
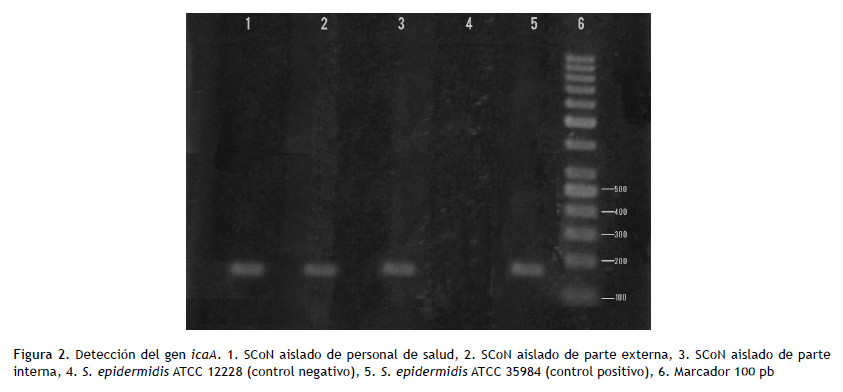
Luego se amplificaron los genes icaA e icaD en las cepas positivas a ARC, obteniendo como resultado que 13,6 % (3/22) y 22,7 % (5/22) de los aislados provenientes de la parte externa e interna respectivamente, presentaron ambos genes (Figura 2).
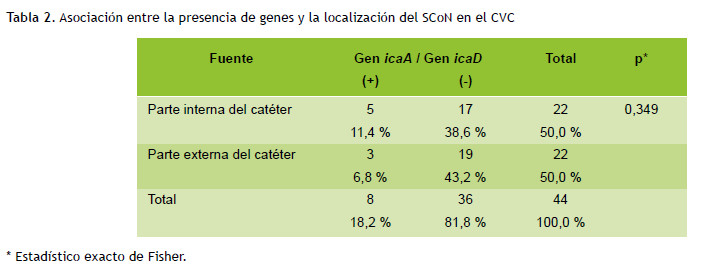
Para evaluar la existencia de una relación entre la presencia de los genes y la localización del SCoN en el catéter, se utilizó la prueba exacta de Fisher con dos variables categóricas dicotómicas concluyendo que no hay relación (Tabla 2).
DISCUSIÓN
Los SCoN son un grupo de microorganismos usualmente considerados inocuos y que forman parte de la flora saprofita de la piel humana; las infecciones causadas por ellos están muy relacionadas al uso de dispositivos médicos, sin los cuales no habría la disposición del paciente a la IIH, lo cual se evidencia en el presente trabajo al aislarlos en la parte externa e interna de CVC retirados de pacientes de UCI.
El método recomendado por Freeman et al. (10) que usa el agar rojo de Congo es un método alternativo de elección para la detección de la capacidad productora de biopelículas, y consideramos que sería más adecuado para el género Staphylococcus, lo que coincide con Peña et al. (12) que mencionan que hay especificidad por la reacción química del exopolisacárido de Staphylococcus con el colorante rojo de Congo. Evidenciar la formación de polisacárido por los SCoN podría estar cumpliendo un rol importante en la patogénesis de estos microorganismos y como marcador de virulencia, lo que contribuiría a la discriminación preliminar de los aislados contaminantes.
Sin embargo, las cepas aisladas de la parte externa e interna de los CVC y que evidenciaron coloración negra mediante este método, no han tenido una total correspondencia con los resultados moleculares, probablemente debido a que otros genes estarían implicados en la formación de biopelículas por SCoN, o por la posibilidad que los aislados presenten una fase de variación en la formación de biopelículas, causada por inserción en diferentes sitios del operón ica (13), o porque estos genes se superponen y son cotranscritos(14). Pinheiro et al. (5) encontraron que los aislados que fueron positivos para el gen icaA fueron también positivos para icaD lo que coincide con nuestros resultados, donde las cepas positivas tuvieron la presencia de ambos genes. La expresión simultánea de estos genes parece promover un incremento significativo de la N-acetilglucosamina transferasa; otra posibilidad sería que la proteína IcaA requiera de IcaD, para asumir una conformación activa. Zmantar et al. (15) mencionan que las diferencias entre el fenotipo y el genotipo podrían deberse a que la expresión de ica estaría influenciada por las condiciones ambientales, como la osmolaridad, condiciones anaeróbicas durante su crecimiento, temperaturas altas y concentraciones subinhibitorias de ciertos antibióticos que facilitarían la transcripción de ica y la formación de biopelículas; por lo que no se puede dejar de considerar que las características clínicas de los pacientes que presentaron IIH asociadas a CVC, así como los tratamientos recibidos, podría haber influenciado en el comportamiento de los aislados en el laboratorio. La habilidad de los estafilococos para adherirse y proliferar podría explicar su habilidad para colonizar los dispositivos médicos en los hospitales, especialmente en las UCI.
En conclusión (16), de las 151 muestras de CVC se obtuvieron 27 aislados de SCoN de la parte externa y 46 de la parte interna. En la prueba que utilizó el agar rojo de Congo para evaluar la capacidad de formar biopelículas, 81,4 % (22/27) de los aislados de la parte externa y 47,8 % (22/46) de la parte interna del catéter fueron positivos. De estos aislados positivos en ARC, en 13,6 % (3/22) y 22,7 % (5/22) de la parte externa e interna respectivamente, se detectó la presencia de ambos genes icaA e icaD, no mostrándose relación (prueba exacta de Fisher) entre la presencia de genes y la localización del SCoN en el CVC. A pesar de los resultados obtenidos, que señalan una baja prevalencia de los genes responsables de la formación del exopolisacárido en las cepas clínicas evaluadas, hay que señalar la importancia del control y prevención de la colonización por estas bacterias, ya que se pueden incrementar las oportunidades para la transferencia genética entre ellas y hacer de una bacteria comensal avirulenta, un patógeno en potencia.
Agradecimiento: Al Dr. Enrique Paz, Jefe de UCI del HNGAI, por las coordinaciones realizadas para la colección de muestras.
REFERENCIAS BIBLIOGRÁFICAS
1. Pujol M, Limón E. Epidemiología general de las infecciones nosocomiales. Sistemas y programas de vigilancia. Enferm Infecc Microbiol Clin. 2013; 31(2): 108-13. [ Links ]
2. Peru, Ministerio de Salud [base de datos en línea]. Lima: Centro Nacional de Epidemiología, Prevención y Control de Enfermedades; 2018. Disponible en: http://www. [ Links ]dge.gob.pe/portal/index.php?option=com content&view=article&id=398&Itemid=248
3. Aguilar F, Aguilar S, Cubas D, Coaguila L, Fernández D, Moreno M, et al. Portadores de bacterias multirresistentes de importancia clínica en áreas críticas (UCI-UCIN) de un hospital del norte del Perú. Horiz Med. 2016; 16 (3): 50-7 [ Links ]
4. Buttner H, Mack D, Rohde H. Structural basis of Staphylococcus epidermidis biofilm formation: mechanisms and molecular interactions. Front Cell Infect Microbiol. 2015; 5: 14. [ Links ]
5. Pinheiro L, Ivo C, Cataneli V, Oliveira A, Henrique C, Ribeiro M. Reduced susceptibility to vancomycin and biofilm formation in methicillin-resistant Staphylococcus epidermidis isolated from blood cultures. Mem Inst Oswaldo Cruz. 2014; 109 (7): 871-878. [ Links ]
6. Argudín MA, Vanderhaeghen W, Vandendriessche I, Denis O, Coenye T, Butaye P. Biofilm formation of ica operonpositive Staphylococcus epidermidis from different sources. APMIS. 2015; 123 (12): 1081-1089. [ Links ]
7. Maki D, Weise C, Sarafin H. A semiquantitative culture method for identifying intravenous-catheter-related infection. N Engl J Med. 1977; 296(23): 1305-1309. [ Links ]
8. Donlan R, Murga R, Bell M, Toscano M, Carr J, Novicki T,et al. Protocol for Detection of Biofilms on Needleless Connectors Attached to Central Venous Catheters. J Clin Microb. 2001; 39(2): 750-753 [ Links ]
9. Instituto Nacional de Salud. Manual de Procedimientos Bacteriológicos en Infecciones Intrahospitalarias. Lima. INS. 2001. Serie de Normas Técnicas N° 28. [ Links ]
10. Freeman D, Falkiner F, Keane C. New method for detecting slime production by coagulase negative Staphylococci. J Clin Pathol. 1989; 42(8): 872-874. [ Links ]
11. Arciola C, Baldassarri L, Montanaro L. Presence of icaA e icaD genes and slime production in a collection of Staphylococcal strains from catheter associated infections. J Clin Microbiol. 2001; 39 (6): 2151-2156. [ Links ]
12. Peña J, Uffo O. Producción de bioilme en genotipos de Staphylococcus aureus aislados de mastitis bovina en Cuba. Rev Salud Anim. 2013; 35 (3): 189-196. [ Links ]
13. Kiem S, Sup W, Ran K, Yong N, Lee JY, Song JH et al. Phase variation of biofilms formation in Staphylococcus aureus by IS256 insertion and its impact on the capacity adhering to polyurethane surface. J Korean Med Sci. 2004; 19(6): 779-782. [ Links ]
14. Zhou S, Chao X, Fei M, Dai Y, Liu B. Analysis of S. epidermidis icaA and icaA genes by polymerase chain reaction and slime production: a case control study. BMC Infect Dis. 2013; 13: 242. [ Links ]
15. Zmantar T, Chaieb K, Makni H, Miladí H, Abdallah FB, Mahdouani K, et al. Detection by PCR of adhesins genes and slime production in clinical Staphylococcus aureus. J Basic Microbiol. 2008; 48(4): 308-314. [ Links ]
16. Salazar-Salvatierra ME. Detección de los genes icaA e icaD en estafilococos coagulasa negativos productores de biopelículas en catéteres endovenosos de la UCI del HNGAI. [Tesis de Maestría]. Lima, Perú. Universidad Nacional Mayor de San Marcos, 2009. 57 pp. [ Links ]
Fuentes de financiamiento:
Este artículo ha sido financiado por los autores.
Conflictos de interés:
Los autores declaran no tener ningún conflicto de interés.
Correspondencia:
María Elena Salazar Salvatierra Dirección: Jr. Puno 1002. Lima, Perú.
Teléfono: 3652300 / 182
Correo electrónico: msalazars@unmsm.edu.pe
Recibido: 19 de marzo de 2018.
Evaluado: 17 de abril de 2018.
Aprobado: 08 de mayo de 2018.