Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO
Compartir
Horizonte Médico (Lima)
versión impresa ISSN 1727-558X
Horiz. Med. vol.18 no.3 Lima jul./set. 2018
http://dx.doi.org/10.24265/horizmed.2018.v18n3.11
ARTÍCULO DE REVISIÓN
Inmunología del cáncer I: bases moleculares y celulares de la respuesta inmune antitumoral
Cancer immunology I: molecular and cellular bases of the antitumor immune response
Joel de León1 ORCID iD https://orcid.org/0000-0002-3664-8023, Arturo Pareja1 ORCID iD: https://orcid.org/0000-0002-5988-5515
1. Universidad de San Martín de Porres, Facultad de Medicina Humana, Instituto de Investigación, Centro de Investigación de Infectología e Inmunología. Lima, Perú.
RESUMEN
Significativos recursos materiales, financieros y humanos se dedican a la investigación de la biología del cáncer. La validación de biomarcadores, el desarrollo de novedosos métodos para el diagnóstico y la terapia, la implementación de programas de pesquisa a nivel poblacional y la promoción de estilos de vida saludables han impactado positivamente en la prevención y control de este grupo de enfermedades. Sin embargo, el cáncer sigue siendo un problema de salud mundial, entre otros factores, por la compleja relación que se establece entre el sistema inmune del hospedero y las células neoplásicas. Está demostrado que los mecanismos efectores que posee el sistema inmune permiten detectar y eliminar las células transformadas. Sin embargo, estos mismos mecanismos promueven la evolución somática de los tumores, al seleccionar variantes celulares resistentes a la acción de la inmunidad. Esta interacción ocurre fundamentalmente en el microambiente tumoral y ha sido conceptualizada como inmunoedición tumoral. Lo anterior sustenta la racionalidad de la inmunoterapia, la que buscar reforzar la inmunidad antitumoral, a la vez que bloquea los mecanismos de evasión a la inmunovigilancia. Con este trabajo de revisión iniciamos una serie de tres artículos que, en este orden, recorrerán las bases moleculares y celulares de la respuesta inmune antitumoral, presentarán los fundamentos de la biología tumoral y, finalmente, abordarán las implicaciones de la compleja relación entre el sistema inmune y las neoplasias para la inmunoterapia en cáncer.
Palabras claves: Sistema inmunológico; Procesos del sistema inmunológico; Inmunovigilancia; Cáncer (Fuente: DeCS BIREME).
ABSTRACT
Substantial material, financial and human resources are dedicated to research on tumor biology. The validation of biomarkers, the development of novel diagnostic and therapeutic methods, the implementation of early detection programs in communities, and the promotion of healthy lifestyles have positively impacted on the prevention and control of this group of diseases. However, cancer remains a global health problem, due to the complex relationship between the host immune system and the cancer cells. It is a fact that the immune system´s effector mechanisms enable the detection and elimination of cancer cells. However, these immune mechanisms also promote the somatic evolution of tumors by selecting cellular clones resistant to immunity. This complex relationship conceptualized as cancer immunoediting develops mainly at the tumor microenvironment. Immunotherapy approaches are designed to reinforce antitumor immunity, while blocking immune escape mechanisms. This review starts a series of three articles that are going to review the molecular and cellular bases of the antitumor immune response, present the bases of tumor biology and, finally, address the implications of the complex relationship between the immune system and neoplasias for cancer immunotherapy.
Keywords: Immune system; Immune system phenomena; Immune monitoring; Neoplasms (Source: MeSH NLM).
INTRODUCCIÓN
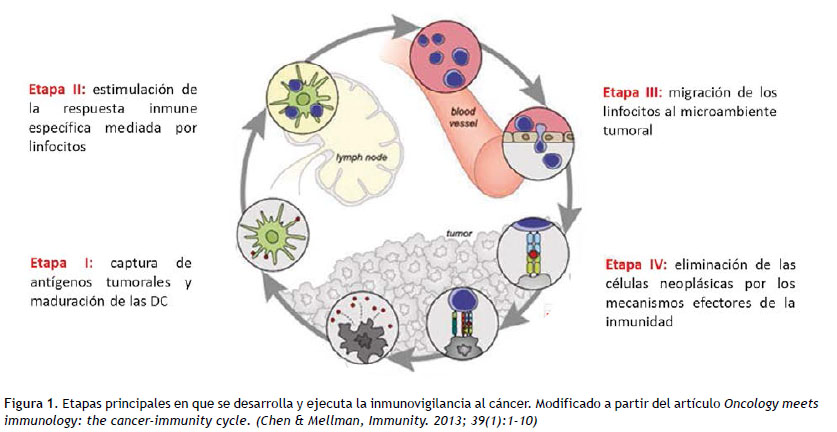
La inmunovigilancia es la habilidad del sistema inmune (SI) de detectar y eliminar células en alguna de las múltiples etapas del proceso de carcinogénesis (1). Este fenómeno se ha sustentado en evidencias provenientes de estudios con modelos animales inmunodeficientes (2), y en pacientes con trastornos en la actividad del SI (2). Se ha demostrado la relación entre la presencia en el microambiente tumoral de células de la inmunidad con actividad citotóxica y el pronóstico de pacientes con distintos tipos de tumores (3,4).
La inmunovigilancia es un proceso que se desarrolla en cuatro etapas principales. Como se representa en la Figura 1, inicia con la detección de antígenos específicos o asociados al tumor por parte de las células presentadoras de antígeno (APC del inglés Antigen Presenting Cells). En esta etapa las células dendríticas (DC, del inglés Dendritic Cells) son protagónicas, lo que se debe a su localización, su perfil de expresión de receptores de antígenos y su capacidad migratoria (5). Esta primera etapa concluye con la maduración de las DC (evento que se detallará más adelante en el desarrollo de esta revisión) y su migración a los linfonodos adyacentes al tejido en carcinogénesis. La segunda etapa implica la activación de la respuesta antitumoral específica mediada, fundamentalmente, por linfocitos T auxiliadores CD4+ y citotóxicos CD8+.
Estos reciben señales de activación, proliferación y diferenciación funcional tras la interacción con las DC. La migración efectiva de los linfocitos activados al tejido alterado, y su extravasación para interactuar con las células transformadas, constituye la tercera etapa de este proceso. Por último, se ejecutan los mecanismos efectores de la inmunidad que deben conducir a la eliminación de las células transformadas. En esta cuarta etapa se induce la muerte de las células con la consecuente liberación de antígenos tumorales en un contexto inflamatorio, lo que promueven la estimulación de las DC, reiniciando un proceso cíclico virtuoso (6). La influencia de la inmunovigilancia en la progresión tumoral es tan relevante que se ha demostrado el valor pronóstico y predictivo de la composición y localización del infiltrado inmune en el microambiente tumoral (3,7,8).
Sin embargo, la inestabilidad genética que caracteriza el proceso de carcinogénesis (9-11) favorece la aparición de clones celulares resistentes a la actividad del SI, lo que es considerado un proceso de edición tumoral estimulado por la inmunovigilancia (2,12,13). Esta resistencia al control del SI involucra diversos mecanismos, los que limitan la efectividad de una o varias de las fases del ciclo de relación entre el SI y los tumores (2,14).
La presente revisión da inicio a una serie de tres trabajos que recopilan los aspectos más novedosos relacionados con las bases de la inmunología del cáncer y su impacto en el desarrollo de la inmunoterapia. En este primer trabajo se destacan las características de los componentes de la respuesta inmune involucrados en la vigilancia al desarrollo del cáncer, la dinámica de la relación entre estos, así como el establecimiento y regulación de sus mecanismos efectores.
Sistema inmune: generalidades
El SI es una densa red de moléculas y células que actúan de manera coordinada para garantizar el mantenimiento o restablecimiento de la homeostasis en los diferentes tejidos del organismo. A la luz de los conocimientos actuales, se valora la relevancia del SI no solo por su capacidad de discriminar entre aquellos elementos propios o ajenos al hospedero, sino por su habilidad para detectar señales de peligro, independientemente de su origen (15). Lo anterior explica la reactividad del SI a la carcinogénesis, considerando su efecto negativo sobre la homeostasis tisular y la expresión alterada de antígenos en las células neoplásicas (16,17). Estos antígenos actúan como señales moleculares de peligro para el SI, a pesar del carácter "propio" de las células transformadas.
El reconocimiento de los antígenos se basa en la expresión de una amplia gama de receptores, distribuidos de manera heterogénea en las diversas poblaciones celulares del SI (18,19,20). Estos reconocen diferentes patrones moleculares en los antígenos, lo que conduce a la estimulación del mecanismo efector que resulte más eficiente para restablecer la homeostasis en el tejido insultado.
Los componentes del SI se distribuyen en órganos linfoides con diferentes características histológicas y grado de organización. Lo anterior permite la activación del mecanismo efector más eficiente, en dependencia del sitio más probable de contacto con el antígeno. Una densa red de vasos linfáticos, el sistema circulatorio, y una gran diversidad de moléculas con capacidad quimiotáctica aseguran la comunicación entre los diferentes puntos de la geografía del SI (21,22).
La distribución y características de los receptores que permiten el reconocimiento de los antígenos, la inmediatez de la respuesta y la capacidad de generar memoria inmune son elementos que dividen la respuesta inmune en dos grandes categorías: la respuesta inmune innata, de mayor antigüedad filogenética que ha coevolucionado con nuestra especie y ha fijado genéticamente un grupo de receptores que reconocen patrones moleculares con poca especificidad (18); y la respuesta inmune adquirida, basada en el reconocimiento de antígenos con receptores que se distribuyen de manera clonal, con muy alta variabilidad y especificidad (19,20).
Los componentes del SI innato reaccionan en dependencia de la experiencia de contacto con patógenos y otros mediadores de daño tisular que ha tenido la especie durante la evolución, mientras que la reactividad del SI adquirido genera una memoria basada en la experiencia de contacto con antígenos que ha tenido cada individuo. Los mecanismos efectores asociados a ambas ramas de la respuesta inmune participan en la inmunovigilancia al cáncer (2,23).
Los vertiginosos avances tecnológicos de las dos últimas décadas, y el desarrollo de modelos celulares y animales basados en herramientas de la ingeniería genética (24), han permitido profundizar en el papel del SI en la etiopatogenia del cáncer. Además, han propiciado el diseño, validación e implementación de diversas estrategias de inmunoterapia (25). La descripción de nuevas moléculas y subpoblaciones celulares involucradas en la inmunidad, así como el conocimiento acerca de la influencia del metabolismo celular (26) y la composición de la microbiota en la regulación de la respuesta inmune (27), han aportado nuevos alcances a la descripción de la relación entre el SI y las neoplasias.
Sistema inmune: principales componentes celulares y moleculares
Componentes moleculares del sistema inmune
Receptores de antígenos
La reactividad del SI está determinada, en primer lugar, por la naturaleza del antígeno que es reconocido. Gran diversidad de receptores se han agrupado en la categoría receptores de patrones moleculares (PRR, del inglés Pattern Recognition Receptors). Estos se expresan preferentemente en células del sistema innato (28), aunque también se presentan en células de la inmunidad adaptativa (29,30). Los mismos se caracterizan por reconocer patrones moleculares, tanto asociados a patógenos (PAMPs, del inglés Patogen Associated Molecular Patterns) como a señales de peligro (DAMPs, del inglés Danger Associated Molecular Patterns). Los PRR se distribuyen de manera no clonal, y se expresan en la membrana plasmática, en el citoplasma celular o son secretados (31). Entre los PRR destacan los receptores tipo Toll (TLR, del inglés Toll-like receptors). La estructura, localización celular, mecanismos de transducción de señales y ligando principales de los TLR han sido extensamente estudiados (32). Otros receptores que se clasifican como PRR son los llamados receptores basureros (33), los receptores β-glucanos (34), las lectinas que reconocen manosa (35), y los receptores tipo NOD (NLR, del inglés NOD-like receptors) (36). Estos últimos tiene un importante papel en la activación de los inflamasomas (37), estructuras supramoleculares que median la maduración de mediadores inflamatorios.
A diferencia de los PRR, los receptores de antígeno expresados en los linfocitos B (BCR, del inglés B-cells receptor) y T (TCR, del inglés T-cells receptor) se caracterizan por tener una elevada especificidad y su distribución es clonal. Estos receptores se expresan durante la linfopoyesis en los órganos linfoides primarios: la médula ósea en el caso de los linfocitos B y el timo en el caso de los linfocitos T auxiliadores (T CD4+) y citotóxicos (T CD8+). Ambos receptores poseen en su estructura dominios de reconocimiento antigénico, zonas de muy alta variabilidad en la composición de aminoácidos, lo que confieren a estas poblaciones celulares una gran diversidad de reconocimiento. Esta variabilidad no está codificada en la línea germinal, sino que se produce a partir de la recombinación de varios segmentos de genes y la inserción de nucleótidos al azar durante el proceso de recombinación (38,39). Interesantemente, este proceso de generación de diversidad se produce en ausencia de contacto con el antígeno, lo que sustenta la ocurrencia de eventos de selección clonal durante la linfopoyesis para eliminar los clones autoreactivos (40,41). La selección clonal ocurre en los órganos linfoides primarios, en dos etapas principales: la selección positiva, en la que se asegura la supervivencia de los clones de linfocitos B y T que recombinaron adecuadamente sus receptores de reconocimiento de antígenos; y la selección negativa, en la que los clones que reconocen los antígenos propios con alta afinidad son eliminados por apoptosis (40,41). Durante este proceso también se produce la generación de linfocitos con actividad reguladora, fundamentalmente los llamados linfocitos T reguladores+ naturales o tímicos (tTreg), los que van a jugar un rol determinante en el control de la respuesta inmune en la periferia (42). Esta población, junto a los linfocitos T reguladores inducidos en la periferia (iTregs) (43), participan de los mecanismos de evasión tumoral a la inmunovigilancia (2).
Complejo principal de histocompatibilidad
Los linfocitos B tienen la capacidad de reconocer epítopos lineales o conformacionales en los antígenos, por contacto directo con el BCR. Sin embargo, los linfocitos T reconocen solamente epíotopos lineales generados a partir de un procesamiento previo del antígeno y presentados en el complejo principal de histocompatibilidad (MHC, del inglés Major Histocompatibility Complex).
El MHC es un complejo molecular, altamente polimórfico, que se divide en dos clases: el MHC I, formado por una cadena α altamente polimórfica y una segunda proteína de menor peso molecular, llamada β2-microglobulina, cuya secuencia es invariante; el MHC II, formado por dos cadenas polimórficas de similar peso molecular, nombradas α y β. En el caso del MHCI, presenta a los linfocitos T CD8+ péptidos de entre 8 a 11 aminoácidos, en un surco formado por el plegamiento de la cadena α (44). Por su parte, el MHC II presenta péptidos a los linfocitos T CD4+, de hasta 16 aminoácidos, insertados en un surco formado por las cadenas α y β (44). A diferencia del MHC I, que se expresa en todas las células nucleadas, el MHC II está expresado en poblaciones específicas con función APC. En esta categoría se incluyen las DC, los macrófagos y los linfocitos B (45), aunque otras poblaciones como los basófilos y los linfocitos Tγδ han evidenciado capacidad de presentación en MHCII (46,47). Las APC, especialmente las DC y los linfocitos B, juegan un rol determinante en la regulación de la respuesta inmune adaptativa, como se tratará más adelante.
La llamada maquinaria de procesamiento y presentación de antígenos está compuesta por una diversidad de moléculas que aseguran la fragmentación del antígeno, el acoplamiento de los péptidos generados a MHC I o II y la expresión en membrana de estas moléculas (48). Durante el procesamiento antigénico, aquellas moléculas endógenas de cada célula o generadas como consecuencia de infecciones intracelulares se procesan por la llamada vía endógena, y los péptidos son presentados en MHC I a los linfocitos T CD8+ (44). Por su parte, las moléculas que son incorporadas a la células por endocitosis, fagocitosis o por mediación de un receptor (ej. BCR), son procesadas por las APC y los péptidos se presentan en MHC II a los linfocitos T auxiliadores CD4+ (44). La presentación cruzada es un procesamiento alternativo de los antígenos exógenos que permite que estos sean presentados por las DC en MHC I (49). Este fenómeno es determinante para presentar antígenos virales (50) o tumorales a los linfocitos T CD8+ citotóxicos (51). La capacidad del SI de controlar la progresión del cáncer depende en gran medida de la presentación cruzada de antígenos. Una de las estrategias de evasión de los tumores a la inmunovigilancia es precisamente la reducción de la inmunogenicidad de las células neoplásicas, al afectar los mecanismos de procesamiento y presentación de antígenos (2).
Citocinas y quimiocinas
La comunicación entre las células del SI resulta determinante durante todas las etapas de generación, ejecución y regulación de la respuesta inmune. Esta señalización depende en gran medida de proteínas de bajo peso molecular llamadas citosinas, secretadas por células del SI y de otros tejidos (52). Las citosinas se agrupan en función de su estructura, el tipo de receptor que reconocen y la función principal que cumplen. La respuesta inmune involucra la liberación de un perfil o patrón de citosinas, las que tienen un efecto pleiotrópico dependiente del contexto en el que se producen (53).
Un tipo particular de citosinas son las quimiocinas, muy relevantes en el tráfico celular (54). La actividad coordinada de las quimiocinas, sus receptores, y otras moléculas como las selectinas e integrinas, regulan la migración de las diferentes células del SI (55).
Inmunoglobulinas
Las inmunoglobulinas o anticuerpos juegan un papel muy importante en el reconocimiento antigénico, la actividad efectora y regulación de la respuesta inmune (56,57). Son glicoproteínas que se expresan en la membrana plasmática de los linfocitos B como componente principal del BCR, o se secretan por las células plasmáticas. Estas últimas constituyen un estado de diferenciación de linfocitos B, inducido por el reconocimiento del antígeno (58). Las inmunoglobulinas están formadas por 4 cadenas de proteínas, dos ligeras con talla aproximada de 25 KDa (nombradas κ o λ, según su origen genético), y dos pesadas con talla de unos 50 KDa, lo que completa un peso molecular de unos 150KDa. En su estructura se identifican dos regiones principales: una variable o Fab, donde se ubica la zona responsable del reconocimiento antigénico; y una constante o Fc responsable de la actividad efectora de estas moléculas (56). Para el reconocimiento antigénico, las llamadas regiones determinantes de la complementariedad son muy importantes por su elevada variabilidad en la composición de aminoácidos (56).
Las inmunoglobulinas se dividen en 5 clases principales: IgE, IgA, IgD, IgM e IgG. Sus características generales son (56): 1) IgE, relevante en el control de infecciones parasitarias y en los procesos alérgicos; 2) IgA, con estructura dimérica, juega un rol protagónico en la inmunidad a nivel de mucosas; 3) IgD, se detecta solo en trazas en el suero, con una función principal como receptor en la membrana de los linfocitos B; 4) IgM, con estructura pentamérica, es muy relevante en la respuesta inmune primaria con elevada capacidad de opsonización y estimulación del sistema de complemento; 5) IgG, es la inmunoglobulina más abundante en suero; incluye 4 subclases (IgG1, IgG2, IgG3 e IgG4 en humanos); su capacidad de opsonización y de unión a receptores de la porción Fc estimula la actividad del complemento, la fagocitosis y la citotoxicidad mediada por las células asesinas naturales (NK, del inglés Natural Killer).
Componentes celulares del sistema inmune
Células del sistema inmune innato
El SI innato incluye un grupo diverso de poblaciones celulares cuyos receptores de reconocimiento antigénico no se distribuyen de manera clonal. Estas células no requieren un proceso de diferenciación para reaccionar ante las señales de peligro. Poblaciones como las células NK, NKT, Tγδ, los macrófagos y los neutrófilos, aunque participan en procesos de regulación de la respuesta inmune (59-61), tienen como papel principal la eliminación directa de microbios y células infectadas o neoplásicas.
Las DC juegan un papel protagónico en la regulación de la respuesta inmune, especialmente en la coordinación de la actividad del SI innato y adquirido (62). Estas constituyen un grupo heterogéneo de subpoblaciones celulares, que se distinguen por su fenotipo, localización y función (63). El contacto de las DC, a través de sus PRR con PMAPs o DAMPs, induce alteraciones morfofuncionales en las DC. Este proceso, llamado maduración induce: 1) incremento en el número y extensión de las dendritas, lo que aumenta el área de contacto intercelular; 2) incremento en la capacidad migratoria; 3) incremento de la actividad como APC, relacionado con la sobreexpresión de los componentes de la APM y las moléculas MHCI y MHCII; 4) incremento en la expresión de moléculas estimuladoras de la respuesta celular adaptativa; 5) reducción de la capacidad fagocítica (64). El proceso de maduración de las DC es determinante para comunicar al SI adquirido la presencia de una condición peligrosa en un tejido determinado. Este fenómeno es la base de la Teoría del Peligro postulada por la investigadora Polly Matzinger (65), la que sustenta la capacidad de los antígenos de estimular la respuesta inmune en base a su carácter de peligroso, y no en base a ser o no propio del hospedero. La alerta del SI adquirido ante la presencia de células cancerosas depende en gran medida de la información que transmiten las DC a los linfocitos tras la maduración, inducida por el contacto con los antígenos tumorales.
Células del sistema inmune adquirido
A diferencia del SI innato, los componentes celulares del SI adquirido se limitan a dos poblaciones: los linfocitos B y los T. Estas poblaciones comparten propiedades comunes como la distribución clonal de sus receptores de reconocimiento antigénico, su alta especificidad y diversidad de reconocimiento, los procesos de selección clonal durante la ontogenia y, por último, la capacidad para dejar memoria de los antígenos a los que ha estado expuesto cada individuo (66).
Otras propiedades, sin embargo, distinguen a estas dos poblaciones. Una de las más importantes es la diferencia en los mecanismos que median su activación y actividad funcional. Mientras que los linfocitos T requieren la presentación antigénica de epítopos lineales en el contexto de las moléculas MHC, los linfocitos B pueden reconocer directamente, a través de su BCR, epítopos lineales o conformacionales en los antígenos.
Respecto a la función, la señalización que reciben los linfocitos T CD4+ de parte de las DC al momento de su activación, determina un patrón de diferenciación funcional que evidencia el alto grado de especialización de estas células (67). Las propiedades de estos subtipos funcionales de linfocitos T auxiliadores se describirán más adelante. En el caso de los linfocitos T CD8+, su capacidad citotóxica los caracteriza, siendo mediadores fundamentales en el control de la progresión tumoral (3,4, 68).
Los linfocitos T CD4+ con actividad reguladora son muy relevantes como parte de los mecanismos que utilizan las células neoplásicas para evadir la inmunovigilancia (2). Como se mencionó anteriormente, se distinguen dos poblaciones de linfocitos CD4+ reguladores. Por una parte, los tTregs son generados durante el proceso de selección clonal en el timo. Estos expresan el factor de transcripción "regulador maestro" FOXP3 y un fenotipo CD4+CD25+CTLA-4+ (42). Mientras los iTregs son generados durante los eventos de activación y diferenciación de la respuesta inmune adaptativa en los órganos linfoides periféricos, no siempre expresan FOXP3 y su fenotipo es más heterogéneo (43). La actividad inmunosupresora de estas células está mediada por diversos mecanismos (69).
Los linfocitos B poseen como actividad principal la secreción de inmunoglobulinas. Este proceso es consecuencia de la diferenciación a células plasmáticas, y en el mismo intervienen tanto señales provenientes del contacto con el antígeno como la influencia de la actividad auxiliadora de los linfocitos T CD4+ (70). El contacto entre linfocitos T y B influye en el cambio de clases de inmunoglobulinas y en el incremento de la afinidad de estas por el antígeno (70).
Dinámica de la respuesta inmune antitumoral
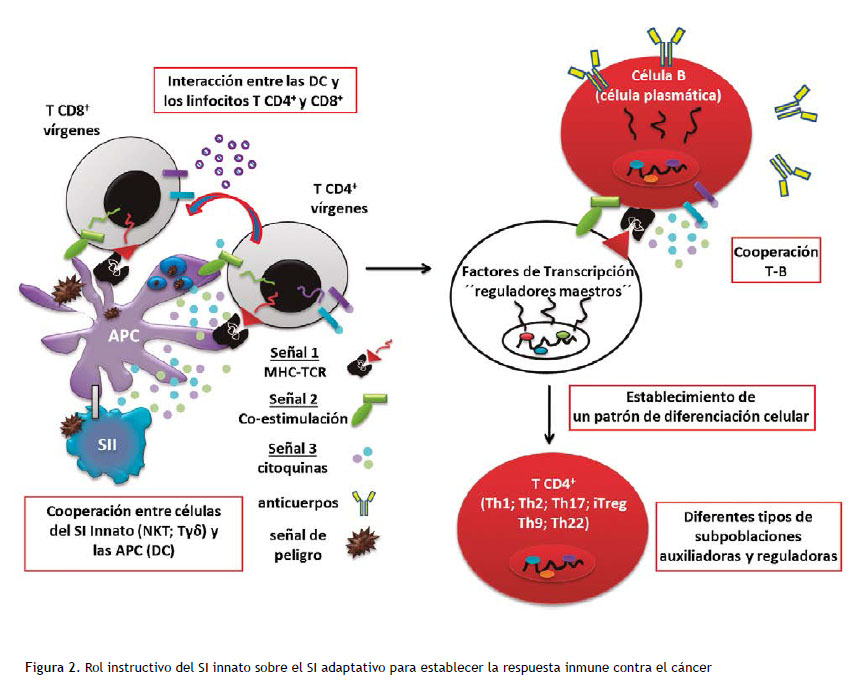
Uno de los eventos más relevantes para el establecimiento de una respuesta inmune antitumoral efectiva involucra la interacción entre las DC y los linfocitos T, auxiliadores y citotóxicos, en los linfonodos (6). Durante este contacto, las DC que han madurado después de reconocer antígenos tumorales en el contexto de señales de peligro, presentan los antígenos a los linfocitos T en las moléculas de MHC (Figura 2). Esta presentación antigénica constituye la llamada señal 1 que reciben los linfocitos a través de su TCR, y determina la activación de aquellos clones de linfocitos T específicos para los antígenos tumorales. El proceso de activación induce cambios en la expresión de marcadores moleculares en los linfocitos y la producción de citosinas, entre las que destaca la intercelucina 2 (IL2) como principal factor de supervivencia y proliferación linfocitario (71). Sin embargo, para que ocurra la activación efectiva, la expansión clonal y la diferenciación funcional de los linfocitos T se requieren otras dos señales: la señal 2, basada en la interacción entre moléculas coestimulatorias; y la señal 3 mediada por citosinas (Figura 2).
Una vez reconocidos los antígenos tumorales en un contexto peligroso se produce la maduración de las DC, con la cooperación de linfocitos del SI innato. La interacción entre las DC y los linfocitos T CD4+ y CD8+, a través de tres señales, induce la activación, proliferación y diferenciación funcional de estas células. La cooperación T-B favorece el cambio de clases y la maduración de la afinidad de los anticuerpos.
Las moléculas que median la coestimulación se sobreexpresan en las DC como parte del proceso de maduración, el cual es favorecido no solo por el contacto de las DC con el antígeno, sino además por la cooperación con otras poblaciones del SI innato (Figura 2). Desde el punto de vista conceptual, la señales coestimulatorias indican a los linfocitos T que los antígenos que reconocen a través de su TCR se detectaron por las DC en el contexto de señales de peligro (72). Estas señales estimulan la maquinaria de proliferación celular de los linfocitos e inducen importantes cambios en el metabolismo para soportar la expansión clonal (73). Entre estas destacan la molécula CD40 y la familia de moléculas B7, incluyendo ICOS-L, B7.1 (CD80), B7.2 (CD86) (72). Las dos últimas interactúan con la molécula CD28 expresada en los linfocitos T. Una segunda molécula llamada CTLA-4, expresada en los linfocitos T, es también ligando de B7.1 y B7.2. Esta molécula induce señales que inhiben la actividad linfocitaria, lo que contribuye al carácter agudo de la respuesta inmune (72). Otras moléculas de la familia B7 median señales negativas en los linfocitos T, como B7H1 (PD-L1) y B7DC (PD-L2) al interactuar con su ligando común PD-1 (74).
La manipulación de las señales de coestimulación, conocidas como puntos de control de la inmunidad, es una de las estrategias utilizada por los tumores para evadir la vigilancia de la inmunidad (2,75). Actualmente, el uso de anticuerpos monoclonales para regular estos puntos de control tiene gran impacto como estrategia de inmunoterapia en cáncer (75). Estos temas serán tratados exhaustivamente en el tercer artículo de esta serie de trabajos de revisión.
El proceso de diferenciación de los linfocitos T auxiliadores a los diferentes patrones de respuesta inmune está determinado por el sitio donde es detectado el antígeno, además de su concentración y naturaleza molecular. Estos criterios determinan el perfil de los PRR que son estimulados y, por tanto, modulan la expresión de MHC, las moléculas de coestimulación y la secreción de un perfil de citosinas por parte de las DC, lo que influye cualitativamente y cuantitativamente en las señales que recibe el linfocito T (76). Actualmente, se definen cuatro patrones principales de diferenciación para los linfocitos T CD4+: Th1 (del inglés T-helper 1); Th2; Th17; iTregs (77). Otras dos subpoblaciones, Th9 y Th22, también han sido descritas (77). Estos patrones de diferenciación en los linfocitos T auxiliadores se estimulan por la influencia de la señal de citosinas (señal 3), las que median la activación de factores de transcripción considerados reguladores maestros de la actividad de cada una de las subpoblaciones (Figura 2) (77). El patrón de diferenciación no es terminal, o sea, las condiciones del microambiente donde actúan los linfocitos puede modificarlo y por tanto influir sobre la funcionalidad de estas células (77).
En lo que se refiere a la respuesta antitumoral, el patrón de diferenciación que ha mostrado mejor relación con el pronóstico de los pacientes es Th1 (3,4). La diferenciación a Th1 es inducida por la citosina IL12 que secretan las DC, y para su actividad ellos producen IFNγ lo que promueven la respuesta inmune celular mediada por linfocitos T CD8+ citotóxicos. Los linfocitos Th1 estimulan también la actividad de células fagocíticas, como los macrófagos proinflamatorios tipo M1, y la citotoxicidad mediada por células NK, poblaciones que contribuyen a la vigilancia inmunológica en cáncer (2).
En el caso de la respuesta mediada por anticuerpos, la cantidad y calidad de estos está influida por la naturaleza del antígeno y las señales de los linfocitos T auxiliadores. Una vez que los linfocitos B detectan los antígenos a través de su BCR, estos endocitan el receptor y actúan como APC al procesar y presentar los epítopos lineales generados en MHCII (78). Cambios en la expresión de receptores de quimiocinas estimula la migración de los linfocitos B al encuentro con las células T auxiliadoras que han sido previamente activadas por las DC (Figura 2). La cooperación T-B favorece el intercambio de señales a través del contacto TCR-MHCII, CD40-CD40L y la influencia de las citosinas (78). La integración de estas señales contribuye a la supervivencia y proliferación de los linfocitos B, su diferenciación a célula plasmática, y a los eventos de maduración de la respuesta mediada por las inmunoglobulinas, incluyendo el cambio de clase y el incremento de la afinidad por el antígeno (70).
Mecanismos efectores de la respuesta inmune
La eliminación de células neoplásicas está determinada, en última instancia, por los mecanismos efectores que logren acceder al microambiente donde estas se desarrollan, e induzcan la muerte celular. El SI posee una gran diversidad de mecanismos efectores, humorales y celulares, que involucran a componentes del SI innato y adquirido. El éxito de la respuesta inmune en la restauración de la homeostasis radica en la actividad coordinada de varios efectores de la inmunidad, y el control de la magnitud y duración de su respuesta.
Los llamados anticuerpos naturales, el sistema de complemento, las citosinas proinflamatorias y los interferones tipo I son ejemplos de mediadores humorales de la respuesta inmune innata (79). Por su parte, la actividad fagocítica de células como los macrófagos y neutrófilos, y la citotoxicidad mediada por las células NK, son relevantes en el control del cáncer por parte del SI innato (2).
En el caso del SI adquirido, la presencia de linfocitos T CD8+ citotóxicos en el microambiente tumoral se ha asociado con buen pronóstico de pacientes con diferentes localizaciones tumorales (3,4). Tanto los linfocitos T CD8+ como las células NK, poseen mecanismos similares para inducir la muerte celular. En ambos casos, gránulos con actividad citolítica que contienen diversos componentes proteicos activos, incluyendo granzimas y perforinas, median la muerte por apoptosis (80). Sin embargo, a diferencia de las NK, los gránulos citolíticos en los linfocitos T CD8+ requieren del proceso de activación inducido por las DC para su estructuración. Además, los linfocitos T citotóxicos requieren que el antígeno que reconocen se exprese en la membrana plasmática de la célula diana en el contexto de MHCI, mientras que las células NK reconocen directamente una serie de señales de estrés celular que las licencian para matar (80). Estas propiedades de ambas poblaciones son manipuladas por los tumores para resistir la muerte medida por estas células (2), tema que será objeto de atención en próximas revisiones de esta serie.
En el caso de las inmunoglobulinas, su capacidad de reconocer antígenos tumorales permite la activación de mecanismos de muerte mediada por el complemento (81). La activación del complemento por la vía clásica, depende de la formación de inmunocomplejos antígeno-anticuerpo (81), lo que conduce a formar el complejo de ataque de membrana e induce la muerte celular por alteraciones osmóticas. Por otra parte, la expresión en macrófagos y NK de receptores que reconocen la porción Fc de las inmunoglobulinas, activa en estas células la actividad fagocítica y citotóxica, respectivamente (82).
Estos mecanismos efectores, junto a la muerte celular inducida por el INF γ y el par molecular FAS-FASL, son las estrategias más relevantes que utiliza el SI para eliminar las células transformadas (2). El control de los mismos, por mediadores antiinflamatorios como las citosinas IL10 y el TGFβ, la actividad de los tTregs e iTregs, los cambios en el metabolismo celular y las señales negativas mediadas por los puntos de control de la inmunidad, contribuyen a limitar la magnitud y duración de la respuesta inmune (83). Los mecanismos efectores del SI, constituyen presiones selectivas que favorecen la evolución somática de los tumores a partir de la inestabilidad genética de las células neoplásicas.
En conclusión, los mecanismos que median la activación del SI ante la ocurrencia de procesos de carcinogénesis no difieren de aquellos que participan en otros procesos de control de la homeostasis tisular mediados por la inmunidad. Los actores celulares y los mecanismos moleculares que activan y regulan la respuesta inmune, las características de la actividad efectora, y las estrategias para contribuir al control de la inflamación en los tejidos, son similares a los que participan en la inmunovigilancia al cáncer. Los cambios de paradigma respecto a la reactividad del SI frente a antígenos peligrosos, independientemente de su carácter propio o ajeno, unido al avance en los métodos, tecnologías y modelos de experimentación genéticamente modificados para el estudio de la carcinogénesis han permitido revalorizar la importancia de la inmunidad en el control del cáncer. La complejidad de la inmunovigilancia, por su paradójica contribución a la progresión y evolución somática del cáncer, así como las estrategias de inmunoterapia basadas en el dominio de estos conocimientos, serán objeto de atención en próximos trabajos de revisión.
Fuentes de financiamiento: Este artículo ha sido financiado por los autores.
Conflictos de interés: Los autores declaran no tener ningún conflicto de interés.
REFERENCIAS BIBLIOGRÁFICAS
1. Ribatti D. The concept of immune surveillance against tumors. The first theories. Oncotarget. 2017; 8(4):7175-80. [ Links ]
2. Vesely MD, Kershaw MH, Schreiber RD, Smyth MJ. Natural innate and adaptive immunity to cancer. Annu Rev Immunol. 2011; 29:235-71. [ Links ]
3. Galon J, Costes A, Sanchez-Cabo F, Kirilovsky A, Mlecnik B, Lagorce-Pagés C, et.al. Type, density, and location of immune cells within human colorectal tumors predict clinical outcome. Science. 2006; 313(5795):1960-64. [ Links ]
4. Fridman WH, Pagès F, Sautès-Fridman C, Jérôme G. The immune contexture in human tumours: impact on clinical outcome. Nat Rev Cancer. 2012; 12:298-306 [ Links ]
5. Gardner A, Ruffell B. Dendritic Cells and cancer immunity. Trends Immunol. 2016; 37(12):855-865. [ Links ]
6. Chen DS and Mellman I. Oncology meets immunology: the cancer-immunity cycle. Immunity. 2013; 39(1):1-10. [ Links ]
7. Galon J, Mlecnik B, Bindea G, Angell HK, Berger A, Lagorce C, et. al. Towards the introduction of the ‘Immunoscore’ in the classification of malignant tumours. J Pathol. 2014; 232(2):199-209
8. Taube JM, Galon J, Sholl LM, Rodig SJ, Cottrell TR, Giraldo NA, et. al. Implications of the tumor immune microenvironment for staging and therapeutics. Mod Pathol. 2018; 31(2):214-234. [ Links ]
9. Greaves M, Maley CC. Clonal evolution in cancer. Nature. 2012; 481(7381): 306-313. [ Links ]
10. Yao Y, Dai W. Genomic Instability and Cancer. J Carcinog Mutagen. 2014; 5:1000165. [ Links ]
11. Chalmers ZR, Connelly CF, Fabrizio D, Gay L, Ali S, Ennis R, et. al. Analysis of 100,000 human cancer genomes reveals the landscape of tumor mutational burden. Genome Medicine. 2017; 9:34-48. [ Links ]
12. Khong HT and Restifo N. Natural selection of tumor variants in the generation of "tumor escape" phenotypes. Nat Immunol. 2002; 3(11):999-1005. [ Links ]
13. Efremova M, Rieder D, Klepsch V, Charoentong P, Finotello F, Hackl H, et. al. Targeting immune checkpoints potentiates immunoediting and changes the dynamics of tumor evolution. Nat Commun. 2018; 9:32. [ Links ]
14. Rabinovich GA, Gabrilovich D, Sotomayor EM. Immunosuppressive strategies that are mediated by tumor cells. Annu Rev Immunol. 2007; 25: 267-96. [ Links ]
15. Gallucci S, Matzinger P. Danger signals: SOS to the immune system. Curr Opin Immunol. 2001; 13(1):114-19. [ Links ]
16. Fucikova J, Moserova I, Urbanova L, Bezu L, Kepp O, Cremer I, et. al. Prognostic and Predictive Value of DAMPs and DAMP- Associated Processes in Cancer. Front Immunol. 2015; 6:402. [ Links ]
17. Hernandez C, Huebener P, Schwabe RF. Damage-associated molecular patterns in cancer: a double-edged sword. Oncogene. 2016; 35(46):5931-41. [ Links ]
18. Suresh R, Mosser DM. Pattern recognition receptors in innate immunity, host defense, and immunopathology. Adv Physiol Educ. 2013; 37(4): 284-91. [ Links ]
19. Treanor B. B-cell receptor: from resting state to activate. Immunology. 2012; 136(1): 21-27. [ Links ]
20. Wucherpfennig KW, Gagnon E, Call MJ, Huseby ES, Call ME. Structural biology of the T-cell receptor: insights into receptor assembly, ligand recognition, and initiation of signaling. Cold Spring Harb Perspect Biol. 2010; 2(4): a005140. [ Links ]
21. Sokol CL, Luster AD. The chemokine system in innate immunity. Cold Spring Harb Perspect Biol. 2015; 7(5): a016303. [ Links ]
22. Moser B, Wolf M, Walz A, Loetscher P. Chemokines: multiple levels of leukocyte migration control. Trends Immunol. 2004; 25(2):75-84. [ Links ]
23. O’Sullivan T, Saddawi-Konefka R, Vermi W, Koebel CM, Arthur C, White JM, et. al. Cancer immunoediting by the innate immune system in the absence of adaptive immunity. J. Exp. Med. 2012; 209(10):1869-82.
24. Radiloff DR, Rinella ES, Threadgill DW. Modeling cancer patient populations in mice: Complex genetic and environmental factors. Drug Discov Today Dis Models. 2007; 4(2): 83-88. [ Links ]
25. Galluzzi L, Vacchelli E, Bravo-San Pedro JM, Buqué A, Senovilla L, Baracco EE, et. al. Classification of current anticancer immunotherapies. Oncotarget. 2014; 5(24):12472-508. [ Links ]
26. Belkaid Y and Hand T. Role of the microbiota in immunity and inflammation. Cell. 2014; 157(1): 121-41. [ Links ]
27. Ganeshan K, Chawla A. Metabolic regulation of immune responses. Annu Rev Immunol. 2014; 32: 609-34. [ Links ]
28. Mogensen TH. Pathogen recognition and inflammatory signaling in innate immune defenses. Clin Microbiol Rev. 2009; 22(2): 240-73. [ Links ]
29. Buchta CM, Bishop GA. Toll-like receptors and B cells: functions and mechanisms. Immunol Res. 2014; 59(1-3): 12-22. [ Links ]
30. Rahman AH, Taylor DK, Turka LA. The contribution of direct TLR signaling to T cell responses. Immunol Res. 2009; 45(1): 25-36 [ Links ]
31. Kawai T, Akira S. The roles of TLRs, RLRs and NLRs in pathogen recognition. Int Immunol. 2009; 21(4): 317-37. [ Links ]
32. O'Neill LA, Golenbock D, Bowie AG. The history of Toll-like receptors - redefining innate immunity. Nat Rev Immunol. 2013; 13(6): 453-60. [ Links ]
33. Zani IA, Stephen SL, Mughal NA, Russell D, Homer-Vanniasinkam S, et. al. Scavenger Receptor Structure and Function in Health and Disease. Cells. 2015; 4(2): 178-201. [ Links ]
34. Tsoni SV, Brown GD. beta-Glucans and dectin-1. Ann N Y Acad Sci. 2008;1143:45-60. [ Links ]
35. Turner MW. The role of mannose-binding lectin in health and disease. Mol Immunol. 2003; 40(7):423-9. [ Links ]
36. Franchi L, Warner N, Viani K, Nuñez G. Function of Nod-like Receptors in Microbial Recognition and Host Defense. Immunol Rev. 2009; 227(1): 106-28. [ Links ]
37. Franchi L, Eigenbrod T, Muñoz-Planillo R, Nuñez G. The inflammasome: a caspase-1-activation platform that regulates immune responses and disease pathogenesis. Nat Immunol. 2009; 10(3): 241-47. [ Links ]
38. Tonegawa S. Somatic generation of antibody diversity. Nature. 1983; 302: 575-81. [ Links ]
39. Jung D, Alt FW. Unraveling V(D)J Recombination: Insights into Gene Regulation. Cell. 2004; 116(2): 299-311. [ Links ]
40. Klein L, Kyewski B, Allen PM, Hogquist KA. Positive and negative selection of the T cell repertoire: what thymocytes see (and don't see). Nat Rev Immunol. 2014; 14(6): 377-91. [ Links ]
41. Pelanda R, Torres RM. Central B-Cell Tolerance: Where Selection Begins. Cold Spring Harb Perspect Biol. 2012; 4(4): a007146. [ Links ]
42. Hsieh CS, Lee H, Lio CJ. Selection of regulatory T cells in the thymus. Nat Rev Immunol. 12(3): 157-16.
43. Kanamori M, Nakatsukasa H, Okada M, Lu Q, Yoshimura A. Induced Regulatory T Cells: Their Development, Stability, and Applications. Trends Immunol. 2016; 37(11): 803-11. [ Links ]
44. Neefjes J, Jongsma MLM, Paul P, Bakke O. Towards a systems understanding of MHC class I and MHC class II antigen presentation. Nat Rev Immunol. 2011; 11(12): 823-36. [ Links ]
45. Roche PA, Furuta K. The ins and outs of MHC class II-mediated antigen processing and presentation. Nat Rev Immunol. 2015; 15(4): 203-16. [ Links ]
46. Maddur MS, Kaveri SV, Bayry J. Basophils as antigen presenting cells. Trends Immunol. 2010; 31(2):45-8. [ Links ]
47. Brandes M, Willimann K, Moser B. Professional antigen- presentation function by human gamma-delta T Cells. Science. 2005; 309(5732): 264-68. [ Links ]
48. Blum JS, Wearsch PA, Cresswell P. Pathways of Antigen Processing. Annu Rev Immunol. 2013; 31: 443-73. [ Links ]
49. .Joffre OP, Segura E, Savina A, Amigorena S. Cross-presentation by dendritic cells. Nat Rev Immunol. 2012; 12(8): 557-69. [ Links ]
50. Heath WR, Carbone FR. Cross-presentation in viral immunity and self-tolerance. Nat Rev Immunol. 2001; 1(2): 126–34. [ Links ]
51. Sánchez-Paulete AR, Teijeira A, Cueto FJ, Garasa S, Pérez-Gracia JL, Sánchez-Arráez A, et. al. Antigen cross- presentation and T-cell cross-priming in cancer immunology and immunotherapy. Ann Oncol. 2017; 28(suppl-12): xii44- xii55. [ Links ]
52. Dinarello CA. Historical Review of Cytokines. Eur J Immunol. 2011; 37(Suppl 1): S34-S45. [ Links ]
53. Ozaki K, Leonard WJ. Cytokine and Cytokine Receptor Pleiotropy and Redundancy. J Biol Chem. 2002; 277(33): 29355-358. [ Links ]
54. Griffith JW, Sokol CL, Luster AD. Chemokines and chemokine receptors: positioning cells for host defense and immunity. Annu Rev Immunol. 2014; 32: 659-702. [ Links ]
55. Ley K, Laudanna C, Cybulsky MI, Nourshargh S. Getting to the site of inflammation: the leukocyte adhesion cascade updated. Nat Rev Immunol. 2007; 7(9): 678-89. [ Links ]
56. Schroeder HW, Cavacini L. Structure and Function of Immunoglobulins. J Allergy Clin Immunol. 2010; 125(202): S41-S52. [ Links ]
57. .Holodick NE, Rodríguez-Zhurbenko N, Hernández AM. Defining Natural Antibodies. Front Immunol. 2017; 8: 872. [ Links ]
58. Nutt SL, Hodgkin PD, Tarlinton DM, Corcoran LM. The generation of antibody-secreting plasma cells. Nat Rev Immunol. 2015; 15(3): 160-171 [ Links ]
59. Balato A, Unutmaz D, Gaspari AA. Natural killer T cells: an unconventional T-cell subset with diverse effector and regulatory functions. J Invest Dermatol. 2009; 129(7): 1628-42. [ Links ]
60. Lünemann A, Lünemann JD, Münz C. Regulatory NK-cell functions in inflammation and autoimmunity. Mol Med. 2009; 15(9-10): 352-58. [ Links ]
61. Paul S, Lal G. Regulatory and effector functions of gamma- delta (γδ) T cells and their therapeutic potential in adoptive cellular therapy for cancer. Int J Cancer. 2016; 139(5): 976-85.
62. 62.Qian C, Cao X. Dendritic cells in the regulation of immunity and inflammation. Semin Immunol. 2018; 35: 3-11. [ Links ]
63. Mildner A, Jung S. Development and function of dendritic cell subsets. Immunity. 2014; 40(5): 642-56. [ Links ]
64. Dalod M, Chelbi R, Malissen B, Lawrence T. Dendritic cell maturation: functional specialization through signaling specificity and transcriptional programming. EMBO J. 2014; 33(10):1104-116. [ Links ]
65. Matzinger P. Tolerance, danger, and the extended family. Annu Rev Immunol. 1994; 12: 991-1045. [ Links ]
66. Litman GW, Rast JP, Fugmann SD. The origins of vertebrate adaptive immunity. Nat Rev Immunol. 2010; 10(8):543-53. [ Links ]
67. Luckheeramn RV, Zhou R, Verma AD, Xia B. CD4+T cells: differentiation and functions. Clin Dev Immunol. 2012; 2012: 925135. [ Links ]
68. Halle S, Halle O, Försterv R. Mechanisms and dynamics of T cell-mediated cytotoxicity in vivo. Trends in Immunology.2017; 38(6): 432-443. [ Links ]
69. Vignali DAA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol. 2008; 8(7): 523-32. [ Links ]
70. den Haan JM, Arens R, van Zelm MC. The activation of the adaptive immune system: cross-talk between antigen- presenting cells, T cells and B cells. Immunol Lett. 2014;162(2 Pt B):103-12. [ Links ]
71. Bachmann MF, OxeniusA. Interleukin 2: from immunostimulation to immunoregulation and back again. 2007. EMBO Rep. 8(12): 1142-148.
72. Sharpe AH, Abbas AK. T-Cell costimulation: biology, therapeutic potential, and challenges. N Engl J Med. 2006; 355(10): 973-75. [ Links ]
73. Frauwirth KA, Riley JL, Harris MH, Parry RV, Rathmell JC, et. al. The CD28 signaling pathway regulates glucose metabolism. Immunity. 2002; 16(6): 769-77. [ Links ]
74. Sharpe AH, Pauken KE. The diverse functions of the PD1 inhibitory pathway. Nat Rev Immunol. 2018; 18(3): 153-67. [ Links ]
75. Jenkins RW, Barbie DA, Flaherty KT. Mechanisms of resistance to immune checkpoint inhibitors. Br J Cancer. 2018; 118(1): 9-16. [ Links ]
76. Tubo NJ, Jenkins MK. TCR signal quantity and quality in CD4+ T cell differentiation. Trends Immunol. 2014; 35(12): 591-96. [ Links ]
77. Zhu J, Yamane H, Paul WE. Differentiation of effector CD4 T cell populations. Annu Rev Immunol. 2010; 28: 445-89 [ Links ]
78. Rodríguez-Pinto D. B cells as antigen presenting cells. Cell Immunol. 238(2): 67-75
79. Shishido SN, Varahan S, Yuan K, Li X, Flemingd SD. Humoral innate immune response and disease. Clin Immunol. 2012; 144(2): 142-58. [ Links ]
80. Chávez-Galán L, Arenas-Del Angel MC, Zenteno E, Chávez R, Lascurain R. Cell death mechanisms induced by cytotoxic lymphocytes. Cell. Mol. Immunol. 2009; 6(1): 15-25. [ Links ]
81. Rogers LM, Veeramani S, Weiner GJ. Complement in monoclonal antibody therapy of cancer. Immunol Res. 2014; 59(1-3): 203-10. [ Links ]
82. Hubert P, Amigorena S. Antibody-dependent cell cytotoxicity in monoclonal antibody-mediated tumor immunotherapy. Oncoimmunology. 2012; 1(1): 103-105. [ Links ]
83. Viganò S, Perreau M, Pantaleo G, Harari A. Positive and negative regulation of cellular immune responses in physiologic conditions and diseases. Clin Dev Immunol.2012;2012:485781 [ Links ]
Correspondencia: Joel de León
Dirección: Av. Alameda del Corregidor N° 1531, Urb. Los Sirius. La Molina. Lima, Perú.
Teléfono: 365 2300 (anexo 147)
Correo electrónico: jdeleond@usmp.pe
Recibido: 11 de junio de 2018.
Evaluado: 10 de julio de 2018.
Aprobado: 18 de Julio de 2018.