INTRODUCCIÓN
El avance terapéutico en medicina es cada vez más eficaz, pero también se torna agresivo por lo que un grupo de pacientes que se hospitalizan son sometidos a procedimientos de soporte vital, y es necesario que ingresen a unidades de cuidados críticos 1. Entre el 9 y 20 % de dichos pacientes son susceptibles de adquirir infecciones nosocomiales, de las cuales 10,6 % son fúngicas; esto representa un alto impacto en la morbilidad y mortalidad de los pacientes, además de incrementar el tiempo de hospitalización y los costos del tratamiento 2.
La candidiasis es la segunda infección más importante en individuos hospitalizados. Esta enfermedad es causada por especies de Candida, levaduras comensales de la piel y las mucosas que pueden convertirse en patógenos oportunistas en los pacientes críticamente enfermos 3,4. Los factores de riesgo como terapias inmunosupresoras, supresión de la microflora bacteriana intestinal por el uso de antimicrobianos de amplio espectro, el ayuno prolongado, los procedimientos invasivos de ventilación mecánica, y el uso de catéteres y sondas vesicales y nasofaríngeas contribuyen a alterar los mecanismos básicos de defensa en estos pacientes 5.
En las últimas décadas varios países están reportando el surgimiento de diferentes especies Candida spp. (no C. albicans) como causa de candidiasis. Estos hallazgos probablemente están relacionados con la mejora en los métodos de diagnóstico rutinario y el uso prolongado de fluconazol en unidades de cuidados críticos, lo que promueve la resistencia debido a mutaciones inducidas 6-8. Además, los aislamientos de estas especies varían según la región geográfica. Así, C. glabrata es aislada con mayor frecuencia en Norteamérica y Europa, mientras que C. parapsilosis ocupa el segundo lugar en aislamientos en el sur de Europa y Asia, y la especie C. tropicalis es frecuente en la India y América Latina 6,9,10.
En el Perú se ha reportado una incidencia de 2,04 casos de candidemia por cada 1000 hospitalizaciones, y se han identificado las especies C. tropicalis (24,7 %), C. parapsilosis (25,3 %), C. glabrata (9,5 %), C. guilliermondii (2,9 %) y C. krusei con 1,4 % 11,12. El objetivo de este estudio fue determinar la frecuencia y susceptibilidad a antifúngicos de las especies Candida (no C. albicans) aisladas de las muestras de los pacientes de unidades de cuidados críticos del Hospital Regional de Lambayeque (HRL).
MATERIALES Y MÉTODOS
Diseño y población de estudio
Estudio de tipo observacional, transversal analítico y de temporalidad prospectiva, entre febrero del 2018 y mayo del 2019. El estudio se realizó con las muestras clínicas de orina, sangre, líquido peritoneal y secreción traqueal en las que se aislaron microorganismos. Estas muestras procedían de los pacientes hospitalizados en las unidades de cuidados críticos: unidad de cuidados intensivos (UCI) y unidad de cuidados intermedios (UCIN) del Hospital Regional de Lambayeque (HRL), que es un hospital de tercer nivel de atención (III-I), y es el de mayor complejidad en la región norte del Perú.
Variables y mediciones
Se utilizó un muestreo bietápico. En la primera fase se revisaron 232 resultados de las muestras clínicas en las que se aislaron microorganismos de los pacientes de unidades de cuidados críticos para calcular la frecuencia de especies Candida spp. (no C. albicans). La segunda fase correspondió a la susceptibilidad antifúngica: se aplicó un diseño no probabilístico de todas las cepas aisladas en la etapa previa. Adicionalmente, se registraron los datos de edad, sexo, servicio hospitalario, tipo de muestra, uso previo de antimicrobiano y cuadro clínico-patológico de los pacientes en quienes se aisló Candida spp. (no C. albicans).
Las especies de Candida spp. (no C. albicans) se identificaron mediante la técnica del tubo germinal siguiendo el método descrito por Hernández-Botero et al. 13. La técnica consiste en emulsionar una porción de la colonia fúngica, cultivada en medio agar Sabouraud, en 0,5 ml de suero humano y luego incubar a 37 °C por dos horas. Este tiempo se seleccionó debido a su mejor relación entre sensibilidad del 98 % y especificidad del 99,6 % para diferenciar Candida albicans de las otras especies. También se realizó la producción de velo o película según las indicaciones de Guevara Robles et al. 14, para lo cual se inoculó una asada de la colonia de levadura en un tubo de vidrio que contenía caldo BHI y se incubó a temperatura de 37 °C por 24 horas. Las interpretaciones se realizaron según el procedimiento de Zurita Macalupú et al. 15.
Para la formación de clamisdosporas se empleó agar harina de maíz con Tween 80 15 de acuerdo a la técnica descrita por Linares et al. 16 y la identificación de cada especie se realizó según las indicaciones de Koehler et al. mencionadas en un estudio realizado en Buenos Aires 17. Finalmente, todas las cepas fueron sembradas en placas de Petri con CHROMagar TM Candida, luego se incubaron a 37 °C durante 24 a 48 horas, y las levaduras fueron identificadas según el color que especificaba en fabricante.
La prueba de susceptibilidad antifúngica se realizó por el método de Kirby-Bauer, como indica Zurita Macalupú et al. 15. La interpretación de la sensibilidad de los puntos de corte se realizó según las indicaciones del documento M44-A2 del CLSI: para el fluconazol se consideró un halo igual o mayor que 19 mm como sensible, y como resistente a un halo menor o igual que 14 mm; para el voriconazol se consideró mayor o igual que 17 mm como sensible y menor o igual que 13 mm como resistente.
Las variables edad y sexo del paciente, servicio hospitalario, tipo de muestra, uso previo de antimicrobiano y cuadro clínico-patológico se recolectaron de la historia clínica mediante la técnica de documentación y se registraron en una ficha de recolección de datos.
Análisis de datos
Se calculó la frecuencia absoluta y relativa de Candida spp. (no C. albicans) en relación a las variables independientes. Para el análisis de datos se utilizó el programa informático de SPSS 24.0.
Consideraciones éticas
El protocolo de estudio fue revisado y aprobado por el Comité de Ética en Investigación del Hospital Regional de Lambayeque (0211-055-18 CEI). Los aislamientos fueron identificados con códigos numéricos y se mantuvo en reserva la identidad del paciente de quien procedió la muestra. Los registros fueron de acceso restringido solo al personal investigador.
RESULTADOS
Se revisaron 232 muestras con aislamientos de microorganismos de pacientes de unidades de cuidados críticos del Hospital Regional de Lambayeque en las que se observó que la frecuencia de Candida spp. (no C. albicans), fue del 19,82 % (46). Entre estas, la especie más frecuente fue C. tropicalis con el 67,39 % (31), seguido de las especies C. glabrata con un 17,39 % (8), C. parapsilosis con un 10,86 % (5) y C. krusei 4,34 % (26) (Figura 1). La frecuencia de C. albicans fue de 11,20 % (26 casos).
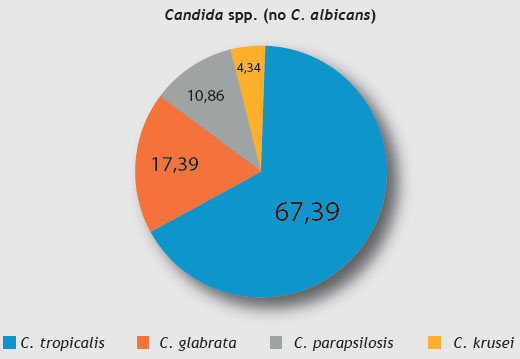
Figura 1 Frecuencia relativa de las especies de Candida spp. (no C. albicans) aisladas de pacientes de unidades de cuidados críticos de un hospital de tercer nivel del norte del Perú
Los pacientes en quienes se aisló Candida spp. (no C. albicans) se caracterizaron porque la mayoría era del sexo femenino, con 26 casos (56,52 %) y tener de 60 años a más con 36, 95 % (37 pacientes) (Tabla 1). Además, en cuanto al tipo de muestra, se determinó que en la orina se encontró el mayor porcentaje de aislamientos con el predominio de C. tropicalis (58,10 %), seguido de C. glabrata (25,00 %) y C. parapsilosis (20,00 %); mientras que en las muestras de secreción traqueal la especie más frecuente fue C. tropicalis (32,20 %), en segundo lugar se encontró C.glabrata (37,50 %), y finalmente, C. parapsilosis (60,00 %). Esta última especie no se aisló en las muestras de sangre.
Tabla 1 Características de los pacientes de unidades de cuidados críticos de un hospital de tercer nivel del norte del Perú, desde quienes se aislaron Candida spp. (no C. albicans)
| Variables | N | % |
| Grupo etario (años) | ||
| Menos de 14 | 4 | 8,69 |
| 15 a 29 | 10 | 21,73 |
| 30 a 44 | 9 | 19,56 |
| 45 a 51 | 6 | 13,04 |
| 60 a más | 17 | 36,95 |
| Sexo | ||
| Femenino | 26 | 56,53 |
| Masculino | 20 | 43,47 |
| Servicio hospitalario | ||
| UCI | 28 | 60,86 |
| UCIN | 18 | 39,13 |
| Tipo de muestra | ||
| Líquido peritoneal | 3 | 6,52 |
| Orina | 21 | 45,65 |
| Sangre | 6 | 13,04 |
| Secreción traqueal | 16 | 34,78 |
| Uso previo de antimicrobianos | ||
| Antibacteriano | 31 | 67,39 |
| Antibacteriano y antifúngico | 7 | 15,21 |
| Sin tratamiento | 8 | 17,39 |
| Cuadro clínico | ||
| ITU | 2 | 4,34 |
| IRA | 19 | 41,30 |
| Sepsis | 23 | 50,00 |
| TEC | 2 | 4,34 |
UCI: unidad de cuidados intensivos, UCIN: unidad de cuidados intermedios, ITU: infección del tracto urinario, IRA: infección respiratoria aguda, TEC: traumatismo encéfalocraneano
La susceptibilidad antifúngica de las cepas de Candida spp. (no C. albicans) frente al fluconazol y al voriconazol se observan en la tabla 2. Nueve cepas (19,56 %) mostraron resistencia al fluconazol, y diez (21,73 %) al voriconazol.
Tabla 2 Susceptibilidad de Candida spp. (no C. albicans) a los antifúngicos fluconazol y voriconazol en muestras de pacientes de cuidados críticos de un hospital de tercer nivel del norte del Perú.
| Antifúngico | C. tropicalis | C. glabrata | C. parapsilosis | C. krusei | Total |
| N = 31 (%) | N = 8 (%) | N = 5 (%) | N = 2 (%) | N = 46 (%) | |
| Fluconazol | |||||
| Sensibles | 29 (93,54) | 6 (75,00) | 2 (40,00) | 0 (0,00) | 37 (80,43) |
| Resistentes | 2 (6,45) | 2 (25,00) | 3 (60,00) | 2 (100,00) | 9 (19,56) |
| Voriconazol | |||||
| Sensibles | 26 (83,87) | 5 (62,50) | 4 (80,00) | 1 (50,00) | 36 (78,26) |
| Resistentes | 5 (16,12) | 3 (37,50) | 1 (20,00) | 1 (50,00) | 10 (21,73) |
DISCUSIÓN
En el presente estudio la frecuencia de Candida spp. (no C. albicans) es mucho menor en comparación a los porcentajes reportados por Gong et al. 18, Motoa et al. 19, Rodríguez et al. 11 y por Villalobos-Vindas et al. 20, esto se explica en el cuadro clínico de base del paciente; así, en este estudio solo el 50,00 % de los aislamientos provinieron casos de sepsis, por tanto, de pacientes con mayores probabilidades de tener complicaciones con las levaduras mencionadas; mientras que en los estudios mencionados todos correspondieron, únicamente, a casos de pacientes con sepsis ocasionada por la candidemia.
Las especies C. tropicalis y C. glabrata son las predominantes en nuestro estudio, lo que coincide con otros reportes 21,22. Los pacientes de esta investigación presentaron dos factores de riesgo por el simple hecho de estar en UCI y UCIN, el primero fue el uso de catéteres, situación en la que C. tropicalis aprovecha la formación de las biopelículas y así ambas especies pueden ocasionar la infección 24 y, en segundo lugar, la terapia antibiótica previa, que disminuye la microflora intestinal normal, que en condiciones normales, controla la proliferación de C. glabrata (23. Otros estudios multicéntricos (25, 26) informaron el aumento de C. glabrata en los últimos años como agente etiológico de candidemias.
Así mismo, al contrastar la prevalencia de Candida spp. (no C. albicans) con el tipo de muestra, se observó una asociación estadística para ambas variables y el porcentaje de aislamientos es similar a otros estudios 21,29,30) reportado por Heras-Cañas et al. 30, Kaur et al. (21 y por Toka Ozer et al. 29. Probablemente La razón de este hallazgo sea que el tracto urinario es una fuente importante de esta levadura no solo porque es comensal de la mucosa sino también por el empleo frecuente de las sondas urinarias en los pacientes de
UCI y UCIN. Las levaduras se adhieren, forman biopelículas e inician su paso a gérmenes patógenos. También la candiduria se asocia con la candidemia, se desencadenan complicaciones en la recuperación del paciente crítico 29 y se prolonga la estancia en UCI lo que implica un aumento en la tasa de mortalidad que es alta a los 30 días de permanencia en estas unidades de cuidados críticos 31.
Por otro lado, C. parapsilopsis no se logró aislar de los hemocultivos, un hallazgo que se opone de los estudios realizados en el Perú por Rodríguez et al. (2017) 11 y Moreno- Loaiza et al. 12, quienes reportaron que esta especie fue la más frecuente. Esta diferencia se explicaría porque en estas investigaciones incluyeron un mayor número muestras de neonatos quienes, según Orozco et al. 27, son colonizados en un 36 % por C. parapsilopsis el cual, además, está presente en 32 % de las manos en el personal que manipula o está en contacto con los neonatos, lo que contribuiría a la transmisión horizontal de la infección.
En relación a la edad, el mayor porcentaje de aislamientos se presentó en pacientes críticos de 60 años a más y del sexo femenino, como también han reportado Ghrenassia et al. 28 y Toka et al. 29. Este grupo etario presenta mayores condiciones debilitantes como la disminución de las defensas inmunológicas y de la capacidad para retornar a un equilibrio fisiológico normal fenómeno conocido como "homeostenosis", muy común en este tipo de pacientes 1. Asimismo, no hay predilección por el sexo masculino o el femenino, y las levaduras pueden causar infecciones en ambos, ya que este no es un factor de riesgo estadísticamente significativo.
Los pacientes ingresados en Unidades de Cuidados Intensivos (UCI) presentaron más casos de aislamientos de Candida spp. (no C. albicans), resultado que concuerda con la investigación realizada por Ajenjo et al. 22. Para explicar este hallazgo se debe indicar que los pacientes críticamente enfermos de una UCI precisan de ventilación mecánica, por lo que están más propensos a la migración de secreciones y microrganismos de la orofaringe o del tracto intestinal a las vías respiratorias inferiores con la consecuente colonización de la tráquea; todo esto facilitado por la disminución fisiológica de las defensas inmunológicas 1,2, a diferencia de los pacientes que se encuentran en el servicio de UCIN los cuales no requieren de ventilación mecánica.
En esta investigación, la mayoría de aislamientos fueron de pacientes críticos con una exposición previa a antibacterianos en porcentaje mucho menor a lo reportado por Ajenjo et al. 22, Gong et al. 18, Kaur et al. 21, Moreno- Loaiza et al. 12 y Tiraboschi et al. 9. Esta diferencia se podría explicar porque estas investigaciones incluyeron a C. albicans dentro del análisis estadístico de las Candida spp. no C. albicans. Se ha demostrado que un paciente de UCI que se ha expuesto a cuatro antibióticos diferentes tiene aproximadamente el 35 % de riesgo de candidemia. Además, el empleo de los antibióticos como profilácticos puede suprimir la microflora intestinal del paciente, reducir la presión sanguínea y ocasionar el crecimiento excesivo de hongos 3.
En cuanto a la condición del paciente y el aislamiento de Candida spp. (no C. albicans), el 50,00 % de los aislamientos ocurrió en pacientes críticos con sepsis, este porcentaje es mayor a los hallazgos de Ajenjo et al. 22 y Rodríguez et al. 11. Esto se explica porque la mayoría de aislamientos fueron de urocultivos, y de pacientes jóvenes y ancianos. En estos grupos etarios de pacientes críticos, es probable encontrar una pielonefritis, una infección aguda que genera urosépsis, con una mortalidad del 30 %, según Asensio Martín et al. 2.
Acerca de la susceptibilidad antimicótica, diversas teorías explican los mecanismos de sensibilidad o resistencia; sin embargo, no siempre las especies de Candida spp. (no C. albicans) responden de la misma manera. Respecto al fluconazol, la mayoría de cepas aisladas en nuestro estudio fueron sensibles a dicho producto, lo que coincide con Rodriguez et al. 11 y Tiraboschi et al. 9) ; este hecho se explica porque en nuestra investigación y en las mencionadas las especies con mayor número de aislamiento fueron C. tropicalis, C. glabrata, C. parapsilosis y otras, las cuales presentan bajo número de resistencia que no afecta el porcentaje total, a diferencia de C. krusei que muestra una resistencia intrínseca, pero como mantiene un porcentaje bajo de aislamiento, no alteró los reportes totales de sensibilidad.
En cuanto al voriconazol, se observó un alto porcentaje de resistencia, a diferencia de los reportes de Archímedes da Matta et al. 25, Motoa et al. 19 y Toka Ozer et al. 29.
Estos resultados probablemente se deben a que las cepas aisladas en este estudio fueron del grupo de pacientes críticos que recibieron tratamiento previo con antibacterianos y antifúngicos, y estas levaduras pueden llegar a generar resistencia cruzada entre azoles como el fluconazol, de uso común en la región, y el voriconazol, como lo plantean Nieto et al. 32. A esta explicación se suma a la probabilidad de que C. glabrata haya adquirido resistencia intrínseca a los azoles ya que esta levadura presentó el 37,5 % de cepas resistentes.
Se concluye que la frecuencia de Candida spp. (no C. albicans) es alta en los pacientes de unidades de cuidados críticos del Hospital Regional de Lambayeque, lo que podría incrementar de riesgo de morbilidad y mortalidad. Así mismo, estas especies muestran una alta resistencia a los antifúngicos fluconazol y voriconazol, por lo que es importante considerar a este tipo de levaduras en las infecciones oportunistas y el uso racional de los antimicóticos en el tratamiento de estos pacientes.















