INTRODUCCIÓN
En diciembre del 2019 sorprendió la aparición de casos de neumonía de causa desconocida en la ciudad de Wuhan, en China. Se encontró que el agente causante era un nuevo coronavirus. De esta manera, ocurría el tercer brote de coronavirus del siglo XXI: los primeros son el SARS-CoV en el 2002, y el MERS-CoV en el 2012 1. Desde su aparición, este nuevo coronavirus (SARS-CoV-2, causante de COVID-19) se expandió rápidamente por todo el mundo. Hasta el 24 de octubre de 2020 se reportaron más de 42 millones de casos COVID-19 y 1 145 847 muertes en el mundo. El país con la mayor cantidad de casos es Estados Unidos con casi 8 millones y medio de casos y es también el que registra la mayor cantidad de decesos: 224 058 fallecidos. En el Perú, hasta esa fecha, se registraron 879 876 casos y 33 948 muertes 2.
Alrededor del 80 % de pacientes con COVID-19 experimentan síntomas leves a moderados con resolución espontánea de la infección; aproximadamente, el 20 % desarrolla síntomas respiratorios graves y el síndrome de dificultad respiratoria aguda, y el 6 % de los pacientes infectados empeoran considerablemente y requieren de síntomas de manera considerable al punto de requerir un ventilador mecánico 3.
En ausencia de pautas terapéuticas comprobadas, varios medicamentos ya conocidos empezaron a ser evaluados en ensayos clínicos por sus probables beneficios en el tratamiento de COVID-19. Entre ellos, el fármaco antiparasitario ivermectina. En este contexto, es de especial relevancia comprender la patología de las manifestaciones clínicas de COVID-19, y así identificar los posibles objetivos farmacológicos para la investigación de los medicamentos 4.
En el 2015, William C. Campbell y Satoshi Ōmura obtuvieron el Premio Nobel por sus trabajos que condujeron al descubrimiento de la ivermectina que, aparte de su eficacia como antiparasitario, continúa ofreciendo otras aplicaciones clínicas debido a su capacidad para reutilizarse para tratar nuevas enfermedades. Además de su función terapéutica en la oncocercosis y la estrongiloidiasis, es necesario investigar el potencial de la ivermectina como medicamento antiviral 5,6.
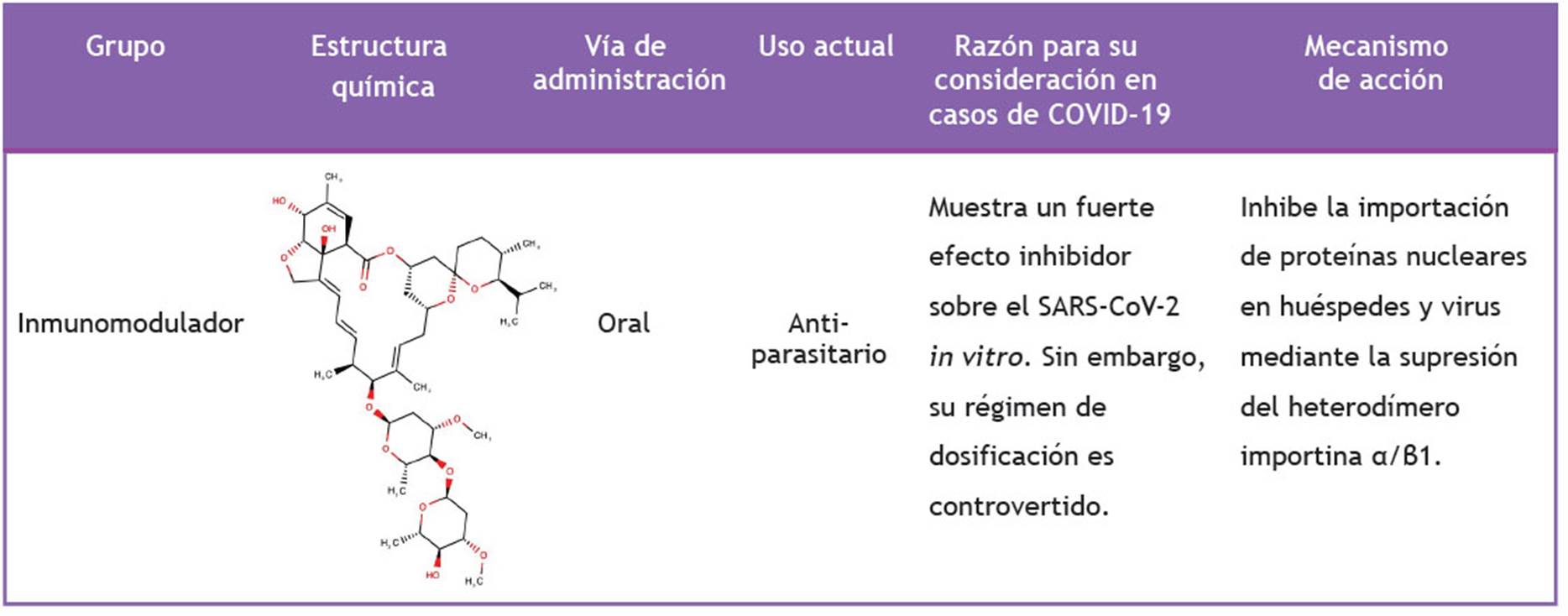
La ivermectina es un fármaco antiparasitario semisintético de amplio espectro aprobado por la FDA (del inglés Food and Drug Administration) que potencia la neurotransmisión mediada por GABA y se une a los canales de cloruro activados por glutamato en el parásito 7. Además, refuerza la inmunidad humana porque aumenta la producción de IL-1 y otras citocinas, activa la producción de aniones superóxido y mejora la respuesta de los linfocitos a los mitógenos 8. En la mayoría de parasitosis, la ivermectina se usa en dosis de 0,15 mg/kg-0,2 mg/kg de peso corporal, como tableta oral y es bien tolerada. Asimismo, ha demostrado potentes efectos antivirales in vitro contra distintos virus ARN, como el virus del Zika, el virus de la influenza A, el virus de la enfermedad de Newcastle, el virus de Chikungunya, entre otros 9,10. La ivermectina bloquea la replicación del VIH inhibiendo la interacción entre la proteína integrasa del VIH-1 y el heterodímero α/β1 de la importina 11. Sin embargo, su actividad antiviral de amplio espectro depende de la IMPα/β1 durante la infección 12.
En esta revisión ofrecemos una visión amplia de los conocimientos actuales relacionados a la ivermectina y su potencial terapéutico como agente eficaz y seguro para la infección por COVID-19, desde su descubrimiento e historia hasta su relación con el SARS-CoV-2, la evidencia sobre su mecanismo de acción y su eficacia, hasta su seguridad de su empleo en las décadas que ha sido utilizado. A pesar de la evidencia existente, la información sobre el virus y la enfermedad evolucionan rápidamente, por lo que se pide a los lectores a actualizarse con regularidad.
ESTRATEGIA DE BÚSQUEDA
Este trabajo es una revisión narrativa sobre la eficacia y seguridad de la ivermectina como potencial agente terapéutico farmacológico para el tratamiento de la COVID-19. La búsqueda de información se realizó en las bases de datos Pubmed y Google Scholar. Las palabras utilizadas para la búsqueda en estas bases de datos fueron "SARS-CoV-2", "COVID-19", "ivermectina" y "tratamiento". Se seleccionaron los artículos que trataban sobre el tema, publicados en idioma inglés o español.
ORIGEN Y ANTECEDENTES HISTÓRICOS DE LA IVERMECTINA
En el año 1973, el profesor Omura, del Instituto Kitasato en Japón, y el laboratorio Merck Sharp & Dohme (MSD), en Estados Unidos de América, iniciaron una colaboración internacional con el fin de producir nuevos fármacos de uso veterinario. Esta colaboración conduciría luego al descubrimiento y desarrollo de la ivermectina. En 1974, el equipo de Omura logró aislar un organismo de los suelos de un campo de golf en una ciudad japonesa y envió las muestras al laboratorio en EE. UU. En 1975, William Campbell, investigador veterinario americano, evaluó las muestras provenientes de Japón en busca de potenciales agentes terapéuticos de aplicación en la medicina veterinaria. De las cepas de la bacteria Streptomyces avermitilis (Figura 1) logró aislar las avermectinas que demostraron tener una importante actividad contra los parásitos en modelos animales. Cuando se comprobaron la seguridad y eficacia de la ivermectina, el laboratorio farmacéutico y la OMS iniciaron, en 1982, un programa para usar el fármaco en humanos. En 1987, la ivermectina fue autorizada para uso humano vía oral como tabletas de 6 mg, comenzando así el Programa de Control de la Oncocercosis en países africanos. En las Américas se inició un programa similar en 1993. En 1997, después de la primera década del programa, más de 18 millones de personas estaban siendo tratadas con ivermectina cada año. Esto confirmaba la seguridad del fármaco a las dosis indicadas 13.
En el 2003, el equipo en Japón secuencia el genoma de Streptomyces avermitilis. El gobierno japonés aprueba el uso de ivermectina para otras infecciones parasitarias en humanos, como estrongiloidiasis y escabiosis. En el 2008, 60 millones de personas en África tomaban una dosis única anual de ivermectina y se habían administrado más de 1800 millones de tabletas de ivermectina para oncocercosis a más de 68 millones de personas en el mundo. Desde inicios de los años ochenta, la ivermectina ya casi alcanza los 40 años de empleo y aún se siguen descubriendo indicaciones para su uso en múltiples enfermedades en humanos 13,14.
Se conocen varias avermectinas: ivermectina, abamectina, doramectina, moxidectina, emamectina, nemadectina, eprinomectina, selamectina. De ellas, la única probada e indicada en humanos es la ivermectina 14.
ESTRUCTURA DEL SARS-COV-2 Y PATOGENIA
El SARS-CoV-2 es un virus con ARN monocatenario de sentido positivo, pertenece al género Betacoronavirus, subfamilia Orthocoronavirinae, familia Coronaviridae. El ARNm genómico puede actuar como un ARNm para la traducción de las poliproteínas virales. El genoma del SARS-CoV-2 contiene 14 open reading frames (ORF). Las dos unidades transcripcionales principales, ORF1a y ORF1ab, comprenden dos tercios del genoma viral y codifican dos poliproteínas principales: pp1a (~500 kDa) y pp1ab (~800 kDa), respectivamente. Estos polipéptidos son escindidos por la proteasa similar a quimotripsina codificada por virus (3CLpro), la proteasa principal (Mpro) y la proteasa similar a papaína (PLpro) en 16 proteínas no estructurales (nsp1 a nsp16), que se ensamblan para formar el complejo de replicación y transcripción (RTC) implicado en la transcripción y replicación del genoma 15. La poliporteína pp1a se escinde en 11 proteínas no estructurales (nsp1-nsp11) y la pp1ab, en cinco (nsp12-nsp16). Estas proteínas no estructurales juegan un papel importante en la patogénesis de COVID-19. Las poliproteínas no estructurales nsp3 y nsp5 codifican PLpro y 3CLpro, respectivamente, que ayudan en la escisión de péptidos y en el antagonismo inmune innato del huésped. Las nsp12 y nsp15 codifican ARN polimerasa dependiente de ARN (RdRp) y ARN helicasa, respectivamente. Otros ORF en el extremo 3' del genoma viral codifican cuatro proteínas estructurales: la glicoproteína (S) de la superficie del pico, la proteína de membrana (M), la proteína de envoltura (E) y las proteínas de la nucleocápside (N) que son los componentes principales del virus y desempeñan un papel crucial en la integridad estructural y en la patogénesis 16. La proteína S es una glicoproteína transmembrana homotrimérica que determina la diversidad de los coronavirus y el tropismo del hospedador. Tiene dos subunidades funcionales: S1, responsable de unirse a los receptores ACE2 del huésped; y S2, que se encarga de la fusión del virión y las membranas celulares. La proteína M ayuda en el transporte de nutrientes a través de la membrana celular y la formación de la envoltura viral. La proteína E juega un papel importante en la morfogénesis y ensamblaje viral. La proteína N participa en el empaquetamiento del ARN viral en la ribonucleocápside y también ayuda a la evasión inmune al atenuar las respuestas inmunes del huésped 4,17.
El ciclo de vida del SARS-CoV-2 consta de cinco pasos: adhesión, penetración, biosíntesis, maduración y liberación. La entrada del virus en las células huésped se ve facilitada por las interacciones entre la proteína S y sus receptores (ACE2) que se encuentran en distintos órganos como el corazón, los pulmones o los riñones. La proteína S se une a ACE2 a través de la región del dominio de unión al receptor (RBD) de la subunidad S1, que consta de un núcleo y un motivo de unión al receptor (RBM). El RBM reconoce específicamente la ACE2 humana como su receptor 4. La interacción (unión) proteína S/ACE2 es el principal determinante para infectar una especie hospedadora, la ACE2 es el receptor de SARS-CoV-2 17. Después de la unión del virus a los receptores ACE2 del hospedador, la proteína S sufre una escisión proteolítica de dos pasos: primero en el sitio de escisión S1/S2 para la iniciación y luego otra en el sitio S2' para la activación. Este último actúa como un péptido de fusión viral que se inserta en la membrana, seguido de la unión de dos heptadas repetidas en S2 formando un paquete de seis hélices. La formación de este paquete da como resultado la fusión y la entrada del virus en la célula huésped (penetración) 18. Después de la internalización, el virión pierde la cápisde y libera el ARNss viral en el citoplasma de la célula huésped, que luego se une a los ribosomas y se traduce en dos poliproteínas, pp1a y pp1ab. Estas poliproteínas son escindidas por proteinasas codificadas por el virus en 16 nsps. Muchas de estas proteínas no estructurales se congregan para formar el RTC en vesículas de doble membrana que son, principalmente, un ensamblaje de subunidades que contienen RdRp y helicasa 17. La síntesis de ARN genómico sigue a la traducción y ensamblaje de complejos de replicasa viral. El RTC es responsable de la replicación del ARN y la transcripción de los sgRNA (RNA sub-genómicos). Estos últimos sirven como ARNm para la traducción de proteínas estructurales y accesorias (biosíntesis). Después de la traducción, las proteínas S, E y M se transportan al retículo endoplásmico de donde pasan hacia el compartimento intermedio del retículo endoplásmico-Golgi (ERGIC). En este compartimento los genomas virales son encapsulados por la proteína N, que luego brota en la membrana y da como resultado la formación del virus maduro (maduración). La proteína M regula la mayoría de las interacciones proteína-proteína necesarias para el ensamblaje del virus. Sin embargo, las partículas similares a virus (VLP) solo se pueden formar cuando la proteína M se coexpresa con la proteína E, lo que sugiere el papel de estas dos proteínas en la producción de la envoltura viral. Después del ensamblaje, los viriones se transportan a la superficie celular en vesículas y salen por exocitosis (liberación) 4,17.
La patología de COVID-19 se caracteriza por la rápida replicación de SARS-CoV-2, lo que desencadena una respuesta inmunitaria amplificada que puede conducir a una tormenta de citocinas que frecuentemente induce una respuesta pulmonar inflamatoria grave 19. La progresión de la enfermedad puede dar lugar a una insuficiencia respiratoria progresiva derivada del daño alveolar y provocar la muerte. Además, la monitorización de la carga viral del SARS-CoV-2 en pacientes con enfermedad grave indica cargas más altas, así como una mayor persistencia viral 6,20.
FISIOPATOLOGÍA DE COVID-19 E IVERMECTINA
La unión selectiva de la ivermectina y su alta afinidad con los canales de cloruro activados por glutamato en las células nerviosas y musculares de los nemátodos aumenta la permeabilidad de la membrana celular a los iones de cloruro, lo que resulta en hiperpolarización de las células, parálisis y muerte del parásito. La ivermectina se une en un 93,2 % a las proteínas plasmáticas y tiene una vida media de 18 horas después de la administración oral 4. Además de su acción antiparasitaria, varios estudios han demostrado una potente actividad antiviral de contra una amplia gama de virus in vitro. Se ha comprobado que la ivermectina inhibe la interacción entre la proteína integrasa del VIH-1 y el heterodímero de importina IMPα/β1, lo que inhibe la replicación del virus. También se conoce su capacidad de limitar a las infecciones causadas por varios virus ARN (virus del dengue, virus del Nilo Occidental, virus de la encefalitis equina venezolana y virus de la influenza) y virus de ADN (virus de la pseudorrabia) 11. Los estudios mostraron que la división de la célula huésped podría verse afectada durante la infección por SARS-CoV debido a un cierre nucleocitoplasmático dependiente de la señal de la proteína de la nucleocápside viral que involucra IMPα/β1. La actividad antiviral del factor de transcripción STAT1 es bloqueada por la proteína accesoria ORF6 del SARS-CoV, que provoca el secuestro de IMPα/β1 en el retículo endoplásmico rugoso / membrana de Golgi. La eficacia de la ivermectina contra el SARS-CoV-2 se plantea debido a su acción inhibidora sobre la importación nuclear mediada por IMPα/β1 4.
Destaca de manera especial el trabajo publicado por Caly et al. que estudiaron la actividad antiviral de la ivermectina contra el SARS-CoV-2 y observaron que un solo tratamiento con ivermectina pudo causar una reducción de, aproximadamente, 5000 veces la carga viral a las 48 horas en un aislamiento de SARS-CoV-2 en células Vero/hSLAM 11. Este importante hallazgo motiva a prestar atención a la ivermectina como un potencial fármaco antiviral, ya que su eficacia al inicio de la infección puede reducir la carga viral, prevenir la progresión de la enfermedad y limitar la transmisión de persona a persona. La acción antiviral única de la ivermectina, combinada con un perfil de seguridad favorable, permite que se le considere como una posible opción de tratamiento para la COVID-19 4. La inhibición de la importación nuclear de proteínas virales mediada por la IMPα/β1 es el proceso que se sugiere como el mecanismo probable subyacente a su actividad antiviral (Tabla 1). También se ha reportado un posible papel ionóforo de la ivermectina: dado que los ionóforos se han descrito como posibles antivirales, la ivermectina podría inducir un desequilibrio iónico que interrumpa el potencial de la membrana viral, amenazando así su integridad y funcionalidad 6.
Varias proteínas virales son importadas en el núcleo de las células humanas tras la infección con el SARS-CoV-2, y en el caso de la ivermectina hay un objetivo específico en la membrana nuclear del huésped para este transporte que se llama convenientemente "importina", de especial relevancia para la infección viral. La ivermectina bloquea esta capacidad de transportar proteínas virales a través de importinas al núcleo y, por lo tanto, disminuye la capacidad del virus para causar daño a la célula (Figura 2) 21.
Asimismo, investigaciones preliminares refieren que la ivermectina se concentra selectivamente en el tejido pulmonar, alrededor de tres veces más la concentración plasmática y es secuestrada en el tejido pulmonar con un tiempo de residencia prolongado, lo que abre paso a la necesidad de más investigación para evaluar mejor la efectividad de la ivermectina para el tratamiento de virus respiratorios como el SARS-CoV-2 22,23.
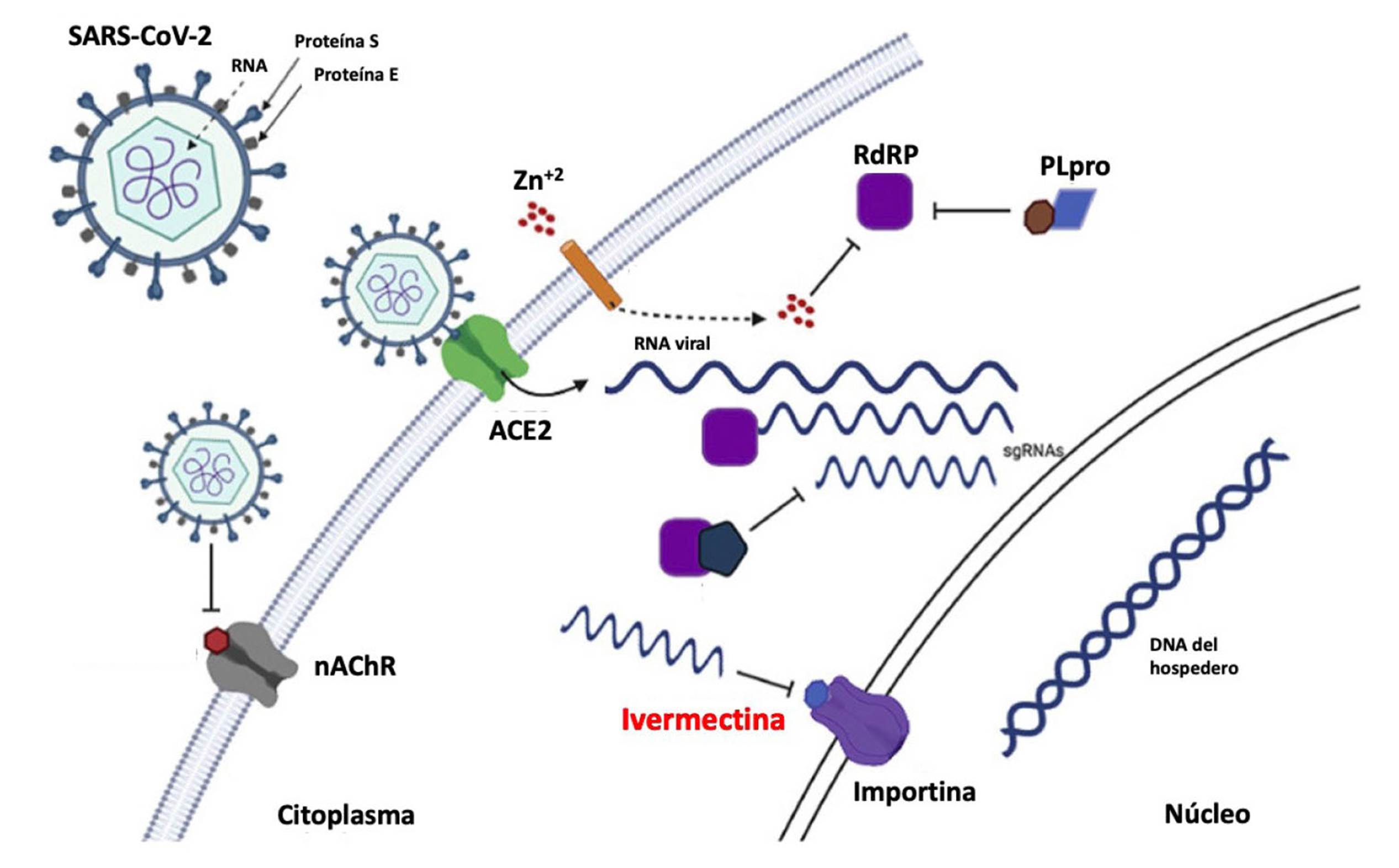
Figura 2 Lugar de acción de la ivermectina y su interacción con la importina α/β1. Adaptado de Panoutsopoulos, 2020 (21)
La ivermectina se usa en una dosis de 0,15 mg/kg a 0,2 mg/kg de peso corporal para la mayoría de las parasitosis como tableta oral y es bien tolerada. Sería razonable utilizar una dosis similar empíricamente en pacientes con COVID-19 con síntomas leves a moderados, mientras se obtiene evidencia contundente en ensayos clínicos controlados y aleatorizados 24.
La estructura molecular de la ivermectina es compleja y está formada por un conjunto de isómeros de lactona macrocíclicos (Figura 3). Se une a los canales de cloruro activados por glutamato y aumenta la permeabilidad de los iones de cloruro. Los canales de iones son dianas antivirales atractivas por dos razones. En primer lugar, los virus también pueden tener canales iónicos activos en el ensamblaje viral, la morfogénesis y la liberación viral (como la proteína E en el SARS-CoV). Además, la inhibición de los canales iónicos del huésped puede perjudicar la replicación viral 25 y se demostró que la propia ivermectina es capaz de inhibir la replicación del SARS-CoV-2 in vitro11. Todo esto indica que este medicamento es un potencial fármaco antiviral como modulador de la permeabilidad de los canales de cloruro. Por tanto, actualmente es objeto de ensayos clínicos como posible tratamiento de COVID-19 25.
La ivermectina ha mostrado actividad antiviral in vitro frente a varios virus en los últimos años. Respecto al VIH, se considera que inhibe la interacción del virus y el heterodímero IMPα/β1 (responsable de la importación nuclear de la proteína integrasa). Otros efectos reportados son la capacidad de limitar la infección de ciertos virus ARN (como el de la influenza, del dengue y el del Nilo Occidental). Se ha demostrado también que la ivermectina es eficaz contra el virus ADN de la pseudorrabia, tanto in vitro como in vivo, y aumenta la supervivencia de los ratones infectados por el virus de la pseudorrabia. Finalmente, ya se ha mencionado el estudio in vitro que demostró que la ivermectina es un inhibidor del SARS-CoV-2, y que con una sola adición a las células Vero-hSLAM infectadas con el virus puede reducir eficazmente el ARN viral aproximadamente en 5000 veces. Los autores asumieron que esto puede lograrse inhibiendo la importación nuclear de proteínas virales mediada por la IMPα/β1 y que esta inhibición alteraría el mecanismo de escape inmunológico del virus. Estos importantes hallazgos sientan la base y la necesidad para continuar con ensayos clínicos para confirmar el rol del fármaco en el tratamiento de personas con COVID-19 11,26.
Li et al. publicaron un estudio que buscó identificar alteraciones de la vía de infección con virus relacionados con la ivermectina en células de cáncer de ovario humanas. Se utilizó el marcado con isótopos estables mediante proteómica cuantitativa de aminoácidos en cultivo celular (SILAC) para analizar células de cáncer de ovario humanas TOV-21G tratadas con y sin el fármaco (20 μmol/L) durante 24 horas, identificaron 4447 proteínas relacionadas con ivermectina en las células. El análisis de la red de vías reveló cuatro rutas antivirales estadísticamente significativas, que incluyen las vías de infección por HCMV, HPV, EBV y VIH1. Curiosamente, en comparación con los 284 genes relacionados con el SARS-CoV-2 reportados de GencLip3, identificaron 52 alteraciones proteicas relacionadas con el SARS-CoV-2 cuando se trata con y sin ivermectina. La red proteína-proteína (PPI) se construyó a partir de las interacciones entre 284 genes relacionados con el SARS-CoV-2 y entre 52 proteínas relacionadas con el SARS-CoV-2 reguladas por la ivermectina. El análisis de detección de complejos moleculares de la red PPI identificó tres módulos centrales, que incluían las citocinas con la familia de factores de crecimiento, la MAP quinasa con la familia de proteínas G, y las proteínas de clase HLA. El análisis de Gene Ontology reveló 10 componentes celulares estadísticamente significativos, 13 funciones moleculares y 11 procesos biológicos. Tales hallazgos demuestran la propiedad antiviral de amplio espectro de la ivermectina en el tratamiento de COVID-19 en el contexto de la medicina predictiva, preventiva y personalizada en enfermedades relacionadas con virus; además, las proteínas reguladas por ivermectina identificadas incluían algunas proteínas relacionadas con el SARS-CoV-2: esto podría ayudar a explotar los posibles biomarcadores relacionados con la ivermectina y los mecanismos novedosos en el tratamiento de esta infección viral 27.
Se sabe que la ARN-polimerasa dependiente de ARN (RdRp) juega un papel crucial en la replicación del SARS-CoV-2 y, por lo tanto, podría ser un objetivo farmacológico potencial. Parvezet et al. publicaron un estudio en el que emplearon enfoques computacionales integrales que incluyen la reutilización de fármacos y el acoplamiento molecular para predecir cuál es el candidato eficaz dirigido a la RdRp del SARS-CoV-2. El estudio reveló que la rifabutina, la rifapentina, la fidaxomicina, la 7-metil- guanosina-5'-trifosfato-5'-guanosina y la ivermectina tienen una interacción inhibidora potencial con la RdRp del SARS-CoV-2 y podrían ser fármacos eficaces para COVID-19 28.
Respecto a la relación de la ivermectina con las importinas y su consecuente actividad antiviral, cabe destacar que el transporte dentro y fuera del núcleo es fundamental para la función de las células y los tejidos eucariotas, con un papel clave en la infección viral. Los mediadores de este transporte, que dependen de la señal de direccionamiento, son los miembros de la superfamilia de proteínas importinas, de las que existen múltiples formas. La vía mediada por el heterodímero IMPα/β1 es la ruta mejor caracterizada por la cual las proteínas del huésped ingresan al núcleo a través de poros nucleares incrustados en la envoltura nuclear. Un gran número de proteínas virales también utilizan esta vía, donde IMPα dentro del heterodímero IMPα/β1 desempeña la función adaptadora de reconocimiento de señales de focalización específicas, mientras que la IMPβ1 realiza las principales funciones nucleares de unión a/translocación a través de los poros nucleares, y liberación de la carga de importación nuclear dentro del núcleo 29,30.
Aunque la determinación de IMPα como objetivo de la ivermectina fue claramente respaldada por muchos años de investigación, la unión directa a IMPα solo se demostró formalmente recientemente utilizando un conjunto de técnicas biofísicas. Estas técnicas indican que la unión de la ivermectina con IMPα induce un cambio estructural que, probablemente, sea la base de la incapacidad de la IMPα para unir cargas de importación nuclear viral. Además, el cambio estructural también parece afectar la heterodimerización de IMPα con IMPβ1 29,31. La IMPα por sí sola no puede mediar la importación nuclear, solo lo logra dentro del heterodímero que forma con IMPβ1. Por lo tanto, la ivermectina inhibe la importación nuclear no solo al evitar el reconocimiento de la señal por IMPα, sino también al asegurar que se impida la formación del complejo IMPα/β1, esencial para mediar el transporte posterior por el poro nuclear 29.
Dado que muchos virus dependen de la importación nuclear dependiente de IMPα/β1 de proteínas virales específicas para la consolidación de la infección, estudios recientes indican que la ivermectina es un potente inhibidor del SARS-CoV-2 11. Entonces, el mecanismo de inhibición de la producción de virus infecciosos se realiza, principalmente, a través de la selección de IMPα para prevenir su rol en la importación nuclear, y de proteínas virales en particular (Figura 4). Finalmente, Jans y Wagstaff destacan que la alta especificidad de un antiviral para un virus en particular también significa, inevitablemente, que su utilidad contra un virus distinto puede ser limitada o inexistente, pero los antivirales que se dirigen al huésped pueden reutilizarse más fácilmente, siempre que los virus en cuestión dependan de la misma vía de funciones del huésped para una infección consolidada, simplemente porque la vía/función del huésped a la que se dirige es la misma. Siempre que la toxicidad no sea un problema, los agentes dirigidos al huésped tienen el potencial de ser agentes genuinamente de amplio espectro contra varios virus diferentes que dependen de una vía común del huésped, como es el caso de la ivermectina 29.
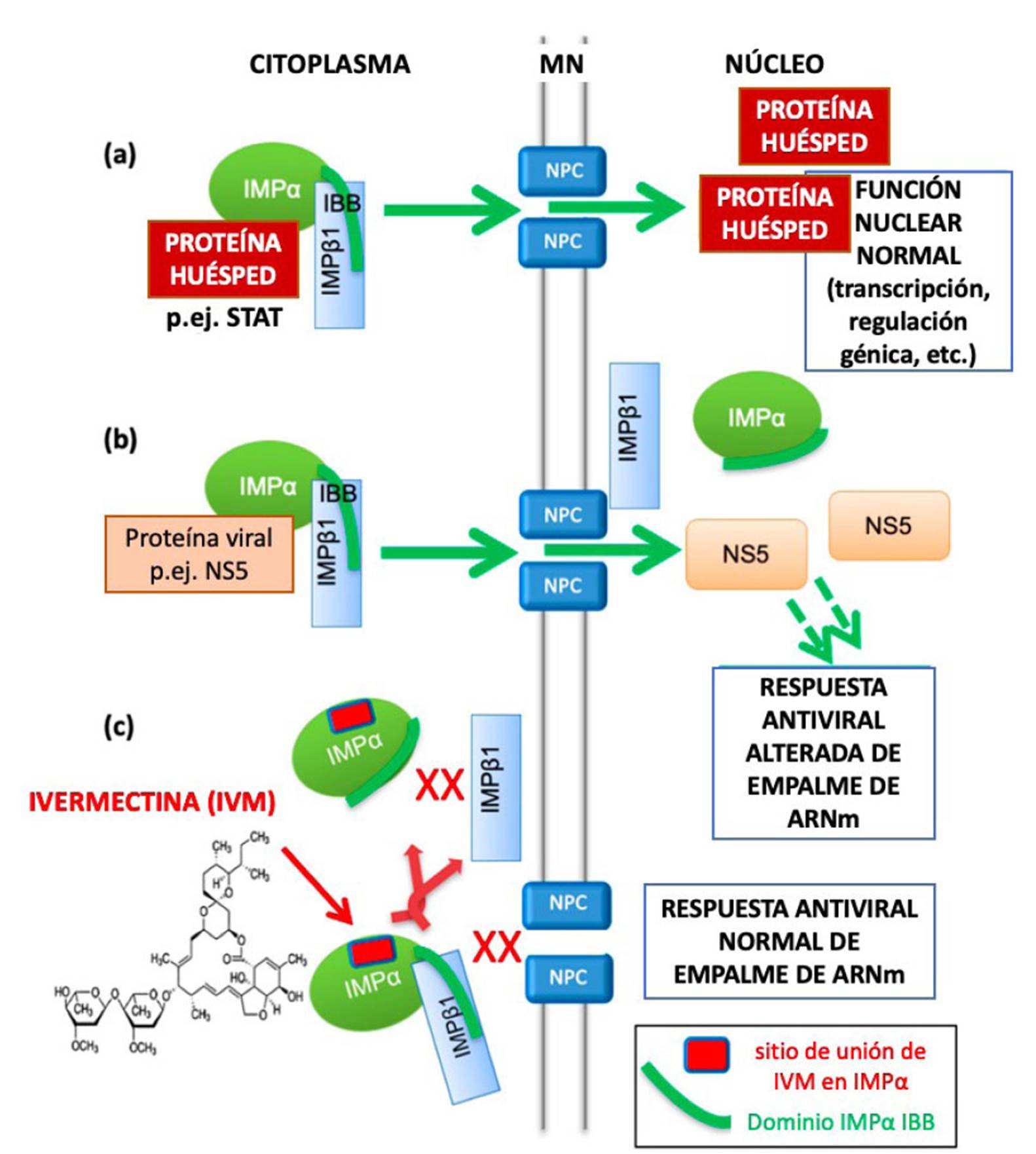
Figura 4 Esquema que muestra el rol de IMPα en el transporte nuclear de proteínas virales y del huésped y el mecanismo de inhibición por parte de la ivermectina. Adaptado de Jans y Wagstaff, 2020 (29) : (a) Las proteínas del huésped, como los miembros de las familias de factores de transcripción STAT o NF-κB, se localizan en el núcleo por la acción del heterodímero IMPα/β1, donde la región "IBB" (unión a IMPβ) de la IMPα (línea curva verde) está unida con IMPβ1 para permitir el reconocimiento de carga por la IMPα dentro del heterodímero. Posteriormente, IMPβ1 media el transporte del complejo trimérico a través del poro nuclear (NPC = complejo de poro nuclear) incrustado en la membrana nuclear (MN). A esto le sigue la liberación dentro del núcleo para permitir que los factores de transcripción lleven a cabo una función normal en la regulación transcripcional, incluida la respuesta antiviral. IMPα puede mediar la importación nuclear únicamente cuando forma parte del heterodímero con IMPβ1. (b) En la infección viral, las proteínas virales específicas (p.ej., NS5 en diferentes virus) capaces de interactuar con IMPα utilizan el heterodímero IMPα/β1 para acceder al núcleo y antagonizar la respuesta antiviral. Esto es fundamental para permitir la producción óptima de los virus. No se ha examinado qué proteínas del SARS-CoV-2 pueden acceder al núcleo de las células infectadas. (c) El compuesto dirigido a IMPα, ivermectina, se une a IMPα (sitio de unión que se muestra como una pastilla roja) tanto dentro del heterodímero IMPα/β1 para disociarlo, como al IMPα libre para evitar que se una a IMPα/β1 y bloquea la importación nuclear de NS5.
Lehrer y Rheinstein realizaron un estudio para determinar si la ivermectina podría unirse al dominio de unión formado por la proteína de pico del SARS-CoV-2 con ACE2. Utilizaron el programa AutoDock Vina Extended para realizar el estudio de acoplamiento y encontraron que la ivermectina se acopló en la región de la leucina 91 del pico y la histidina 378 del receptor ACE2. Concluyeron que el acoplamiento de ivermectina puede interferir con la unión del pico a la membrana celular humana 32.
En el estudio de cohorte retrospectivo conocido como ICON (Ivermectin in Covid Nineteen), Rajter et al. se plantearon como objetivo determinar si la ivermectina se asocia con una menor tasa de mortalidad en pacientes hospitalizados con COVID-19. Se incluyó a 280 pacientes con infección confirmada por SARS-CoV-2. Los pacientes se clasificaron en dos grupos de tratamiento en función de si recibieron al menos una dosis de ivermectina en cualquier momento durante la hospitalización o no. El resultado primario fue la mortalidad hospitalaria por todas las causas. Se observó una menor mortalidad en el grupo que recibió ivermectina. La mortalidad también fue menor entre los 75 pacientes con enfermedad pulmonar grave tratados con ivermectina, pero no hubo diferencias significativas en las tasas de extubación exitosa. Después del ajuste de las diferencias entre los grupos y los riesgos de mortalidad, la diferencia de mortalidad fue significativa para toda la cohorte. Los autores concluyeron que el tratamiento con ivermectina se asoció con una menor mortalidad durante el tratamiento de COVID-19, especialmente, en pacientes con compromiso pulmonar grave 33.
Si bien se han publicado investigaciones observacionales in vitro y se vienen realizando estudios clínicos para demostrar de manera sólida la seguridad y eficacia de la ivermectina en el tratamiento de COVID-19, es recomendable considerar las experiencias individuales como los reportes de casos clínicos en los que involucra el empleo del medicamento como el de Marchese et al. acerca de un paciente italiano de 59 años tratado con dexametasona intravenosa en dosis altas y dos dosis intravenosas de tocilizumab para la neumonía intersticial bilateral asociada con la infección por SARS-CoV-2 que desarrolló prurito, dolor abdominal y aumento del recuento de eosinófilos. El examen de las heces confirmó la presencia de larvas de S. stercoralis. El paciente fue tratado con un curso de 4 días de ivermectina con recuperación completa 34.
ENSAYOS CLÍNICOS DE IVERMECTINA PARA COVID-19
En la actualidad, se realizan diversos ensayos clínicos para confirmar la evidencia proveniente de los estudios in vitro, reportes de casos y estudios observacionales respecto a la eficacia de la ivermectina en el tratamiento de COVID-19.
Al respecto, es importante resaltar un ensayo clínico en Argentina cuyos resultados se conocieron recientemente en el mes de setiembre, y que demuestra el efecto de la droga sobre el virus en etapas tempranas de la infección. Se trata del proyecto Evaluación del Efecto Antiviral del Fármaco Ivermectina contra SARS-CoV-2 que mostró que la administración de ivermectina a dosis de 0,6 mg/kg de peso (el triple de lo usado habitualmente) produce la eliminación más rápida y profunda del virus cuando se inicia el tratamiento en etapas tempranas de la infección (hasta 5 días desde el inicio de síntomas). En este estudio, aprobado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT), intervinieron 45 pacientes con COVID-19 leve o moderada, a 30 de ellos se les administró dosis altas de ivermectina y al resto no. Luego se hicieron las mediciones de seguridad del medicamento, cuantificación de virus en secreciones respiratorias y niveles de ivermectina en sangre. Los pacientes que recibieron ivermectina presentaron una respuesta antiviral significativamente diferente a los no tratados: el efecto se evidenció en una mayor reducción del virus en las secreciones 35.
En el mes de julio concluyó un ensayo clínico realizado en Egipto con el objetivo de evaluar el posible rol de la ivermectina oral como fármaco quimioprofiláctico posterior a la exposición de familiares asintomáticos en contacto cercano con pacientes con COVID-19 confirmados por RT-PCR. Los autores sugieren que la ivermectina es un fármaco eficaz y prometedor contra COVID-19,y también que es un medicamento económico, disponible y bastante seguro 36.
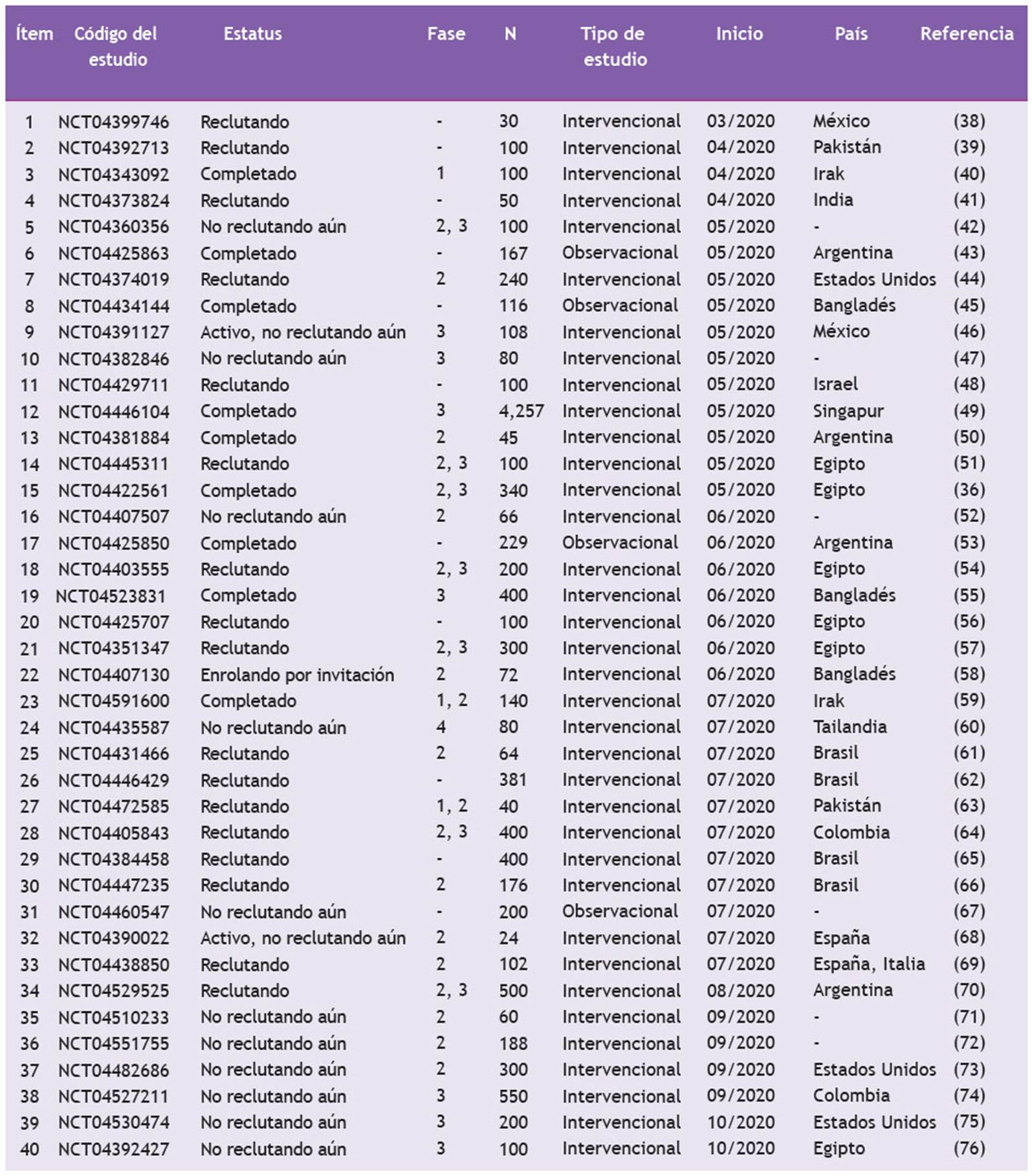
En la página clinicaltrials.gov 37, al 25 de octubre de 2020, se encontraron 40 estudios clínicos en todo el mundo, entre intervencionales y observacionales, que evalúan el beneficio clínico de la ivermectina para tratar o prevenir el COVID-19 (Tabla 2) 38)(39)(40)(41)(42)(43)(44)(45)(46)(47)(48)(49)(50)(51)(36)(52)(53)(54)(55)(56)(57)(58)(59)(60)(61)(62)(63)(64)(65)(66)(67)(68)(69)(70)(71)(72)(73)(74)(75)(76
SEGURIDAD DE LA IVERMECTINA
Por lo general, la aplicación terapéutica de ivermectina no se asocia con una toxicidad significativa, por lo que la mayoría de los efectos adversos documentados como náuseas, erupción cutánea, mareos, picazón, eosinofilia, dolor abdominal, fiebre y taquicardia podrían atribuirse a la gran letalidad de microfilarias invasoras (para lo cual está indicada la ivermectina) que dan lugar a reacciones tipo Mazzotti. Sin embargo, en grandes dosis, el fármaco podría atravesar la barrera hematoencefálica, afectar la transmisión gabaérgica y provocar la depresión del SNC, además de potenciar los efectos de las benzodiazepinas. Se espera las personas expuestas a dosis múltiples más altas que la terapéutica muestren efectos secundarios similares a los documentados en las pruebas preclínicas en mamíferos. Las sobredosis en humanos se han asociado con vómitos, taquicardia y anomalías en el ECG, fluctuaciones significativas de la presión arterial, efectos sobre el SNC (somnolencia, ataxia) y alteraciones visuales (midriasis) 77.
La concentración antiviral de ivermectina se obtuvo en un estudio solo después de una dosis alta. La hipersensibilidad al fármaco es la principal consideración de seguridad relacionada al uso de la ivermectina, pero la sobredosis en humanos se ha asociado con distintos efectos adversos como dolor abdominal, astenia, hipotensión, edema, taquicardia, mareos, dolor de cabeza, hipertermia, insomnio, depresión, ataxia, psicosis, confusión, convulsiones, somnolencia, vértigo, prurito, erupción cutánea, urticaria, diarrea, náuseas, vómitos, eosinofilia, leucopenia, mialgia, visión borrosa, conjuntivitis leve, opacidad puntiforme, fiebre, y linfadenopatía. La dosis de ivermectina considerada como segura para su empleo terapéutico en humanos es ≤ 200 μg/kg 12.
Los efectos adversos que rara vez se observan con la ivermectina son convulsiones, hipotensión y empeoramiento del asma, por lo que el uso del fármaco debe evitarse en pacientes con antecedentes de alergia, enfermedad hepática y asma 24.
Se ha demostrado que la ivermectina se tolera bien en general. En su mayor parte, los efectos secundarios son leves y transitorios por naturaleza. Ya en el 2002, la seguridad y la farmacocinética del fármaco, administrado en dosis más altas y/o más frecuentes que las aprobadas para uso como antiparasitario se evaluaron en un estudio de escalada de dosis, doble ciego, controlado con placebo. Las evaluaciones de seguridad abordaron tanto los efectos conocidos de la ivermectina sobre el SNC como la toxicidad general. El criterio de valoración de seguridad principal fue la midriasis, cuantificada con precisión mediante pupilometría. La ivermectina fue generalmente bien tolerada, sin indicios de toxicidad asociada al SNC para dosis hasta 10 veces mayores que la dosis más alta aprobada por la FDA de ≤ 200 μg/kg. Todos los regímenes de dosis tuvieron un efecto midriático similar al placebo. Los eventos adversos notificados con mayor frecuencia fueron dolor de cabeza, náuseas, mareos y erupción cutánea, que se presentaron tanto en sujetos tratados con ivermectina como con placebo. Este estudio demostró que la ivermectina, generalmente, es bien tolerada en estas dosis más altas y en regímenes más frecuentes 22,78.
En julio de este año concluyó, en Egipto, un ensayo clínico que evaluó el posible rol de la ivermectina administrada por vía oral en familiares asintomáticos luego del contacto cercano con pacientes con COVID-19. Los autores reportaron que en el grupo que recibió ivermectina, 11 participantes (5,4%) presentaron efectos adversos: diarrea (1,5 %), náuseas (1 %), fatiga (1 %), somnolencia (0,5 %), dolor abdominal (0,5 %), sensación de ardor (0,5 %), acidez (0,5 %) y hormigueo / entumecimiento (0,5 %) (36).
PERSPECTIVAS Y PROPUESTAS
En la actualidad se vienen proponiendo diversas ideas de mejora con la finalidad de optimizar la eficacia de la ivermectina; además de la evidencia respecto a la administración del fármaco vía oral. Los sistemas para la administración pulmonar de ivermectina, basados en micro y nanotecnología, pueden ofrecer oportunidades para acelerar la reutilización clínica de este fármaco en la infección por SARS-CoV-2. Así, los avances recientes en la tecnología farmacéutica y los nanomateriales se pueden aplicar al tratamiento de infecciones pulmonares 79,80. A pesar de los desafíos que enfrenta el desarrollo de estos portadores de administración de fármacos y la incertidumbre con respecto a la eficacia de la ivermectina, es un hecho que tiene un potencial prometedor. En un escenario optimista, las nuevas formas de dosificación de los medicamentos pueden contribuir a mitigar la infección por SARS-CoV-2, y también ser efectivas contra otras enfermedades virales emergentes 6.
Diversas vías han sido propuestas en los estudios sobre la reutilización de la ivermectina para el tratamiento del SARS-CoV-2. Una de ellas es el desarrollo de una fórmula inhalatoria que administre eficientemente una elevada concentración local en el pulmón y minimizar la exposición sistémica; y también evaluar los efectos sinérgicos de la ivermectina con otros compuestos que también inhiben la replicación del SARS-CoV-2 81.
Adicionalmente, se ha estudiado el efecto de la ivermectina inhalada en ratas exponiéndolas al fármaco durante cuatro semanas (cuatro horas diarias por cinco días). El nivel sin efectos adversos observados (NOAEL) se determinó en 380 mg/m3. Basado en esto, Elkholy et al. indican que el desarrollo de una forma inhalada de ivermectina necesita más atención, dada su eficacia potencial en el tratamiento de COVID-19. El uso de ivermectina inhalada como posible medicamento antiviral contra el SARS-CoV-2 podría ser una solución fácil y asequible frente a una pandemia mundial, por lo que se justifica realizar más estudios para investigar la eficacia y seguridad de la ivermectina inhalada en la población humana 82,83. En la misma línea, Chaccour et al. administraron una formulación de ivermectina hecha a base de etanol a catorce ratas usando un nebulizador para administrar partículas con depósito alveolar. En todos los animales se determinó el perfil farmacocinético de la ivermectina en plasma y pulmones. No hubo cambios relevantes en el comportamiento o el peso corporal, pero sí una elevación retardada de las enzimas musculares compatible con rabdomiólisis de hasta 11 g/kg, que también se observó en el grupo de control y que se ha atribuido a la dosis de etanol. No hubo anomalías histológicas en los pulmones de ninguna rata. Todas mostraron concentraciones de ivermectina detectables en los pulmones siete días después de la intervención 84.
CONCLUSIONES
Actualmente, los esfuerzos para enfrentar la pandemia por el SARS-CoV-2 están pasando de la cuarentena estricta a priorizar el distanciamiento social. Al mismo tiempo, existen grandes expectativas por la aprobación de una vacuna para prevenir la COVID-19, pero mientras no se disponga de ella es importante enfocarse de manera urgente también en alternativas terapéuticas con fármacos como la ivermectina, que prevengan la progresión de la enfermedad y mejoren el pronóstico de los pacientes. Se ha demostrado que la ivermectina tiene un mecanismo de acción que disminuye la carga viral del SARS-CoV-2. Existen distintas evidencias sobre su eficacia y seguridad: reportes de casos, estudios observacionales y ensayos clínicos, como el que ha concluido recientemente en Argentina, que respalda la utilidad de la ivermectina para COVID-19 en las etapas tempranas de la enfermedad; o el ensayo clínico realizado en Egipto, que sugiere el empleo del fármaco como quimioprofiláctico tras la exposición de familiares asintomáticos en contacto cercano con pacientes con COVID-19; además de la expectativa adicional por los resultados de diversos ensayos clínicos que se realizan, principalmente, en países en vías de desarrollo y que buscan una alternativa terapéutica costo-efectiva. Asimismo, la ivermectina es un fármaco que se ha utilizado por décadas como antiparasitario y es bien tolerado. La reutilización de medicamentos conocidos como la ivermectina es una opción importante para prevenir la reemergencia y la circulación del nuevo coronavirus.