INTRODUCCIÓN
Diversas enfermedades están estrechamente relacionadas con la generación de especies reactivas de oxígeno (ROS, del inglés reactive oxygen species). Estos compuestos se caracterizan por tener un electrón desapareado en su orbital externo, condición que los torna altamente reactivos 1,2. En el ser humano los ROS se generan en la cadena respiratoria mitocondrial, la reacción del peróxido de hidrógeno con iones ferrosos, la interacción de ascorbato con iones cúpricos 3, etc. Los ROS ejercen acción oxidante sobre las proteínas, lípidos y ácidos nucleicos 4. Además, afectan diversas vías de señalización celular en las que intervienen el factor nuclear kappa B (NF-B), el factor 2 relacionado a NF-E2 (Nrf2), la quinasa Jun N-terminal (JNK) 5, entre otros; y ocasiona así el estrés oxidativo, situación en la que no se dispone de una adecuada defensa antioxidante 6. Esta defensa está constituida por enzimas como la superóxido dismutasa, catalasa glutatión reductasa, etc., así como por compuestos no enzimáticos como el ácido úrico, transferrina, ceruloplasmina, glutatión, etc.
Los humanos no cuentan con una defensa antioxidante eficiente para evitar el daño ocasionado por los ROS. Por ello, deben ingerir sustancias que les proporcionen una adecuada protección antioxidante. Las frutas y verduras son fuentes importantes de sustancias antioxidantes, ya que sus metabolitos secundarios son flavonoides, polifenoles, taninos, vitamina C, licopenos, antocianinas, etc., sustancias que, entre otras funciones, neutralizan el efecto dañino de los ROS en el ser humano 7,8,9.
Los ROS pueden alterar las proteínas, propiciar la lipoperoxidación y dañar el ADN. Por lo tanto, están vinculados a una gran diversidad de enfermedades del ser humano 10,11, tales como cáncer, diabetes mellitus, psoriasis, aterosclerosis, obesidad, cataratas, etc. Asimismo, los estudios epidemiológicos muestran que las personas que ingieren alimentos como frutas y verduras tienen menos posibilidades de padecer enfermedades crónicas no transmisibles 12.
Diversas publicaciones han descrito las propiedades antioxidantes del tumbo 13, lo que ha permitido conocer la considerable variación en la composición química y las propiedades antioxidantes de esta fruta, que están relacionadas al contenido de nutrientes en el terreno, diferencias geográficas e influencia de la luz solar. Respecto al cerezo, se ha observado una gran diversidad genética en todo el mundo 14 que se investiga para establecer si esta diferencia se expresa en la morfología del fruto, lo que significaría que existen procesos adaptativos a agroecosistemas diferentes. En relación con los compuestos antioxidantes (fenoles totales, flavonoides) y con la capacidad antioxidante 15, se ha observado que existen considerables diferencias vinculadas a la naturaleza del terreno, la altitud y la variabilidad genética, entre otros factores.
En las diferentes regiones del Perú, durante todo el año, crece una gran variedad de frutos. En algunos casos, para su desarrollo no se emplean fertilizantes ni plaguicidas, como ocurre con el aguaymanto, la tuna o el camu camu. El tumbo y el cerezo (también llamado capulí o guinda, según la zona de producción) son los frutos estudiados en esta investigación y cuyas propiedades antioxidantes se desconocen, especialmente si consideramos que se han recolectado en distintos pisos ecológicos. En tal sentido, se ha evaluado el contenido de antioxidantes de ambos frutos, su capacidad antioxidante y el efecto que muestran en ratas sometidas a la acción hepatotóxica del paracetamol.
MATERIALES Y MÉTODOS
Diseño y población de estudio
El estudio es de tipo analítico, transversal y prospectivo experimental. La identificación taxonómica de los frutos Passiflora mollissima (tumbo) y Prunus serotina (cerezo) fue realizada en el Herbarium Areqvipense (HUSA) de la Universidad Nacional de San Agustín de Arequipa. Los frutos se colectaron en los valles interandinos de las regiones Arequipa, Cusco y Moquegua. Las ubicaciones geográficas fueron las siguientes: Arequipa (Yunga) 16°24´40.26" S; 71°38´42.96" O, Arequipa (Quechua) 15° 6′ 37.296″ S; 72° 31′ 3.507″ O, Arequipa (Suni) 15° 14′ 9.22″ S; 73° 4′ 21.154″ O, Cusco (Quechua) 14° 23′ 26.185″ S; 72° 5′22.938″ O, Cusco (Suni) 14° 17′ 1″ S; 72° 02′ 25″ O, Moquegua (Quechua) 16° 39' 21.78" S; 70° 57' 21.84" O y Moquegua (Suni) 16° 35' 46.44" S; 71° 13' 28.86" O.
La metodología descrita por Carrión y García 17 fue utilizada para preparar los extractos. Pesamos 2,5 g de pulpa de los frutos que luego fueron macerados con una solución hidroalcohólica. Se mantuvieron en oscuridad y refrigeración por 24 horas y se centrifugaron a 5000 r. p. m. durante 20 minutos. Los sobrenadantes se guardaron a 0 °C. Este procedimiento se repitió por tres veces.
Se utilizaron 36 ratas albinas adultas machos de la cepa Wistar de tres meses de edad con pesos entre 250 y 380 gramos, alojadas en jaulas mantenidas en condiciones de laboratorio estandarizadas (ciclos de 12 horas de luz/oscuridad, temperatura 22 ± 2 °C y humedad 51 %), con acceso a agua ad libitum y alimento estándar para ratas obtenido del bioterio de la Universidad Católica de Santa María, donde se realizó el estudio. Los animales estuvieron en un período de adaptación previo de siete días.
Los tratamientos fueron administrados por vía oral durante siete días. Al grupo control negativo se le administró 1 mL de agua destilada. El grupo control positivo recibió paracetamol en una dosis de 200 mg/kg de peso corporal. A todos los grupos experimentales se les administró paracetamol (200 mg/kg de peso corporal) y además, 200 mg/kg de peso corporal de tumbo liofilizado (grupo experimental I), 400 mg/kg de peso corporal de tumbo liofilizado (grupo experimental II), 300 mg/kg de peso corporal de cerezo liofilizado (grupo experimental III) y 600 mg/kg de peso corporal de cerezo liofilizado (grupo experimental IV). Concluido el tratamiento, las ratas, previamente anestesiadas con cloroformo, fueron sacrificadas, y reservamos una muestra de sangre y una parte del hígado.
VARIABLES Y MEDICIONES
Reactivos químicos
El etanol era grado HPLC y el metanol, grado HPLC; el carbonato de sodio y el sulfato ferroso se adquirieron de JT Baker. El paracetamol, quercetina, nitrito de sodio, cloruro de aluminio, 2,2-difenil-picril-hidrazil (DPPH), 2,4,6-tripiridil-s-triazina-Fe3+ (TPTZ) y 1,1,3,3-tetraetoxipropano eran de la marca Sigma Aldrich. El ácido gálico fue de Fluka Analytica. El hidróxido de sodio fue de Macron Fine Chemicals. El ácido acético glacial fue de Fisher Alert. El n-butanol era un producto de Scharlau. El Folin-Ciocalteu, cloruro férrico, ácido tiobarbitúrico y butil hidroxitolueno se adquirieron en Milipore Corporation. Todos los reactivos fueron de grado para análisis.
Los extractos hidroalcohólicos de ambos frutos se utilizaron para realizar las determinaciones analíticas de fenoles totales y flavonoides, así como la capacidad antioxidante mediante las técnicas DPPH, FRAP y TBARS.
Determinación de fenoles totales
Los fenoles totales se calcularon con el método descrito por Singleton y Rossi 18. Para ello, se midió 1 mL del reactivo Folin-Ciocalteu al 10 %, luego 100 µL de la muestra, y agregamos 1 mL de la solución de carbonato de sodio 7,5 %, 2,9 mL de agua supra pura hastba completar el volumen, luego se colocó en baño maría a 45 °C x 15 minutos y se leyó en el espectrofotómetro (Shimadzu UV 1800) a una longitud de onda a 725 nm. Elaboramos una curva de calibración con una solución patrón recién preparada de ácido gálico (250 ppm; 0,25 mg/mL); para este propósito, se utilizaron concentraciones comprendidas entre 50 y 300 ppm. Los resultados se expresan como mg equivalentes de ácido gálico/100 g de muestra fresca (mg EAG/100g).
Determinación de flavonoides
Los flavonoides se calcularon con el método descrito por Zhishen 19. Se elaboró una curva patrón con quercetina, luego se agregó 1,250 mL de agua supra pura y nitrito de sodio al 5 % a 0,250 mL de muestra, y todo ello quedó en reposo por 5 minutos. Se añadió cloruro de aluminio al 10 % y se dejó en reposo por 6 minutos. Por último, se agregó 0,5 mL de hidróxido de sodio 1N y 0,300 mL de agua destilada. La absorbancia se leyó en el espectrofotómetro a una longitud de onda de 510 nm. Los resultados se expresan como mg de quercetina/100 g de fruta fresca (mg EQ/100g).
Determinación de la capacidad antioxidante: técnica DPPH
Para este procedimiento se empleó el método de Brand-Williams 20, que se fundamenta en la reducción del radical libre 2,2-difenil-picril-hidrazil (DPPH). Utilizamos volúmenes de muestra entre 0,02 y 0,200 mL, luego se añadió 1,0 mL de la solución del DPPH (con D.O. aprox. 2,0) y metanol hasta completar un volumen final de 2,0 mL y se mantuvo en reposo en la oscuridad por 30 minutos. La absorbancia se leyó en el espectrofotómetro (longitud de onda de 515 nm). Las determinaciones se realizaron por triplicado y los resultados se expresan como valor IC50, que corresponde a la concentración de la muestra problema que disminuye la densidad óptica del control en un 50 %.
Determinación de la capacidad antioxidante: técnica FRAP
Para este análisis se utilizó la técnica FRAP (Ferric Reducing Ability of Plasma) propuesta por Benzie y Strain 21, que emplea un tubo de ensayo con 1,0 mL del reactivo 2,4,6-tripiridil-s-triazina-Fe3+ (TPTZ), luego, entre 0,1 y 0,3 mL de muestra y agua hasta completar 2 mL. Se colocó en baño maría a 37 °C por 15 minutos para leer la absorbancia a 593 nm. Con una solución de TPTZ con concentraciones distintas de sulfato ferroso se preparó una curva estándar. Los resultados se expresan como mmoles de Fe2+/100 g de muestra fresca.
Determinación de sustancias reactivas al ácido tiobarbitúrico (TBARS)
Empleamos el método de Ohkawa 22 modificado, que consiste en colocar en un tubo de ensayo suero (0,5 mL), ácido clorhídrico al 25 % (0,5 mL), solución de BHT al 2 % (0,045 mL) y 500 µL de TBA (1 % p/v en hidróxido de sodio 0,05 M). Se preparó un control con agua destilada, los tubos fueron agitados en un vortex y se colocaron en baño maría a ebullición por 10 minutos. Los tubos se enfriaron con hielo y añadimos 1,5 mL de n-butanol, se agitaron nuevamente, luego se centrifugaron por 10 minutos a 4000 rpm y se dejaron en reposo durante 30 minutos. Se separó la fase superior y se leyó a 532 nm, las lecturas fueron comparadas con una curva patrón utilizando TEP (1,1,3,3-tetratohipoxipropano), consideramos que 1 mol de TEP forma, por hidrólisis, 1 mol de MDA.
Estudio histopatológico
Pequeñas porciones de los hígados de las ratas se colocaron en una solución de formol al 10 %, en amortiguador fosfato 0,1 M y pH 7,4. Luego, los cortes histológicos fueron coloreados con tinción de hematoxilina y eosina.
RESULTADOS
En la Tabla 1 se observa el resultado del contenido de compuestos fenólicos del tumbo de Cusco (Suni) (287) y Cusco (Quechua)(584) con una diferencia estadísticamente significativa. Los valores encontrados en las muestras de las regiones Arequipa (Quechua) y Arequipa (Suni) no difieren de las de la región Moquegua (Quechua). El contenido de flavonoides hallados en los frutos provenientes de Cusco (Quechua), Moquegua (Suni), Arequipa (Yunga) y Arequipa (Suni) no fue estadísticamente significativo. Los valores más bajos de flavonoides se encontraron en las muestras originarias de las regiones Arequipa (Quechua) (223,54 mg EQ/100 g) y Moquegua (Quechua) (314,72 mg EQ/100 g).
La capacidad antioxidante del tumbo se evaluó con la técnica DPPH, que se expresa como valores IC50 (mg/mL). Para realizar las comparaciones se utilizó un análisis de varianza complementado con el test de Tukey, que evidenció que la muestra de la región Cusco (Suni) tiene el mayor valor IC50, seguido de Arequipa (Quechua) y las otras regiones, como Arequipa (Suni), Cusco (Quechua) y Moquegua (Quechua), con promedios menores; las muestras de Arequipa (Yunga) y Moquegua (Suni) son las que reportaron los valores menores (IC50: 0,41 y 0,45 mg/mL, respectivamente), es decir, que corresponden a las muestras con mayor capacidad antioxidante (Tabla 1).
Al evaluar la capacidad antioxidante del tumbo con la técnica FRAP, observamos que la muestra de la región Cusco (Quechua) tenía la mayor capacidad antioxidante (8,32 mmoles de Fe2+ /100 g de fruto fresco), que fue estadísticamente igual a los frutos de las regiones Arequipa (Yunga y Suni) y Moquegua (Suni); mientras que la menor capacidad antioxidante se encontró en la muestra proveniente de Arequipa (Quechua) (Tabla 1).
Tabla 1 Contenido de compuestos fenólicos, flavonoides y capacidad antioxidante del fruto de tumbo (Passiflora mollissima) de diferentes zonas agroecológicas
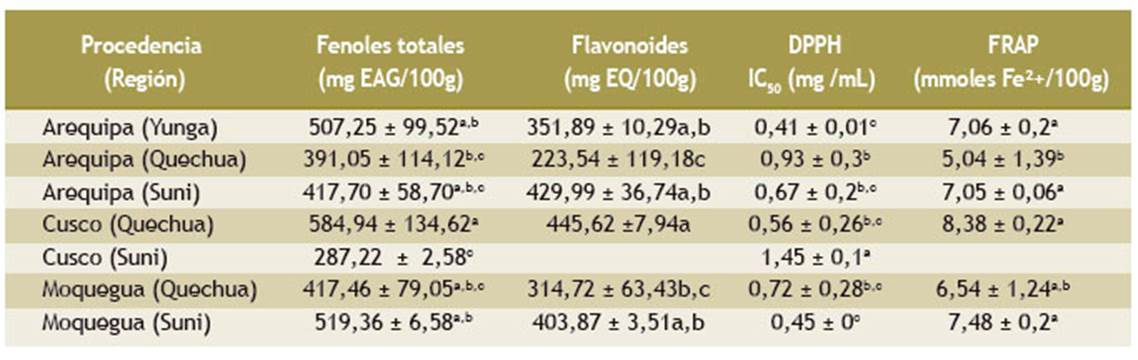
Los valores son los promedios ± DE (desviación estándar).
Las letras diferentes dentro de la columna son significativas según la prueba de Tukey (p < 0,05).
En la Tabla 2 se observa que el cerezo de la región Arequipa (Yunga) tuvo el mayor contenido de polifenoles (181,81 mg EAG/100 g), valor mayor que el fruto de la región Cusco (Quechua) (107,12 mg EAG/100 g), pero el fruto de la región Cusco (Suni) (60,04 mg EAG/100 g). El cerezo de la región Arequipa (Yunga) tiene el contenido más elevado de flavonoides (205,18 mg EQ/100 g), y el fruto de la región Arequipa (Quechua) muestra el valor más bajo (74,08 mg EQ/100 g).
La evaluación de la capacidad antioxidante, con la técnica DPPH, permite observar que el fruto del cerezo de la región Arequipa (Yunga) posee un valor IC50 de 2,1 mg/ mL, que es el más bajo en comparación con los frutos de las otras regiones, lo cual significa que tuvo la mayor capacidad antioxidante. Asimismo, al evaluar la capacidad antioxidante con la técnica FRAP de los frutos originarios de Arequipa (Yunga), Arequipa (Quechua) y Cusco (Quechua), se observa que los valores encontrados no muestran diferencias significativas (Tabla 2).
Tabla 2 Contenido de compuestos fenólicos, flavonoides y capacidad antioxidante del fruto de cerezo (Prunus serotina) de diferentes zonas agroecológicas
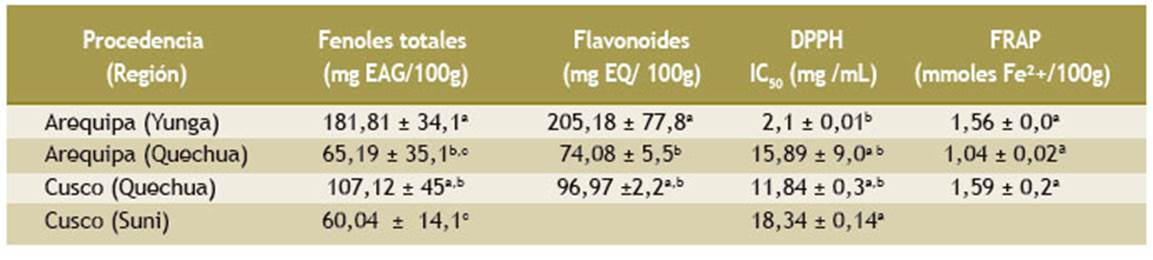
Los valores son los promedios ± DE (desviación estándar).
Las letras diferentes dentro de la columna son significativas según la prueba de Tukey (p < 0,05).
En la Tabla 3 se observa que las ratas de los grupos I y II que recibieron paracetamol 200 mg/kg de peso y tumbo liofilizado a las dosis de 200 y 400 mg/kg de peso, respectivamente, mostraron una menor concentración sérica de malondialdehído que el grupo control positivo, al que solamente se le administró paracetamol. Por el contrario, los grupos III y IV que recibieron la misma dosis de paracetamol (300 y 600 mg/kg del liofilizado de cerezo, respectivamente) mostraron valores séricos de malondialdehído mayores que los observados al inicio del tratamiento.
Tabla 3 Niveles séricos de malondialdehído (MDA) en ratas tratadas con paracetamol y extractos liofilizados de tumbo (Passiflora mollissima) y cerezo (Prunus serotina)
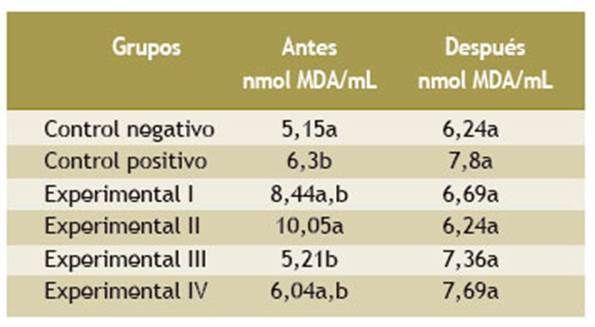
Los valores son los promedios ± DE (desviación estándar).
Las letras diferentes dentro de la columna son significativas, según t de Student (p < 0,05).
El estudio histopatológico del hígado de las ratas del grupo control negativo mostró una estructura normal bien conservada y sin signos de necrosis (Figura 1A). Al grupo control positivo se le administró solamente paracetamol y mostró una estructura lobulillar conservada con focos de necrosis coagulativa de hepatocitos y hemorragia con infiltrado linfocitario portal leve (Figura 1B). El hígado de la rata tratada con paracetamol y tumbo (400 mg/kg de peso corporal) muestra una estructura lobulillar normal, sin signos de necrosis, ni edema (Figura 1C); mientras que en el tejido hepático del animal tratado con paracetamol y cerezo (dosis de 600 mg/kg de peso) se observa edema leve de hepatocitos sin necrosis, estructura lobulillar conservada y congestión vascular leve focal (Figura 1D).
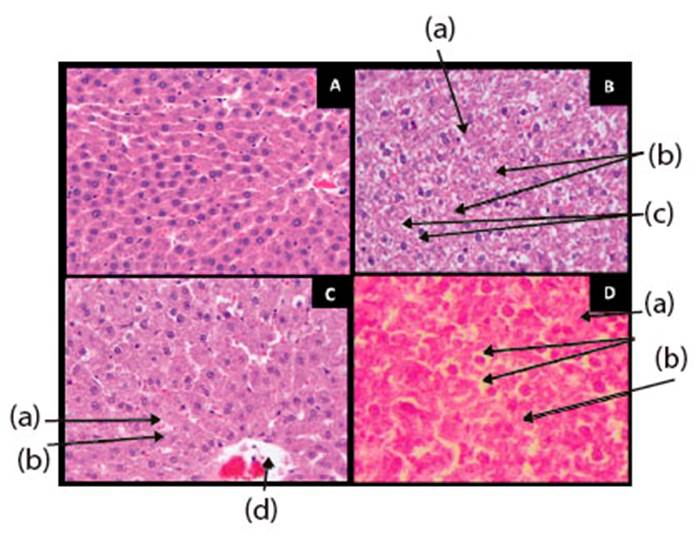
Figura 1 Hígado de rata luego del tratamiento A. Control negativo, B. Control positivo con tratamiento de paracetamol 200 mg/kg de peso, C. Grupo experimental II con tratamiento tumbo 400 mg/kg peso y paracetamol 200 mg/kg de peso y D. Grupo experimental IV con tratamiento cerezo 600 mg/kg peso y paracetamol 200 mg/kg. (a) ausencia de núcleos (necrosis de hepatocitos, (b) citoplasmas claros y granulares, (c) edema intracelular de hepatocitos, (d) vena centro lobulillar. Coloración hematoxilina-eosina (40 X)
DISCUSIÓN
El contenido de compuestos antioxidantes en un alimento depende de diversos factores como el genotipo, composición del suelo, clima, naturaleza del riego, altitud, etc. 16,23,24. En nuestro estudio hemos evaluado los compuestos antioxidantes de dos frutos, el tumbo y el cerezo, que se consumen con frecuencia en Arequipa y también en regiones colindantes como Cusco y Moquegua. Los polifenoles son compuestos de conocidas propiedades antioxidantes que se encuentran como componentes de una gran diversidad de frutos 25. El tumbo colectado en tres regiones del Perú (Arequipa, Cusco y Moquegua) tiene un elevado contenido de polifenoles (287,2 a 584,9 mg EAG/100 g), valores que son considerablemente mayores a la papaya de monte (167 mg EAG/100 g), al aguaymanto (154 mg EAG/100 g) y al tomate de árbol (130 mg EAG/100 g), mientras que las concentraciones de polifenoles del cerezo de la región Cusco (Suni) (60 mg EAG/100 g), de Arequipa (Quechua) (65 mg EAG/100 g) y la tuna roja (52 mg EAG/100g) son menores. En cambio, el tumbo o curuba, como se le conoce en Colombia 13, muestra un valor de 460 mg EAG/100 g, que es menor que el del tumbo colectado en Arequipa (Yunga), Cusco (Quechua) y Moquegua (Suni). Sin embargo, otra muestra de curuba también colectada en Colombia 26 tenía un contenido de fenoles totales de 635 mg EAG/100 g, que es mayor que todas las muestras de tumbo colectadas en las diversas regiones del Perú. En un estudio que valora la capacidad antioxidante de frutas colectadas en Ecuador 27, la Passiflora mollissima muestra 1010 mg EAG/100g de fenoles totales, cantidad que es superior a todos los frutos colectados con diferente ubicación geográfica.
El cerezo es un fruto con un volumen de antioxidantes que depende de la región donde se colecta. Así ocurre con el cerezo de Puebla (México), que contiene 325 mg EAG/100 g de fenoles totales 13, cantidad que difiere notablemente de la concentración de otra planta de cerezo (746 mg EAG/100 g) que se recoge en el mismo 28; ambos valores son mayores que los de las muestras colectadas en el Perú. El contenido de flavonoides 13 de la primera muestra de cerezo (146 mg EQ/100 g) es menor al del cerezo de Arequipa (Yunga), aunque mayor que las muestras recogidas en Arequipa (Quechua) y Cusco (Quechua).
El contenido de flavonoides del cerezo colectado en Arequipa (Yunga) (205 mg EQ/100 g) fue más elevado que los valores mostrados por las diferentes variedades de frambuesa 29, que son similares a los contenidos de flavonoides observados en el cerezo colectado en Arequipa (Quechua) y Cusco (Quechua). Mientras que los flavonoides del tumbo proveniente de las regiones estudiadas muestran valores mayores que las variedades de manzanas Rome beauty y Golden delicious 30. Los elevados contenidos de polifenoles y flavonoides del tumbo hacen de este fruto una excelente fuente de antioxidantes, cuyo consumo proporcionaría protección frente a enfermedades crónicas no transmisibles.
La evaluación de la capacidad antioxidante con la técnica FRAP muestra que el cerezo tiene valores que se asemejan a frutas como fresa, limón, ciruela y naranja 31, cuyos valores están comprendidos entre 0,94 y 1,59 mmoles de Fe2+/100 g, pero son menores que la capacidad antioxidante del tumbo de todas las regiones estudiadas, cuyos valores están comprendidos entre 5,04 mmoles de Fe2+/100 g, de la región Arequipa (Quechua) y 8,38 mmoles de Fe2+/100 g de la región Cusco (Quechua).
La evaluación de las propiedades bioactivas del fruto de Lycium barbarum32, con la técnica DPPH, muestra valores de la capacidad antioxidante que no difieren mayormente de unas muestras colectadas en China (IC50 : 0,795 mg/mL) y en Mongolia (IC50 : 0,784 mg/mL). En Grecia, algunos frutos recogidos tienen valores (IC50 entre 0,830 y 1,150 mg/mL) que dependen del mes en que fueron colectados. Estos valores son similares a los del tumbo de las regiones Arequipa, Cusco y Moquegua, pero son menores que los del cerezo originario de la región Arequipa (Quechua) y Cusco (Quechua y Suni).
En un estudio comparativo de las propiedades antioxidantes de varias frutas tropicales que utilizó la técnica DPPH 33 encontramos los siguientes valores IC50: guayaba (2,11 mg/mL), el plátano (13,4 mg/mL), la papaya (3,5 mg/mL) y la naranja (5,4 mg/mL), hallazgos más elevados que todas las variedades de tumbo colectadas en las regiones Cusco, Arequipa y Moquegua; es decir, que las frutas tropicales poseen menor capacidad antioxidante que el tumbo. Por el contrario, las capacidades antioxidantes de la guayaba, papaya y naranja son similares a las del cerezo de la región Arequipa (Yunga) (IC50: 2,1 mg/mL). Sin embargo, la capacidad antioxidante del plátano solo se compara con la del cerezo procedente de las regiones Arequipa (Quechua) y Cusco (Quechua y Suni).
La administración de 400 mg/kg de peso de paracetamol a las ratas durante siete días ocasionó un efecto hepatotóxico que fue evidente con el estudio histopatológico y por los valores de transaminasas, catalasa, superóxido dismutasa, etc. Estos efectos fueron revertidos por la administración de 500 mg/kg de peso de un extracto de Prunus serotina34, resultado similar al que hemos obtenido en condiciones análogas.
Las propiedades antioxidantes y hepatoprotectoras de los frutos de distintos orígenes muestran claramente que los polifenoles y flavonoides son compuestos bioactivos importantes que tienen un efecto protector en el hígado. En consecuencia, es necesario continuar con las investigaciones para establecer los mecanismos moleculares de la acción hepatoprotectora del tumbo y el cerezo















