INTRODUCCIÓN
En el año 2021 se diagnosticaron más de 9 millones de casos de tuberculosis (TB) en el mundo 1. Actualmente, el tratamiento de la TB enfrenta dos grandes retos: la drogo- resistencia y las reacciones adversas medicamentosas (RAM). El Perú está entre los países con mayor incidencia de tuberculosis, con un número de 116 casos por 100 mil habitantes 1. La incidencia de tuberculosis multirresistente (TB-MDR) en el Perú es de 9,40 % (resistente a rifampicina e isoniacida/rifampicina, TB-MDR/RR) 2. La frecuencia de RAM en pacientes con TB-MDR que suspendieron el tratamiento es del 2,00 %, pero el 30,00 % requiere de la remoción del fármaco sospechoso 3. La RAM más severa es la hepatotoxicidad, actualmente denominada "injuria hepática inducida por medicamentos (Drug-induced liver injury o DILI, por sus siglas en inglés)", con una incidencia del 7 % en pacientes con TB-MDR 4, basada en los criterios de la American Thoracic Society (ATS) 5. Los estudios sobre hepatotoxicidad por medicamentos antituberculosos son importantes, pues, actualmente, existen tres áreas de interés en este campo. Primero, es difícil llegar a identificar un fármaco causal único porque los esquemas contienen más de un medicamento (v. gr. isoniacida, rifampicina y pirazinamida), los cuales se administran simultáneamente y son conocidos por su riesgo de hepatotoxicidad. Segundo, a los pacientes con TB-MDR se les agregan otros antituberculosos, lo cual aumenta la posibilidad de injuria hepática inducida por antituberculosos (IHIA). Tercero, los criterios para catalogar un caso de IHIA son variados; por ejemplo, un reciente estudio publicado en el 2021 encontró una incidencia de IHIA en pacientes con TB-MDR de 16,40 %, sin embargo, no se utilizaron los criterios actualmente vigentes de la DILI-Expert Working Group 6. Por consiguiente, sería interesante el reporte de casos de hepatotoxicidad, con criterios actualizados, y el reporte del potencial de hepatotoxicidad de antibióticos utilizados en el tratamiento de la TB-MDR. Entre los más frecuentes están la isoniacida, pirazinamida, fluoroquinolonas, etionamida, amoxicilina/acido clavulánico (23 %), ácido paraminosalicílico, entre otros 7.
La presente investigación tiene el objetivo de estudiar las características clínicas de la injuria hepática inducida por antituberculosos (IHIA) utilizando los criterios de la DILI- Expert Working Group.
MATERIALES Y MÉTODOS
Diseño y población de estudio
El diseño del estudio fue de tipo descriptivo y retrospectivo. Se incluyó a pacientes mayores de 18 años con diagnóstico de TB-MDR. Para realizar esta investigación se revisaron las historias clínicas de pacientes hospitalizados con diagnóstico de TB-MDR e IHIA, como resultado del uso de medicamentos antituberculosos, durante el periodo comprendido desde enero de 2014 a diciembre de 2018. La población estudiada estuvo conformada por pacientes del Hospital Nacional Guillermo Almenara Irigoyen en Lima, Perú.
Variables y mediciones
Se denominó TB-MDR a la resistencia simultánea, como mínimo, a isoniacida y rifampicina, la cual se verificó mediante pruebas convencionales; TB extensamente resistente (TB XDR), resistencia a fármacos de segunda línea (amikacina, kanamicina o capreomicina), que se verificó mediante una prueba rápida, una prueba molecular o pruebas convencionales 2. Se utilizó los criterios de la DILI-Expert Working Group para el diagnóstico de la IHIA 6. Los criterios de exclusión que se tomaron en cuenta fueron la enfermedad hepática preexistente, tales como cirrosis biliar primaria, colangitis esclerosante primaria, hepatitis autoinmune u otra enfermedad crónica del tracto biliar. Para catalogar el grado de severidad de la IHIA también se tomó como referencia los criterios de la DILI-Expert Working Group, y se consideró leve o moderada si la bilirrubina sérica fue inferior a 2,00 mg/dl o si fue ≥ 2 mg/dl, respectivamente. Además, se catalogó como severo a las concentraciones de bilirrubina ≥ 2 mg/dl, la razón internacional normalizada (INR) ≥1,50; también ascitis, encefalopatía o compromiso de otro órgano, trasplante o muerte relacionando con la DILI 6.
Se utilizó el RUCAM (Roussel Uclaf Causality Assessment Method) 8 como instrumento para la evaluación de la causalidad. Según los puntajes obtenidos, el RUCAM 8 se clasifica en improbable, posible, probable y altamente probable. De acuerdo con las recomendaciones de este instrumento, se considera como uno solo a todos los fármacos antituberculosos potencialmente hepatotóxicos cuando un paciente los está tomando simultáneamente durante el evento de IHIA; para este estudio, en el análisis de causalidad, se consideró como un todo a rifampicina, isoniacida, pirazinamida, etionamida, quinolonas, amoxicilina/acido clavulánico, si el paciente estaba tomando estos antituberculosos cuando se presentó la reacción adversa.
Como método para establecer una asociación específica de un fármaco a IHIA, se utilizó dos métodos: la reexposición y la suspensión de los fármacos sospechosos y seguimiento del paciente con evolución clínica y de enzimas hepáticas sin IHIA. Durante el tratamiento de tuberculosis se usó un esquema de tratamiento con múltiples antibióticos potencialmente hepatotóxicos. Usualmente el esquema inicial para casos de tuberculosis pansensible es con rifampicina, isoniacida, etambutol y pirazinamida, cuando se produce IHIA, y las causas más probables y reportadas son rifampicina, isoniacida y pirazinamida. Cuando se está ante el caso de un paciente con IHIA, se suspende el tratamiento. Luego de que las enzimas hepáticas recuperan sus valores normales, se procede a la reintroducción progresiva de los fármacos de acuerdo con la metodología previamente descrita 9; usualmente se inicia con etambutol, luego rifampicina e isoniacida, finalmente pirazinamida (al mismo tiempo que se evalúa el proceso clínico y con toma de muestras para los exámenes de la función hepática ALT, FA, GGT y bilirrubinas séricas). Con el objetivo de identificar la asociación específica con un fármaco antituberculoso, se constató en las historias clínicas los procesos de la fase de exposición al medicamento (challenge), el retiro de fármacos (dechallenge) al detectar IHIA, la fase de reexposición (rechallenge) y la descripción de la evolución y seguimiento del paciente. Durante todo el proceso de reexposición, el paciente estuvo hospitalizado y se fue monitoreando su evolución clínica, y también se fue evaluando los exámenes de su función hepática (ALT, FA, bilirrubinas, GGT séricas). En la fase de reexposición, se consideró la asociación especifica de IHIA a un fármaco antituberculoso cuando se verificó la elevación de las enzimas hepáticas más de 2 veces el LSN de ALT, que con la discontinuación disminuyó a niveles previos a su reintroducción 5. En la fase de seguimiento, por consultorio externo, generalmente, se confirmó la asociación cuando se restableció el tratamiento y se excluyó el antituberculoso sospechoso, y no se produjo el evento de IHIA. El segundo método utilizado fue la constatación de la descripción en la historia clínica de la suspensión única y exclusiva de un antituberculoso sospechoso, y la verificación de la remisión o ausencia de elevación de enzimas hepáticas más de 2 veces el LSN de ALT en la evolución y seguimiento del paciente.
Para los objetivos de este estudio, se verificó la exposición de todos los fármacos antituberculosos componentes del esquema para el paciente de acuerdo con la sensibilidad o resistencia del Mycobacterium tuberculosis, y se tomó en cuenta la asociación temporal entre su administración y un evento de IHIA. Sin embargo, se tuvo presente que los resultados de los exámenes de resistencia suelen demorar o se conocen después de haber iniciado un tratamiento para el caso de tuberculosis pansensible.
Análisis estadístico
Es un estudio descriptivo y las variables continuas se presentan como media y desviación estándar. Las concentraciones de ALT, FA, bilirrubina y GGT séricas se presentaron como el número de veces por encima del valor límite normal. El índice de masa corporal (IMC) se calculó en base a la talla y el peso.
Consideraciones éticas
En la historia clínica se verificó la firma del paciente en el consentimiento informado para el tratamiento con antituberculosos. El paciente es parte del estudio retrospectivo, por lo que el consentimiento informado no se solicitó para la publicación de esta serie de casos; sin embargo, se establecieron las estrategias necesarias para impedir la identificación del paciente en la publicación de los datos.
RESULTADOS
El presente estudio reporta las características de 7 casos (de un total de 188, frecuencia 3,70 %) de DILI asociada a antituberculosos en pacientes con TB-MDR, cuyo evento se presentó a los 30,4 + 27,7 días del inicio del tratamiento. De ellos, 3 (43,00 %) presentaron ictericia; 4 (57,00 %) tuvieron patrón hepatocelular, y 3 (43,00 %), patrón colestásico; se registraron 4 (57,00 %) casos leves y 3 (43,00 %), moderados. La media de la fosfatasa alcalina (FA) (desviación estándar), la alanina aminotransferasa (ALT) y la gamma glutamiltranspeptidasa (GGT) séricas fueron de 2,40 (1,10), 7,90 (7,10) y 5,6 (3,70) veces el límite superior normal (LSN). La media de bilirrubina total fue de 2,30 (2,10) (rango 0,50-6,40 mg/dl). Cuatro casos estuvieron asociados a la pirazinamida (86,00 %); 1, a la pirazinamida y la etionamida; 1, a la rifampicina, la isoniacida y la pirazinamida Z; 1, a la rifampicina y pirazinamida Z. La media de hospitalización fue de 48,14 días; adicionalmente, se necesitó realizar de 1 a 3 internamientos durante el periodo de investigación.
El estudio se llevó a cabo en el Hospital Nacional Guillermo Almenara Irigoyen entre 2014 y 2018, donde se atendió a 188 pacientes. En los 7 casos de IHIA (4 varones y 3 mujeres) asociada a antituberculosos con TB-MDR (3,70%), la media de edad (desviación estándar) fue de 39,10 (13,30) años. Se detectó 6 pacientes con tuberculosis pulmonar y 1 paciente con tuberculosis urogenital; 6 presentaron resistencia a la isoniazida; 5, a la rifampicina; 4, a la estreptomicina; 2, a la pirazinamida, y 1, a la etionamida (Tabla 1). Cuatro pacientes tuvieron antecedentes de consumo de alcohol y 1, de tabaquismo. La media de índice de masa corporal (IMC) fue de 22,40 2,26 y un rango de 19,90-26,20. La evolución fue favorable en todos los pacientes.
Características de la IHIA
El criterio diagnóstico de IHIA de los niveles de alanina-aminotransferase (ALT) igual o elevada 5 veces por encima del LSN se presentó en 4 pacientes; de fosfatasa alcalina igual o mayor de 2 veces por encima de LSN, en 3 pacientes. Además, en 2 pacientes se encontró un incremento mayor o igual al triple de la concentración de ALT y un aumento concomitante de los niveles de bilirrubina sérica superior a 2 veces el LSN (Tabla 1).
La DILI se presentó a 30,40 (27,70) días (rango de 8-90 días) de exposición de los pacientes a los antituberculosos. Tres presentaron ictericia (43,00 %). Según el patrón de lesión, de acuerdo con la clasificación RUCAM, 4 (57,00 %) pacientes desarrollaron una lesión hepatocelular y 3 (43 %), lesión colestásica. La presentación de la IHIA fue leve en 4 (57%) y moderado en 3 (43,00 %). Los promedios de la fosfatasa alcalina (FA), la alanina aminotransferasa (ALT) y la gamma glutamiltranspeptidasa (GGT) séricas fueron de 2,40 (1,10), 7,90 (7,10) y 5,60 (3,70) veces el LSN. La
media de bilirrubina total fue de 2,30 (2,10) (rango de 0,50- 6,40 mg/dl). Asimismo, 1 paciente desarrolló IHIA durante la gestación, y se detectó 1 paciente con diabetes mellitus (Tabla 1).
Causalidad de la DILI con fármaco
La relación de causalidad de la IHIA con el fármaco antituberculoso se hizo mediante la verificación del proceso de reexposición en la historia clínica de 5 pacientes: en 3 se identificó la pirazinamida; en 1, la rifampicina y la pirazinamida; en 1, la pirazinamida y la etionamida. En 2 pacientes el criterio de remisión del evento al suspenderse el antituberculoso fue criterio de asociación con la DILI (en un paciente se suspendió conjuntamente la rifampicina, la isoniacida y la pirazinamida, y en otro paciente, solo la pirazinamida). Debe observarse que el antituberculoso identificado en los 7 pacientes fue la pirazinamida, que es uno de los antituberculosos asociados a IHIA.
Durante el proceso de la IHIA, seis pacientes estuvieron expuestos al esquema rifampicina, isoniacida, etambutol y pirazinamida (solo un paciente lo estuvo a rifampicina, pirazinamida, levofloxacina y cicloserina). La explicación de ello es que los resultados de los exámenes donde se evidenciaba drogorresistencia fue posterior al inicio del esquema usado en pansensibles. La drogorresistencia se manifestó frente a la isoniacida (1 paciente), la rifampicina (1 paciente), la rifampicina e isoniacida (1 paciente), la rifampicina, la isoniacida, el etambutol y la pirazinamida (1 paciente), la rifampicina, la isoniacida, el etambutol y la estreptomicina (1 paciente), y la rifampicina, la isoniacida, el etambutol y la pirazinamida y la etionamida (1 paciente). Como parte del esquema, para dar el alta al paciente, se administró quinolonas a 7 de ellos (6 recibieron levofloxacino; 1, ofloxacina), y 1 paciente recibió acido amoxicilina/acido clavulánico, los cuales fueron tolerados (Tabla 1).
DISCUSIÓN
Uno de los hallazgos principales del presente estudio es que la pirazinamida es el fármaco con mayor potencialidad de desarrollar la IHIA en pacientes TB-MDR, lo cual coincide con hallazgos de estudios similares. En el estudio de Keshavjee et al., de 91 casos de hepatotoxicidad en pacientes con TB-MDR, 69 estuvieron recibiendo pirazinamida cuando se presentó el evento, y en 7 (10,20 %) se suspendió definitivamente; 75 pacientes tomaban etionamida/protionamida, y en 8 (10,70 %) se excluyó de su tratamiento; por otro lado, de 90 pacientes que recibían fluoroquinolonas, se suspendió el tratamiento en 1 (1,10 %) 7. En el estudio descrito para el diagnóstico de IHIA se utilizó los criterios de la ATS (American Thoracic Society) 5, ALT igual o más de 5 veces el LSN o 3 veces más de ALT del LSN más ictericia. El estudio de Lee et al. describió a 29 pacientes con TB-MDR que desarrollaron la DILI, motivo por el que se suspendió definitivamente la protionamida en 5 (17,00 %), la pirazinamida en 3 (10,30 %), el ácido para-aminosalicílico en 1 (3,4 %), la cicloserina en 1 (3,4 %) y la rifabutina en 1 (3,4 %) 10. En este último estudio, los criterios de IHIA fueron los mismos que se utilizaron en el presente trabajo 6. Torun et al. reportaron 12 casos de hepatotoxicidad en pacientes con TB-MDR (12/263; 4,50 % de frecuencia), y el evento se logró controlar suspendiendo la protionamida en 7 y la pirazinamida en 1 paciente; la definición operacional utilizada fue la elevación de transaminasas séricas en presencia de síntomas o elevación de transaminasa por 5 veces el LSN 11. Existen otros estudios, sin embargo, no se ha realizado el análisis de causalidad e identificación del fármaco asociado a la IHIA 12-14.
La pirazinamida es una prodroga que se activa a nivel hepático a ácido pirazinoico. Se ha reportado que el metabolito de pirazinamida, denominado ácido 5-hydroxypyrazinoic (5-OH-PA), estaría asociado a la IHIA resultante del metabolismo de pirazinamida por una amidasa hepática para formar ácido pyrazinoico, luego esta última es hidrolizada por la xanthine oxidase, y se forma el acidohidroxipirazinoico (5-OH-PA) 15. Por otro lado, recientemente se ha aplicado la metodología toxicogenómica para describir un nuevo mecanismo de hepatotoxicidad de la etionamida, el cual consiste en la producción de estrés del retículo endoplásmico, es decir, produce acumulación de proteína desplegada en el retículo endoplásmico, la cual activa la respuesta a la misma, que lleva a la apoptosis celular; los genes de estrés del retículo endoplásmico celular, como Atf4 y Hspa5 (Grp78), ayudan a aliviar el exceso de carga de proteínas; con el estrés prolongado del retículo endoplásmico la activación de genes como Ddit3 (Chop) contribuye a la muerte celular 16.
Tabla 1 Características clínicas de la hepatotoxicidad por antituberculosos en pacientes con tuberculosis multidrogorresistente
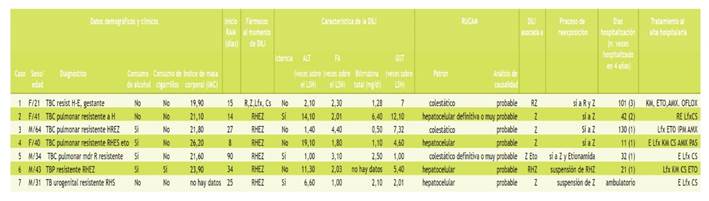
DILI: injuria hepática inducida por medicamento (drug-induced liver injury, DILI); RUCAM: Roussel Uclaf Causality Assessment Method; Pirazinamida; R: rifampicina, H: isoniacida, E: etambutol, ALT: Alanineaminotransferase; FA: fosfatasa alcalina; GGT: gammaglutamil transpeptidasa; LSN: límite superior normal; R: rifampicina; H: isoniacida; E: etambutol; Z: pirazinamida; S: estreptomicina; Eto: etionamida; Lfx: levofloxacino; OFL: ofloxacina; AMX: ácido amoxicilina/ácido clavulánico; Cs: cicloserina; KM: kanamicina; IMP: imipenem/cilastatina; PAS: para-aminosalicilico.
El presente estudio ha encontrado una media de estancia hospitalaria de 48 días. Se ha reportado que dicha estancia en pacientes con TB-MDR (sin especificar si es por IHIA o no) está en el rango de 90 días 17 a 240 días 18. Aunque la cifra reportada de estancia hospitalaria es mucho menor que la publicada en otros estudios, este punto es de interés por dos razones: primero, porque abre el debate entre los que propugnan un tratamiento externalizado del paciente hasta los que proponen la vuelta al sistema antiguo de sanatorios 19; segundo, porque el progresivo incremento de la TB-MDR y TB-XDR hace necesario que se realicen modificaciones en los sistemas de salud para prevenir su expansión 20.
Asimismo, este estudio presenta limitaciones esencialmente por su diseño retrospectivo, el cual no permite la realización de un seguimiento exhaustivo durante y después del proceso de IHIA, especialmente en lo que se refiere a datos de laboratorio y evolución clínica del paciente. Por otro lado, la utilización de criterios actualizados y validados para la detección de la IHIA e instrumentos como el RUCAM para el análisis de causalidad, como el utilizado en el presente estudio, hacen difícil la comparación con otras investigaciones porque, en publicaciones previas, se ha empleado una diversidad de criterios con puntos de corte diferentes en las enzimas hepáticas, y la mayoría de ellos asumen la causalidad a los 3 antituberculosos (isoniacida, rifampicina y pirazinamida) y no describen los procesos de reexposición y sus resultados.
En conclusión, la IHIA en pacientes TB-MDR se inicia después de la cuarta semana, el patrón predominante es hepatocelular y frecuentemente asociado a la pirazinamida, y la media de estancia hospitalaria supera el mes y medio.















