INTRODUCCIÓN
Ante una situación de estrés fisiológico (ejercicio, agitación, miedo) o patológico (proceso agudo o crónico, uso de ciertos fármacos, procedimientos) se produce una estimulación del sistema nervioso simpático, el cual, en condiciones normales, prepara al organismo para afrontarla y, por lo general, incrementa la capacidad de respuesta, ofreciendo una mayor cantidad de glucosa y de oxígeno disponible (DO2) 1. La glucosa plasmática aumenta, lo mismo que el oxígeno disponible, debido al crecimiento del gasto cardiaco y la concentración arterial de oxígeno. Al disponer de glucosa y oxígeno, la célula genera un mayor volumen de piruvato que excede la capacidad de metabolismo de la mitocondria hacia el ciclo de Krebs, por lo que se convierte en lactato 2.
Cuando un paciente sufre un proceso patológico que aumenta el consumo o disminuye la disponibilidad de oxígeno, el lactato puede incrementarse por una condición de hipoperfusión 3. Por lo tanto, es importante entender el mecanismo de la génesis de lactato e interpretar de manera adecuada el estado del paciente para administrar los soportes requeridos.
En esta revisión, se expondrá el mecanismo mediante el cual la estimulación del sistema simpático promueve el aumento de los valores de lactato sérico; además, trataremos de explicar la compleja interacción farmacológica y fisiológica del lactato con las catecolaminas y la utilidad de este conocimiento para el manejo del paciente críticamente enfermo con sepsis y choque séptico.
El lactato como fuente de energía
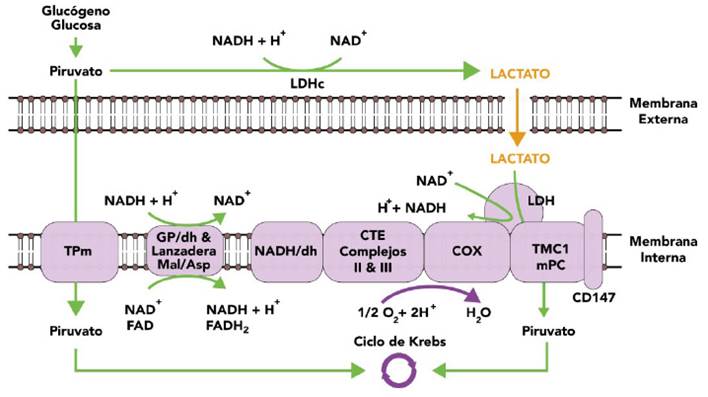
El lactato proviene del metabolismo de la glucosa. A través del proceso de glucólisis, la glucosa se convierte en piruvato por acción de la enzima fosfofructocinasa en la vía de Embden-Meyerhof (2). El piruvato obtenido puede seguir dos rutas: en la primera, ingresa a la mitocondria, y puede ser convertido en acetilcoenzima A y, así, entrar al ciclo de Krebs para producir adenosín trifosfato (ATP); en la segunda ruta, el piruvato puede ser convertido en el citosol a lactato por acción de la enzima deshidrogenasa láctica 2,4.
El lactato es un metabolito altamente dinámico, producto del metabolismo anaerobio y puede usarse como combustible por varias células del organismo, particularmente, durante el aumento del metabolismo ocasionado por el ejercicio o la enfermedad 5; y, en condiciones aerobias, se genera lactato constantemente. Además, se produce un traslado entre células consumidoras y productoras que cumple con tres propósitos: ser una fuente de energía, ser un precursor gluconeogénico y actuar como molécula de señalización 6.
Desde el punto de vista bioenergético, un incremento en la glicólisis, incluso con una disposición de oxígeno adecuada, requiere una cantidad suficiente de NAD+ para aceptar electrones en su primer paso de oxidación. Es necesario, entonces, un mecanismo de reciclaje en el citosol para producir NAD+ desde NADH; en este punto, en la conversión de piruvato a lactato, el electrón de NADH pasa al piruvato y genera el NAD+ necesario para la glicólisis 7. Por lo tanto, un incremento en la disposición de glucosa en la célula como fuente de energía produce también lactato aun en una condición aerobia.
El lactato que es captado por las células consumidoras se convierte en piruvato en el interior de la mitocondria, con base en la teoría del transporte intracelular de lactato 5,6. El metabolismo del lactato en el interior de la mitocondria ocurre por acción del complejo de oxidación de lactato mitocondrial (COLm), que contiene varios componentes esenciales para la oxidación de lactato como un transportador de monocarboxilato (TMC), la enzima lactato-deshidrogenasa (LDH) y una citocromo-oxidasa (COx) 6 (Figura 1).
La producción y absorción de lactato es variable en los diferentes tejidos del organismo. Los valores de lactato sanguíneo son el resultado de la relación entre la producción, la reabsorción, el metabolismo y la excreción. La diferencia en las concentraciones de lactato en distintos tejidos de un mismo organismo está explicada por este principio 5,8.
En el sistema cardiaco, el lactato es consumido por las fibras musculares cardiacas durante el aumento de la demanda de trabajo del miocardio. Ahí otra vez se convierte en piruvato al interior de la mitocondria cardiaca por acción de la deshidrogenasa láctica mitocondrial (LDHm), gracias al transporte por la vía del MCT1 (una isoforma del transportador de monocarboxilato) 5,8.
En el tejido nervioso, las células pueden utilizar el lactato como fuente de energía, lo que se ha confirmado mediante el análisis inmunológico de LDHm 5. En el sistema nervioso, el lactato deriva del glicógeno astrocítico en el aumento del metabolismo cerebral y tiene un rol energético importante. Además, el glicógeno astrocítico mantiene los niveles de ATP en el cerebro en valores adecuados y actúa como un posible mecanismo de defensa neuronal 9.
El músculo esquelético es el sitio de mayor producción y de aclaramiento de lactato del cuerpo. En un incremento rápido del metabolismo muscular, el lactato es liberado a la circulación y, si el músculo se mantiene en actividad, este lactato puede ser nuevamente utilizado como recurso para obtener energía 5.
Sistema nervioso simpático en condiciones de estrés
En el modelo de Langley y Gaskey, el sistema nervioso autónomo incluye al sistema nervioso parasimpático de origen craneal y sacro, y está dividido por el sistema simpático a nivel toracolumbar 1,10.
Las neuronas preganglionares del sistema nervioso autónomo simpático emergen del sistema nervioso central hacia los ganglios de la cadena simpática, donde realizan sinapsis con la neurona posganglionar 11, viajan junto al nervio raquídeo y se extienden hacia todas las zonas del cuerpo siguiendo la distribución de los dermatomas. Estas neuronas preganglionares controlarán los vasos sanguíneos, los músculos piloerectores y las glándulas sudoríparas 10,12. La fibra preganglionar puede atravesar el ganglio paravertebral hacia los ganglios prevertebrales simpáticos celíaco, mesentérico superior y mesentérico inferior, realizar sinapsis con la neurona posganglionar y salir para dar la inervación simpática a los órganos de los sistemas digestivo, urinario, reproductor y a las glándulas suprarrenales 11.
La noradrenalina es una catecolamina que cumple la función de neurotransmisor y de hormona. De acuerdo al sitio de liberación y donde genere su efecto se produce en los siguientes lugares: 1) la unión de la neurona posganglionar con el tejido efector del sistema nervioso simpático, 2) algunos núcleos del sistema nervioso central y 3) las glándulas suprarrenales, desde donde se libera a la circulación 12.
El sistema nervioso simpático se activa ante las situaciones de estrés y el aumento de la demanda de energía por el organismo. Está distribuido de manera amplia y cuando es estimulado genera importantes cambios en varios órganos y sistemas.
El gasto cardiaco se incrementa por dos mecanismos dependientes de la entrada de calcio al interior del miocito. El primero es un inotropismo positivo secundario a la unión con la troponina C que libera el sitio activo de la actina para su unión con el puente cruzado de la miosina. El segundo es un mecanismo cronotrópico positivo secundario al incremento de cargas positivas que eleva el potencial de reposo y logra que el potencial de umbral se alcance más rápido, lo que ocasiona su despolarización 12.
En el aparato vascular, la vasoconstricción es más intensa, lo que incrementa el volumen estresado y la presión media de llenado sistémico, eleva las resistencias vasculares y, en consecuencia, aumenta la presión arterial. En las vías respiratorias, ocurre una broncodilatación y leve contracción de los vasos sanguíneos, lo cual favorece a la redistribución del flujo sanguíneo a las zonas mejor oxigenadas. Disminuye la actividad del sistema digestivo y aumenta del metabolismo basal hasta en un 100 %, incrementa la glucogenólisis y la gluconeogénesis hepáticas y, además, eleva la lipólisis en el tejido adiposo 10,12.
En el sistema nervioso central, las neuronas adrenérgicas se originan, principalmente, en el locus coeruleus, desde aquí sus axones se dirigen y actúan sobre receptores adrenérgicos en la amígdala central, circunvolución del cíngulo, giro cingulado, hipocampo, neocórtex, médula espinal, cuerpo estriado y tálamo 13,14. La estimulación por las neuronas noradrenérgicas aumenta la capacidad del organismo para procesar estímulos relevantes o sobresalientes y suprimir estímulos irrelevantes. En una visión general, los sistemas liberadores de noradrenalina afectan el aprendizaje y la toma de decisiones, el control del sueño y la vigilia, la relevancia sensorial y las respuestas hemodinámicas cerebrales 15.
La médula suprarrenal es el tercer lugar que produce catecolaminas: este órgano sintetiza y libera importantes cantidades de adrenalina y noradrenalina a la circulación sistémica 12,16. La estimulación de la médula suprarrenal por los nervios simpáticos provoca la liberación de catecolaminas endógenas a la circulación general, teniendo casi los mismos efectos sobre los órganos que la estimulación simpática directa; se diferencian en que las catecolaminas circulantes producen un efecto 5 a 10 veces más prolongado, ya que permanecen de 2 a 4 minutos en la sangre 12.
Catecolaminas endógenas
Las catecolaminas se sintetizan a partir del aminoácido tirosina, que sufrirá varias reacciones bioquímicas en el interior de la célula 17. Por varias reacciones enzimáticas, la tirosina se convierte en noradrenalina. Una pequeña parte de la noradrenalina es metilada a adrenalina. La noradrenalina y adrenalina resultantes son transportadas al interior de las vesículas granulares para su almacenamiento, hasta que llega el estímulo para su liberación 18.
La acción de las catecolaminas finaliza por dos mecanismos: el primero, la inactivación enzimática; el segundo, la captación neuronal y extraneuronal. Para la inactivación de las catecolaminas endógenas existe un sistema enzimático específico constituido por la catecol-o-metiltransferasa (COMT) y la monoaminooxidasa (MAO). La MAO es una enzima oxidativa localizada principalmente en la membrana mitocondrial externa de las neuronas, aunque también está en el tejido no neuronal, y su actividad se centra en la fracción citoplasmática de las monoaminas fuera de las vesículas. La COMT es una enzima localizada en los tejidos neuronales y extraneuronales, y se ubica en la fracción soluble citoplasmática que puede estar asociada a la membrana celular. Esta enzima metaboliza las catecolaminas circulantes en el riñón, el hígado y las que son liberadas localmente en el tejido efector 19-23.
Fisiología de la liberación de lactato por estimulación adrenérgica
En varios tejidos, sobre todo en el muscular, la estimulación adrenérgica incrementa la formación de lactato mediante un aumento en la actividad de la bomba Na+/K+ ATPasa mediado por la estimulación del receptor adrenérgico β2. La activación de este receptor aumenta la producción de AMP cíclico, lo que induce la estimulación de la glucogenólisis y la glucólisis con la producción concomitante de ATP y la activación de la bomba Na+/K+ ATPasa. Esta activación consume ATP, lo que lleva a la generación de ADP. El incremento en la concentración de ADP estimula mayor generación de piruvato y, en consecuencia, más lactato 3,24 (Figura 2).
Ante la estimulación por catecolaminas endógenas o exógenas, se produce un estado llamado glucólisis aerobia acelerada, que ocurre cuando la tasa de metabolismo de los carbohidratos excede la capacidad oxidativa de las mitocondrias que incrementan el lactato en condición aerobia 3.
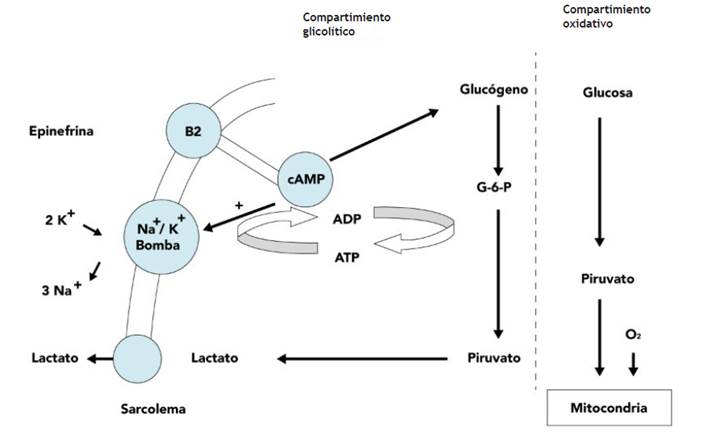
Figura 2 Relación del receptor β2 adrenérgico con la bomba Na+/K+ ATPasa y la producción de lactato Modificado de (3) Receptor β2 adrenérgico y producción de lactato
La estimulación del receptor β2 ocasiona un incremento aeróbico de los niveles de lactato por un mecanismo dependiente de la bomba Na+/K+ ATPasa, ya explicado en este capítulo. El receptor β2 es una proteína transmembrana asociada a la proteína G; su estimulación produce un cambio conformacional que activa la adenilato-ciclasa y aumenta la concentración de AMPc intracelular, lo que lleva a la estimulación de proteincinasa A, la cual induce la liberación de Ca++ y, como resultado, favorece la contracción muscular 25.
El receptor β2 adrenérgico transmite señales hacia el interior de la célula a través de un sistema de segundo mensajero acoplado a proteína G. La unión de un agonista de alta eficacia y alta afinidad se asocia con una heterogeneidad conformacional que puede ser importante para permitir que el receptor β2 adrenérgico active varias proteínas de señalización o reguladoras alternativas, dependiendo del contexto fisiológico (Gs, Gi, quinasas y arrestinas) 26.
Algunos codones específicos en los genes que codifican el receptor β2 adrenérgico han presentado polimorfismos 27 que pueden influir de manera positiva o negativa en los sistemas cardiovascular, respiratorio, metabólico y musculoesquelético debido a la gran expresión de los receptores β2 adrenérgicos en todo el cuerpo 25. Las alteraciones de este receptor se correlacionan con hipertensión, con mayor requerimiento de vasopresor durante la cirugía 27; sin embargo, no se ha comprobado que estos polimorfismos predispongan a un mejor rendimiento en atletas 25.
El lactato y las situaciones de estrés
Durante las situaciones de estrés, como ejercicio, exposición al peligro, enfermedad o trauma, el estímulo simpático genera una liberación de catecolaminas endógenas, las cuales pueden estimular los receptores adrenérgicos 10,12.
Cuando una persona sana se ejercita, la elevación de catecolaminas estimula la producción de lactato en el músculo estriado, pero no en el tejido adiposo. En este proceso, el receptor β2 es el adrenoreceptor más importante en la regulación de la producción de lactato 28. El ejercicio de moderada a alta intensidad produce hiperlactatemia por estrés: cuando se alcanza un porcentaje del máximo oxígeno consumido (VO2 max), la acumulación de lactato se incrementa. Las concentraciones plasmáticas de epinefrina y norepinefrina se elevan en el ejercicio, lo cual estimula la glucogenólisis y la producción de lactato. Entonces, en el ejercicio, el lactato se incrementa por el incremento del metabolismo y no solo por la disminución de la disposición de oxígeno por el tejido. Esto se comprueba con la capacidad del músculo para producir lactato en condiciones aeróbicas durante el ejercicio de gran intensidad 7.
La enfermedad crítica está asociada con hiperlactacidemia, y a mayor concentración de lactato en la sangre, mayor es el riesgo de muerte de los pacientes. La teoría básica es que la hiperlactacidemia de la enfermedad crítica se produce por una hipoperfusión tisular o por hipoxia tisular y es indicativa de metabolismo anaerobio. Sin embargo, en estudios en humanos no se ha encontrado una relación lineal entre los niveles de lactato y los marcadores de perfusión u oxigenación 7.
La producción metabólica hipóxico-anaeróbica de lactato puede ser global (shock) o focal (p. ej., isquemia intestinal). El aumento no hipóxico del nivel de lactato en el enfermo crítico puede ser el resultado de la eliminación alterada, la disfunción de la piruvato deshidrogenasa, el aumento de la degradación de proteínas a piruvato y la glucólisis aeróbica acelerada 29.
En el caso del shock séptico, las guías de manejo actuales sugieren realizar un manejo clínico enfocado en normalizar los niveles de lactato. Sin embargo, ante la evidencia de otras formas de producción y aclaramiento de lactato no relacionado con anaerobiosis, se ha planteado que la resucitación guiada por lactato como marcador de normalización de la hipoxia/isquemia puede llevar a una sobreactuación al tratar de aclarar un lactato generado por otro mecanismo fisiopatológico 30.
El estudio ANDROMEDA Shock Trial, desarrollado en Latinoamérica, compara la resucitación guiada por objetivo clínico de tiempo de llenado capilar con la resucitación guiada por niveles en sangre arterial de lactato, e indica que no existió diferencia en la mortalidad a los 28 días entre los dos grupos. No obstante, el grupo de pacientes guiados por perfusión periférica recibió menor cantidad de fluidos de resucitación dentro de las primeras 8 horas y desarrolló menos disfunción orgánica asociada a las 72 horas de la randomización 31.
Entre los pacientes con shock séptico que desarrollan hiperlactatemia y se relacionan con el grado de hipoperfusión aparecen dos patrones clínicos: el primero, los pacientes con hiperlactatemia asociada a saturación venosa central baja (ScvO₂), alta diferencia de CO₂ arterial y venoso (P(cv-a) CO₂) o tiempo de llenado capilar prolongado; y, el segundo patrón, los que tienen hiperlactatemia aislada. Los pacientes del primer grupo presentan una mayor disfunción circulatoria 32.
Con esta premisa, se propone que los niveles de lactato durante la enfermedad severa están en relación con un mecanismo de anaerobiosis, principalmente, pero que existen otros determinantes capaces de mantener niveles elevados de lactato, incluso cuando la condición de hipoxia/isquemia está resuelta.
El incremento de la glicólisis aerobia por la estimulación del receptor β2 es un mecanismo común en la generación de lactato durante estados iniciales de shock7. El incremento de AMPc, por estimulación adrenérgica del receptor β2, activa la glucogenólisis y la glucólisis, las cuales favorecen la síntesis de lactato dependiente de la bomba Na+/K+ ATPasa mediante la producción de ATP 33.
El lactato y el uso de catecolaminas exógenas
La administración de fármacos que estimulan los receptores adrenérgicos puede incrementar la producción aeróbica de lactato por el mismo mecanismo fisiopatológico que emplean las catecolaminas endógenas en el estrés. Los fármacos vasoactivos e inotrópicos son utilizados con frecuencia en las unidades de cuidados intensivos por su capacidad de modificar los determinantes del oxígeno disponible (DO2) en casos de compromiso de la hemodinamia y perfusión.
Las investigaciones en pacientes con shock séptico, en quienes compararon el efecto de epinefrina, norepinefrina y dobutamina en el soporte hemodinámico, mostraron que la epinefrina es tan efectiva como la combinación norepinefrina-dobutamina para alcanzar objetivos hemodinámicos; sin embargo, el grupo que empleó epinefrina presentó una acidosis láctica marcada, pero transitoria y, además, un incremento en el ratio de los niveles de lactato/piruvato 29.
Un estudio prospectivo observacional evaluó la relación entre los niveles de adrenalina, lactato y mortalidad en pacientes con shock séptico en unidades de cuidados intensivos y reportó que las personas que reciben adrenalina como soporte hemodinámico muestran una correlación positiva entre la máxima dosis de adrenalina y la concentración máxima de lactato en sangre. En este estudio se calcula el índice lactato como el grado de variación de lactato en relación al incremento de adrenalina. Es relevante la conexión de este índice con la mortalidad de los pacientes con shock séptico, ya que los sobrevivientes tienen un índice de lactato más elevado que los no sobrevivientes. Esto puede sugerir que la respuesta en la producción de lactato por la estimulación β2 es predictiva de sobrevida en pacientes críticos, al contrario de la elevación de lactato dependiente de hipoxia 34.
Uso de fármacos para modificar la concentración de lactato
El uso de fármacos con actividad antagonista sobre el estímulo simpático ha sido propuesto para disminuir los efectos ocasionados por la descarga adrenérgica secundaria a la injuria, ya que es un mecanismo capaz de incrementar el consumo de oxígeno por los tejidos, sobre todo a nivel cardiaco.
El shock séptico es la principal causa de muerte en los pacientes internados en unidades de cuidados intensivos y, según la definición de la Campaña de Sobrevivencia a la Sepsis, está asociado a la hipoperfusión e incremento en los valores de lactato. Aunque la resucitación con fluidos y el uso de vasopresores son los tratamientos de soporte hemodinámico más utilizados para mantener la presión arterial y el flujo sanguíneo a los órganos vitales, estos procedimientos pueden tener efectos cardiacos deletéreos. La sobreestimulación simpática y el uso de catecolaminas exógenas pueden incrementar el riesgo de comprometer la función cardiaca durante la sepsis 35.
La hiperlactacidemia persistente durante el shock séptico ha sido catalogada como multifactorial: por generación anaeróbica secundaria a hipoperfusión, por la producción aeróbica dependiente de la descarga adrenérgica y por la disminución en el aclaramiento de lactato 36.
El experimento en modelos animales publicado por Hernández et al. plantea que una respuesta adrenérgica excesiva puede causar hiperlactacidemia persistente y que la modulación adrenérgica puede resultar beneficiosa. El estudio consistió en inducir un shock séptico por endotoxemia en un modelo animal y asignarlo a uno de tres grupos: control, esmolol y dexmedetomidina. Las variables hemodinámicas y los niveles de lactato (muscular, portal y sistémico) fueron monitorizados: la frecuencia cardiaca más baja se observó en el grupo esmolol, y los valores finales de lactato más bajos se encontraron en los grupos de dexmedetomidina y esmolol. No se observó diferencia en la producción de lactato muscular en los tres grupos; los niveles de lactato portal disminuyeron al administrarse esmolol y dexmedetomidina, y el aclaramiento de lactato fue mayor en los grupos esmolol y dexmedetomidina que en el control. En conclusión, el uso de dexmedetomidina y esmolol fue asociado con valores arteriales y portales más bajos de lactato y con mejoría del aclaramiento de lactato 36.
Dos revisiones sistemáticas recientes informaron que el uso de betabloqueadores en shock séptico disminuye la mortalidad a los 28 días 35,37. En la revisión sistemática y metaanálisis de Li et al. (2020) se reporta, además, que el empleo de betabloqueadores en pacientes con sepsis y shock séptico reduce la mortalidad a los 28 días en los pacientes que reciben esmolol (RR = 0,59, CI: 0,48-0,74, p: < 0,00001) y disminuye la frecuencia cardiaca, los niveles plasmáticos de troponina; mientras que los valores de presión arterial media, de presión venosa central, de saturación venosa central y de lactato no presentaron diferencia estadísticamente significativa. El trabajo concluye que la falla circulatoria secundaria a la sepsis tiene un componente de dilatación vascular periférica, pero también un grado variable de compromiso miocárdico. Optimizar el aporte y el consumo de oxígeno miocárdico del paciente séptico mejora las posibilidades de sobrevida, a pesar de no mostrar una diferencia en los valores de lactato 35.
Con base en los estudios citados, el uso de betabloqueadores con actividad sobre los receptores β1 disminuye la mortalidad en pacientes con shock séptico, lo que se explica por la evidencia de modulación sobre la función cardiaca de la respuesta adrenérgica. Esta es un área de estudio que requiere más trabajos para su total entendimiento. Sin embargo, de acuerdo con estos resultados, podemos afirmar que el objetivo de controlar la descarga adrenérgica durante el shock séptico estaría basado en disminuir el consumo de oxígeno por el miocardio, como una condición para disminuir la mortalidad; y que la producción aeróbica de lactato por hiperadrenergia es un proceso necesario para permitir el intercambio entre las células de lactato como molécula para generar energía.
CONCLUSIONES
En una situación de estrés, el sistema nervioso simpático responde con la liberación de catecolaminas a la brecha sináptica y al torrente sanguíneo. Esto ocasiona un incremento en el oxígeno y la glucosa disponibles para hacer frente a la condición de peligro.
El lactato puede producirse en condiciones aeróbicas gracias al estímulo adrenérgico sobre los receptores β2. Este tipo de receptor acoplado a la proteína G produce, finalmente, un incremento en la concentración de AMP cíclico que induce la estimulación de la glucogenólisis y glucólisis con producción concomitantes de ATP y la activación de la bomba Na+/K+ ATPasa. El ATP se fragmenta por el trabajo de la bomba y se incrementa la concentración de ADP, lo que estimula una mayor generación de piruvato. Al mismo tiempo, se observa un estado conocido como glucólisis aerobia acelerada, en el que la generación de piruvato supera la capacidad de metabolismo de la mitocondria, por lo que se convierte en lactato y se exporta a la circulación.
El incremento de las catecolaminas endógenas o exógenas aumenta la producción de lactato por vías comunes. El incremento en la concentración de lactato por estimulación adrenérgica está expuesto como una respuesta adecuada que permite afrontar las situaciones de estrés.
La regulación de la respuesta simpática, cuando los niveles de adrenalina están elevados como sucede en shock séptico, reduciría la mortalidad por un mecanismo dependiente del control de consumo de oxígeno por el músculo cardiaco. Aunque también, en estudios experimentales, existe una asociación con la producción y aclaramiento de lactato respecto al uso de fármacos betabloqueadores.