Introducción
La sepsis es la respuesta desordenada del organismo ante la infección, que se caracteriza por un daño a los órganos, muchas veces irreversible, lo que la convierte en una entidad potencialmente mortal 1. En EE. UU., la sepsis afecta aproximadamente a 1,7 millones de personas, con una mortalidad hasta del 50 % 2. Pese a los avances en su diagnóstico y manejo, aún no se dispone de un tratamiento claro; sin embargo, se ha demostrado que el uso racional y dirigido de antibióticos, sumado a medidas de soporte para los fallos orgánicos, es esencialmente clave en su pronóstico.
En la actualidad, se ha resaltado el importante papel del tracto gastrointestinal en la fisiopatología de la sepsis, al ser un promotor del fallo multiorgánico mediante procesos de permeabilidad intestinal aumentada: esto conlleva a eventos de translocación bacteriana a sitios estériles que exacerban la respuesta inflamatoria y, por ende, el mal pronóstico 3.
En condiciones fisiológicas, existe una simbiosis muy interesante entre el microambiente intestinal, con su diversidad de bacterias, y el huésped, con beneficios claros para ambas partes siempre y cuando se conserve la integridad de la pared intestinal, con lo cual permanecen reguladas las respuestas inflamatorias y antiinflamatorias. Sin embargo, cuando este equilibrio colapsa en la sepsis, predomina la respuesta inflamatoria desordenada, con el posterior fallo orgánico. De esta manera, el intestino desempeña un papel importante en la mediación de la sepsis intraabdominal y en la propagación de la sepsis extraabdominal. Cabe mencionar que las intervenciones terapéuticas habituales durante la sepsis, como el uso de antibióticos, inhibidores de la bomba de protones y la nutrición parenteral, son factores potenciales que alteran la composición microbiana y el entorno gastrointestinal mediante procesos que aún no están bien dilucidados. Esta revisión tiene como objetivo comprender la compleja función del microbioma intestinal en la sepsis y su importancia en el desarrollo, tratamiento y pronóstico de esta entidad.
Estrategia de búsqueda
La información se buscó en las bases de datos MEDLINE, LILACS, SCIELO, PUBMED y WEB of SCIENCES. Los descriptores de ciencias de la salud se utilizaron en inglés (sepsis, gastrointestinal microbiome, probiotics, fecal microbiota transplantation) y en español (sepsis, microbioma intestinal, probióticos, trasplante de microbiota fecal). Los filtros empleados fueron los siguientes: revisiones, revisiones sistemáticas, metaanálisis y ensayos clínicos randomizados de los últimos diez años, y se excluyó a la población menor de 18 años. Como resultado, 122 estudios fueron seleccionados con base en su título y resumen que permitan responder a las preguntas de los objetivos de esta revisión descriptiva.
Microbioma
El término microbioma se refiere a todos los microbios que viven dentro del huésped, incluida la luz intestinal que contiene el microbioma intestinal;es decir, una población de aproximadamente 40 billones de células bacterianas 4. Históricamente, se pensaba que el huésped y las bacterias comensales, pese a que comparten el mismo escenario, tenían comportamientos individuales sin ninguna conexión entre ellos. Sin embargo, a medida que crece la comprensión del microbioma, se ha hecho evidente la simbiosis existente y las perturbaciones que desempeñan un papel muy importante en la fisiopatología de algunas enfermedades agudas y crónicas 5,6.
La microbiota humana contiene más de 1 000 especies diferentes que residen dentro de la luz intestinal 7. La diversidad es muy interesante; el microbioma contiene más de dos millones de genes microbianos 4. El primer contacto entre el huésped humano y el microbioma ocurre a la salida del recién nacido por el canal de parto y, como tal, los microbios vaginales son la fuente original de las bacterias comensales que finalmente compondrán el microbioma 8. Se conoce que las primeras interacciones entre los microbios y el sistema inmunológico del recién nacido inician el desarrollo de una relación simbiótica que permite que ocurra la aceptación de los microorganismos comensales. La inmunoglobulina A (Ig A), presente en la leche materna, limita la activación inmune en respuesta a antígenos extraños y oligosacáridos, y permite la expansión de ciertas poblaciones de bacterias beneficiosas. Se cree que la interrupción de este proceso está asociada con el desarrollo de enfermedades que marcan una disfunción de la barrera epitelial, como el asma. La composición del microbioma en la primera infancia es alterada por distintos factores como la composición de la leche materna, la introducción de alimentos sólidos y la exposición temprana a antibióticos; sin embargo, entre los 2 y 3 años, la composición del microbioma se vuelve estable 9.
Existen cuatro filos dominantes que comprenden todo el microbioma humano, pero la mayoría de las bacterias intestinales se agrupan en dos: firmicutes y bacteroidetes. De acuerdo con la edad, estos dos filos están sujetos a importantes alteraciones: en los ancianos, el filo firmicutes está aumentado en comparación con bacteroidetes; se cree que este incremento es secundario a la dieta y a otros factores ambientales. Un aumento en la proporción de firmicutes a bacteroidetes se asocia con el desarrollo de síndromes metabólicos como la diabetes tipo 2 y la obesidad 9,10.
Capa de moco intestinal
El moco intestinal es de vital importancia para la defensa contra las bacterias, la acción de enzimas digestivas y otras sustancias tóxicas que pueden dañar el epitelio intestinal, el cual se mantiene íntegro debido a las propiedades hidrófobas que derivan de glicoproteínas cargadas negativamente y que son liberadas por células epiteliales de tipo caliciformes que repelen a toxinas cargadas positivamente 11. Originalmente, la capa de moco intestinal fue considerada como una estructura estática, concepto que ha sido abandonado en la actualidad, ya que ahora se sabe que es una estructura dinámica y que puede ser alterada por una variedad de factores.
El desarrollo y las propiedades de la capa de moco epitelial varían de acuerdo con su ubicación en el tracto gastrointestinal. En el intestino delgado, está compuesta solo por un estrato semipermeable, lo que permite el paso de algunos péptidos antibacterianos. Las moléculas de mayor tamaño y las que son potencialmente patógenas se eliminan mediante el desprendimiento de moco, que luego se excreta en la materia fecal. En el colon, el moco consta de dos capas distintas: la externa, que es similar a la del intestino delgado; y la interna, que es completamente impermeable a las bacterias luminales 12. En ratones alterados genéticamente, que no tienen el gen Muc2 (regulador de la producción de glicoproteínas de mucina), se ha evidenciado que carecen de esta capa interna libre de bacterias y que están propensos a desarrollar inflamación intestinal espontánea, lo que demuestra cuán importante es el moco en la regulación de la homeostasis intestinal 13.
Inmunidad intestinal
Microbioma y su relación con el sistema inmunológico intestinal
El sistema inmunológico intestinal es de vital importancia dentro de la última línea de defensa del organismo frente a la invasión de patógenos entéricos. La interacción entre el microbioma y el sistema inmunológico encierra un conjunto de reacciones y mecanismos de naturaleza muy compleja, pero vital para lograr una inmunidad adecuada del huésped. Cuando este fino equilibrio se altera, ocurre una serie de acontecimientos que llevan a posibles eventos patológicos como translocación bacteriana e infección intestinal, que pueden desencadenar en resultados nefastos para el huésped 14,15.
Microbiota intestinal e inmunidad innata
La inmunidad innata es de vital importancia dentro del sistema inmunitario intestinal: su función es mantener un equilibrio entre la tolerancia a microorganismos comensales y la protección ante patógenos oportunistas; además, puede restringir la proliferación excesiva de patobiontes, y regula su crecimiento 16.
El aparato celular inmune innato (conformado por macrófagos, células dendríticas, neutrófilos, entre otros) responde de manera inmediata con el reconocimiento y fagocitosis de los patógenos invasores que han superado la barrera mucosa y epitelial; así, se previene el proceso de migración bacteriana a la luz intestinal y órganos distantes 17.
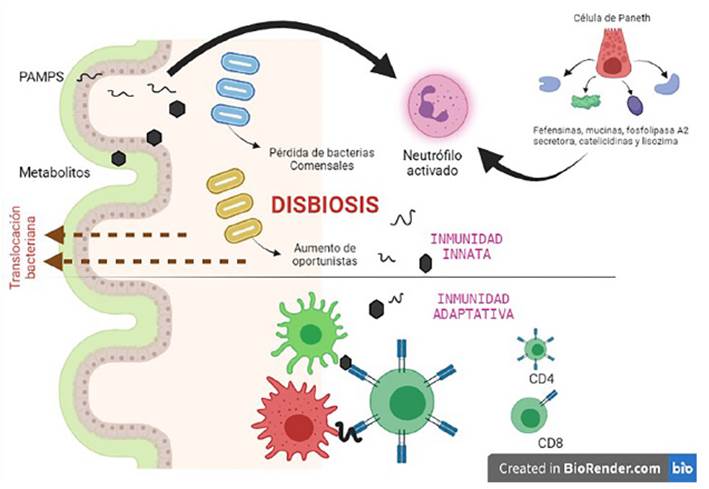
Los productos derivados de la translocación bacteriana activan la respuesta inmune por células innatas mediante vías de reconocimiento de patrones moleculares asociados a patógenos (PAMP). Esto desencadena una respuesta inflamatoria sistémica marcada por el exceso de neutrófilos activados en el intestino, los cuales ocasionan un daño mayor en la mucosa. A este proceso se añade la desregulación del microambiente entérico por el tratamiento médico usual, que conlleva al crecimiento importante de patógenos oportunistas y una pérdida marcada de bacterias comensales, reacciones que se tornan más evidentes y potenciadas en el enfermo crítico 18,19. La disbiosis de la microbiota marca la gravedad de la disfunción inmunitaria de la mucosa, por ende, de la translocación bacteriana expresada en reacciones que culminarán en infección intestinal y sepsis.
No solo las células inmunitarias clásicas conforman la primera línea de defensa innata intestinal, sino también varios componentes antimicrobianos generados a partir de células de Paneth, células caliciformes y enterocitos han sido identificados como responsables de la inmunidad innata 20. Destacamos en este conjunto celular a las defensinas, mucinas, fosfolipasa A2 secretora, catelicidinas y lisozima, caracterizadas por su gran acción microbicida 21. Además, ciertas moléculas algo distintas, como el butirato, promueven también la liberación de mucina, lo que aporta en el mantenimiento de la homeostasis intestinal 22.
La infección por Clostridiun difficile (CDI) y la diarrea asociada a Clostridium difficile (CDAD) son objeto de estudio respecto a la relación entre la microbiota intestinal y la inmunidad innata. En la infección por CDI, la disbiosis y la composición diversa de la microbiota fecal se asocian con cuadros infecciosos graves y refractarios a la terapia antibiótica. Las alteraciones del metabolismo de los ácidos biliares, del metabolismo fermentativo y de la producción de sustancias antimicrobianas explican el papel de la microbiota en la infección dependiente de la toxina de CDI. La inmunidad innata (representada por macrófagos, células dendríticas, monocitos y mastocitos intestinales) se activa por las toxinas de CDI. Esto ocurre a través de las vías de señalización y reconocimiento inmunitario que emplean sensores superficiales e intracelulares, entre los que destacan los receptores tipo toll (TLR) que son TLR 4, TLR5 y el receptor tipo NOD1. El resultado de la activación de estas vías es la producción de citocinas proinflamatorias como interleucinas (IL) en especial la IL-18, IL-12, IL-1β, interferón gama (IFN-γ) y el factor de necrosis tumoral alfa (TNF-α) y quimiocinas (MIP-1a, MIP-2, IL-8, leptina), que son responsables de los daños inflamatorios asociados con el CDI. Otras reacciones como el aumento de la permeabilidad de la mucosa, el edema, la desgranulación de los mastocitos, la infiltración neutrofílica local intensa y la muerte de las células epiteliales contribuyen a un daño intestinal más severo 23.
Microbiota intestinal y la inmunidad adaptativa de las mucosas
Líneas arriba se ha expuesto la importante función de la inmunidad innata sobre la microbiota intestinal.
La inmunidad adaptativa también ha desarrollado un sistema de defensa más especializado, que mantiene la protección cuando los patógenos han superado la primera barrera de la inmunidad innata. Una vez que los patógenos cruzan el epitelio, las células especializadas en la inmunidad adaptativa (linfocitos T intraepitelilales y los linfocitos de la lámina propia 24) son activadas por las células presentadoras de antígeno (macrófagos y células dendríticas) y, de esta forma, ocurren ciertos encaminados a erradicar el microorganismo, lo que permite establecer una inmunidad más duradera y de memoria. Por esta razón, la pérdida de estas valiosas células de linaje T en la mucosa intestinal derivaría en un importante déficit de protección contra la enfermedad entérica por alteración de la integridad de la barrera intestinal, lo que lleva a complicaciones infecciosas muy graves como la sepsis 23,25.
Un tipo de células T algo distintas, pero muy importantes en su función, son los linfocitos T γδ; estos son reconocidos por un receptor de células T (TCR) algo distinto, y cuya función se basa en controlar la respuesta inmune adaptativa de una amplia gama de microorganismos patógenos mediante la secreción de citocinas después de una agresión a la mucosa intestinal 26. De igual forma, la ausencia de estas células T γδ intraepiteliales puede inducir el cambio de comportamiento de tipos bacterianos intestinales no invasivos hacia tipos mucho más invasivos, que logren establecer una translocación bacteriana con paso a la circulación sistémica. En pacientes críticos con sepsis, las células T γδ en sangre periférica se reducen significativamente, lo que se traduce en un aumento significativo de la mortalidad 27.
Otra función importante de la microbiota intestinal está relacionada con la modulación de la producción de Ig A secretora, sobre todo, contra los comensales entéricos y sus antígenos. En ausencia de Ig A, las bacterias comensales intestinales pueden ingresar con mayor facilidad en la lámina propia y en el tejido submucoso, lo que conduce a la translocación bacteriana entérica 28.
En pacientes con trasplante de intestino delgado, las complicaciones infecciosas están mediadas por el deterioro severo de la barrera intestinal y por el agotamiento de linfocitos en el epitelio intestinal, que es inducido por el uso de anticuerpos monoclonales como el alemtuzumab, dato que debe considerarse durante el tratamiento de este tipo de pacientes 29.
Por lo anterior, observamos la complejidad existente en la relación microbiota intestinal y sistema inmunológico. Hemos destacado sus funciones principales en la defensa contra los microorganismos patógenos; sin embargo, todavía es necesario establecer un estudio más profundo que aclare el panorama de su tarea en el organismo.
Alteración del microbioma intestinal en la sepsis
Alteración intestinal en la sepsis
La insuficiencia intestinal es un trastorno común en la unidad de cuidados intensivos. Por lo general, el paciente crítico desarrolla algunos síntomas intestinales relacionados al manejo global de su enfermedad; entre ellos, la diarrea, distensión abdominal, vómito, motilidad intestinal disminuida, ulceración por estrés con hemorragia gastrointestinal resultante e hipertensión intraabdominal. Con tres o más de ellos, se establece un aumento de la mortalidad en estos pacientes; igualmente, la gravedad de la enfermedad se puede estimar mediante biomarcadores de insuficiencia intestinal como las proteínas de unión a ácidos grasos intestinales elevadas, que expresan el daño de los enterocitos, y la citrulina disminuida, un marcador de la masa de los enterocitos. Durante la sepsis, se produce una pérdida del medio intestinal homeostático adaptativo, lo que conduce a una serie de perturbaciones locales, que pueden conducir rápidamente a la propagación sistémica de la enfermedad 30,31.
Permeabilidad intestinal en la sepsis
Un trastorno muy importante dentro de la fisiopatología de la sepsis es la disfunción significativa de la barrera intestinal con hiperpermeabilidad resultante para elementos luminales, como microbios y sus productos microbianos, que pueden causar lesiones locales y distantes. En estudios preclínicos se ha observado que las uniones estrechas se alteran al inicio y la hiperpermeabilidad intestinal persiste durante al menos 48 horas desde que comienza la sepsis 32. El moco ejerce también un papel crucial en la defensa del huésped: evita que las bacterias y las enzimas digestivas entren en contacto directo con el epitelio intestinal; en la enfermedad crítica, esta capa de moco se afecta, lo que induce una disfunción de las células epiteliales. En el paciente crítico es muy común encontrar una reperfusión intestinal reducida que puede disminuir la hidrofobicidad de la capa mucosa y alterar la permeabilidad intestinal 33.
En el paciente séptico, los defectos epiteliales, como el deterioro de la producción de ácidos grasos de cadena corta (AGCC), por ejemplo, el butirato, afectan en gran medida a la barrera epitelial debido a la apoptosis epitelial, lo que resulta en una mala absorción de nutrientes y, sobre todo, en una translocación de patógenos. Sin embargo, está descrito en ratones con enfermedad de injerto contra huésped que, cuando se ingieren cepas bacterianas que producen grandes cantidades de AGCC, disminuye la gravedad de la enfermedad, lo que se explica por la elevada concentración intestinal de butirato que mejora las uniones intercelulares, reduciendo así la apoptosis celular 34,35.
Disbiosis
La composición del microbioma se altera drásticamente en la sepsis como resultado del aumento de la permeabilidad y la apoptosis. Tres factores determinan el contenido microbiano en el intestino: la introducción de especies bacterianas a través de la orofaringe, la eliminación de microbios a través de la materia fecal y la regulación y proliferación de especies bacterianas dentro del tracto gastrointestinal 10. Además, el estrés y el uso de antibióticos e inhibidores de la bomba de protones cambian inevitablemente la composición del microbioma, con posterior destrucción o alteración de las bacterias comensales.
La transición en la que el microbioma se convierte en patobioma se denomina disbiosis 36, en la cual ocurre una pérdida de diversidad microbiana (con predominio
de microorganismos patógenos como Escherichia coli, Pseudomonas aeruginosa, Enterococcus, Staphylococcus aureus y Klebsiella) y alteraciones en bacterias presentes para volverse más patógenas 34 (Figura 1).
En el entorno del huésped se conoce los factores que indujeron a los microbios a volverse más nocivos. Una posible explicación la encontramos en el papel central del fosfato, que es un importante nutriente implicado en la proliferación y el crecimiento bacteriano. La depleción intestinal de fosfato ocurre en situaciones como malabsorción, nutrición parenteral o insuficiencia hepática, y se ha asociado con la presencia de cepas de Pseudomona aeruginosa más infectantes 37. La restauración de fosfato mediante polímeros de polietilenglicol, administrados como un enema rectal, se asocia con la preservación del microbioma 38.
Los opioides, producidos de manera endógena o administrados de forma exógena, pueden alterar el microbioma en pacientes críticos con sepsis. Está demostrado que la dinorfina, un opioide endógeno liberado en el microambiente intestinal en el estrés, puede interactuar, sobre todo, con Pseudomona aeruginosa, y promueve un fenotipo más agresivo 39. De igual forma, se conoce una mayor patogenicidad de Klebsiella pneumoniae y Staphylococcus coagulasa negativo con exposición a opioides 40.
Apoptosis del epitelio intestinal en la sepsis
En el intestino, la apoptosis de manera basal ocurre tanto en la cripta intestinal como en la punta de las vellosidades. Este proceso de muerte celular programada está regulado al alza en la sepsis, tanto en pacientes como en modelos preclínicos de sepsis, en los cuales es evidente que este proceso reduce en gran medida la eficacia de la barrera intestinal, creando así un medio inflamatorio local. Algunos modelos murinos de sepsis han demostrado una regulación positiva de la muerte de las células epiteliales que es activada por las vías mitocondriales y reguladoras de la muerte que tiene el receptor. La sepsis inducida por neumonía ha aumentado la apoptosis del epitelio intestinal, lo que origina el incremento de la expresión de proteínas proapoptóticas Bid y Bax, y la proteína antiapoptótica Bcl-xL en la vía mitocondrial, así como un aumento del ligando Fas y disminución de Fas, FADD, pFADD, TNF-R1 y TRADD en la vía mediada por receptores. Por otro lado, la neumonía por Pseudomonas aeruginosa induce un aumento similar en la apoptosis del epitelio intestinal, esto se asocia con un aumento de Bcl-2 y TNF-R1 y una disminución de Fas. En particular, la prevención de la apoptosis epitelial intestinal inducida por sepsis en ratones transgénicos, mediante la sobreexpresión de la proteína antiapoptótica Bcl-2, conduce a una supervivencia marcada después de una neumonía por CLP y Pseudomonas aeruginosa. La edad parece tener un papel significativo en la apoptosis intestinal en la sepsis. Los modelos murinos han mostrado una mortalidad significativamente mayor en ratones de edad avanzada en comparación con animales más jóvenes. La administración del factor de crecimiento epidérmico (EGF) es otra estrategia que ha mejorado los resultados beneficiosos en estudios preclínicos, su administración sistémica mejora la supervivencia tanto en CLP como en neumonía, incluso si se inició 24 horas después del inicio de la sepsis. A diferencia de Bcl-2, que es puramente una proteína antiapoptótica, el EGF tiene múltiples efectos sobre la integridad intestinal, ya que normaliza la apoptosis epitelial intestinal y la proliferación de criptas comúnmente disminuidas en la sepsis y mantiene la longitud adecuada de las vellosidades. El EGF también mejora la permeabilidad intestinal a través de una disminución en la claudina 2, mediador de la unión estrecha que forma los poros 9.
Opciones terapéuticas dirigidas a restaurar el microbioma
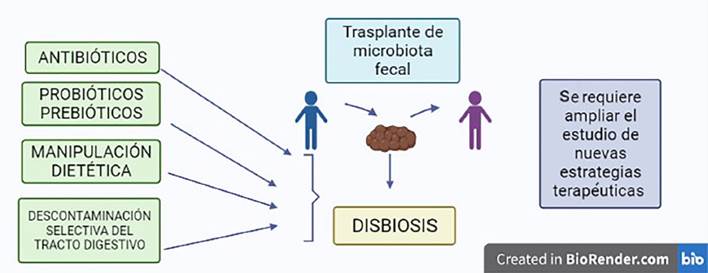
De acuerdo con los conocimientos acerca de los trastornos del microbioma, se despliegan algunas opciones terapéuticas para tratar de reconstituir el ambiente comensal intestinal. El espectro terapéutico abarca desde el trasplante de un microbioma exógeno completo de donantes sanos, la administración de bacterias sanas y/o estimulación de la producción de bacterias buenas por el huésped hasta la descontaminación selectiva del aparato digestivo. Cada uno de estos enfoques se ha mostrado prometedor en el manejo de la sepsis; sin embargo, tienen limitaciones que les impiden ser el tratamiento estándar de manejo.
Trasplante de microbioma fecal
El uso, a menudo inadecuado, de antibióticos en el paciente crítico es la causa más común de aparición de patógenos resistentes y, por ende, de la alteración del microbioma. Con esto, la incidencia de Clostridium difficile se ha incrementado en la UCI y se ha convertido en una infección cada vez más grave y potencialmente mortal 41. Las guías más recientes sobre la infección por Clostridium difficile y el trasplante de microbiota fecal (TMF) recomiendan a este como el tratamiento de primera elección en adultos o niños con recurrencias múltiples, independientemente de la gravedad 42-45. Si bien el C. difficile se trata con vancomicina o metronidazol por vía oral, han aumentado los casos recurrentes y los fracasos del tratamiento. Para que un TMF tenga éxito, los pacientes no deberían recibir antibióticos, ya que la terapia antimicrobiana continua altera el microbioma trasplantado. Esto ha limitado el uso del trasplante de microbiota fecal en la unidad de cuidados intensivos a unos pocos informes de casos en pacientes con diarrea intratable 46,47. Por lo tanto, el trasplante de microbiota fecal en pacientes críticamente enfermos es una estrategia experimental en la sepsis que requiere más estudios rigurosos para conocer su papel en el tratamiento futuro de este cuadro.
Uso de probióticos
El uso de probióticos y, en menor grado, prebióticos y simbióticos en la unidad de cuidados intensivos ha demostrado ser útil de manera significativa. Ciertos metaanálisis recientes de más de 2000 pacientes muestran una reducción en la tasa de neumonía e infecciones asociadas al ventilador en pacientes críticamente enfermos con el empleo de probióticos sin diferencias en la mortalidad. De igual forma, la duración de la estancia hospitalaria o la duración de la ventilación mecánica se redujeron 48. Cabe destacar que estas conclusiones están limitadas por una evidencia de baja calidad caracterizada por una heterogeneidad importante en el diseño de cada investigación. En el 2016, un estudio multicéntrico aleatorizado analizó el uso de probióticos en pacientes ventilados por sonda nasogástrica (en especial, aquellos que contienen Bacillus subtilis y Enterococcus faecalis vivos). Los enfermos que recibieron terapia con probióticos tuvieron una reducción estadísticamente significativa en la tasa de neumonía asociada al ventilador en comparación con los que no la recibieron 49. Pese a estos hallazgos, todavía se requieren ensayos bien diseñados, con evidencia firme que avale antes un empleo más amplio de probióticos en la unidad de cuidados intensivos.
Descontaminación selectiva del tracto digestivo
Por último, un método controvertido para atacar el patobioma es la descontaminación selectiva del tracto digestivo. Esta estrategia consiste en la aplicación tópica de antimicrobianos no absorbibles en la orofaringe o el intestino para prevenir o erradicar el transporte orofaríngeo e intestinal de microorganismos patógenos, sin afectar de manera negativa el microbioma restante del paciente. Los datos que justifican la descontaminación selectiva del tracto digestivo son convincentes: un metaanálisis de 29 ensayos demuestra una disminución en la mortalidad, con una razón de probabilidades de 0,73 (IC del 95 %: 0,64 a 0,84) 50. Sin embargo, existen muchas preocupaciones de carácter teórico sobre el desarrollo de resistencia a los antimicrobianos con el empleo de esta estrategia, lo que ha limitado su uso casi exclusivamente a un pequeño número de países con bajas tasas de resistencia basal.
Conclusiones
La interconexión entre el epitelio, el microbioma intestinal y el sistema inmunológico local es esencial para mantener una simbiosis adecuada. La sepsis es una entidad que puede alterar el microambiente intestinal, ya que genera un estado disbiótico caracterizado por hiperpermeabilidad, apoptosis de células epiteliales e hiperinflamación. Este estado puede mostrar un claro dominio de bacterias patógenas y progresar a una infección y la muerte. El enfoque para un tratamiento útil se basa en el restablecimiento de un microambiente intestinal homeostático mediante alternativas que son de cierta utilidad, pero que aún tienen limitaciones que requieren ser superadas.