INTRODUCCIÓN
El cáncer colorrectal (CCR) es la segunda causa de muerte por cáncer en los Estados Unidos y Europa. Varias guías médicas respaldan el screening poblacional en adultos a través de varias modalidades; sin embargo, en EE. UU. las pruebas son realizadas solo en el 63 % de la población adulta elegible 1,2.
En el Perú, el CCR ocupa el cuarto lugar tanto en incidencia como en mortalidad por cáncer, con un estimado de 4610 casos nuevos y 2367 muertes en el año 2018; por ello, está en el tercer y cuarto lugar, dentro de los cánceres más frecuentes en varones y mujeres, respectivamente 3-5.
Diferentes estudios han demostrado una disminución de la mortalidad por CCR con una detección precoz y un tratamiento eficaz 6-8, por lo que el screening en pacientes asintomáticos sigue siendo un objetivo clave para lograr resultados favorables de supervivencia, mediante la identificación precoz de esta neoplasia maligna y sus lesiones previas, incluidos los pólipos de alto riesgo 9,10. Es recomendable realizar el tamizaje correspondiente a todos los hombres y mujeres de 50 años o más, con el empleo de varias pruebas disponibles que incluyen el test de sangre oculta en heces (FOBT) en sus dos modalidades (test de guayacol o gFOBT y el test fecal inmunoquímico o FIT), la sigmoidoscopia flexible, la colonografía por tomografía computarizada y la colonoscopia. Las evidencias directa e indirecta indican que todas las pruebas son efectivas, pero difieren en su sensibilidad, especificidad, costo y seguridad 11.
Es importante destacar los límites del cribado diagnóstico actual y la dificultad para establecer marcadores sustitutos apropiados para la detección precoz de esta enfermedad. Las actuales pruebas de detección en heces no son sensibles para detectar lesiones precancerosas y pueden pasar por alto un CCR temprano. Por lo tanto, un punto de corte bajo debe ser considerado para realizar una colonoscopia más detallada en estos pacientes, asimismo, se requieren más herramientas para ayudar a identificar este cáncer de forma temprana 10.
En este contexto podrían resultar útiles como pruebas no invasivas los biomarcadores plasmáticos de tumor, que son productos moleculares metabolizados y secretados por el tejido neoplásico y caracterizados bioquímicamente en el plasma sanguíneo. Muchos grupos químicos están representados, incluidos hormonas, antígenos, aminoácidos, ácidos nucleicos, enzimas, proteínas y lípidos específicos de membrana celular, que pueden utilizarse como herramientas para la detección precoz, el pronóstico y/o la predicción de la respuesta al tratamiento del CCR 10,12.
En el presente ensayo se analizan cuatro de los biomarcadores plasmáticos existentes basados en proteínas. Se caracterizan de acuerdo a su accesibilidad, factibilidad, eficacia diagnóstica y a su empleo en un panel combinado para la detección precoz de cáncer colorrectal. Estos productos son el antígeno carcinoembrionario (CEA), que es un tipo de glicoproteína citoplasmática que se expresa en gran medida en la mayoría de tejidos cancerosos 13-15; la ciclooxigenasa 2 (COX-2), cuya expresión es inducida por promotores tumorales 16,17; el inhibidor tisular de metaloproteinasa 1 (TIMP-1), que podría tener una función promotora de tumores 18, y los autoanticuerpos asociados a tumor (TAAbs) anti-p53, que aprovechan la inmunidad antitumoral para magnificar la respuesta inmune. Informes recientes han demostrado que los autoanticuerpos son detectables antes de la aparición radiográfica tumoral en el 26,5 % de los pacientes con cáncer de pulmón 19.
Resulta de especial preocupación buscar alternativas que garanticen la aceptación y la adherencia de la población adulta elegible a los programas de screening de CCR, como puede serlo el desarrollo de pruebas menos invasivas, precisas, factibles, a un coste accesible en países que tienen ingresos medianos y bajos, que permitan clasificar adecuadamente grupos de alto riesgo que requieran colonoscopía y disminuir la mortalidad por esta enfermedad. El objetivo de esta revisión es determinar la utilidad de los biomarcadores plasmáticos propuestos en la detección precoz del CCR, analizando la evidencia actualizada para el diseño de un nuevo panel combinado. Para facilitar su comprensión y comparación, se revisarán inicialmente las pruebas de screening basadas en heces para CCR, el test de ADN fecal multitarget incorporado en las Guías de la Sociedad Americana de Cáncer (ACS) del 2018, el test de metilación SEPT9 (Epi proColon) aprobado por la FDA (2016) y los ensayos de múltiples microRNAs.
ESTRATEGIA DE BÚSQUEDA
Se realizó una búsqueda en bases de datos bibliográficas, como PubMed, Google Scholar y Cochrane Library, entre artículos de tipo estudios primarios, revisiones, consensos y guías clínicas publicados desde 2002 hasta julio de 2020, en idiomas español e inglés. Los términos de búsqueda fueron Carcinoembryonic Antigen, Cyclooxygenase 2, Tissue Inhibitor of Metalloproteinase 1, Autoantibodies, Colorectal Neoplasms, Biomarkers y Early Diagnosis.
DESARROLLO
El biomarcador ideal de CCR debería poder medirse de forma sencilla y cuantitativa, ser muy específico y sensible, así como fiable y reproducible 20. Debería poder estratificarse el riesgo entre diferentes poblaciones y seleccionar pacientes que realmente necesiten una prueba de segunda línea (investigaciones colonoscópicas y radiológicas). Idealmente, este objetivo se puede lograr con un método no invasivo y económico, que utilice muestras biológicas fácilmente disponibles como suero, orina, aliento y heces 21. Adler et al. refieren que el cumplimiento del cribado puede mejorarse con la opción de las pruebas basadas en muestras sanguíneas (en aquellos que rechazan la colonoscopía) 22 o, en su lugar, un screening basado en muestras de heces, debido a que las pruebas sanguíneas de detección han mostrado un mayor nivel de aceptación y cumplimiento en la población objetivo.
La colonoscopía es el patrón de referencia de las pruebas de screening, con una sensibilidad y especificidad para identificar pólipos y cáncer por encima del 98 %. Sin embargo, es una prueba invasiva que debe repetirse con frecuencia (cada 3 a 5 años) y su implementación es costosa; las tasas de cumplimiento son bajas y existe un riesgo de perforación de 1 por cada 1000 a 10 000 colonoscopias. Por lo tanto, estas limitaciones hacen que la prueba no tenga éxito como herramienta de detección en términos de costos de implementación en muchos países 9.
Estudios de ensayos aleatorios han encontrado que el empleo de la sigmoidoscopia flexible como herramienta de detección primaria está asociada a una disminución de 23 % en la incidencia de CCR y de 31 % en la mortalidad de esta enfermedad 1,21. Sin embargo, todavía es una técnica invasiva que requiere de muchos recursos.
Actualmente, se encuentran disponibles dos tipos de análisis de sangre oculta en heces (FOBT) que se basan en guayacol e inmunoquímicos, respectivamente. También está disponible una prueba fecal para evaluar las alteraciones del ADN de células exfoliadas, en combinación con la detección de sangre oculta. Los resultados anormales de cualquier prueba de detección de heces son una indicación para la realización de la colonoscopia. La FOBT con guayacol se basa en la detección de la actividad pseudoperoxidasa del grupo hemo de la sangre humana, mientras que la prueba inmunoquímica fecal (FIT) detecta de manera directa la proteína globina de la hemoglobina humana en las heces. Se ha demostrado que FIT es superior a FOBT con guayacol en las tasas de participación en el cribado y en la detección de adenoma avanzado y CCR 23.
La sensibilidad para detectar el CCR con la prueba FIT (punto de corte de 100 ng/ml) es del 73,8 % frente al 92,3 % para un ensayo de ADN en heces multitarget, que incluye ensayos moleculares cuantitativos para las mutaciones de KRAS, metilación aberrante de NDRG4, BMP3 y β-actina, además de un inmunoensayo de hemoglobina. En las lesiones precancerosas avanzadas la prueba FIT tiene una sensibilidad de 23,8 %, mientras que para la prueba de ADN en heces la sensibilidad es de 42,4 %. La tasa de detección de pólipos con displasia de alto grado es del 46,2 % con la prueba FIT, frente al 69,2 % con la prueba de ADN en heces 24. Para los pólipos sésiles serrados (que miden más de 1 cm), la tasa de detección es solo del 5,1 % con FIT y 42,4 % con el muestreo de ADN en heces 12) (Tabla 1).
Tabla 1 Rendimiento diagnóstico de test para screening de cáncer colorrectal en poblaciones de riesgo promedio
| Pruebas en heces | Pruebas estructurales | Sangre | ||||
|---|---|---|---|---|---|---|
| gFOBT hs | FIT | ADN -FIT | Colonografía por TC | Colonoscopia | Metilación SEP9 | |
| Sensibilidad | 62-79% | 73-88% | 84-97% | 67-94% | 89-98% | 68-73% |
| (ad >10mm) | (ad >10mm ) | |||||
| Especificidad | 87-96% | 91-96% | 84-85% | 86-98% | ||
| (ad >10mm ) |
Basado en datos de Qaseem et al. (25)
gFOBT hs: test de sangre oculta en heces con guayaco de alta sensibilidad
FIT: test inmunoquímico en heces
ADN-FIT: test de ADN fecal multitarget combinado con FIT
Ad: adenoma
A pesar de sus limitaciones inherentes conocidas 26, la prueba inmunoquímica fecal (FIT) todavía se considera el análisis más rentable para la detección del CCR en todo el mundo. El uso generalizado de esta prueba está respaldado, en personas de 45 años a más, por la American Cancer Society (ACS) 27 que, en su Guía actualizada 2018 para el Screening en CCR en adultos de riesgo promedio, recomienda como opciones para su detección precoz a las siguientes pruebas: FIT anual, FOBT con guayacol de alta sensibilidad anual, prueba de ADN en heces multitarget cada 3 años, colonografía por tomografía computarizada cada 5 años, sigmoidoscopia flexible cada 5 años y colonoscopia cada 10 años.
Aunque el reforzamiento del cribado de CCR mediante FIT ha contribuido a disminuir las muertes relacionadas, la mortalidad aún es elevada y también existe el riesgo significativo de resultados falsos negativos, los cuales abren el camino hacia el desarrollo de pruebas diagnósticas alternativas 28,29. Recientemente, se han propuesto varias técnicas de diagnóstico innovadoras, como la endoscopia con video-cápsula, la biopsia líquida para detección de células tumorales circulantes (CTC) en sangre periférica o el análisis de compuestos orgánicos volátiles en el aire exhalado 30,31, aunque por el momento ninguno de estos enfoques parece estar listo para su uso clínico. No obstante, están surgiendo datos alentadores para algunos biomarcadores sanguíneos que se muestran a continuación.
Metilación SEPT9
El gen SEPT9 codifica una proteína llamada septin-9, que participa en una amplia gama de vías biológicas como la división del citoplasma, la polarización celular, el transporte de vesículas y la reconstrucción de membranas. Esta proteína actúa como supresora de tumores, ya que regula activamente el crecimiento de las células y previene que se dividan de manera descontrolada. La metilación de la región promotora del gen SEPT9 en las islas CpG va acompañada de un silenciamiento génico, con la consiguiente pérdida de actividad supresora del CCR. Debido al papel comprobado de la inhibición de SEPT9 en la progresión patológica de lesiones benignas a malignas en el tejido colorrectal, la empresa Epigenomics AG (Frankfurt Prime Standard: ECX; Frankfurt, Alemania) está comercializando, hace más de 10 años, el primer ensayo de metilación SEPT9 en sangre por PCR en tiempo real, que está disponible como prueba comercial en Europa con el nombre de Epi proColon 1,0 32.
En un estudio de tamizaje realizado en tres hospitales chinos y basado en el kit Epi proColon 2.0, el ensayo SEPT9 mostró una sensibilidad del 75,1 % y una especificidad del 95,1 % para la detección del CCR 33. La tasa de detección para CCR en el estadio 0 fue de 57 %, para el estadio I fue de 64 % y en el estadio II, de 88 %. Este resultado lo convierte, potencialmente, en una herramienta valiosa para el cribado poblacional, solo o en combinación con otros métodos de diagnóstico más convencionales.
El estudio prospectivo y multicéntrico PRESEPT evaluó la precisión del ADN metilado del SEPT9 circulante en la detección precoz del CCR en 7941 individuos asintomáticos de 50 años a más, que cumplieron criterios de detección de riesgo promedio, y determinó que la prueba alcanzó 48,2 % de sensibilidad y 91,5 % de especificidad 34. Se realizó un análisis de rendimiento clínico independiente en muestras de plasma del estudio PRESEPT, para lo cual se utilizó un ensayo de ADN SEPT9 actualizado, y se determinó que la sensibilidad para detectar el CCR fue del 68 % 35, una mejora con respecto al informe anterior 34, y la especificidad fue del 80 % 35.
El test en sangre que detecta ADN SEPT9 metilado circulante fue aprobado por la FDA el 2016 y puede representar una opción para personas de 50 años a más, con un riesgo promedio de CCR, que rechazan otras modalidades de detección. Sin embargo, una limitante a esta prueba es su falta de sensibilidad para los adenomas avanzados. Además, el intervalo para repetir la prueba es incierto. El panel de la National Comprehensive Cancer Network (NCCN, por sus siglas en inglés) consideró que aún no había evidencias suficientes para recomendar el uso rutinario de este ensayo en sus guías clínicas del 2018 23.
Micro RNA (miARN) circulantes
Los miARN, pequeños, estables, de cadena única, no codificantes y que contienen aproximadamente 20-24 nucleótidos, juegan un papel esencial en la regulación postranscripcional de genes eucariotas, por lo que se han convertido en los RNA no codificantes más estudiados 36. Estas pequeñas moléculas participan activamente en un conjunto de procesos celulares tanto fisiológicos como patológicos, que incluyen la transformación maligna. Tanto el plasma como el suero son las matrices adecuadas para investigar la expresión de miARN 37,38. En teoría, pueden detectarse en todos los fluidos corporales, ya que se consideran, por lo general, moléculas relativamente estables 39. Las principales técnicas para estudiar los miARN incluyen la PCR de transcripción inversa cuantitativa (qRT-PCR), los microarrays y la secuenciación de próxima generación (NGS) 40.
Varios metaanálisis han intentado resumir la utilidad clínica potencial de los miARN circulantes en la detección temprana del CCR 41-45. Todos concluyen que el rendimiento diagnóstico podría magnificarse de manera sustancial si pudiera detectarse, simultáneamente, más de un tipo de miARN.
En 2014, un metaanálisis de Wang et al., que incluyó 47 estudios de CCR, concluyó que los ensayos con un solo miARN (29 estudios) tenían un rendimiento menor para el diagnóstico de CCR en comparación con los ensayos de múltiples miARN (18 estudios), porque el área bajo la curva AUC fue 0,79 versus 0,89 41. La sensibilidad y la especificidad también fueron más altas, con 81 % y 84 %, respectivamente. Similares resultados se observaron en el metaanálisis de Zeng et al. (24 ensayos de 19 artículos diferentes), con un total de 1558 pacientes CCR y 1085 controles 42, en el cual las pruebas con múltiples miARN mostraron mayor precisión diagnóstica (AUC, 0,92; 84 % de sensibilidad y 87 % de especificidad) que la evaluación de un solo miARN (AUC, 0,84; 78 % de sensibilidad y 78 % de especificidad), aunque su aplicación clínica generalizada todavía se ve complicada por una serie de problemas preanalíticos, analíticos y clínicos. Entre los miARN que se han evaluado individualmente, el miR-21 es quizás el más estudiado, ya que está fuertemente expresado en pacientes con CCR y, por lo tanto, se ha propuesto como biomarcador de diagnóstico y pronóstico 43-46.
Biomarcadores proteicos circulantes
El rico contenido de proteínas en la sangre, consecuencia del desarrollo tumoral y los factores del huésped, proporciona una oportunidad ideal para desarrollar diagnósticos no invasivos para el cáncer colorrectal.
La instrumentación en espectrometría de masas ha avanzado lo suficiente como para permitir el descubrimiento de diversas alteraciones proteicas directamente en el plasma con una alta sensibilidad. Además, el uso de la proteómica para aprovechar la respuesta inmune en forma de seropositividad a los antígenos tumorales puede complementar los paneles de biomarcadores de proteínas circulantes para la detección del cáncer. La profundidad de análisis, posible actualmente en un entorno de descubrimiento de nuevas proteínas, permite la detección de marcadores potenciales a concentraciones inferiores a 1 µg/L. Estas bajas concentraciones pueden estar por debajo de los límites de detección del ELISA y, por lo tanto, requieren el desarrollo de ensayos con una alta sensibilidad analítica 47,48.
Algunos biomarcadores proteicos propuestos para un uso combinado en la detección precoz del CCR son los siguientes:
CEA
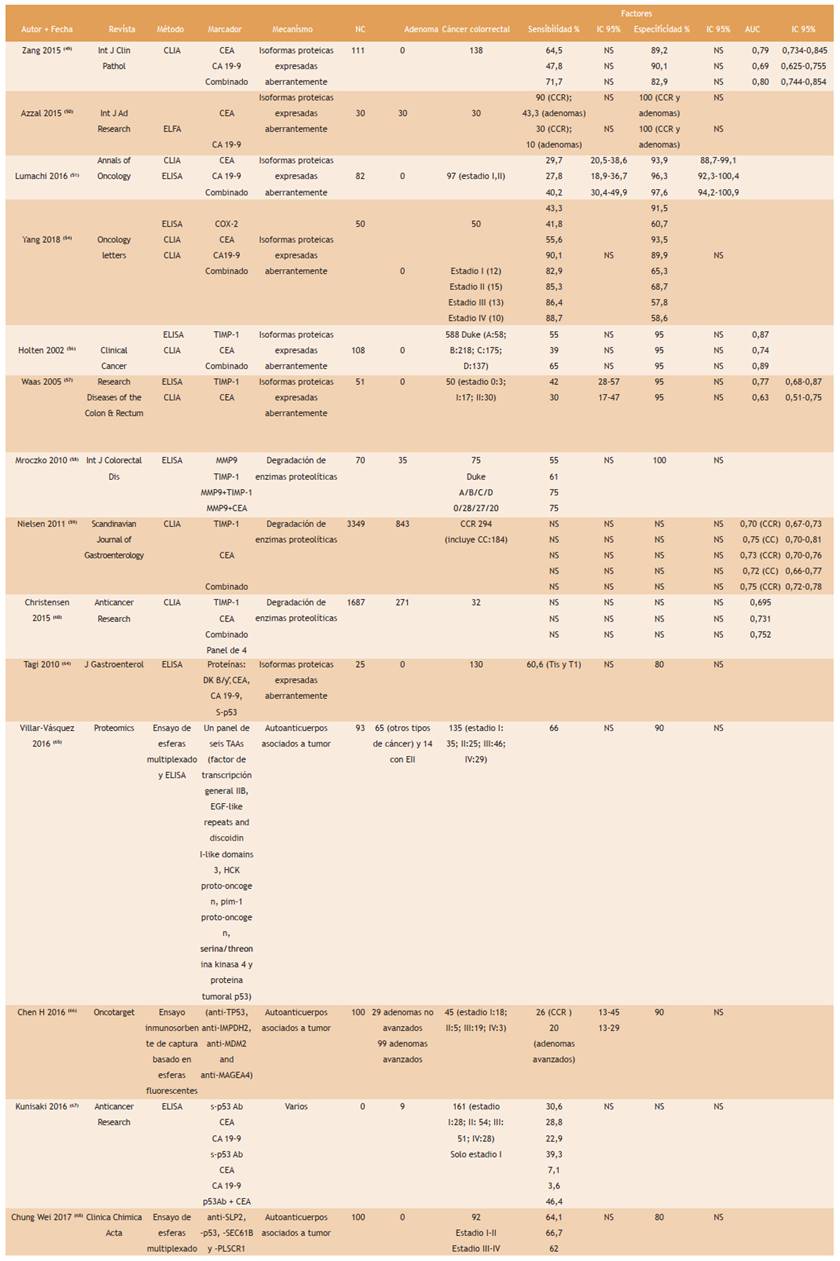
El CEA en suero fue el primer biomarcador soluble para uso en el CCR y sigue siendo el único recomendado para su uso con fines de seguimiento (49). En diversos estudios ha mostrado que la sensibilidad del CEA varió ampliamente desde 7,1 % hasta 64,5 %; la especificidad, desde 60,7 % hasta 93,9 %; y el AUC, desde 0,63 hasta 0,79, para el diagnóstico precoz de cáncer colorrectal 49-51,55-60,67. Si bien su sensibilidad como marcador único es relativamente baja, en combinación con otros biomarcadores adecuados, podría mejorar sustancialmente.
Ciclooxigenasa-2 (COX-2)
Wasilewicz et al. encontraron, en muestras de tejido, diferencias significativas asociadas con una alta expresión de COX-2 en adenomas colorrectales versus otros pólipos. Demostraron que una alta expresión de COX-2 se asocia con factores de riesgo típicos de la transformación maligna de pólipos colónicos 52. Xiao et al. demostraron que COX-2 participa en la formación y el desarrollo de tumores mediante la inhibición de la muerte celular y la promoción del crecimiento celular. La COX-2 se expresó fuertemente en el 62,0 % de los pacientes con CCR y en el 6,0 % de los pacientes con lesiones benignas, pero no en sujetos sanos y por ello se concluye que la alta expresión de COX-2 ocurre en la etapa temprana del CCR y participa en el desarrollo del cáncer 53.
Un estudio determinó que la sensibilidad de COX-2 plasmática fue de 43,3 % y la especificidad de 91,5 % 54, por lo que podría ser útil como marcador para el diagnóstico temprano de CCR. Se sospecha que la actividad de COX-2 promueve la angiogénesis, la invasión tisular tumoral y la resistencia a la apoptosis y a la quimioterapia. La actividad de la ruta de señalización COX-2-PGE2-receptores de prostaglandina E puede suprimir las células dendríticas (DCs), las natural killer (NK), los linfocitos T y la inmunidad tipo 1 y, a la vez, estimular la inmunidad tipo 2 que promueve la evasión inmune tumoral. La COX-2 y la cascada de prostaglandinas juegan un papel importante en la "inflamogénesis del cáncer". Además, los inhibidores de la ciclooxigenasa pueden bloquear esta evasión inmune tumoral; por lo tanto, se podrían aprovechar los beneficios de incorporarlos a la terapia citotóxica estándar 55.
TIMP-1
En diversos estudios publicados sobre el diagnóstico precoz de cáncer colorrectal, se encontró que TIMP-1 presenta una sensibilidad que va desde 42 % hasta 61 %; una especificidad desde 95 % hasta 100 %, y un AUC desde 0,695 hasta 0,870 56-60.
Un metaanálisis reciente de Xiang C et al., con 34 estudios seleccionados y 59 proteínas analizadas, resume la eficiencia diagnóstica de nuevos marcadores sanguíneos proteómicos, como TIMP-1, MST1/STK4 y S100A9, que mostraron un excelente rendimiento para la detección de CCR. TIMP-1 obtuvo una sensibilidad del 42 %, una especificidad del 88 % y un AUC de 0,71 61.
Observamos que TIMP-1 tiene una alta especificidad y mejor sensibilidad que CEA, la cual mejora cuando se emplean ambos marcadores de manera combinada 56-60.
AutoAb p53
La presencia de autoanticuerpos precede a los hallazgos clínicos en meses o incluso años 62. El autoanticuerpo anti-p53 se detectó entre 17 y 47 meses antes de la manifestación clínica del tumor en personal que manipulaba uranio y que tenía un alto riesgo de desarrollar cáncer de pulmón. Además, pueden ser biomarcadores valiosos, ya que son proteínas serológicas estables que se expresan en niveles elevados en el suero a pesar de los niveles bajos del antígeno correspondiente. El CCR tiene la segunda tasa más alta de seropositividad de autoanticuerpos anti-p53 debido, en parte, a la alta frecuencia de mutaciones de TP53 63. Se considera que los paneles de autoanticuerpos que incluyen anti-p53 tienen mayor valor de aplicación con alta sensibilidad y especificidad.
Con el anti-p53 como parte de diferentes paneles de autoanticuerpos, se encontró una sensibilidad que va desde 26 % hasta 66,7 % para estadios tempranos de CCR; y una especificidad entre 80 %-90 % (64-66,68). Un estudio mostró una sensibilidad combinada del 20 % para la detección de adenomas avanzados 66. Asimismo, se encontró que anti-p53 presentó un 39,3 % de sensibilidad para estadio I de CCR, como prueba única 67. En resumen, anti-p53 mostró una especificidad mayor de 80 % y una sensibilidad próxima al 40 % en estadios tempranos de CCR, lo que muestra, además, cierta utilidad en la detección de adenomas avanzados.
En una revisión sistemática, Wang et al. (2019) establecen que para el autoanticuerpo anti-p53 el DOR (Diagnostic Odds Ratio) fue de 10,86 y el AUC de 0,82 en todos los estadios del CCR. Dos estudios explicaron la heterogeneidad y, cuando se eliminaron, el DOR subió a 11,01 y el AUC a 0,83; sin embargo, los efectos de umbral diagnóstico no pudieron eliminarse. Los umbrales de diagnóstico variaron entre los diferentes estudios, que incluyeron la absorbancia media o niveles de autoanticuerpos del grupo control más dos o tres desviaciones estándar (SD), curvas ROC (Receiver Operating Curve) y proporción positiva, que son las principales barreras para replicar o comparar los diferentes estudios. Para el estadio temprano de CCR, el autoanticuerpo anti-p53 mostró un DOR de 4,82 y un AUC de 0,72, por lo que puede tener un papel prometedor en el cribado 69) (Tabla 2).