Introducción
La salud materna y perinatal es una de las prioridades actuales de la salud global, determinada dentro del programa de salud internacional de los objetivos de desarrollo sostenible de las Naciones Unidas (ONU) 1, la Organización Mundial de la Salud (OMS) 2) y el Departamento de Servicios Humanos y de Salud de los Estados Unidos de América 3. Aunque se ha registrado una disminución significativa de la morbimortalidad materna desde el año 2000, estas organizaciones estiman que, de igual forma, sigue existiendo una brecha muy amplia de cobertura y cumplimiento de indicadores, ya que este indicador es 14 veces mayor en países en vía de desarrollo, en comparación con los países desarrollados 1-3. Dentro de las guías de estrategias y líneas para la investigación producidas por la OMS, se encuentra la salud materna, tanto inmediata como tardía, como un campo de interés de imperativo desarrollo, sobre todo por el vacío que aún existe sobre los mecanismos fisiopatológicos moleculares de impacto traslacional en el cuidado agudo y crítico que sufre la gestante durante el parto 1.
La enfermedad cardiovascular (CVD), incluidos la enfermedad de las arterias coronarias (CAD) y el accidente cerebrovascular (ACV), es la principal causa de mortalidad materna 4. Los resultados adversos del embarazo, incluidos la preeclampsia, el parto prematuro, la diabetes mellitus gestacional (DMG) y la edad del producto de la concepción (EPC), se han asociado con el riesgo futuro de CVD materno 4-6. El embarazo normal requiere de una adaptación cardio-metabólica materna significativa, con un aumento del gasto cardíaco del 30 % al 50 %, cambios en el perfil de lípidos, que incluyen un aumento aproximado del 50 % en el colesterol total, y un aumento significativo en la resistencia a la insulina durante la segunda mitad de la gestación para facilitar la transferencia de glucosa al feto 5. Dadas estas modificaciones orgánicas drásticas, se ha formulado la hipótesis de que el embarazo puede actuar como una "prueba de esfuerzo" para futuras enfermedades cardiovasculares 5. La abrupción placentaria sigue siendo una preocupación crítica para la morbilidad y
mortalidad materna, fetal y neonatal 6,7. De hecho, es una complicación rara pero grave que afecta de 3 a 10 de cada 1000 embarazos en todo el mundo 8, lo que representa alrededor del 10-20 % de todas las muertes neonatales en los países desarrollados 7,9. Las complicaciones maternas asociadas con el desprendimiento de placenta incluyen shock hemorrágico, coagulación intravascular diseminada (CID), insuficiencia renal, isquemia y necrosis de órganos y muerte, las cuales están relacionadas con la enfermedad coronaria y el ACV 10,11.
Ahora bien, si se dejan a un lado todas las implicaciones que acarrean las complicaciones maternas al momento del parto o posparto en la salud cardiovascular y solamente se estudia la abrupción placentaria como factor de riesgo independiente para la aparición de eventos cerebro y cardiovasculares, se tiene que evidencia emergente y con alta calidad sostiene que esta condición aumenta más del doble el riesgo de morir por causa cardiovascular a mediano y largo plazo, principalmente por CAD 11. Actualmente, la evidencia en español que haya estudiado esta condición es prácticamente inexistente, con resultados inconclusos provenientes de Latinoamérica 12. No obstante, en nuestra región, la morbimortalidad materna sigue siendo elevada. Considerando lo anterior, además de la magnitud, gravedad y trascendencia de las enfermedades maternas y las implicaciones sobre los programas y metas en salud global 13-16, el objetivo de esta revisión es sintetizar evidencia reciente sobre el riesgo de enfermedad cardiovascular y cerebrovascular a largo plazo en mujeres con antecedente personal de abrupción placentaria.
Estrategia de búsqueda
Se realizó una búsqueda bibliográfica utilizando términos como "Cardiovascular Disease", "Cerebrovascular Disease" y "Placental Abruption", así como sinónimos, que se combinaron con los operadores booleanos "AND" y "OR" en los motores de búsqueda y bases de datos PubMed, ScienceDirect, Embase, EBSCO y MEDLINE. Como criterio de inclusión, se definió que cualquier artículo relacionado con la evaluación del riesgo cardiovascular y cerebrovascular en mujeres con antecedente de abrupción placentaria sería incluido, y se daría prioridad a los estudios originales y a las revisiones sistemáticas y metaanálisis; además, debían estar disponibles en texto completo. Como criterios de no inclusión, se estableció que no se considerarían los artículos publicados en un idioma distinto al español y al inglés. Dada la amplitud del tema y la gran variedad de publicaciones, se incluyeron los artículos publicados entre el 2000 y el 2022. Se identificaron un total de 210 artículos potencialmente relevantes, con una revisión del título y el resumen de todos ellos, de los que finalmente se consideraron 65 artículos, tras su discriminación según los criterios de inclusión y no inclusión. Asimismo, se incluyeron otras referencias de utilidad para la discusión de conceptos generales. Las estimaciones y cálculos encontrados se expresaron en sus medidas originales, ya sean frecuencias, porcentajes, intervalos de confianza (IC), diferencia de medias (DM), riesgo relativo (RR), odds ratio (OR) o hazard ratio (HR).
Resultados
Aspectos fisiopatológicos de la abrupción placentaria y su relación con la enfermedad cardiovascular
El desprendimiento de placenta es una de las causas de hemorragia durante la segunda mitad del embarazo, la cual consiste en la separación temprana de la placenta del revestimiento del útero antes de completar la segunda etapa del trabajo de parto 17. El desprendimiento de placenta es una complicación relativamente rara pero grave del embarazo, que pone en riesgo el bienestar de la madre y el feto. El abruptio placentae ocurre cuando hay un compromiso de las estructuras vasculares que soportan la placenta, específicamente por una alteración en la continuidad de las redes vasculares que conectan el revestimiento uterino y el lado materno de la placenta, y tiene como factor importante la hemorragia a nivel de la interface decidua-placenta 18. A medida que el hematoma aumenta de tamaño, se produce una mayor separación y compresión del espacio intervelloso suprayacente, lo que provoca la destrucción local del tejido placentario y un déficit en el aporte de oxígeno y nutrientes al feto.
Un estudio descriptivo retrospectivo, cuyo objetivo fue determinar los resultados de embarazos con desprendimiento de placenta e investigar la relación entre las características clínicas maternas y los desenlaces perinatales negativos, encontró varias complicaciones en pacientes que presentaron desprendimiento de placenta, tales como útero de Couvelaire (16,5 %), CID (5,8 %) y shock hemorrágico (2,9 %) 19. Además, el 19,4 % de las pacientes presentadas requirió transfusión de sangre, pero ninguna terminó con histerectomía o insuficiencia renal o muerte 19. Cuando la pérdida sanguínea sobrepasa el 25 % de la volemia, se presenta un rápido deterioro en la estabilidad hemodinámica, lo cual, en contexto de hipoperfusión tisular junto con metabolismo anaeróbico y acidosis, conlleva a la falla ventricular izquierda y posterior shock18. La cascada de la coagulación se activa con el consumo de factores de coagulación y desencadena una, la cual, en contexto de hemorragia, conduce a un mayor consumo de factores de coagulación, y se forma un círculo vicioso 20,21.
De acuerdo con lo descrito hasta la fecha, los factores de riesgo que influyen sobre la integridad de la red vascular de soporte placentario son el trauma abdominal, el consumo de cocaína, la hipertensión arterial, el polihidramnios, la corioamnionitis, la edad de la gestación, los antecedentes de anomalías vasculares, el tabaquismo y el antecedente de isquemia placentaria 22-28. La afectación vascular con posterior sangrado puede tener distintos desenlaces de acuerdo con la severidad del sangrado, el estado hipóxico del tejido circundante y el efecto de masa ocasionado por la acumulación de sangre 22,25. En el mejor de los casos, no hay manifestaciones y, si se llega a identificar la abrupción, se realiza una vigilancia estricta por riesgo de parto pretérmino; cuando existe separación mínima o parcial de la placenta, hay activación de nociceptores con expresión de dolor a nivel abdominal o dorsal 22,23. Cuando la acumulación de sangre y el sangrado son significativos, hay dolor acompañado de contracciones y sangrado vaginal, con posterior hipotensión. Estos últimos mecanismos desencadenan respuestas compensadoras en el feto, lo que provoca taquicardia por un tiempo determinado; cuando se produce fatiga, se desencadena una bradicardia con acidosis y lesión multiorgánica (Figura 1) 22.
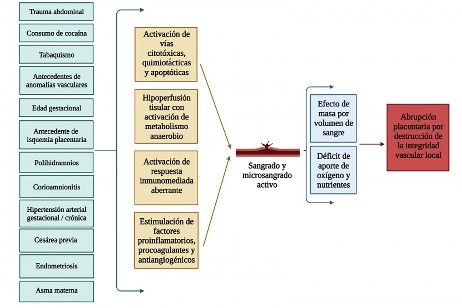
Figura 1 Factores de riesgo y mecanismos fisiopatológicos asociados a la abrupción placentaria (22-26)
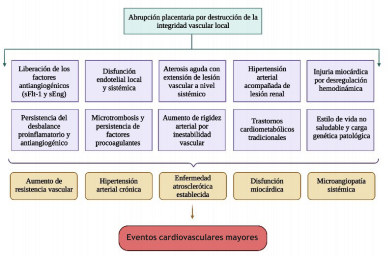
Ahora bien, los mecanismos secundarios asociados al desarrollo de la enfermedad cardiovascular aguda y a largo plazo son más complejos y condicionantes. Se cree que la persistencia del desbalance antiangiogénico y proinflamatorio entre el periodo de la complicación y el tiempo postparto es la base de este proceso fisiopatológico 25-27. Durante la exacerbación de los mecanismos fisiopatológicos iniciales del daño estructural en la red vascular placentaria, se produce una desregulación inmunomediada por células asesinas naturales y células dendríticas, que causan remodelado de las arterias espirales, lo que genera estrés oxidativo, hipoperfusión y activación de nuevas vías citotóxicas 26. Esto tiene un impacto sistémico, lo que ocasiona también disfunción endotelial materna e hipertensión gestacional, la cual persiste posterior al embarazo 29. Esto se sabe debido a la detección sérica que han realizado algunos estudios de niveles elevados de factores antiangiogénicos (sFlt-1: soluble fms-like tyrosine kinase 1; y sEng: soluble endogline) en gestantes, y que dichos niveles persisten incluso por tiempo representativo posterior al parto 28,29.
La secreción de estas proteínas en esta condición se ha asociado como factor de riesgo independiente de disfunción miocárdica durante la gestación, además de servir como predictores de desenlaces adversos en el embarazo 30,31. Adicionalmente, la aterosclerosis de las arterias espiraladas (también llamada aterosis aguda) es una complicación que deriva de todos los mecanismos citotóxicos e inmunomediados del estrés oxidativo 32, genera eventos microtrombóticos y diseminación del depósito de moléculas lipídicas en otras regiones vasculares, las cuales podrían explicar el aumento del riesgo cardiovascular e incremento de la incidencia de eventos cerebro-cardiovasculares, en comparación con aquellas que no presentan abrupción placentaria 30-32.
Se ha observado que esta respuesta aberrante no se resuelve fácilmente tiempo después de la gestación 32-35. Evidencia con soporte sobre estudios proteómicos ha encontrado que las mujeres con este antecedente presentan una sobrexpresión de vías de señalización proinflamatorias y procoagulantes 33-35, las cuales, acompañadas de factores epigenéticos, tales como sobrepeso/obesidad, hipertensión arterial esencial, hiperglicemia/insulinorresistencia, disfunción endotelial, enfermedad vascular periférica, enfermedad vascular aterosclerótica establecida específica, disfunción miocárdica, consumo de alcohol, dieta hipercalórica, facilitan, sin lugar a duda, la presentación de un evento vascular mayor con lesión de órgano blanco 30-35. Fisiológicamente, las mujeres realizan un cambio adaptativo cardiaco y vascular para la redistribución del flujo sanguíneo y resistencia vascular que permita un adecuado suministro al feto 36. Sin embargo, en mujeres que presentan abrupción placentaria y otras complicaciones, existe menor reserva cardiovascular, menor regulación de la resistencia vascular sistémica y de la presión arterial media (causados principalmente por lesión vascular), lo cual puede acompañarse también de alteraciones neurobiológicas de la presión arterial, que son más frecuentes en población de nuestra región (afrodescendientes), incrementando de manera irremediable el riesgo cardiovascular a mediano y largo plazo (Figura 2) 36.
Carga de enfermedad y datos epidemiológicos de las complicaciones cerebro-cardiovasculares postparto
Conociendo la compleja adaptación cardiovascular e inmune materna, se deduce, entonces, que la mala adaptación durante el embarazo es el principal mecanismo fisiopatológico de complicaciones asociadas a la gestación y al parto 37. Aunque la mayoría de estos cambios vuelven a la normalidad después del parto, aquellas mujeres que presentan complicaciones como la abrupción placentaria tienen un mayor riesgo de desarrollar infarto de miocardio, tromboembolismo venoso y accidente cerebrovascular en etapas posteriores de la vida (38). Muchos estudios han demostrado que las mujeres con antecedentes de preeclampsia, diabetes gestacional, parto prematuro y parto de bebés con bajo peso al nacer (BPN) tienen un mayor riesgo de desarrollar trastornos cardiometabólicos y eventos cardiovasculares posteriores 37,39-43. Además, un estudio reciente, cuyo objetivo fue analizar el riesgo de complicaciones cardiovasculares graves en el puerperio posterior al parto por cesárea, reportó que el riesgo de tener un evento cardiovascular adverso fue significativamente mayor en el grupo de cesárea (OR 2,23; IC 95 % 1,98-2,51) para todos los tipos de eventos cardiovasculares, y se halló que la trombosis venosa profunda fue la complicación más frecuente con una incidencia del 0,11 % tras el parto por cesárea y del 0,06 % tras el parto vaginal 44.
La tromboembolia en el embarazo ocurre en aproximadamente 0,5 a 2,0 por cada 1000 partos 45. El riesgo de desarrollar tromboembolismo aumenta en un factor de 4 a 5 durante el embarazo, y de 20 a 80 durante los 3 meses posteriores al parto 46. En particular, se ha determinado que el periodo más crítico es el que se encuentra entre las primeras 2 semanas después del parto 47, que representa aproximadamente el 10 % de la mortalidad materna, lo que resulta en 1,1 a 1,5 muertes por cada 10 000 partos 48. De la mano, el riesgo de ACV isquémico arterial es mayor durante el puerperio que durante el embarazo 49. Por su parte, el ACV hemorrágico ocurre con mayor frecuencia durante el segundo o principios del tercer trimestre y en el periodo posparto temprano. De manera específica, el riesgo de hemorragia subaracnoidea aneurismática alcanza su punto máximo entre las 30 y 34 semanas de embarazo. Sin embargo, la hemorragia intracerebral ocurre más durante el puerperio que durante el embarazo 49. Aproximadamente el 50 % de todas las rupturas aneurismáticas en mujeres <40 años están relacionadas con el embarazo. Pero las malformaciones arteriovenosas (MAV) son más controvertidas, pues los estudios han demostrado que la hemorragia cerebral debida a MAV asociada con el embarazo se producen de manera uniforme, tanto durante el periodo de gestación como en el posparto 50,51.
Si bien existen muchas causas de ictus durante el embarazo o el puerperio, la mayoría son similares, con etiologías comunes como el ictus isquémico o hemorrágico, aunque las causas específicas del embarazo incluyen preeclampsia/eclampsia. La embolia de líquido amniótico (ELA), las MAV, el aneurisma de la arteria cerebral, el síndrome de encefalopatía posterior reversible (PRES) y la angiopatía posparto (PPA) también son causas bien conocidas 52,53. Comparativamente, la incidencia de ACV específica por edad para los menores de 45 años oscila entre 10 y 30 por 100 000 años-persona 54. Pero, entre los casos de ictus relacionados con el embarazo, el 11 % son anteparto, el 41 % se producen en el momento del parto (ingreso por parto) y el 48 % son posparto (ingreso por una complicación posparto) 55.
El estudio más reciente a la fecha que ha evaluado el fenómeno principal discutido en esta revisión es el de Ananth et al. 11, quienes sintetizaron un volumen representativo de casos con abrupción placentaria (más de 60 000), con el fin de comparar los perfiles de morbilidad materna en caso de desprendimiento prematuro de placenta grave con respecto a los casos de desprendimiento leve, moderado y sin desprendimiento 11. En comparación con las mujeres sin desprendimiento, el RR de complicaciones maternas fue de 2,14 (IC 95 % 1,89-2,41) en mujeres con desprendimiento leve y de 4,29 (IC 95 % 4,11-4,47) en mujeres con desprendimiento grave. Los RR para muchas de las complicaciones fueron de 2 a 7 veces más altos entre los casos de desprendimiento severo. De hecho, los RR para edema pulmonar (RR 2,40; IC 95 % 1,82-3,17), insuficiencia cardíaca aguda (RR 4,20; IC 95 % 3,08-5,74), enfermedad cerebrovascular puerperal (RR 1,20; IC 95 % 0,92-1,55), cardiomiopatía (RR 1,68; IC 95 % 1,26-2,26) fueron todos considerablemente más altos en mujeres con desprendimientos severos 11. Esto permite evidenciar con claridad el impacto que tiene la abrupción placentaria sobre la carga de enfermedad y supervivencia cardiovascular.
Salud neurovascular y cardiovascular a largo plazo en mujeres con antecedente de abrupción placentaria
A pesar de que aún existen vacíos en la evidencia, el perfil de riesgo cardiovascular en mujeres con antecedente de abrupción parece ser distinto al de mujeres con embarazos sin complicaciones, dado que Veerbeek et al. 56 ejecutaron un estudio donde encontraron que las mujeres con antecedente de desprendimiento placentario tenían una presión arterial media, índice de masa corporal, colesterol total, colesterol HDL, colesterol LDL, glucemia en ayunas y proteína C reactiva significativamente más altos en comparación con los controles con embarazos sin incidentes 56.
Además de lo expuesto previamente, evidencia sintetizada permite observar que las mujeres que sufrieron desprendimiento de placenta tienen un riesgo de 2,65 veces mayor (IC 95 % 1,55-4,54) de muerte relacionada con cardiopatía coronaria/accidente cerebrovascular vs. complicaciones no fatales de cardiopatía coronaria/accidente cerebrovascular (RR 1,32; IC 95 % 0,91-1,92). Además, el desprendimiento se ha asociado con una mayor mortalidad por cardiopatía coronaria (RR 2,64; IC 95 % 1,57-4,44) que por ACV (RR 1,70; IC 95 % 1,19-2,42) 11. Por otro lado, un estudio de cohorte prospectivo encontró que el desprendimiento se asoció con mayores tasas de ACV isquémico no mortal (HR 1,4; IC 95 % 1,1-1,7) y ACV hemorrágico (HR 1,4; IC 95 % 1,1-1,9), y las tasas de mortalidad cerebrovascular fueron de 0,8 y 0,5 por 10 000 años-persona entre mujeres con y sin desprendimiento, respectivamente (HR 1,6; IC 95 % 0,9-3,0) 57.
Factores de riesgo que se asocian con la abrupción placentaria, ¿se pueden controlar?
Dentro de los metaanálisis existentes que han estimado la magnitud de los factores de riesgo asociados con la abrupción placentaria, se puede identificar que algunos son modificables y pueden ayudar a las mujeres que poseen un mayor riesgo a un control estricto del cuidado.
Una revisión general 58 encontró ocho factores de riesgo, dentro de los cuales están el asma materna (RR 1,29; IC 95 % 1,14-1,47), la cesárea previa (RR 1,38; IC 95 % 1,35-1,42), el consumo de cocaína (RR 4,55; IC 95 % 1,78-6,50), la endometriosis (OR 1,40; IC 95 % 1,12-1,76), la hipertensión crónica (OR 3,13; IC 95 % 2,04-4,80), la edad materna avanzada (OR 1,44; IC 95 % 1,35-1,54), el tabaquismo materno (OR 1,80; IC 95 % 1,75-1,85) y el uso de técnicas de reproducción asistida (OR 1,87; IC 95 % 1,70-2,06), que se calificaron como evidencia sugestiva (clase III) (58). Otros factores de riesgo son peso inferior al normal antes del embarazo (OR 1,38; IC 95 % 1,12-1,70), la preeclampsia (OR 1,73; IC 95 % 1,47-2,04), el leiomioma uterino (OR 2,63; IC 95 % 1,38-3,88) y el consumo de marihuana (OR 1,78; IC 95 % 1,32-2,40), que se calificaron como factores de riesgo con evidencia débil (clase IV) 58.
El desprendimiento de placenta también se asocia con el doble de riesgo del evento cardiovascular mayor en el futuro, y las mujeres con diabetes gestacional tienen más de 7 veces el riesgo de desarrollar diabetes tipo 2 59,60. Un metaanálisis evidenció que el riesgo de abrupción entre las anomalías müllerianas en comparación con el útero normal fue de 3,10 (IC 95 % 1,47-4,74) veces mayor 61. Igualmente, otras anomalías uterinas como leiomiomas presentan una asociación significativa con el riesgo de abrupción (2,63; IC 95 % 1,38-3,88) 62.
Perspectivas futuras y consideraciones sobre la salud materna en países de bajos y medianos ingresos
En los últimos años, se ha prestado cada vez más atención a los impactos sociales y económicos de las barreras para garantizar la salud materna, y se ha enmarcado el problema como una preocupación de desarrollo más amplia con influencia en el bienestar del hogar y como indicador de desarrollo territorial. Pocos estudios han explorado el gasto de bolsillo y catastrófico de la morbilidad materna, que pueden ser particularmente graves en las economías rurales donde el hogar es la principal unidad económica que cubre la mayor parte de sus propias necesidades de subsistencia.
Un estudio realizado en Kes 63, con el fin de indagar las consecuencias de la muerte materna para los hogares en las zonas rurales del oeste, centrándose, particularmente, en los impactos financieros inmediatos, encontró que los hogares que sufrieron una muerte materna gastaron alrededor de un tercio de su gasto de consumo anual per cápita en el acceso y uso de la atención médica, en comparación con un máximo del 12 % entre los hogares que tuvieron un embarazo y un parto saludables 63. Los costos de los funerales a menudo eran más altos que los costos de atención médica y, en conjunto, obligaron a los hogares a liquidar activos y pedir dinero prestado. Además, los miembros sobrevivientes de los hogares tenían una importante redistribución del trabajo y las responsabilidades para compensar las contribuciones perdidas de las mujeres fallecidas 63. El seguimiento posparto para las mujeres con factores de riesgo cardiovascular debe incluir modificaciones en el estilo de vida y un abordaje adecuado de los factores de riesgo, tales como hipertensión arterial, diabetes mellitus, dislipidemia, obesidad, entre otros, con el fin de disminuir eventos adversos en el puerperio y las futuras gestaciones. Graves et al. 64 recomiendan evaluar, a los 6 y 12 meses posparto, las cifras de tensión arterial, perfil lipídico completo, índice de masa corporal, uroanálisis, modificaciones en el estilo de vida que incluya una dieta saludable baja en grasas, actividad física, y educar a las pacientes sobre los riesgos del desarrollo de una enfermedad cerebrovascular y, además, en caso de ser necesario, considerar la remisión a un especialista para una evaluación o intervención adicional, todo esto con el fin de optimizar su salud para las futuras gestaciones 64. Aún falta mucho para alcanzar las metas de la salud materna establecidas por la salud global 65. No obstante, existen hojas de rutas que pueden ser implementadas de manera estricta para controlar la carga de enfermedad, el impacto económico y mejorar los indicadores de desarrollo humano, con el objetivo de promover la calidad de vida y los determinantes de la salud en el enfoque materno-perinatal.
Conclusiones
Se puede concluir, entonces, que el riesgo cardiovascular y cerebrovascular es inminente en mujeres con antecedente de abrupción placentaria, dado por numerosos mecanismos fisiopatológicos complejos. No obstante, este riesgo se eleva considerablemente al asociarse con factores modificables tradicionales y no tradicionales. Es necesario llevar a cabo mayor número de estudios en países de bajos y medianos ingresos, que permitan identificar si existen diferencias en magnitud y gravedad de la presentación de los eventos vasculares, tiempos, capacidad funcional y supervivencia, adaptados al contexto social y de salud de estas sociedades. Además, se necesitan programas estrictos de evaluación cardiovascular personalizados a largo plazo, para valorar y prevenir la aparición de eventos cerebro y cardiovasculares.