Introducción
Los factores de transcripción son proteínas celulares especializadas que se unen a secuencias promotoras del gen para regular su expresión genética. Estos factores están influenciados por diversos factores epigenéticos, reguladores de genes y los cofactores moleculares. Los factores de transcripción regulan cientos de genes que están relacionados con el desarrollo del organismo y tienen vastas redes con un gran número de componentes 1. El factor nuclear del potenciador del gen de la cadena ligera kappa en células B activadas (NF-κB) es uno de los factores de transcripción nuclear con una amplia gama de funciones biológicas, el cual existe en casi todos los tipos de células de mamíferos. Fue descubierto por Sen y Baltimore en 1986 cuando estudiaban los factores de transcripción asociados a los genes de las inmunoglobulinas en las células B1, de allí surgió su denominación actual 2. Desde entonces, los estudios de investigación se enfocaron en las funciones críticas de NF-κB en diversos procesos biológicos, incluidos proliferación celular, metástasis, respuesta al daño del ADN, apoptosis y respuesta inmunitaria a través de sus vastos genes diana 3. El factor NF-κB está estrechamente relacionado con alteraciones celulares asociadas a la inmunidad y el cáncer 4. El factor NF-κB es importante en muchas de las vías de señalización celular y está ampliamente involucrado en la génesis, desarrollo y progresión del cáncer 5. Por tanto, el objetivo principal de esta revisión es comprender los mecanismos de regulación del factor de transducción NF-κB, su patogénesis, evolución y posibles blancos terapéuticos en el cáncer.
Estrategia de búsqueda
Se consultaron las bases de datos PubMed, Scopus y SciELO, a partir del año 2000 hasta el año 2022. Se buscaron todas las referencias bibliográficas en relación con las palabras clave: NF-kappa B; Factor NF-kB de Transcripción; Factor Nuclear kappa B; Neoplasias (español); NF kappaB; NF-kB; NF-kB Transcription
Factor; Nuclear Factor kappa B; Transcription Factor NF kB; kappa B Enhancer Binding Protein; Neoplasms (inglés). De los artículos seleccionados, se excluyeron aquellas revisiones repetitivas, y las fuentes originales se consideraron como prioritarias. Se agregaron artículos anteriores al rango de fecha de búsqueda, cuando fueron investigaciones históricas relevantes o investigaciones pivotales con vigencia actual.
Estructura del factor nuclear NF-κB
NF-kappa-B es un complejo homo o heterodimérico formado por las proteínas de clase I NFKB1 (p105/p50) y NFKB2 (p100/p52), en las cuales las subunidades proteicas NF-κB p50 y p52 son generadas por un proceso proteolítico parcial a partir de las proteínas inhibitorias p105 y p100, respectivamente; y las proteínas de clase II RelA (p65), RelB y c-Rel. Ambas clases comparten dominios proteicos similares al oncogén Rel (RHR), los cuales son secuencias de aminoácidos altamente conservadas durante la evolución y forman una zona aproximada de casi 300 residuos de longitud, ubicada cerca de sus extremos amino. Esta región RHR es responsable de la unión específica de secuencia al ADN. A diferencia de la clase I, la clase II, además de poseer la contraparte celular del oncogén viral de la reticuloendoteliosis aviaria (RHR), contiene un dominio de transactivación (TAD), en sus extremos carboxilo, que se requiere para el transporte de los complejos NF-kB activos al núcleo. Las posibilidades combinatorias entre las proteínas clase I y II nos ofrecen el ensamblaje de quince homo y heterodímeros distintos del NF-κB, sin embargo, no todos los dímeros potenciales se observan in vivo. Los heterodímeros p50-RelA y los homodímeros p50 son los dímeros más comunes que se encuentran en la ruta de señalización de NFκB; p50-RelA es el principal producto final de la actividad transcripcional inducida por NF-κB a través de la señalización canónica, el heterodímero p52-RelB es más activo en la señalización de NF-κB no canónico 6 (Figura 1).
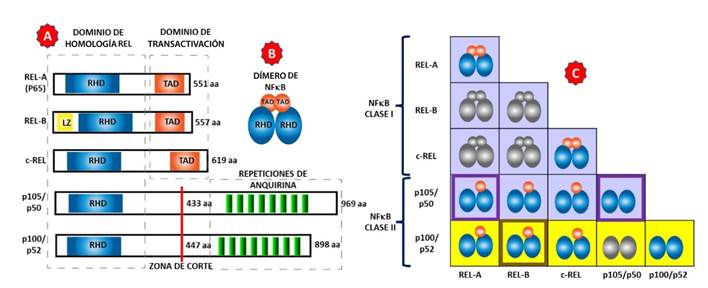
Figura 1 Familia de proteínas del factor de transcripción NF-κB. A) Estructura de las cinco proteínas de NF-κB; RelB cuenta, además, con un dominio zipper de leucina (LZ); la zona de corte permite la presencia de la proteína p105 (969 aa) o p50, una proteína acortada (433 aa) y de la proteína p100 (898 aa) o p52 (447 aa). B) El factor de transcripción NF-κB actúa con la formación de dímeros (homo o heterodímeros). C) Posible formación de dímeros de la combinación homo y heterodimérica; dímeros en gris, no han sido vistos a nivel celular; fondo lila: actividad en la vía canónica del NF-κB; fondo amarillo: actividad en la vía no canónica o alternativa del NF-κB; recuadros más intensos: principales dímeros activos. Aa: aminoácidos.
Familia de proteínas inhibidoras del factor nuclear NF-κB (IκB)
El factor nuclear NF-κB está regulado por las proteínas de la familia IκB, las cuales se caracterizan por tener en su estructura repeticiones de anquirina (proteína de la membrana plasmática y del citoesqueleto subyacente que permite la unión a diferentes proteínas integrales y que es esencial para mantener la integridad de la membrana), la cual interactúa con el dominio RHD de la proteína NF-κB 7. IκB está compuesto por ocho miembros que son IκBα, IκBβ, IκBɛ, IκBζ, IκBNS, Bcl-3, p100 y p105; cada miembro contiene una serie de dominios con repeticiones de la proteína anquirina (ARD), las cuales forman una estructura con residuos de aminoácidos que reconocen específicamente y se unen a los dímeros de NF-κB, y así evitan que el factor nuclear ingrese en el núcleo 8.
Vías de señalización del factor nuclear NF-κB
Existen dos vías de señalización diferentes de NF-κB: la vía canónica y alternativa (no canónica), con distintos mecanismos de activación. La vía NF-κB canónica se activa para responder a una diversidad de estímulos externos implicados en la inflamación, la respuesta inmunitaria, la proliferación celular, la diferenciación y la supervivencia 9. Por otro lado, el NF-κB alternativo se activa solo a través de un grupo de receptores de la superfamilia del factor de necrosis tumoral (TNF), lo que indica que las funciones biológicas de esta rama de la vía son más específicas 10. La vía no canónica de NF-κB es responsable del desarrollo de células, estructuras inmunitarias y participa activamente en las enfermedades inflamatorias crónicas 11 (Figura 2).
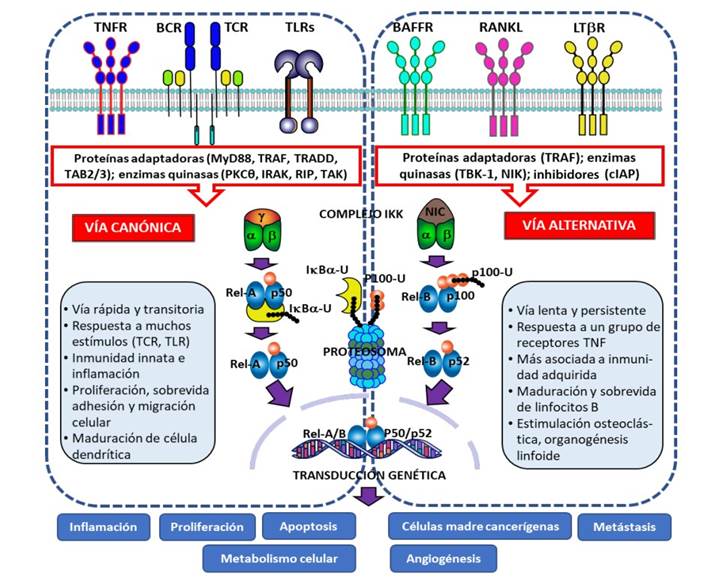
Figura 2 Vías de señalización del factor de transcripción NF-κB. Vía canónica: la activación de los receptores TNFR, BCR, TCR y TLRs produce fosforilación y cambios conformacionales intracitoplasmáticos del receptor a través de diversas proteínas adaptadoras y quinasas, que finalmente activan una quinasa (TAK1), que fosforila y activa el complejo IκB quinasa-β (IKK), el cual consta de dos subunidades catalíticas, IKKα (IKK1) e IKKβ (IKK2), así como de una proteína accesoria no catalítica, IKKγ, la cual es un modulador esencial de NF-κB (NEMO), que actúa como una proteína chaperona y reguladora del complejo IKK; el complejo IKK activado induce la fosforilación y ubiquitinación y posterior degradación proteosomal del IκBα, liberando las proteínas NF-κB (Rel-A/p50), que ingresan libres al núcleo para impulsar la transcripción de genes objetivo, las cuales participan en diferentes funciones finales. Vía alternativa (no canónica): se produce la activación de un subgrupo específico de receptores de la superfamilia TNF, cuyos ligandos fosforilan y producen cambios conformacionales intracitoplasmáticos del receptor a través de diversas proteínas adaptadoras y quinasas, que finalmente activan la quinasa NIK, la cual es un componente central de la vía no canónica, que activa IκB quinasa-α (IKKα), para desencadenar la fosforilación y ubiquitinación y posterior degradación parcial de la proteína p100 y su transformación a la proteína p52; el dímero Rel-B/p52 se traslada al núcleo para iniciar la transducción genética pertinente; el nivel basal de NIK se mantiene bajo por la acción de un complejo de destrucción de NIK formado por las proteínas TRAF-cIAP; sin embargo, ante los estímulos de activación se ubiquitina y degrada uno de los componentes del sistema (TRAF3) que permite la acción de NIK sobre IKKα, con el posterior traslado de los heterodímeros RelB/p52 al núcleo y la generación de la transducción genética respectiva.
Vía canónica del factor nuclear NF-κB
La activación de la vía NF-κB está basada en la degradación de la proteína IκB, la cual sucede con la fosforilación de IκBα por el complejo IκB quinasa (IKK), ubiquitinación y degradación a través de la vía dependiente de la proteasoma, lo que permite la liberación del NF-κB en el núcleo para iniciar la transcripción genética, en forma temporal, ya que inmediatamente NF-κB interactúa con un IκB no fosforilado, sintetizado en el núcleo y retorna al citoplasma inactivo 12 (Figura 2).
El complejo IKK es un conjunto complejo de proteínas quinasas, incluidas dos subunidades homólogas, catalíticamente activas que son IKKα (IKK1) e IKKβ (IKK2), y una subunidad auxiliar IKKγ (NEMO, modulador esencial NF-kappaB), la cual puede activarse por varios estímulos, tales como factores de crecimiento, citocinas, factores de estrés 13. La regulación de la activación canónica de NF-κB requiere de la participación de IKKβ e IKKγ, aunque esta última no tiene actividad catalítica 14. La vía canónica de NF-κB juega un papel importante en la supervivencia y proliferación celular, la transformación epitelial de células tumorales a mesenquimales, angiogénesis, metástasis del cáncer 5 (Figura 2).
Vía alternativa del factor nuclear NF-κB
La vía de activación NF-κB alternativa está regulada principalmente por IKKα. Esta vía no canónica responde selectivamente a determinados estímulos producidos por ligandos sobre los receptores miembros de la familia TNF, como el receptor β de la linfotoxina (LTβR), el receptor del ligando activador del factor nuclear κB (RANKL), el receptor CD40 (expresado en células presentadoras de antígenos), familia de factores activadores de la célula B (BAFF) 15. La activación del receptor pertinente permite la ubiquitinación y degradación del factor 3 asociado al receptor de TNF (TRAF3), el cual media la degradación de la quinasa inductora de NF-κB (NIK) cuando se asocia en un complejo con TRAF2 y la ubiquitina ligasa E3 cIAP (cIAP1 o cIAP2), en el que TRAF3 sirve como adaptador de unión a NIK 16. Actualmente se cree que NIK e IKKα median la conversión de la proteína p100 a p52, un evento clave de la vía no canónica NF-κB 17. La proteína p100 funciona como inhibidor (IκB) al unirse a RelB y retenerlo en el citoplasma 18. IKKα y NIK promueven la fosforilación de la proteína p100, y ocasiona su ubiquitinación a través
de la proteína ligasa de ubiquitina E3 con repeticiones de transducina β (β-TrCP), que finalmente produce la proteína heterodimérica p52/RelB, la cual puede ingresar al núcleo y cumplir su papel de factor de transducción 15. El control estricto del destino de NIK es importante, pues la acumulación de NIK desregulada se asocia con neoplasias linfoides (Figura 2).
Factor nuclear NF-κB y cáncer
La inestabilidad genómica producida por las mutaciones genéticas y alteraciones cromosómicas es un sello distintivo de la carcinogénesis; sin embargo, hay que diferenciar entre las mutaciones conductoras, que le confieren ventajas a las células cancerígenas en contraposición a las mutaciones pasajeras que no proporcionan tal beneficio proliferativo 19. Los patrones de recurrencia en cánceres secuenciados estiman que la gran mayoría de las mutaciones (97 %) en cáncer son pasajeras 20. Un estudio reciente con la combinación de datos genómicos y epidemiológicos en Estados Unidos, realizada por científicos informáticos del Instituto Salk de Estudios Biológicos, ha combinado información de mutaciones genéticas con datos de prevalencia del cáncer para revelar la base genética de este en toda la población de pacientes con esta enfermedad en los Estados Unidos, y han estimado que el gen supresor de tumores TP53 es el gen mutado con mayor frecuencia (35 %), seguido del gen PIK3CA (13 %), KRAS (11 %), RAF (8 %) y KMT2C, KMT2D
y ARID1A entre los genes conductores mutados con mayor frecuencia 21. Muchas mutaciones oncogénicas, como aquellas ligadas a EGFR, Ras, PI3K y p53, contribuyen a la activación de NF-κB en las células tumorales, por tanto, la investigación de este factor es fundamental en la búsqueda de nuevas rutas terapéuticas para el cáncer.
A pesar de que los componentes genéticos de la vía NF-κB no se encuentran entre los genes más frecuentemente mutados, se han encontrado algunas mutaciones de NF-κB en varios tipos de cáncer, entre los más importantes está la amplificación del gen REL en el linfoma, que conduce a un aumento de la expresión de la proteína REL, así como a la expresión de una proteína p100 truncada, que carece de la secuencia inhibidora con repeticiones de anquirina 22. En la Tabla 1 se pueden observar las principales mutaciones en la vía NF-κB.
Tabla1. Mutaciones del factor nuclear NF-κB identificadas en distintos cánceres
| PROTEÍNA | GEN | MUTACIÓN | TIPO DE CÁNCER | REFERENCIA |
|---|---|---|---|---|
| TRAF1 | TRAF1 | MP | CCR ,CG ,M ,LMC | 23,24,25,26 |
| TRAF2 | TRAF2 | MP | CPr ,DLBCL ,MM | 24,27 |
| TRAF3 | TRAF3 | MP ,DEL ,AMPL | CU ,Cpu ,CNF ,DLBCL ,MZL ,MM ,WM | 24 |
| TRAF2 /3 | TRAF2 /3 | MP ,DEL ,AMPL | CV,CG ,CCC ,M ,CO ,CE | 24 |
| TRAF4 | TRAF4 | MP ,AMPL | CV ,Cpa , | 24 |
| TRAF6 | TRAF6 | MP ,AMPL | CCR ,CG ,CCC | 24,28 |
| TRAF4 /5/6 | TRAF4 /5/6 | MP ,AMPL | CM ,CE ,Cpu ,M ,CO ,CPr ,CE | 24 |
| p50 /p105 | NFKB1 | MP | CU ,CG ,CH ,CO | 29,4 |
| MYD88 | MYD88 | MP ,DEL | CG ,DLBCL ,WM | 30,31,32 |
| ΙκΒα | NFKBIA | MP ,DEL | GLI ,CNF ,DLBCL , | 33,34,35,36 |
| IkBB | NFIKBB | MP | MM , | 37 |
| ΙκΒε | NFKBIE | MP ,DEL | LLC , | 38 |
| IKKB | IKBKB | MP | CPr ,DLBCL ,MM | 39 |
| BCL3 | BCL3 | TR | LLC , | 40 |
| BCL10 | BCL10 | MP ,TR | DLBCL | 41 |
| REL | REL | MP ,AMPL | DLBCL | 22 |
| REL | REL | TRUNC | DLBCL | 22 |
Mutación: mutación puntual (MP), deleción genética (DEL), amplificación genética (AMPL), translocación (TR), truncamiento (TRUNC). Tipos de cáncer: cáncer colorrectal (CCR), cáncer gástrico (CG), melanoma (M), leucemia mieloide crónica (LMC), cáncer de próstata (CPr), linfoma difuso de células B grandes (DLBCL), mieloma múltiple (MM), cáncer de cuello uterino (CU), cáncer de pulmón (Cpu), carcinoma nasofaríngeo (CNF), linfoma de la zona marginal (MZL), macroglobulinemia de Waldenström (WM), cáncer de vejiga (CV), cáncer de cabeza y cuello (CCC), cáncer de ovario (CO), cáncer de endometrio (CE), cáncer de páncreas (Cpa), cáncer de mama (CM), cáncer hepático (CH), glioblastoma multiforme (GLI), leucemia linfocítica crónica (LLC). Modificado de Zhang T, et al.5.
Mecanismos de oncogénesis del factor nuclear NF-κB y cáncer
Inflamación crónica
La inflamación crónica provoca enfermedades autoinmunes, enfermedades degenerativas y cáncer. La génesis tumoral en este contexto es producto de la alteración de las secuencias genéticas, cambios epigenéticos y el microambiente tumoral; por ello, ha sido descrita como una característica emergente del cáncer 23. El factor NF-κB es un regulador fundamental del contexto inflamatorio, de tal forma que el aumento de su actividad puede incrementar las citocinas proinflamatorias y así contribuir directamente a mejorar las condiciones del microambiente tumoral, además, estas citoquinas pueden activar la vía NF-κB y formar un ciclo de retroalimentación positiva para aumentar la actividad de NF-κB en diferentes tipos de células en el sitio de la inflamación 24.
Proliferación
La proliferación celular es un factor fundamental en el proceso celular, y el factor NF-κB también participa en esta actividad al activar genes que regulan la proliferación celular, como las ciclinas D1/D2/D3 25. Además, el factor NF-κB regula la proliferación celular por inducción de enzimas críticas, como la expresión de la proteína ubiquitina ligasa E3 Mdm-2, la cual es dependiente de NF-κB y afecta la estabilidad de p53 y la proliferación celular 26. En diversas células inmunitarias como macrófagos y neutrófilos, la activación de NF-κB activa la expresión de citoquinas inflamatorias tales como TNFα, IL-1β e IL-6, lo cual promueve la proliferación de células malignas y células del estroma tumoral 8.
Apoptosis
Una función importante del NF-κB es regular la supervivencia celular. En las células tumorales, la activación de NF-κB suele conducir a alteraciones en la apoptosis celular 27. El factor NF-κB induce la expresión de genes antiapoptóticos como FLIP, el inhibidor de caspasa-8, el inhibidor de las proteínas de apoptosis c-IAP1/2 y XIAP, y miembros de la familia Bcl2 de reguladores de apoptosis; la regulación al alza de la actividad de NF-κB ha sido detectada en varias células tumorales, y la expresión de genes diana antiapoptóticos de NF-κB también aumenta 28. Por ejemplo, en el adenocarcinoma de pulmón inducido por Kras, la inhibición de la vía NF-κB en las células tumorales mediante la sobreexpresión del represor IκBαM o la eliminación de RelA o IKK2 redujo el tamaño del tumor, pero no se detectaron alteraciones en las vías apoptóticas 29.
Angiogénesis
Uno de los factores angiogénicos más estudiados es el factor de crecimiento vascular-endotelial (VEGF), cuya expresión está fuertemente regulada por el factor inducido por hipoxia 1α (HIF-1α) y otros estímulos como citocinas y oncogenes, que también son mediadores críticos para la activación de NF-κB 30. Asimismo, el factor de crecimiento de fibroblastos básico (bFGF), IL-8, metaloproteinasa de matriz-9 (MMP-9) y otros genes diana de NF-κB están involucrados en múltiples pasos de la angiogénesis 31. El cáncer colorrectal es una de las entidades malignas en la cual la angiogénesis es muy importante, ya que VEGF aumenta notablemente la permeabilidad vascular, promueve la formación de nuevos vasos sanguíneos e induce metástasis 32.
Acción sobre las células madre del cáncer (CMC)
Las CMC son células malignas que tienen la capacidad de autorrenovarse y diferenciarse en células malignas, y son la razón principal de la recurrencia, metástasis y resistencia al tratamiento 33. El factor NF-κB está constitutivamente activado en varias CMC, incluyendo leucemia, glioblastoma, cáncer de próstata, ovario, mama, páncreas y colon 34. El factor NF-κB podría funcionar solo o en sinergia con otras vías de señalización para inducir y promover la autorrenovación, proliferación y metástasis de las CMC a través de la expresión de genes y factores transcripcionales relacionados con las células madre 35.
Regulación del metabolismo celular por el factor NF-κB Algunos estudios han demostrado que la activación de NF-κB en fibroblastos embrionarios de ratón sin expresión de la proteína p53 (knockout del gen), puede aumentar la captación de glucosa al aumentar la expresión del transportador de glucosa 3 (GLUT3) y mantener un flujo glucolítico alto 36. El factor NF-κB también modula la respiración mitocondrial al regular el citocromo c oxidasa-2 (SCO2), una subunidad crítica del complejo respiratorio mitocondrial, a través de la proteína p53; en ausencia de p53, NF-κB se transloca al núcleo y bloquea la fosforilación oxidativa mitocondrial, lo que aumenta el "efecto Warburg" en las células cancerosas 37. Por tanto, la regulación del metabolismo celular por NF-κB depende del estado de p53 en las células.
Metástasis
El factor NF-κB promueve la transición epitelio-mesenquimatosa (EMT) en las células cancerosas, siendo un evento temprano en la generación de las metástasis 38. Existen varias moléculas EMT, dependientes de NF-κB, que potencian la migración de las células cancerosas 39. Además, la activación de NF-κB también promueve la EMT a través de otros mecanismos, como las enzimas degradadoras de la matriz, como las metaloproteinasas (MMP) inducidas por NF-κB que promueven la liberación de TGF-β, que contribuye a la diseminación metastásica 40. Asimismo, algunas moléculas de adhesión celular, como las selectinas, las integrinas y sus ligandos, están reguladas en gran medida por la vía NF-κB 41 y son importantes para promover la extravasación y colonización de células cancerosas en sitios distantes, aunque los detalles del mecanismo siguen siendo esquivos 42.
Otros mecanismos
Se ha demostrado que la activación de NF-κB induce la expresión de citidina desaminasa inducida por activación (AID), una enzima que introduce mutaciones en los genes relacionados a las inmunoglobulinas y al receptor de los linfocitos T, además de p53, Myc y otros genes celulares 43. Asimismo, los mediadores inflamatorios, incluidas las citoquinas, la prostaglandina E2 (PGE2) y las especies reactivas de oxígeno, pueden suprimir la maquinaria de reparación de errores de emparejamiento del ADN a través de diferentes mecanismos que conducen a la acumulación de más mutaciones genéticas 44.
Desarrollo de medicamentos dirigidos al factor NF-κB en cáncer
Teóricamente, la inhibición del factor NF-kB podría potenciar la respuesta al tratamiento del cáncer, sin embargo, la inhibición a largo plazo podría causar efectos secundarios graves, especialmente en la respuesta inmune 45. Dado que NF-κB regula muchas funciones fisiológicas, la inhibición de NF-κB sin afectar otras vías de señalización parece ser inalcanzable, por lo menos hasta el momento actual 5. Se han estudiado y evaluado muchos inhibidores que podrían bloquear la señalización de NF-κB, in vitro o en modelos animales con algunos efectos antitumorales, pero sus efectos en el tratamiento del cáncer humano son desconocidos 46. Las excepciones son los inhibidores de la proteasoma: bortezomib, carfilzomib e ixazomib, que han demostrado tener un efecto importante en el mieloma múltiple y en el linfoma del manto, en los cuales hay activación continua del factor NF-κB 47. El mecanismo de los inhibidores de la proteasoma es inhibir la degradación del IκB ubiquitinado, lo que permite que IκB se una a los dímeros de NF-κB y permanezca en el citoplasma, logrando de ese modo inhibir la transcripción del factor NF-κB 48 (Figura 3A).
Existen otros medicamentos que, si bien es cierto que no intervienen directamente sobre el factor NF-κB, bloquean proteínas o receptores que finalmente interactúan con NF-κB. Por ejemplo, denosumab, un anticuerpo monoclonal que inhibe el ligando RANK, está asociado a las metástasis óseas 49 (Figura 3B). Los inmunomoduladores talidomida, lenalidomida y pomalidomida, que inhiben el TNFα e IL-1β, han sido aprobados para el tratamiento de mieloma múltiple 50. Algunos tipos del linfoma y la leucemia linfática crónica exhiben activación continua de NF-κB a través de la activación del receptor del linfocito B y la posterior activación de la proteína tirosina quinasa de Bruton (BTK), crucial en esta señalización; por tanto, la inhibición de BTK tiene valor terapéutico como una molécula clave para evitar la activación de NF-κB 51.
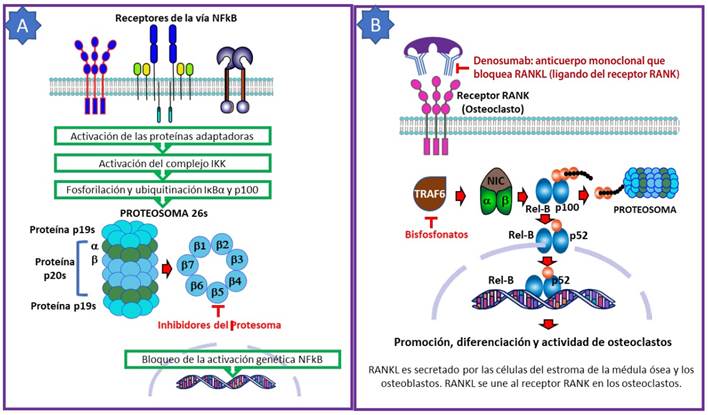
Figura 3 Mecanismo de acción de los inhibidores de proteosoma y los antiresortivos óseos. A) Los inhibidores de proteosoma inhiben la subunidad proteolítica β5 de la proteína 20s y, por tanto, no degradan a los inhibidores IκBα o p100, por ende, no permiten la llegada de Rel-A/p50 o RelB/p52 hacia el núcleo celular para la transducción de genes relacionados con la actividad de la vía NFkB (ver Figura 2). B) Denosumab es un anticuerpo monoclonal específico del ligando RANK que no permite que dicho ligando se adose al receptor RANK en el osteoclasto, lo que impide la sobreactuación de estos cuando existe enfermedad metastásica o pérdida ósea por cualquier otra causa (osteoporosis). Los bisfosfonatos como zoledronato, alendronato o ibandronato bloquean la proteína adaptadora TRAF6 e impiden que la vía continúe hacia la activación osteoclástica.
Conclusiones
El factor nuclear de transcripción NF-κB es importante en muchas vías de señalización celular, participa en diversos procesos biológicos: proliferación celular, metástasis, respuesta al daño del ADN, apoptosis y respuesta inmunitaria, y sus alteraciones están asociadas a trastornos inmunitarios y el cáncer, entre otras patologías. NF-κB se expresa en todos los tipos de células y tejidos. Muchas mutaciones oncogénicas (EGFR, Ras, PI3K y p53) contribuyen a la activación de NF-κB en las células tumorales, y son nuevas rutas de investigación terapéutica para el cáncer. Sin embargo, todavía hay muchas incógnitas sobre los mecanismos y funciones de NF-κB que necesitan tener una mayor exploración. El bloqueo completo del factor NF-κB como método terapéutico no parece ser una estrategia factible hasta el momento. Futuras investigaciones en el factor nuclear NF-κB deberían focalizarse en la inhibición de la actividad promotora del cáncer, y así evitar afectar sus funciones fisiológicas normales; mientras tanto, la combinación de múltiples fármacos dirigidos a diferentes reguladores clave de la vía NF-κB es un objetivo atractivo.















