Introducción
La enfermedad por coronavirus 2019 (COVID-19), desencadenada por el virus del síndrome respiratorio agudo severo tipo 2 (SARS-CoV-2), inició como brote en diciembre de 2019 en la ciudad china de Wuhan y fue declarada pandemia el 11 de marzo de 2020 por la Organización Mundial de la Salud (OMS) 1. Según los Centros para el Control y Prevención de las Enfermedades (CDC), desde febrero de 2020 hasta septiembre de 2021, 1 de cada 4 personas en los Estados Unidos se infectaron con el SARS-CoV-2; se reportó que 1 de cada 3,4 personas presentaron síntomas y que 1 de cada 1,9 sujetos requirió hospitalización 2,3. La sintomatología de la COVID-19 es una afectación principalmente a nivel respiratorio, de características similares a la gripe, pero que puede evolucionar hasta un síndrome de dificultad respiratoria aguda (SDRA) potencialmente letal o, incluso, convertirse en una forma de neumonía fulminante. Además, al igual que en cualquier otra infección del sistema respiratorio, las enfermedades cardiovasculares preexistentes (ECV) y los factores de riesgo cardiovasculares aumentan la vulnerabilidad y las complicaciones cuando la COVID-19 aparece 4,5. Es importante destacar que la elaboración de vacunas, ante la amenaza que significaba la pandemia, se volvió un desafío para los diferentes grupos de investigación y compañías farmacéuticas, por lo cual, en tiempo récord, se logró el desarrollo de nueve moléculas que fueron aprobadas por diferentes organizaciones reguladoras de medicamentos; la mayoría de ellas fueron distribuidas y administradas a la población mundial, principalmente en países de altos y medianos ingresos económicos 6.
Si bien el SDRA destaca como una de las complicaciones más importantes de la COVID-19, no se puede dejar de lado la lesión miocárdica que aparece en forma de síndrome coronario agudo, miocarditis, insuficiencia cardiaca e incluso shock cardiogénico 7. El gran espectro del daño al miocardio en esta enfermedad puede variar desde una elevación asintomática de los niveles de troponinas cardíacas, hasta la aparición de una miocarditis fulminante y/o shock circulatorio 7. A pesar de que no existe una estrategia clara para abordar los eventos cardíacos que aparecen durante la COVID-19, y teniendo en cuenta que el manejo se hace principalmente para controlar los síntomas del paciente a medida que surgen, en este artículo de revisión se pretende dilucidar el riesgo cardiovascular en estos pacientes y abordar la fisiopatología, los mecanismos subyacentes de la lesión miocárdica, las estrategias de tratamiento relacionadas y el seguimiento de los pacientes con patología cardíaca, y hacer énfasis en lo que sucede con los sujetos recuperados de COVID-19 a corto y mediano plazo, poniendo en perspectiva lo que concluye la evidencia actual.
Estrategia de búsqueda
Se realizó una búsqueda bibliográfica en los motores de búsqueda y bases de datos PubMed-MEDLINE, Science Direct, Scopus, Embase y EbscoHost, donde se utilizó los términos MESH "COVID-19", "SARS-CoV-2", "Cardiovascular diseases", "Heart disease risk factors", "Heart diseases", "Heart arrest", "Arrhythmias, Cardiac", así como sinónimos, que se combinaron con los operadores booleanos "AND" y "OR". Como criterio de inclusión, se
definió que cualquier artículo relacionado con la aparición de eventos cardiovasculares en sujetos con COVID-19 y posterior a la recuperación de la enfermedad sería incluido. Se dio prioridad a los estudios originales, revisiones y a las revisiones sistemáticas y metaanálisis. Además, debían estar disponibles en texto completo. Como criterios de exclusión, se estableció que no se contemplarían los artículos publicados en un idioma distinto al español, inglés o portugués. Teniendo en cuenta la amplitud del tema y la gran variedad de publicaciones, se fijó una ventana de tiempo personalizada para la búsqueda, desde 2019 hasta 2022. Se identificaron un total de 4003 artículos potencialmente relevantes, pero luego de una revisión del título y el resumen se fueron descartando hasta obtener un total de 150; tras la lectura a texto completo y discriminación según los criterios de inclusión y exclusión, finalmente, se incluyeron 59 artículos.
Desarrollo
Mecanismos moleculares y fisiopatológicos de la lesión cardiovascular en la COVID-19
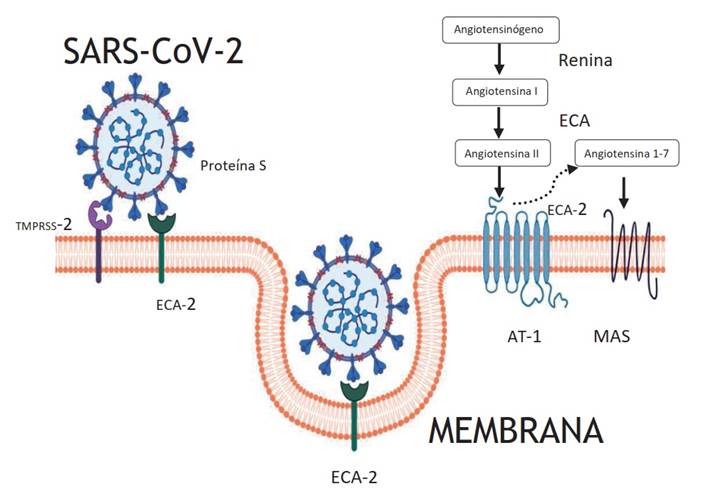
Se conoce que el SARS-CoV-2 ingresa a las células humanas gracias al tropismo por la enzima convertidora de angiotensina 2 (ECA 2). Esta proteína, que es una aminopeptidasa, se expresa ampliamente en órganos tales como pulmones, corazón, riñones e intestino, motivo por el cual la unión del virus a la ECA 2 altera la respuesta neurohumoral del sistema cardiovascular, renal y digestivo, por ende, trastorna las vías de señalización y ocasiona lesión directa sobre corazón, pulmones y otros órganos (Figura 1). El ligando del coronavirus que interactúa con la ECA 2 es la proteína de la espícula o proteína S, la cual tiene dos subunidades: la subunidad 1, que se une a la ECA 2, y la subunidad 2, que determina la fusión del virus con la membrana de la célula huésped 4,8,9.
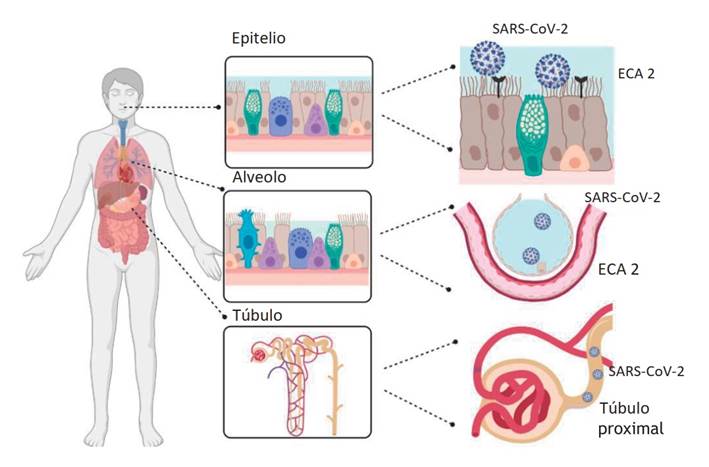
Figura 1 Representación del tropismo del SARS-CoV-2 por la ECA 2 en los diferentes sistemas corporales
Otra molécula importante en el ingreso del virus a las células huésped es la serina proteasa 2 transmembrana (TMPRSS-2), la cual media la escisión de la proteína S del virus. La unión del SARS-CoV-2 a la ECA 2 desencadena un cambio conformacional en la proteína S viral, lo que permite la degradación proteolítica por las TMPRSS-2, por tanto, expone una subunidad de la proteína S que permite su fusión directa a la membrana celular y facilita el ingreso del virus en el interior de la célula huésped (Figura 2) 10-12.
Es importante recordar que el sistema renina angiotensina aldosterona (SRAA) tiene un papel fundamental en el mantenimiento de la adecuada función cardiovascular, y su desregulación conduce a un espectro de enfermedades cardiovasculares, como la hipertensión, la cardiopatía coronaria, la miocarditis y la insuficiencia cardíaca congestiva 7,13-15. Las principales moléculas funcionales del SRAA son el angiotensinógeno, que se produce principalmente en el hígado (zimógeno transformado por la renina a angiotensina I [forma activa], que luego es degradada a angiotensina II por la ECA), y la angiotensina II, la molécula efectora más importante del SRAA (actúa sobre el receptor de angiotensina tipo 1 [RA-1], promueve la vasoconstricción, la retención de sodio, el estrés oxidativo, la inflamación y la fibrosis). Posteriormente, la ECA 2 degrada la angiotensina II y genera angiotensina 1-7, que antagoniza el efecto de la angiotensina II a través del receptor Mas, para promover la vasodilatación, la hipotensión, el efecto antinflamatorio, antiproliferativo y la apoptosis 16.
El SARS-CoV-2 no solo se une a la ECA 2, sino que se sabe que puede conducir a la disminución de la expresión de esta enzima y, a su vez, agravar la lesión pulmonar y cardíaca, pues no se daría la degradación a angiotensina 1-7. Por tanto, predominaría el efecto activo de la angiotensina II (especialmente sobre el RA-1), estimulando las proteínas quinasas activadas por mitógenos (MAPK), aumentando así la expresión de la ciclooxigenasa-2, la liberación de interleucina IL-8 y promoviendo la apoptosis. Esta es una situación que se traduce en una enfermedad de mayor gravedad en pacientes con patologías cardiovasculares preexistentes, y que puede atribuirse en gran parte a la señalización MAPK activada. Sin embargo, este mecanismo no está del todo descrito y los hallazgos que se conocen son asimilaciones que surgen del estudio de otros coronavirus, como el SARS-CoV-1 16,17.
No es solo el efecto sobre la ECA 2 lo que puede llevar a una lesión miocárdica, también hay que tener en cuenta que la COVID-19 grave se caracteriza por una tormenta de citocinas que dan paso a una inflamación sistémica, lo que genera un desbalance entre el suministro y la demanda cardio-metabólica que, asociada a la hipoxia de la enfermedad respiratoria concomitante, puede generar lesión miocárdica aguda 4. Es así como en las formas graves de COVID-19 se presenta una estimulación de la producción de interferón (IFN), secreción de interleucinas (IL), activación de granulocitos y producción de factor de necrosis tumoral (TNF). Estas moléculas tienen muchos mecanismos por los cuales pueden causar daño; por ejemplo, el IFN-γ, la IL-1β, la IL-6, la IL-17 y el TNF-α afectan al músculo esquelético al inducir la proteólisis de las fibras musculares y al disminuir la síntesis de proteínas. Además, la IL-1B y la IL-6 pueden causar fibrosis al aumentar la actividad de los fibroblastos musculares. También, la IL-1B y el TNF-α inhiben la diferenciación y proliferación de células satélite y células progenitoras, involucradas en el crecimiento de las fibras musculares. Por tanto, la disminución de la fuerza y resistencia muscular asociada a la COVID-19 podría ser consecuencia de la actividad de estas moléculas inflamatorias, lo que conduce a que el miocardio deba esforzarse más tratando de llevar nutrientes y oxígeno a estas fibras musculares enfermas y cansadas 4,18. De forma adicional, la angiotensina II estimula la proliferación de células T, que se encuentran en un estado de sobreactivación en personas con enfermedades cardiovasculares como la hipertensión. Estas células T se caracterizan por un fenotipo senescente con acortamiento de los telómeros, pérdida de los factores coestimuladores CD27 y CD28 y aumento del marcador de superficie CD57, con lo cual pierden la capacidad de participar en la activación clásica de la inflamación y se tornan obsoletas para combatir los virus 9,19. La angiotensina II también genera activación de las células natural killer y los monocitos, que poseen actividad citolítica y producen más liberación de citocinas. Además, en pacientes hipertensos, los monocitos tienen un fenotipo proinflamatorio que promueve las tormentas de citocinas y empeora los cuadros en sujetos con la COVID-19 4,9.
Adicionalmente, se ha propuesto que la inflamación sistémica, el estado protrombótico secundario a la inflamación y el aumento de la fricción dentro de las arterias coronarias como respuesta compensadora para intentar mejorar el aporte de oxígeno al miocardio ocasionan ruptura de placas ateromatosas, lo que desencadena eventos coronarios agudos de tipo infarto 4,20. Aunque en una menor proporción, el uso de fármacos sistémicos, como los corticoesteroides, y los desequilibrios electrolíticos propios de la enfermedad sistémica pueden precipitar la aparición de trastornos cronotrópicos como las arritmias, que se pueden generar secundarias a la hipopotasemia que se ha evidenciado en la COVID-19 4,21.
Riesgo y factores de riesgo asociados a desenlaces cardiovasculares a corto y mediano plazo durante la fase pos-COVID-19
En este punto es importante marcar una diferencia entre las personas con antecedentes de enfermedad cardiovascular previa a la infección por el SARS-CoV-2 y aquellas sin estos problemas de salud. Por ejemplo, en una persona con hipertensión arterial se presenta un estado inmunitario caracterizado por disfunción endotelial y estrés oxidativo, con gran expresión en las células endoteliales de la enzima ECA 2, la cual se ve alterada por el coronavirus, y genera una internalización y exfoliación de la enzima que conduce a la disminución de la angiotensina 1-7. Esta situación agrava la hipertensión y hará que la respuesta inflamatoria sea aún más intensa, como se expuso en el apartado anterior 9. Por lo tanto, los principales factores de riesgo para la lesión cardíaca aguda inducida por el SARS-CoV-2 incluyen el tabaquismo, el sexo masculino y las comorbilidades, especialmente la diabetes mellitus, la hipertensión arterial y la enfermedad coronaria 22.
Dentro de los desenlaces a corto plazo destaca la insuficiencia cardiaca, que se reporta hasta en un 24 % de los pacientes, seguida por el tromboembolismo venoso, que se ha identificado en el 21 % de los casos, y en menor medida, las arritmias y miocarditis en un 17 % y 7 % de los pacientes, respectivamente 22. Ahora bien, el infarto agudo de miocardio, facilitado por la interacción entre la ateroesclerosis de las coronarias y el estado proinflamatorio de la COVID-19, se ha reportado hasta en el 9 % de los pacientes, y el riesgo es 5 veces mayor durante la primera semana de síntomas de la enfermedad viral 13,22. También los infartos del miocardio de tipo 2, causados por el desequilibrio entre el suministro de oxígeno miocárdico deficiente y una demanda metabólica aumentada, debido a condiciones patológicas cardíacas y no cardíacas durante la COVID-19, son una importante causa en el mecanismo de esta patología 16,22.
En aquellos pacientes que superan la fase activa de la COVID-19, puede aparecer una insuficiencia cardiaca, ya sea por descompensación de una patología cardiaca previa o como consecuencia de una lesión isquémica aguda durante el cuadro viral. La patogenia de la disfunción miocárdica por el SARS-CoV-2 está estrechamente relacionada con las citocinas inflamatorias. De esta forma, se puede generar un aumento de la rigidez miocárdica, mediada por la interleucina 6, o la aparición de efectos inotrópicos negativos facilitados por la interleucina-1β o la fibrosis miocárdica, inducida también por la IL-1β y el factor de necrosis tumoral alfa 9,13,22.
La miocarditis que se presenta en la COVID-19 tiene tres mecanismos fisiopatológicos: 1) la invasión directa de los cardiomiocitos por el virus, 2) la consiguiente lesión dada por citotoxicidad de las células T y 3) los efectos inotrópicos negativos de las citoquinas activadas en la cascada de la inflamación. Además, los mecanismos autoinmunitarios, desencadenados como respuesta a la liberación de antígenos crípticos de los cardiomiocitos después de las lesiones inducidas por el SARS-CoV-2, también pueden potenciar el desarrollo de miocarditis; pero aún no está claro en qué medida la miocarditis es causada por daño miocárdico viral directo o si solo es una consecuencia de la inflamación sistémica 18,22,23.
La miocardiopatía por estrés o síndrome de tako-tsubo también ha sido descrita, especialmente por activación simpática sostenida como respuesta a la angustia y el estrés que causa aturdimiento del miocárdico inducido por catecolaminas y, además, disfunción microvascular transitoria, que se observa con mayor frecuencia en mujeres de edad avanzada. Un estudio demostró que esta situación de aumento de las catecolaminas por tormenta de citoquinas induce un aumento significativo de la presión arterial, en comparación con pacientes no críticos, por ejemplo, aquellos en hospitalización convencional y no en unidades de cuidados intensivos (145 mmHg vs. 122 mmHg; p < 0,001). Curiosamente, este patrón hipertensivo en pacientes con formas graves de COVID-19 en realidad se asocia con un mejor pronóstico, una menor necesidad de soporte inotrópico y un menor riesgo de desarrollar shock cardiogénico o disfunción multiorgánica 22,24,25.
Las arritmias, por su parte, se ven facilitadas por las alteraciones metabólicas, la hipoxia y la inflamación miocárdica acentuada. Varios manuscritos han señalado cómo las arritmias cardiacas se han desarrollado hasta en un 17 % de los pacientes hospitalizados; asimismo, en un menor porcentaje, se han reportado arritmias malignas potencialmente mortales como son la taquicardia ventricular y la fibrilación ventricular, específicamente en pacientes con altos niveles de troponina T durante la hospitalización (p < 0,001); igualmente, se ha considerado que los sujetos con síndromes de arritmia hereditarias, incluidos el síndrome de QT largo y corto, el síndrome de Brugada y la taquicardia ventricular polimórfica catecolaminérgica, son más susceptibles a los efectos proarrítmicos del SARS-CoV-2, mediados por el estrés, la fiebre, el uso de medicamentos antivirales y las alteraciones electrolíticas 26-30.
El riesgo tromboembólico también se hace latente en los pacientes con la COVID-19, específicamente manifestándose con afectación a nivel de las extremidades inferiores, arterias cerebrales y coronarias 31,32. Estudios han mostrado tasas de incidencia de trombosis venosa y embolia pulmonar de hasta el 27 %, y de trombosis arterial en cerca del 5 % de los pacientes admitidos en unidades de cuidados intensivos; incluso, varios reportes de autopsia evidenciaron trombos en los vasos pulmonares, que pueden ser émbolos grandes proximales, pero que se identifican con mayor frecuencia en forma de microtrombos, con reportes histológicos de cambios inflamatorios, caracterizados por infiltrados de células mononucleares, células infectadas por el virus y daño alveolar difuso 31,33,34. A nivel clínico, estos pacientes se presentan con biomarcadores de activación endotelial muy elevados, por ejemplo, marcadas alzas del dímero D, esencialmente en pacientes graves en quienes parece ser un factor predictor de peor resultado clínico 30,35-37.
Finalmente, el shock cardiogénico es una de las complicaciones más graves de la COVID-19. La literatura científica ha reportado el caso de un individuo de 69 años en quien se observaron marcadores inflamatorios elevados y troponina I hipersensible aumentada antes del desarrollo de shock cardiogénico. El shock cardiogénico se puede mezclar con otros tipos de shock después de la infección por el SARS-CoV-2; por ejemplo, se puede combinar con shock distributivo, pero que finalmente cae en la misma secuencia de hipoperfusión, hipotensión y desbalance entre la demanda y el consumo de oxígeno de los tejidos, que, de no corregirse, se torna mortal. El trabajo de Wang et al. 30 confirmó la presencia de este tipo de shock en el 8,7 % de los pacientes, que fue más común en aquellos ingresados en las unidades de cuidados intensivos, en comparación con sujetos que estaban en hospitalización convencional (30,6 % vs. 1,0 %; p < 0,001) 28,30,38-40.
Síndrome cardiovascular pos-COVID-19: ¿qué se ha descrito?
Una vez superada la fase aguda de la COVID-19, se genera la incertidumbre de qué sucede a nivel cardiovascular con las personas afectadas por esta enfermedad. Pues bien, estudios de autopsia han reportado cambios conformacionales a nivel cardiaco en personas en quienes no se había evidenciado una clara patología cardiovascular: aunque no se reportó una miocarditis propiamente establecida, sí se encontró replicación viral en el miocardio de los fallecidos, con alta expresión de citocinas luego de la fase activa de la COVID-19. A este tipo de lesión miocárdica, silente pero progresiva, se le puede asociar con el subsiguiente desarrollo de una insuficiencia cardiaca, lo cual ha sido respaldado por otros estudios donde, a través de una resonancia cardiaca de seguimiento, se ha demostrado afectación en cerca del 80 % de los pacientes, independientemente de la gravedad y el curso general de la fase aguda de la COVID-19 41-44. Un estudio que evaluó a 1733 sujetos seis meses después del alta hospitalaria por COVID-19, encontró que los principales síntomas posteriores a la fase aguda fueron fatiga y debilidad muscular en el 63 % de los casos, dificultad para dormir en el 26 % y ansiedad-depresión en el 23 %. Si bien los síntomas cardiovasculares no fueron establecidos propiamente como tales, queda en duda el compromiso de estos en la aparición de las anteriores molestias, pues la dificultad para dormir podría ser manifestación de ortopnea y debilidad muscular de un miocardio debilitado, ambos síntomas correspondientes a insuficiencia cardiaca 13,36,45.
El síndrome pos-COVID-19, en general, se define como la aparición o persistencia de los síntomas posteriores a 3 o 4 semanas de aparecida la fase aguda de la enfermedad. Un estudio de seguimiento de 384 pacientes hospitalizados por COVID-19 mostró que las elevaciones de dímero D, ferritina y proteína C reactiva se normalizaron dentro de los 2 meses posteriores al alta. Las radiografías de tórax permanecieron anormales o empeoraron en cerca del 10 % de los pacientes y, en contraste, la fatiga y la dificultad para respirar estaban presentes en casi dos tercios de los pacientes 46,47. El síndrome pos-COVID-19 tiende a ser prolongado en el tiempo; un estudio reportó que el 76 % de los pacientes tenían al menos un síntoma de la persistencia de esta patología por una media de 186 días desde el alta hospitalaria, y el más prevalente fue el desacondicionamiento físico, manifestado por fatiga y debilidad muscular, que se evidenció con tiempos de caminata de 6 minutos por debajo de lo normal previsto, según la edad de los sujetos 45,46.
Respecto del síndrome cardiovascular pos-COVID-19, los síntomas más comunes son el dolor torácico, la opresión, las palpitaciones, los mareos y el aumento de la frecuencia cardíaca en reposo. Aunque no se ha establecido el vínculo fisiopatológico, varias afectaciones pueden estar relacionadas y se describen a continuación 46. La miocarditis pos-COVID-19 empezó a ser llamativa a mediados del 2020, con el surgimiento de varios reportes en la literatura; por ejemplo, en un estudio de 29 pacientes hospitalizados por COVID-19 con troponina elevada de causa desconocida, el 45 % tenía realce tardío de gadolinio en un patrón no isquémico "similar a miocarditis" en la resonancia magnética cardíaca aproximadamente 27 días después del alta, pero con ecocardiograma que mostraba fracción de eyección del ventrículo izquierdo normal, sin anomalías en el movimiento de las paredes ventriculares, con lo cual se descartaba la insuficiencia cardiaca 46,48. Otros estudios con resonancia magnética han informado, en pacientes 6 meses después del alta, la persistencia de edema miocárdico y fibrosis; sin embargo, ninguno de los pacientes informó síntomas relacionados con el sistema cardiovascular durante el seguimiento 49,50.
Otro fenotipo descrito, pero relacionado, es el síndrome de taquicardia ortostática postural (STOP), que consiste en el aumento de la frecuencia cardíaca sin cambios en la presión arterial al pasar de una posición reclinada a una posición erguida. El STOP se ha implicado anteriormente en la sintomatología posviral persistente de cualquier causa, y se cree que más del 40 % de los casos están asociados con autoinmunidad inducida o mimetismo molecular. Se ha sugerido que STOP en el pos-COVID-19 es una posible etiología de los síntomas de dolor torácico, palpitaciones y mareos en los pacientes 51,52. Las arritmias pos-COVID-19 no están del todo claras, la más estudiada ha sido el STOP. Sin embargo, una revisión mostró una incidencia de arritmia 1,7 veces mayor a los 6 meses posteriores a la COVID-19 en pacientes no hospitalizados, en comparación con los controles emparejados; pero se desconoce si esto se debió a una carga de arritmia verdaderamente mayor o a una tasa más alta de detección en la cohorte de los pacientes que tuvieron COVID-19 53.
En términos generales, la pericarditis en la población es idiopática, pero la opinión predominante es que estos casos pueden ser secuelas de infecciones virales. En pacientes hospitalizados con COVID-19, los cambios agudos difusos del ST compatibles con pericarditis fueron notorios hasta en el 12 % de los sujetos incluidos en un estudio. Además, el trabajo de Clark et al. 50 encontró solo un caso de pericarditis 50,54. Kotecha et al. 55 y Moulson et al. 56 informaron una incidencia del 5 % de derrame pericárdico, en su mayoría de tamaño pequeño, en individuos en el período posagudo de COVID-19, pero se sabe que la pericarditis, especialmente con síntomas, es más rara 55,56.
Recomendaciones actuales para mitigar el riesgo cardiovascular y perspectivas futuras
La rehabilitación se ha sugerido como una importante herramienta para tratar las consecuencias posteriores a la COVID-19; en ese sentido, se recomienda que los pacientes realicen ejercicios aeróbicos ligeros a un ritmo acorde a la capacidad individual y se vayan aumentando en intensidad de forma gradual, hasta que se observen mejoras en la fatiga y la disnea, lo cual ocurre generalmente de cuatro a seis semanas. La rehabilitación también debe incluir ejercicios de respiración para fortalecer la eficiencia de los músculos respiratorios, especialmente el diafragma. Dichos ejercicios aeróbicos y respiratorios ligeros deben realizarse diariamente en sesiones de 5 a 10 minutos a lo largo del día. La modificación del comportamiento y el apoyo psicológico complementarios también pueden ayudar a mejorar el bienestar y la salud mental de los individuos 57-59. En cuanto a la evaluación de las patologías y riesgo cardiovascular pos-COVID-19, se debe tamizar a todos los pacientes, idealmente una semana luego del alta hospitalaria, al menos con un electrocardiograma de 12 derivaciones y una radiografía de tórax; y en aquellos con síntomas de insuficiencia cardiaca o pericarditis, debe ampliarse el estudio con ecocardiograma transtorácico o resonancia magnética, según la disponibilidad en los servicios. Asimismo, resulta importante evaluar el riesgo de coronariopatía posterior al COVID-19, así como tamizar la hipertensión que puede desarrollarse, por lo cual se sugiere tamizajes de presión arterial seriados y control de lípidos en sangre 4,46,51.
Es necesario divulgar la necesidad e impacto de poseer evidencia de calidad que permita el control de una condición que genera carga de enfermedad y elevados costos en salud, así como afectación de la calidad de vida de aquellos que padecen de las secuelas cardiovasculares o de otro órgano posteriores a la COVID-19 60-62. Por lo tanto, es imperativo diseñar equipos multidisciplinarios en la búsqueda y seguimiento estricto de estos pacientes, para obtener datos de calidad que permitan desarrollar soluciones prácticas y costo-efectivas.
Conclusiones
El riesgo cardiovascular en pacientes recuperados de COVID-19 a corto y mediano plazo sigue siendo un ámbito en estudio; el enfoque correcto debe ir encaminado a la rápida detección de alteraciones cardiovasculares una vez concluida la fase aguda de la COVID-19. Se entiende que durante la hospitalización de un paciente por este cuadro viral se harán los estudios pertinentes para evaluar la función cardiovascular durante la estadía intrahospitalaria; pero los pacientes que no precisaron de internación clínica y aquellos que son dados de alta deben recibir una rehabilitación y una estratificación cardiovascular encaminada a la detección temprana de alteraciones como las arritmias, la insuficiencia cardiaca, la pericarditis o la miocarditis.
Sería pertinente iniciar la evaluación con exámenes de rápido acceso como el electrocardiograma y la radiografía de tórax; pero debe evaluarse la necesidad particular de estudios más avanzados como el ecocardiograma o la resonancia magnética, los cuales quedarán a criterio del profesional médico tratante. Sin embargo, la invitación es a tomar en consideración las altas tasas de alteraciones cardiovasculares posteriores a la COVID-19 y, por tanto, a no pasar por alto la estratificación en estos pacientes. A futuro, con el surgimiento de estudios de seguimiento, se podrá conocer el real impacto del síndrome cardiovascular pos-COVID-19 y, por ende, es importante invitar a los profesionales de la salud a realizar este tipo de trabajos de investigación.