Introducción
La primera vez que se sugirió la existencia de los radicales libres en una reacción química fue aquella propuesta por Moses Gomberg 1 cuando realizaba la síntesis de tetrafenilmetano. Un radical libre es una molécula caracterizada por tener un electrón desapareado en su orbital externo. Estudios vinculados al efecto del oxígeno sobre las enzimas pepsina, catalasa, colinesterasa y anhidrasa carbónica mostraron que eran afectadas por el oxígeno 2; así mismo, la exposición de ratas a un ambiente con oxígeno puro 3 les produjo la muerte a los tres días, efecto que no pudo adscribirse a los radicales libres por la carencia de un apropiado sustento científico; posteriormente se sugirió la posible transferencia de un solo electrón al oxígeno 4 y la formación del anión superóxido en la cadena respiratoria mitocondrial. En un artículo sobre la teoría del envejecimiento se propuso que el efecto dañino que ejercían los rayos X sobre tejidos animales 5 ocurriría a través de la generación del radical hidroxilo. Posteriormente, se evidenció la existencia del radical hidroxilo (HO•), anión superóxido (O₂•-), radical peroxilo (ROO•), etc., a los que se les denominó especies reactivas de oxígeno 6, mientras que al óxido nítrico (NO•) y al dióxido de nitrógeno (NO₂•) se les identificó como especies reactivas de nitrógeno, y al radical tiilo (RS•), como especies reactivas de azufre, etc.
Diversos estudios epidemiológicos muestran la estrecha relación que existe entre el estrés oxidativo y las enfermedades crónicas no transmisibles como cáncer, diabetes mellitus, psoriasis, aterosclerosis, etc. El estrés oxidativo es una condición de desequilibrio entre la generación de radicales libres y la defensa antioxidante con predominio de los primeros; esta situación ocurre pese a que el ser humano dispone de una defensa antioxidante que no es del todo eficiente 6-8, para lo cual es necesario que ingiera alimentos que posean sustancias con propiedades antioxidantes. El propósito de esta revisión narrativa consiste en proporcionar el conocimiento sobre los procesos que conducen a la generación de radicales libres, así como de los sistemas de defensa antioxidante.
Estrategia de búsqueda
La estrategia utilizada para la elaboración de la presente revisión consistió en realizar una búsqueda en las bases de datos Google Académico, PubMed y Scielo, sin limitación de tiempo, en la que se consideró revisiones y artículos de investigación, habiéndose utilizado los términos en inglés y español: free radicals, reactive oxygen species, antioxidants, oxidative stress, radicales libres, especies reactivas de oxígeno, antioxidantes y estrés oxidativo.
Generación de radicales libres
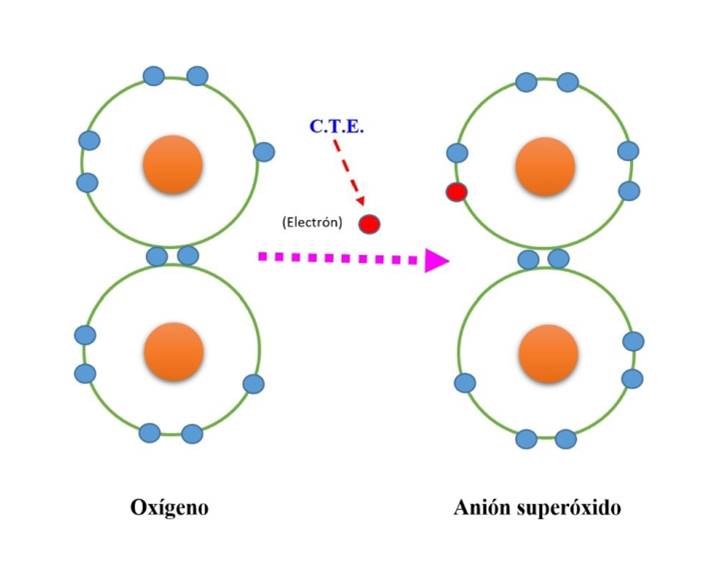
En el ser humano, los radicales libres se generan en la cadena transportadora de electrones mitocondrial con la participación de los complejos respiratorios I y III 9, que ceden un electrón al oxígeno transformándolo en anión superóxido (Figura 1).
Los radicales libres se generan discretamente durante la actividad física moderada y se incrementan durante la actividad física vigorosa 10-12. La fructosa es un carbohidrato que se metaboliza principalmente en el hígado y, debido a que carece de un adecuado proceso de regulación metabólica, ejerce una elevada presión de electrones a nivel mitocondrial, aumentando la generación de radicales libres. Este efecto se encuentra estrechamente vinculado con patologías como obesidad, diabetes mellitus, hipertensión arterial, etc. 13-17.
El anión superóxido es un radical libre que se origina en la mitocondria 18 y que es transformado por la enzima superóxido dismutasa (SOD) 19 en peróxido de hidrógeno y oxígeno (Ecuación 1):
El óxido nítrico (NO•) 20 es sintetizado por la óxido nítrico sintasa y tiene la propiedad de reaccionar con el anión superóxido y generar peroxinitrito, un compuesto poco activo en medio acuoso, pero que puede tornarse muy reactivo cuando ingresa a la membrana lipídica. El peroxinitrito no es propiamente un radical libre (Ecuación 2):
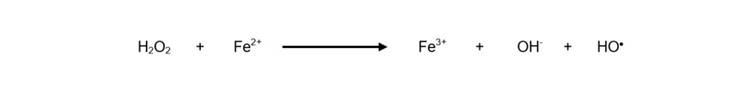
También se ha descrito la reacción que ocurre entre el anión superóxido y el peróxido de hidrógeno en presencia de ion férrico (Fe3+) como catalizador 21 formando el radical hidroxilo (Ecuación 3):
En el proceso de isquemia/reperfusión 22, caracterizado por una deficiencia de oxígeno a nivel celular, se degrada el ATP hasta formar hipoxantina; en esta situación, la xantina deshidrogenasa es convertida en xantina oxidasa. Luego, cuando ocurre la reperfusión, esta enzima reacciona con la hipoxantina y el oxígeno, formando xantina y anión superóxido. Posteriormente, reacciona con la xantina y otra molécula de oxígeno, generando ácido úrico y anión superóxido.
La NADPH oxidasa (NOX) 23 es una enzima que tiene la propiedad de oxidar la coenzima NADPH, formando como producto el anión superóxido, y contribuye a la regulación del tono vascular, participa en el "estallido respiratorio", etc., reacciones que utilizan las células fagocitarias para destruir patógenos, motivo por el cual un defecto en la expresión de una de sus subunidades puede conducir al desarrollo de la enfermedad granulomatosa crónica y la aterosclerosis. (Ecuación 4)
El radical hidroxilo es el más nocivo para el ser humano. Se genera de muy diversas maneras, y la más importante es aquella conocida como reacción de Haber-Weiss-Fenton 24, que se desarrolla en dos etapas, la primera descrita anteriormente, en la que el Fe3+ interacciona con el O₂•formando Fe2+, y la segunda reacción se muestra a continuación. (Ecuación 5)
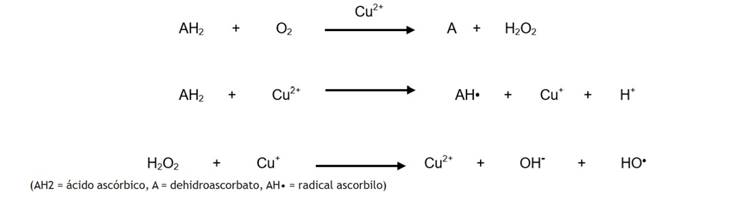
La vitamina C es conocida por sus propiedades antioxidantes, pero puede comportarse como prooxidante 25 en presencia de metales de transición como el Fe3+ o el Cu2+ (Ecuación 6):
Se ha observado que el jarabe de sulfato ferroso utilizado para el tratamiento de la anemia ferropénica en presencia de vitamina C incrementa la formación de especies reactivas al ácido tiobarbitúrico (TBARS) 26, es decir, aumenta la generación de radicales libres; así mismo, cuando se administró sulfato ferroso y vitamina C a ratas albinas 27, todos los animales presentaron daño hepatocelular, resultado que permite sugerir que a las personas que se les prescribe sulfato ferroso y jugo de naranja o limonada, por su contenido de vitamina C para mejorar la absorción de fierro, podría causarles daño hepático. También, se ha observado que la administración de sulfato ferroso a madres gestantes 28 produjo daño oxidativo, efecto que probablemente haya ocurrido como consecuencia de la generación de radicales libres.
La mieloperoxidasa 29 es una enzima que está localizada en los gránulos de los neutrófilos y tiene la propiedad de formar ácido hipocloroso a través de la siguiente reacción (Ecuación 7):
El ácido hipocloroso formado puede reaccionar con el anión superóxido y generar el radical hidroxilo (Ecuación 8):
También es necesario considerar que algunos medicamentos, el humo del cigarrillo y la contaminación ambiental 30 generan radicales libres y sustancias nocivas para el organismo; por este motivo, sugerimos que es más apropiado designarlas como "especies biológicamente reactivas" (EBR), ya que existen sustancias que no son propiamente radicales libres y producen daño.
Sistema antioxidante
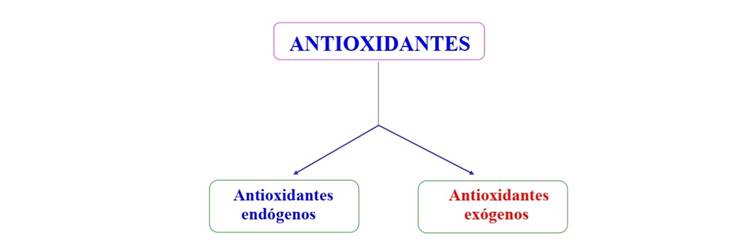
El ser humano dispone de un sistema antioxidante constituido por sustancias que sintetiza y por los compuestos antioxidantes que ingiere con su dieta (Figura 2); en este sentido, podríamos denominar antioxidante endógeno a aquellos compuestos que son sintetizados por la célula y antioxidante exógeno a aquellas sustancias que se incorporan con la alimentación.
Sistema antioxidante endógeno enzimático
Los componentes de este sistema comprenden las enzimas siguientes:
Superóxido dismutasa (SOD) 31. Esta enzima tiene la propiedad de convertir el anión superóxido en peróxido de hidrógeno. Existen tres isoformas: la SOD1 (Cu/Zn) es la principal isoforma que reacciona con el O₂•en el citosol y el espacio intermembrana mitocondrial; SOD2 (Mn), encargada de reaccionar en la matriz mitocondrial con el O₂ •-, y la SOD 3 (Cu/Zn), que se encuentra localizada en el líquido extracelular.
Glutatión peroxidasa (GPX) 32. Tiene la propiedad de reaccionar con el H₂O₂ y eliminar hidroperóxidos, compuestos que se forman durante las reacciones de oxidación de los lípidos; esta enzima requiere glutatión (GSH) y selenio para su actividad. Se han descrito varias isoformas, y la GPX1 es la más abundante.
Tiorredoxina (TRX) 33. Es una tiol-disulfuro oxidorreductasa que tiene la propiedad de reducir otras proteínas como el ribonucleótido reductasa y diversas peroxidasas; la TRX1 es de localización citosólica y extracelular, mientras la TRX2 se localiza en la mitocondria.
Peroxirredoxina (Prx) 30. Es otra enzima antioxidante que tiene la propiedad de catalizar la reducción del peróxido de hidrógeno e hidroperóxidos, formando agua y alcohol, respectivamente, asimismo, regula la concentración de peróxido de hidrógeno, propiedad que le permite modular las vías de señalización celular en las que participan el TNF-α y factores de crecimiento. Se presenta en tres tipos distintos: Prx 1, Prx 2 y Prx 3.
Catalasa (CAT) 34. Esta enzima, caracterizada por ser de amplia distribución en el ser humano, encontrándose preferencialmente en el hígado y riñones, tiene una actividad catalítica muy elevada al descomponer el peróxido de hidrógeno en agua y oxígeno, aunque a bajas concentraciones de peróxido de hidrógeno la catalasa puede oxidar a compuestos fenólicos, constituyendo este tipo de catálisis su actividad peroxidásica.
Glutatión reductasa 35. Tiene la propiedad de reducir el glutatión oxidado (GSSG) y formar dos moléculas de glutatión reducido (GSH) con la activa participación del cofactor NADPH. Esta enzima es muy importante por su propiedad de reconstituir el GSH, ya que cuando se eleva la relación GSSG/GSH se torna tóxica para la célula. Los niveles de GSH son muy importantes para que la glutatión peroxidasa pueda eliminar eficientemente el peróxido de hidrógeno.
Glutarredoxina (Glrx) 36. Es la enzima cuya propiedad consiste en separar el glutatión de la proteína a la que se encuentra unido, permitiendo que las proteínas dispongan de sus grupos sulfhidrilo libres. Esta enzima y la glutatión S-transferasa son claves en el mantenimiento del ciclo de señalización redox celular, superponiéndose su acción con la actividad de las tiorredoxinas. Tiene la propiedad de participar en el control de la apoptosis, para cuya finalidad inhibe Fas y activa Akt y NF-kB.
Tiorredoxina reductasa (TrxR) 37. Es una de las enzimas antioxidantes que tienen la propiedad de reducir la tiorredoxina (TRX) y la proteína disulfuro isomerasa (PDI) utilizando como coenzima a la NADPH; en su sitio activo también tiene los cofactores Se y FAD. Existen varias isoformas de tiorredoxina reductasa, la TrxR1, que tiene localización citosólica; la TrxR3, que se localiza en la mitocondria, y la tiorredoxina glutatión reductasa (TGR), que se localiza en el testículo de manera específica.
Sistema antioxidante endógeno no enzimático
Este sistema está constituido por una diversidad de antioxidantes como el glutatión (GSH), sustancia que se encuentra en concentraciones elevadas en el hígado 5 a 10 mM, mientras que en el plasma es aproximadamente de 20 µM 38; es utilizado por la glutatión peroxidasa para eliminar hidroperóxidos, reacción en la que es convertido en glutatión oxidado (GSSG), compuesto que, necesariamente, debe reducirse para regenerar GSH, para cuyo propósito se requiere de la glutatión reductasa y la NADPH. La mioglobina es una proteína cuya principal función es la de almacenar oxígeno en el tejido muscular, habiéndose descrito que tiene la propiedad de neutralizar la acción del radical libre óxido nítrico 39. Una de las más importantes funciones de la ferritina es el mantenimiento del balance intracelular del fierro, de esta manera impide que este metal genere radicales libres 40. Las metalotioneínas son proteínas de bajo peso molecular caracterizadas por tener varios grupos sulfhidrilo que les permiten reaccionar con el anión superóxido y radicales hidroxilos 41. La CoQ participa en el transporte mitocondrial de electrones y tiene la propiedad de reaccionar con el oxígeno molecular y diversos radicales libres 42. Las poliaminas comprenden a compuestos como la espermina, espermidina y putrescina 43, los que tienen la propiedad de proteger las membranas celulares del radical peroxilo, peróxido de hidrógeno, radical superóxido, etc. La melatonina 44 tiene la propiedad de bloquear la acción nociva del radical hidroxilo, el óxido nítrico y el peroxinitrito.
La transferrina 45 es una glicoproteína que tiene la propiedad de ligarse al hierro trivalente con una elevada constante de unión, de esta manera impide que el hierro pueda intervenir en reacciones que forman radical hidroxilo; así mismo, la ceruloplasmina 46, otra de las proteínas que circulan en el plasma, tiene como función transportar cobre, un metal que genera radical hidroxilo cuando reacciona con el peróxido de hidrógeno. El ácido úrico 47 es el producto final del metabolismo de las purinas, tiene la propiedad de comportarse como un eficiente antioxidante, lo que le permite bloquear el radical hidroxilo, peroxinitrito y peróxidos lipídicos. La albúmina 48 es un componente de las proteínas plasmáticas que cumple múltiples funciones, una de estas propiedades está vinculada con la actividad antioxidante gracias a sus grupos sulfhidrilo; así mismo, se ha descrito que la bilirrubina 49 posee una elevada acción antioxidante, de manera análoga la lactoferrina 50.
Antioxidantes exógenos
El ser humano puede incrementar su defensa antioxidante ingiriendo frutas y verduras, alimentos ricos en sustancias antioxidantes. Estos compuestos (Figura 3) son numerosos y sus propiedades antioxidantes aún no han sido estudiadas en su totalidad, pero han mostrado tener efectos muy beneficiosos para la salud 51.
Este grupo incluye a los polifenoles, carotenoides, algunas vitaminas, elementos traza, etc. Los polifenoles 52 son compuestos orgánicos caracterizados por poseer anillos aromáticos con uno o varios grupos fenólicos que se encuentran de manera natural en los vegetales; su efecto está estrechamente relacionado con la prevención de enfermedades crónicas no transmisibles como cáncer, psoriasis, aterosclerosis, diabetes mellitus, hipertensión arterial, obesidad, etc. Se han identificado más de cuatro mil clases de polifenoles, y se ha podido distinguir químicamente en este grupo a moléculas tales como los ácidos fenólicos, grupo constituido por los derivados del ácido benzoico y del ácido cinámico; así mismo, se ha conseguido diferenciar polifenoles con estructuras ligeramente diferentes como los estilbenos, lignanos y flavonoides.
Las frutas y verduras son fuentes importantes de polifenoles, particularmente los derivados del ácido hidroxibenzoico, como el ácido gálico 53, que se encuentra en la grosella negra; el ácido protocaquético, en la mora y, especialmente, en las hojas del té, que pueden contener hasta 4,5 g/kg de hojas frescas, etc. Los derivados del ácido hidroxicinámico, como el ácido cumárico, se encuentra en la ciruela, kiwi y café; el ácido clorogénico, en la cereza; el ácido sinápico, en la manzana, pera, papa, café, etc.; así mismo, el ácido ferúlico 54 se encuentra especialmente en los cereales como el trigo, arroz, avena, maíz, etc.
Los estilbenos 55 son un pequeño grupo de polifenoles cuyo principal representante es el resveratrol, un antioxidante muy eficiente que se encuentra especialmente en la uva negra, que también es posible encontrarlo en la mora y los arándanos. Otro grupo importante de polifenoles son los lignanos 56, de los cuales uno de los compuestos más conocidos es el secoisolarisirecinol, que se encuentra en la linaza, aunque también se ha identificado en cereales, frutas y verduras, pero en cantidades muy bajas.
Los flavonoides constituyen un grupo muy importante de compuestos naturales con propiedades antioxidantes, cuyo estudio ha recibido preferencial atención. Estos compuestos químicos pueden dividirse en seis grandes subgrupos: flavonoles, flavanonas, flavonas, flavanoles, isoflavonas y antocianidinas.
Los flavonoles como la rutina, isorhamnetina, miricetina, quercetina, etc., corresponden a un importante subgrupo de flavonoides que se encuentran en muchas frutas y verduras como repollo, cebolla, brócoli, perejil, tomate, uvas, mora, bayas, manzana, frambuesa, etc., así como también en el vino tinto, té negro y té verde 57. Otro de los subgrupos de los flavonoides son las flavanonas 58, compuestos que le confieren importantes propiedades antioxidantes al pomelo, mandarina, tangelo, limón, naranja dulce, etc.
Las flavonas 59 conforman otro subgrupo importante de flavonoides que se encuentran en diversos alimentos como naranja, manzana, perejil, té, manzanilla, apio, brócoli, arroz, zanahoria, cebolla, repollo, maíz, etc. Los flavanoles 60 también son un subgrupo con importantes efectos antioxidantes, se encuentran en cereales como kiwi, mora, frambuesa, té negro, té verde, cocoa, vino tinto, chocolate, etc.
Otro de los flavonoides de considerable importancia son las antocianidinas 61, que tienen la particularidad de conferir colores a los alimentos que lo contienen, como mora, arándanos, nueces, cocoa, cereza, fresa, col roja, uva negra, etc. También es importante mencionar a las isoflavonas 62, que se encuentran en las arvejas, semillas de girasol, garbanzos, habas, soya, frijoles negros, etc.
Los carotenoides 63 son compuestos químicos caracterizados por ser liposolubles debido a que tienen una estructura constituida por una larga cadena hidrocarbonada eminentemente hidrofóbica, salvo las xantófilas, que tienen uno o más átomos de oxígeno. Estos compuestos están constituidos por dos subgrupos, los carotenos y las xantófilas. Los carotenos se presentan bajo la forma de α-caroteno, β-caroteno, γ-caroteno y licopeno, y se encuentran en alimentos como calabaza, zanahoria, tomate, espinaca, brócoli, lechuga, mango, sandía, etc., mientras que las xantófilas, que comprenden compuestos como zeaxantina, luteína, β-criptoxantina, violaxantina y zeinoxantina, están presentes en la espinaca, maíz, naranja, tomate, lechuga, espinaca, etc.
La vitamina C 64 es un compuesto hidrosoluble que el ser humano debe ingerir necesariamente con su dieta, se absorbe a nivel intestinal con la participación del cotransportador de sodio y vitamina C (SVCT), participa en los procesos de absorción de hierro no hemo a nivel intestinal, facilita el transporte de glucosa a través de membrana, interviene en la captación de hierro ligado a la transferrina, en la homeostasis del hierro, hidroxilación del colágeno, biosíntesis de carnitina, norepinefrina, metabolismo de la tirosina, reciclaje de la vitamina E, reciclaje de la tetrahidrobiopterina, metabolismo del colesterol, etc. Es un potente agente antioxidante que tiene la propiedad de reducir el proceso de lipoperoxidación, disminuir la oxidación de las proteínas y ADN por acción de los radicales libres.
Las fuentes 65 más importantes de vitamina C entre las verduras son el berro, brócoli, col silvestre, kailán, rabicol, pimiento, etc., mientras que entre los frutos tenemos al camu camu, que tiene un elevadísimo contenido de esta vitamina (2780 mg/100g), guayaba, naranja, marañón, shiraca, tumbo serrano, fresa, lima, limón, toronja, etc.
La vitamina E 66 es un antioxidante liposoluble natural que químicamente corresponde a los compuestos denominados tocoferoles, de los cuales el α-tocoferol es el que presenta mayor capacidad antioxidante. Esta vitamina tiene la propiedad de interrumpir la propagación de la reacción en cadena, ocasionada por radicales libres, que ocurre en la membrana mitocondrial y en el retículo endoplásmico; reacciona preferencialmente con las lecitinas, y las protege del daño oxidativo producido por radicales libres. Los procesos mecanísticos de las reacciones en que participa la vitamina E son muy complejos, en estas reacciones la vitamina E se convierte en radical α-tocoferoxilo, el cual ulteriormente puede transformarse nuevamente en vitamina E con participación de la vitamina C 67. Las fuentes más importantes de vitamina E 68 son el aceite de maíz, aceite de girasol, aceite de soya, maní, avellana, semillas de girasol, yema de huevo, palta, nueces, frijoles y entre los pescados, el bonito y el jurel.
Conclusiones
Los radicales libres son compuestos que se generan en el ser humano a través de múltiples reacciones de índole enzimático y no enzimático; estas sustancias se caracterizan por tener una elevada reactividad, por cuyo motivo reaccionan muy rápidamente con proteínas, lípidos y ácidos nucleicos, por tanto, ocasionan daño a las estructuras celulares; estos efectos están relacionados con una diversidad de enfermedades crónicas no transmisibles.
Para evitar la generación y propagación de los radicales libres, las células y los tejidos disponen de un sistema antioxidante que ejerce un efecto protector cuya eficiencia depende de la naturaleza de sus componentes y de su localización en los tejidos, en tal sentido, resulta de particular interés el estudio de los procesos mecanísticos de la manera cómo opera el sistema antioxidante. La eficacia de la defensa antioxidante puede incrementarse con la ingesta de sustancias antioxidantes que se encuentran en las frutas y verduras.











 texto em
texto em