Introducción
La enfermedad por esteatohepatitis no alcohólica (EHGNA) se presenta debido al depósito de macrovesículas de triglicéridos en el hígado, y se excluye otras etiologías como alcohólica, medicamentosa o secundaria a trastornos genéticos.
Este trastorno afecta a una cuarta parte de los adultos a nivel global; representa una importante carga sanitaria y económica para todas las sociedades y, sin embargo, no tiene un tratamiento de tipo farmacológico óptimo. La prevalencia de esta enfermedad se ha visto incrementada por el estilo de vida sedentario, los bajos niveles de actividad física, el exceso de ingesta de calorías en relación con estilos de alimentación nutricionalmente desequilibrados y poco saludables 1.
La EHGNA conlleva a riesgos cardiovasculares y a un aumento de la mortalidad. En una investigación de 2839 pacientes con DM2, la EHGNA estuvo asociada con una prevalencia significativamente mayor de enfermedad cardiovascular que la que se encontró en las personas sin EHGNA, incluso después de ajustar varios factores de riesgo 2. Asimismo, la esteatofibrosis no alcohólica (NASF) pudo predecir de forma independiente la mortalidad en pacientes con EHGNA en ese grupo de pacientes evaluados 3.
En 2020, un panel internacional de expertos propone una nueva denominación para esta entidad, y se consideró que el término "enfermedad del hígado graso asociada a una disfunción metabólica", conocido por sus siglas en inglés como MAFLD, sería el más apropiado para referirse a un conjunto completo, pero sencillo, de criterios para el diagnóstico de MAFLD, los cuales son independientes de la cantidad de alcohol consumido y se pueden aplicar a los pacientes en cualquier entorno clínico. Esta definición está basada en el reconocimiento de que anomalías subyacentes, como el consumo crónico de alcohol, pueden coexistir con alteraciones en el estado metabólico relacionados con la patogenia de la EHGNA, por lo que el término MAFLD sería el más apropiado tomando en cuenta que pueden coexistir con otras condiciones. El criterio para el diagnóstico de MAFLD sería la evidencia de esteatosis hepática (detectada por imágenes, biomarcadores sanguíneos o histología hepática), asociada con uno o más de los siguientes factores: sobrepeso/obesidad, DM2, evidencia de desregulación metabólica 4.
Esta revisión describirá la fisiopatología de la EGHNA en los pacientes con DM2, además de la clínica, diagnóstico y tratamiento de este estado en estas personas con alto riesgo.
Estrategia de búsqueda
Se hizo una revisión de la literatura usando PubMed, y se tuvo como base los artículos relevantes en inglés publicados hasta el 30 de mayo de 2022. Además, se incluyó en los términos de búsqueda "esteatohepatitis no alcohólica" y "diabetes mellitus tipo 2" en combinación con "histología", "epidemiología", "diagnóstico", "cirrosis", "mortalidad", "tratamiento", "factores de riesgo", "carcinoma hepatocelular o cáncer", "cirugía bariátrica" y "fibrosis". En el caso de los artículos relevantes adicionales, se identificaron a partir de citas referenciadas en otros artículos.
Fisiopatología
La esteatosis es la consecuencia del acúmulo de triglicéridos intracelulares por el aumento de la captación de síntesis de novo en hepatocitos y ácidos grasos libres como efectos de la lipotoxicidad celular.
El daño hepático incluye la inflamación y necrosis causadas debido a mayores niveles de triglicéridos y altos niveles de estrés oxidativo mitocondrial con la subsiguiente producción de radicales libres y peroxisomas.
El aumento de la acción oxidativa a nivel de mitocondrias se produce, por ejemplo, debido a la liberación de adiponectin, interleucina 6 (IL-6), leptina y factor de necrosis tumoral alfa (TNF-alfa), sobreproducido por el estado inflamatorio de los tejidos adiposos viscerales y subcutáneos.
Los mediadores químicos, originados por la necrosis celular y la inflamación, y las adipocinas ocasionan que se activen las células estelares que conllevan a la producción de colágeno, lo que incrementa la generación del factor de desarrollo de los tejidos conjuntivos y el cúmulo de matriz extracelular que estimula la fibrosis (Figura 1). De igual modo, el sistema endocanabinoide y el uso de receptores activados por proliferadores de peroxisomas de tipo gamma (PPAR gamma) pueden ser muy importantes en la fibrogénesis y, a su vez, pueden ser posibles blancos terapéuticos 5.
Incluso últimamente se ha relacionado que la disbiosis a nivel intestinal podría ser muy importante en la patogénesis de la EGHNA y su avance a la esteatohepatitis no alcohólica 6.
Patogénesis de la relación de EHGNA y DM2
Este trastorno se vincula íntimamente con la resistencia a la insulina, debido a ello se considera que es una manifestación hepática a causa del síndrome metabólico. La EHGNA es una manifestación del síndrome metabólico. Esta complicación afecta con más frecuencia a pacientes con DM2. En comparación con pacientes no diabéticos con enfermedades por EHGNA, la prevalencia de esteatosis hepática es aproximadamente un 80 % superior en sujetos con DM2 según sexo y edad 1. De igual modo, en pacientes con diabetes mellitus la frecuencia de cirrosis es cerca de 30 %. Asimismo, la diabetes tipo 2 agrava la EHGNA, ya que la diabetes mal controlada puede promover o exacerbar la esteatosis hepática. Por otro lado, la EHGNA lleva a hiperglicemia, lo que contribuye a un círculo vicioso 2.
La "hipótesis de dos hits" ha perdido vigencia en las últimas revisiones. Esa teoría clásica consideraba que la esteatohepatitis sucedía como consecuencia de un segundo daño tras un primer ataque debido a la inicial infiltración grasa.
Existen 4 cambios histológicos básicos que condicionan el desarrollo de la enfermedad por esteatosis hepática no alcohólica e incluyen esteatosis, estrés oxidativo, inflamación y el desarrollo de fibrosis (Figura 1).
El modelo vigente considera que este proceso ocurre como consecuencia de "múltiples hits" que podrían anteceder a la esteatosis hepática como una explicación más apropiada para considerar la evolución de la EHGNA en un contexto de estado de inflamación 5,7.
Sucesivamente, según lo mostrado en la Figura 2, el modelo actualmente propuesto incluye las siguientes pautas:
1. En pacientes con obesidad, la diabetes ocasiona una elevación de la actividad lipolítica en adipocitos y subsecuente incremento de esteatosis hepática.
2. Asimismo, produce una elevación persistente de los valores de glicemia en la diabetes e insulinorresistencia a nivel del hígado, lo que conduce a una mayor lipolisis en forma temprana y mayor actividad fibrótica tardíamente.
3. Además, la elevación de la glucosa o hiperglucemia y de productos de glicosilación avanzada contribuyen a apoptosis y mayor fibrosis 5,8.
La insulinorresistencia en el hígado asociada a la EHGNA puede producir un aumento de los niveles de insulina compensatoriamente y, sumado a una falla de las células pancreáticas, puede conducir a elevaciones de los niveles de glucosa e incluso a la aparición de diabetes 5,7.
Clínica y diagnóstico
Gran parte de las personas que padecen la EGHNA no presentan síntomas, pero ciertos pacientes con esta afección pueden quejarse de decaimiento, cansancio y malestar en la parte superior derecha del abdomen. Es más probable que los pacientes sean diagnosticados mediante pruebas de laboratorio que muestren aminotransferasas hepáticas elevadas o a partir de estudios por imágenes de abdomen que revelan esteatosis hepática.
El diagnóstico necesita estudios de imágenes y/o estudios serológicos asociados a la esteatosis hepática cuando no existen otras etiologías, y que incorporen la ingesta relevante de alcohol. La biopsia hepática es el patrón de oro para diagnosticar la EHGNA y establecer el pronóstico.
En la actualidad, además del método invasivo de la biopsia hepática, existen pruebas para detectar el hígado graso y ciertas técnicas concretas de clasificación de la EHGNA 9,10.
Debe considerarse que las consecuencias adversas asociadas con la esteatosis hepática no alcohólica parecen estar fuertemente relacionadas con el nivel de actividad inflamatoria y/o de fibrosis hepática, más que simplemente determinar la esteatosis. En efecto, a medida que se disponga de alternativas de tratamiento más efectivas, será aún más relevante determinar el grado de fibrosis 11-13.
Recomendaciones en el diagnóstico de EHGNA en pacientes con diabetes mellitus
Los pacientes que padecen de prediabetes o DM2 y presentan enzimas hepáticas altas (aspartato aminotransferasa o alanina) o hígado graso por ultrasonido deben ser evaluados para identificar la existencia de cirrosis hepática y esteatohepatitis no alcohólica.
La diabetes se asocia con la progresión de la EHGNA que incluye sus manifestaciones más graves, tales como la fibrosis hepática, cirrosis, esteatohepatitis no alcohólica y carcinoma hepatocelular, además de asociarse a un impacto en la mortalidad a nivel cardiovascular. Las concentraciones elevadas de aminotransferasa hepática están asociadas con un nivel más alto de índice de masa corporal (IMC), perímetro de la cintura y niveles más bajos de colesterol lipoproteínas de alta densidad (HDL) y triglicéridos. Es posible emplear pruebas no invasivas, tales como biomarcadores de fibrosis o la elastografía, para evaluar el riesgo de fibrosis y, en determinados casos, se puede requerir la remisión a un especialista en hígado y a una biopsia hepática para un diagnóstico definitivo 10,14,15.
Evaluación de riesgo de fibrosis
El diagnóstico de la EGHNA no solo se circunscribe a diagnosticar la presencia de esteatosis hepática como se ha mencionado previamente, sino al diagnóstico de fibrosis o amenaza de fibrosis clínicamente significativa, etapa en la que radica el verdadero desafío.
Los pacientes con elevado riesgo de EHGNA deben someterse a pruebas de detección de fibrosis, incluidos los pacientes con DM2, prediabetes, obesidad y/o dos o más componentes de riesgos cardiometabólicos, o pacientes con aminotransferasa plasmática persistentemente alta y/o esteatosis hepática encontrada en imágenes, en un periodo mayor a 6 meses 10,16,17.
Paneles clínicos y biomarcadores predictivos de fibrosis
A continuación, se describen los paneles predictivos clínicos de fibrosis significativa 20.
NAFLD fibrosis score
Angulo et al. utilizaron una fórmula de regresión logística para validar un índice denominado "Non-alcoholic fatty liver disease (NAFLD) Fibrosis Score", el cual incorpora edad, plaquetas, IMC, hiperglucemia, albúmina y cociente aspartato aminotransaferasa (AST)/alanino aminotransferasa (ALT).
La fórmula para el NAFLD fibrosis score es la siguiente: -1,675 ± 0,037 x edad (años) ± 0,094 x IMC (kg/m2) ± 1,13 x glucosa elevada en ayunas/diabetes (sí = 1, no = 0) ± 0,99 x 0AST/ALT ratio 0,013 x plaquetas x109/l) 0,66 x albúmina (g/dl).
Se presentaron valores bajos en 61 % de los casos, por lo cual se descartó la fibrosis significativa en el 93 %, junto con una sensibilidad de 82 % y especificidad de 77 %. Las puntuaciones inferiores a -1,4 (F0-F2) se consideraron predictores de ausencia de fibrosis significativa, con 97 %, al igual que puntuaciones indeterminadas entre -1,4 y 0,675 y predictores de fibrosis significativa superiores a 0,675 (F3-F4) 11.
En esta fórmula se encuentra una correlación histológica bajo las siguientes categorías: F0 corresponde a ausencia de fibrosis; F1, fibrosis leve; F2, fibrosis moderada; F3, fibrosis severa; F4, cirrosis 14.
APRI (AST-Platelet Ratio Index)
Calculado del siguiente modo: APRI = [nivel de AST/límite superior normal de AST/recuento de plaquetas (109/l)] × 100. Por lo tanto, comprende una de las formulaciones de biomarcadores más simples y más utilizadas, porque puede diagnosticar con una exactitud aceptable la cirrosis y fibrosis significativas 11.
FIB-4
Se refiere a una mezcla de 4 variables simples: edad, ALT, AST y recuento de plaquetas. Se halla mediante la siguiente fórmula:
Índice FIB-4 = [edad (en años) × AST (en UI/l)] / [recuento de plaquetas (109/l) × ALT (UI/l)]1/2.
En un inicio, esta prueba se examinó en personas coinfectadas por el VIH y el virus de hepatitis C (VHC) y el virus de hepatitis B (VHB). El FIB-4 mostró ser útil de modo parecido al FibroTest para diagnosticar cirrosis y/o fibrosis avanzada en personas que padecen VHC y, a su vez, en investigaciones con pacientes infectados con VHC y VHB 14.
Pruebas de imágenes
En general, la resonancia magnética nuclear (RMN) y la tomografía computarizada (TAC) podrían detectar la esteatosis, pero no tienen la sensibilidad necesaria para la detección de fibrosis o inflamación. Uno de los conflictos para establecer la especificidad y sensibilidad de la resonancia magnética y la TAC para el diagnóstico de la esteatosis hepática es que la mayoría de los pacientes son sometidos a la verificación con la biopsia hepática.
Elastografía
La elastografía estima la rigidez hepática mediante la aplicación de ondas mecánicas y la medición de su velocidad de propagación a través del tejido mediante imágenes. Las opciones para esta modalidad diagnóstica incluyen el ultrasonido y la resonancia magnética (elastografía de resonancia magnética asociada a RMN) 14.
El uso de múltiples paneles serológicos o la combinación de paneles serológicos con imágenes pueden mejorar la capacidad de evaluar correctamente el grado de fibrosis de un paciente 10.
Biopsia hepática
Se considera la prueba de oro para el diagnóstico, y puede indicarse en las siguientes condiciones 10,17,18:
No hay certeza del diagnóstico tras estudios serológicos por imágenes.
Si hay historia sugerente de cirrosis, evidencia de proceso inflamatorio o alto riesgo de actividad fibrótica.
Alta probabilidad del desarrollo de una actividad
fibrótica avanzada o de un proceso cirrótico.
Hallazgos clínicos de un proceso cirrótico.
Presencia de esplenomegalia.
Presencia de citopenias.
Presencia de un nivel de ferritina mayor a 1,5 veces el tope máximo habitual.
Mayor a 45 años y presencia de obesidad o diabetes (mayor probabilidad de actividad fibrótica).
Tratamiento
Los beneficios más resaltantes se dan mediante el tratamiento de las enfermedades relacionadas sin haberse podido establecer un enfoque farmacológico específico.
La alimentación saludable, la pérdida de peso, así como el ejercicio brindan un beneficio clínico significativo y deben tenerse en cuenta en una terapia de primera línea para tratar la EHGNA 19 (Figura 3).
Múltiples estudios demuestran que se requiere una pérdida de un 5 % del peso corporal para optimizar la esteatosis hepática. En un metaanálisis de ocho ensayos que incluyeron a 373 pacientes, la pérdida de peso corporal ≥5 % dio como resultado un mejoramiento en la esteatosis hepática; por otro lado, la pérdida de peso corporal ≥7 % se asoció con una mejoría en la puntuación de la actividad de esteatohepatitis (NAS), que se utiliza para calificar la actividad de la enfermedad 19-21.
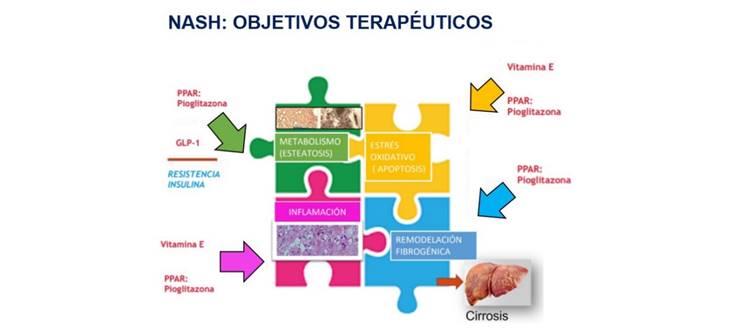
En relación con el tratamiento farmacológico, existen muchas dianas terapéuticas para las cuales se han planteado estudios dentro de la patogénesis de esta entidad (Figura 3). Dentro de ellas, está recomendado el tratamiento con pioglitazona en pacientes con diabetes y la vitamina E en personas que padecen esteatohepatitis no alcohólica sin diabetes comprobada por biopsia, dado que se ha visto que puede lograr una mejora a nivel de la histología hepática 22.
Los agentes de clase tiazolidinediona (pioglitazona) se consideran intervenciones eficaces para el tratamiento de esta enfermedad en personas con diabetes. Estos medicamentos aumentaron los niveles de triglicéridos hepáticos del 39 % al 51 % posterior a los 3 meses de tratamiento, y del 54 % posterior a los 6 meses de tratamiento. En un metaanálisis de cuatro ensayos, donde se comparó tiazolidinedionas con placebo en 344 sujetos diagnosticados con la EHGNA, se halló que, en comparación con el placebo, las tiazolidinedionas tenían más probabilidades de mejorar los parámetros histológicos hepáticos, como la degeneración balonizante (OR 2,1, IC del 95 %: 1,3 a 3,4), la inflamación lobulillar (OR 2,6, IC del 95 %: 1,7 a 4,0) y la esteatosis (OR 3,4, IC 95 %: 2,2 a 5,3). No se evidenció mejoras en la fibrosis al examinarse cada una de las tiazolidinedionas; sin embargo, cuando las evaluaciones de las investigaciones que emplearon pioglitazona se limitaron a tres, se halló un mejoramiento significativo en la fibrosis en pacientes tratados con pioglitazona, a diferencia de los pacientes tratados con placebo 21-24.
Por otro lado, el uso de biguanidas o insulina no ha traído probados beneficios en reversión o regresión de fibrosis en los pacientes con DM2 23,25-27.
El tratamiento con agonistas de GLP-1 como liraglutida o con inhibidores del cotransportador de sodio y glucosa SGLT2 (empagliflozina y dapagliflozina) ha mostrado resultados promisorios en investigaciones previas, pero este resultado podría estar mediado probablemente por la pérdida de peso que generan estos agentes (28-29). En el caso de agonistas del receptor de GLP-1, como liraglutida, un ensayo que incluyó a 52 pacientes con NASH que fueron asignados a recibir liraglutida o placebo durante 48 semanas, en quienes se realizó una biopsia al final del tratamiento, encontró que remitió en 9 (39 %) de 23 pacientes del grupo que recibió liraglutida versus 2 (9 %) del que recibió placebo (RR 4,3; IC del 95 %: 1,0 a 17) 30-33.
En el caso de otro agonista de GLP-1, como semaglutida, en un ensayo de fase 2, que incluyó a 320 personas que padecían EGHNA corroborada mediante una biopsia y fibrosis hepática F1, F2 o F3, este fármaco (0,4 mg por día), dio como resultado tasas elevadas de resolución histológica de la EHGNA, a diferencia del uso de placebo posterior a las 72 semanas (59 versus 17 por ciento; OR 6,87, IC 95 %: 2,60-17,63). Las dosis bajas de semaglutida (0,1 mg o 0,2 mg al día) tuvieron poca eficacia, pero mejoraron la puntuación histológica respecto al placebo (40 %; OR 3,36, IC de 95 %: 1,29-8,86 y 36 %; OR 2,71, IC 95 %: 1,06-7,56, respectivamente) 34-37.
En el futuro es probable que el desarrollo de terapias, en su mayoría en un nivel de ensayo clínico, que se dirijan tanto a la esteatohepatitis y fibrosis hepática como a los factores de riesgo cardiometabólicos sea extremadamente beneficioso 38-41.
Cirugía bariátrica
La cirugía bariátrica reduce significativamente el riesgo de desenlaces hepáticos graves, al igual que la ocurrencia de eventos cardiovasculares graves, en personas que padecen esteatosis hepática no alcohólica comprobada por biopsia 42,43. En personas con DM2 permitieron una mejora en cuanto a desenlaces metabólicos como remisión de diabetes y también una mejora en las puntuaciones de actividad de fibrosis hepática y regresión de fibrosis hepática 44,45.
El reciente estudio "Surgical Procedures and Long-Term Effectiveness in EHGNA Disease and Obesity Risk" (SPLENDOR) incorporó a 1158 pacientes con esteatosis no alcohólica comprobada mediante una biopsia sin cirrosis, con una mediana de seguimiento en siete años, donde solo 5 pacientes formaron parte del grupo sometido a cirugía bariátrica y, en cambio, 40 pacientes del grupo de control experimentaron eventos hepáticos adversos graves en el periodo de seguimiento. La incidencia acumulada de hallazgos hepáticos desfavorables mayores se redujo en un 88 % en el grupo de cirugía bariátrica, en comparación con un 2,3 % del grupo quirúrgico, y un 9,6 % en el grupo no quirúrgico (hazard ratio [HR]: 0,12, p = 0,01) 46.
Asimismo, en un estudio realizado en Israel acerca de la cirugía bariátrica con banda laparoscópica, derivación gástrica o gastrectomía en manga, en comparación con el manejo no quirúrgico de la obesidad con atención habitual, se asoció con una mortalidad por todas las causas más baja durante una mediana de seguimiento de aproximadamente 4,5 años 47-49.
Conclusiones
La alta prevalencia de la DM2 y de la EHGNA puede devenir en un serio problema de salud pública a futuro debido a la mortalidad y morbilidad relacionadas. La influencia recíproca de las dos enfermedades podría alterar el curso natural de ambas condiciones.
En todo paciente con sospecha de EHGNA debe descartarse el origen viral, autoinmune, enfermedad de depósito, fármacos y consumo crónico de alcohol. La valoración del grado de fibrosis por su relación con un mayor riesgo cardiovascular y peor pronóstico de complicaciones hepáticas mediante el uso de un marcador predictivo de fibrosis debe hacerse en todo paciente con riesgo de fibrosis avanzada. El uso de múltiples paneles serológicos o la combinación de paneles serológicos con imágenes pueden mejorar la capacidad de evaluar correctamente el grado de fibrosis de los pacientes.
Hasta el momento, el tratamiento de la EGHNA a través de intervenciones en el estilo de vida es la única medida terapéutica más efectiva sin haber un tratamiento farmacológico óptimo. Dentro de las estrategias farmacológicas, el uso de antidiabéticos orales como la pioglitazona ha mostrado eficiencia para reducir la severidad de fibrosis en pacientes diabéticos con la EHGNA. Existe un amplio espacio en el cual se debe profundizar en las investigaciones a futuro con estudios de tipo prospectivo, con base en hallazgos histológicos y con un mayor tamaño de muestra en pacientes con DM2 y la EGHNA sobre áreas diversas como la fisiopatología de la enfermedad, factores de riesgo relacionados con el desarrollo de la enfermedad y el tratamiento.











 texto em
texto em