Introducción
El oxígeno molecular y el dióxido de carbono son los principales sustratos gaseosos en los organismos que respiran; las variaciones de estos gases fuera del rango fisiológico representan una seria amenaza para la supervivencia de células, tejidos y organismos 1. El oxígeno (O₂) es el aceptor final de electrones producidos durante el metabolismo de los alimentos y en el proceso de transferencia de electrones dentro de las mitocondrias, que a través de la fosforilación oxidativa genera la adenosina trifosfato, la energía bioquímica necesaria para cumplir con todas las funciones celulares 2. Sin embargo, el mismo O₂ se transforma, en una pequeña fracción, en radicales libres capaces de causar estrés oxidativo biológico y graves alteraciones celulares. La baja concentración de O₂ (hipoxia) es perjudicial para el entorno celular y, por ello, la evolución ha creado adaptaciones fisiológicas para resistir la hipoxia transitoria. Sin embargo, las células cancerosas utilizan estos mecanismos de supervivencia de manera hábil para satisfacer sus demandas metabólicas asociadas a un rápido crecimiento y proliferación, y logran resistir los microambientes tumorales hostiles. La vía de respuesta a la hipoxia mejor estudiada involucra al factor inducible por hipoxia (HIF, por sus siglas en inglés), que es un factor de de investigaciones históricas relevantes o investigaciones pivotales con vigencia actual.
Hipoxia y cáncer
La hipoxia se puede definir como un estado en el que el O₂ no está disponible en cantidades suficientes a nivel tisular para mantener una homeostasis adecuada. Esta condición es un fenómeno común en la mayoría de los tumores malignos; la hipoxia tumoral puede conducir a la generación de angiogénesis, que consiste en la producción de vascularización disfuncional, dada la necesidad de mayor aporte vascular por la proliferación celular y a la adquisición de un fenotipo de transición epitelial a mesenquimatoso, que da como resultado movilidad celular y metástasis. Esta condición altera el metabolismo de las células cancerosas y puede contribuir a la resistencia a la terapia al inducir inactividad celular. La hipoxia estimula una red de señalización celular compleja en las células cancerosas, incluidas las vías HIF, fosfoinositidas 3 quinasas (PI3K), proteínas quinasas activadas por mitógenos (MAPK) y factor nuclear kB (NF-kB), que interactúan entre sí y provocan ciclos de retroalimentación positivos y negativos que aumentan o disminuyen los efectos hipóxicos 5. En transcripción regulado por la proteína Von Hippel-Lindau 2 los tumores cancerosos la distribución de O es muy (VHL) y las enzimas prolil hidroxilasas 3. Zhong et al., en su publicación de 1999, señalaron que había una mayor expresión del HIF-1α en varios tipos de cáncer y en sus metástasis, lo que sugirió un papel importante del HIF en la progresión de la enfermedad cancerosa 4.
El objetivo de la presente revisión es remarcar la importancia de la hipoxia en la génesis del cáncer, conocer las principales moléculas que interactúan en la expresión del factor de transcripción, explicar los mecanismos moleculares de las vías involucradas en la inducción del HIF, conocer las consecuencias celulares de la alteración del HIF y las potenciales terapias dirigidas contra este factor.
Estrategia de búsqueda
Se consultaron las bases de datos PubMed, Scopus y SciELO, desde el año 1990 hasta el año 2022. Se buscaron referencias bibliográficas con las palabras clave: Prolina Dioxigenasas del Factor Inducible por Hipoxia, Proteína Supresora de Tumores del Síndrome de Von Hippel-Lindau (VHL), Factor 1 Inducible por Hipoxia y Neoplasias. Se excluyeron aquellas revisiones repetitivas, y se consideraron las fuentes originales como prioritarias. Se agregaron artículos anteriores al rango de la fecha de búsqueda, cuando se trató heterogénea, con niveles de hipoxia leves, hasta niveles severos y anóxicos; la hipoxia es un factor negativo, asociado a resultados adversos en la mayoría de los tratamientos de los distintos tipos de cáncer. La importancia de los niveles de hipoxia está bien demostrada en el tratamiento con radioterapia, ya que habrá mayor destrucción celular de la radiación ionizante en presencia de oxígeno en comparación con condiciones hipo o anóxicas, en las cuales se encuentra una fuerte disminución de la radiosensibilidad 6.
Factor inducible por hipoxia (HIF)
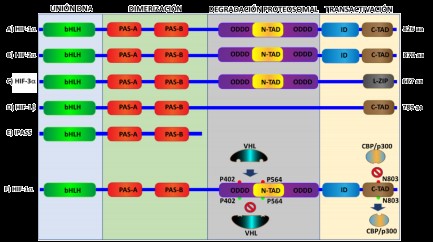
El HIF es el factor de transcripción más importante implicado en la respuesta a la hipoxia a través de la activación de más de una centena de genes reguladores de la actividad celular 7. Asimismo, pertenece a la superfamilia de proteínas básicas hélice-bucle-hélice (bHLH) -con un dominio PAS que actúa como un sensor molecular [bHLH-PAS]-, las cuales son reguladoras transcripcionales, comúnmente presentes en organismos vivos 8. El HIF es un heterodímero conformado por dos subunidades (Figura 1):
a) Subunidad HIF-1α: sensible al O₂, su expresión es inducida por la hipoxia y tiene dos dominios de transactivación terminal: NH2 (N-TAD) y COOH (C-TAD). Estos son responsables de la actividad transcripcional de HIF-1α; C-TAD interactúa con CBP/p300 (coactivadores transcripcionales asociados a los factores de transcripción de unión al ADN y que modifican factores de transcripción y la cromatina a través de la acetilación), para modular la transcripción génica de HIF-1α bajo hipoxia; N-TAD tiene el dominio de degradación dependiente de oxígeno (ODDD), responsable de la estabilidad de HIF-1α 9 (Figura 1 A, F).
Isoforma HIF-2α: tiene un comportamiento similar al HIF-1α, sin embargo, los HIF-1α y 2α se expresan en distintos tejidos, y es más ubicuo en el caso del primero; el HIF-1α regula la expresión génica glucolítica y conduce más vías apoptóticas, mientras que el HIF-2α estimula el crecimiento tumoral y la angiogénesis 10 (Figura 1 B).
Isoforma HIF-3α: actúa contrariamente a las otras isoformas al generar un inhibidor del dominio PAS (IPAS), que impide la unión del HIF-1α al ADN; por tanto, evita la activación genética derivada de la hipoxia 11 (Figura 1 C, E).
b) Subunidad HIF-1β: también conocido como translocador nuclear del receptor de arilos (TNRA). Está constitutivamente expresada en la célula y usualmente se une al receptor de hidrocarburos de arilos, lo que facilita su translocación al núcleo; por tanto, HIF-1β es un factor de ubicación nuclear 12 (Figura 1 D).
La proteína de von Hippel-Lindau (pVHL)
En condiciones de normoxia, la proteína supresora de tumores von-Hippel Lindau (pVHL) es el componente de reconocimiento de una ligasa de ubiquitina E3, que funciona como un regulador maestro de la actividad de HIF; la pVHL se dirige y adhiere a la subunidad HIF-α hidroxilada para su posterior ubiquitinación y degradación proteasómica rápida. El gen VHL, que codifica a la proteína con el mismo nombre, es un gen supresor de tumores, que, por tanto, está asociado a la posibilidad de falla de ambos alelos (dos golpes); contiene tres exones que expresan un ARN mensajero capaz de traducir dos proteínas en función a los lugares de corte y empalme. No se sabe por qué se producen dos proteínas VHL, por lo cual, en adelante, se las denomina genéricamente como pVHL. Esta proteína se desplaza de manera dinámica entre el citosol y el núcleo dependiendo de la transcripción, sin embargo, la mayor parte de la proteína se encuentra en el citosol en condiciones estables, con una vida media relativamente larga, aunque en algunas circunstancias se modifica por poliubiquitinación y se degrada a manos de la ubiquitina ligasa WSB1. La pVHL forma un complejo estable que contiene diversas proteínas, como elongina-B, elongina-C, Cullin-2 y RBX-1, que actúan como un complejo de ubiquitina ligasa. Los pacientes que heredan una copia defectuosa del gen supresor de tumores VHL tienen mayor riesgo de padecer una variedad de cánceres, que incluyen el carcinoma de células claras renales, los hemangioblastomas (tumores de los vasos sanguíneos de la retina, el cerebelo y la médula espinal) y los paragangliomas (tumores del sistema nervioso simpático) 13.
Dominios de las subunidades del HIF-1α (A-C), HIF-1β (D, E). Activación e inhibición del HIF-1α (F): en hipoxia los residuos de prolina en posiciones 402 y 564 sufren hidroxilación por la PH1-3 (rojo), lo que atrae a la proteína de VHL que inicia la ubiquitinación y posterior destrucción proteosomal de la proteína HIF-1α; en normoxia no existe hidroxilación (verde), por tanto, no hay ligazón a VLH y HIF-1α no se destruye. La hidroxilación del residuo de asparagina en posición 803 (rojo) por la enzima FIH inhibe CBP/p300 y HIF-1α, no puede llegar al ADN para generar transcripción genética, independientemente de VHL.
Regulación de la vía HIF
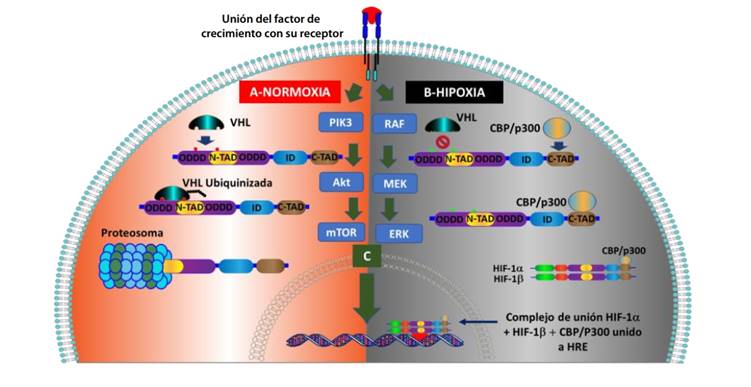
La normoxia conduce a una degradación rápida del factor de transcripción HIF-1α (tiempo promedio de 5 minutos) 14, debido a que el complejo VHL poliubiquitina las subunidades HIF-1α y las marca para su degradación proteasomal; para ello se requiere la hidroxilación de dos residuos de prolina (P402 y P564) dentro del ODDD de HIF-1α, la cual es catalizada por la PHD1-3 (Figura 1-F y Figura 2-A); otro residuo de lisina en el ODDD (K532) podría ser acetilado por la enzima acetilo transferasa ARD-1 (arrest-defective-1) y producir los mismos resultados 15. La hipoxia impide la hidroxilación de las subunidades HIF-1α, por tanto, bloquea la subsiguiente ubiquitinación de estas subunidades por el complejo VHL y previene su degradación proteosomal. Esto permite que se produzca la dimerización de HIF-1α y HIF-1β, y que, a nivel nuclear, se una al elemento de respuesta a la hipoxia del ADN (HRE), que finalmente promueve la transcripción de genes diana a través del promotor o potenciador de varios genes inducibles por hipoxia (Figura 2-B), que incluyen eritropoyetina (EPO), factor de crecimiento endotelial vascular (VEGF), transportadores de glucosa (GLUT) y enzimas glucolíticas, genes involucrados en el metabolismo del hierro y supervivencia de células madre cancerosas 16.
Otro mecanismo importante para la regulación negativa dependiente del oxígeno de la vía HIF-1α, que no implica la proteína pVHL, es mediante el control de la transactivación HIF-1α; así, en normoxia, la hidroxilación dependiente de oxígeno del residuo de asparagina (N803) de HIF-1α por el factor inhibitorio del HIF-1 (FIH-1), también conocido como asparaginil hidroxilasa, bloquea la interacción entre los dos dominios: C-TAD del HIF-1α y los coactivadores CBP/p300, por tanto, impide la transcripción génica posterior mediada por HIF-1α 17 (Figura 1-F).
Se ha demostrado que algunas proteínas que participan en las diferentes vías de señalización celular pueden aumentar la traducción del HIF-1α como mTOR 18, PI3K 19, algunos factores de crecimiento que activan la proteína RAS de la vía MAPK 20, el factor de crecimiento derivado de plaquetas (PDGF) 21, la insulina 22 y el factor de crecimiento similar a la insulina (IGF) 23 (Figura 2-C).
A) En normoxia, la pVHL es atraída por el HIF-1α e inicia el proceso de ubiquitinación, luego se produce su degradación, por consiguiente, no permite que el complejo de unión llegue al núcleo y provoque la transducción genética. B) En hipoxia, VHL no se une al HIF-1α, por tanto, no se degrada y logra unirse con HIF-1β y con CBP/P300 y llegar al núcleo para activar el elemento de respuesta hormonal (HRE) e iniciar la transcripción de genes. C) Las activaciones generadas por vías de señalización importante como PIK3 y MAPK, en células malignas, pueden resultar en transducción genética directa independiente de la condición de O₂.
Consecuencias de la activation del HIF-1α en la célula cancerosa
Aproximadamente, el 60 % de los tumores sólidos tienen <1 % de O₂, lo que conduce a una hipoxia intratumoral, por lo cual se activa la vía HIF-1α, que conduce a generar algunas funciones cruciales para el desarrollo del cáncer, tales como la proliferación celular y apoptosis, angiogénesis, reprogramación del metabolismo celular, invasión y metástasis, que permiten una mayor supervivencia del tumor. (Figura 3)
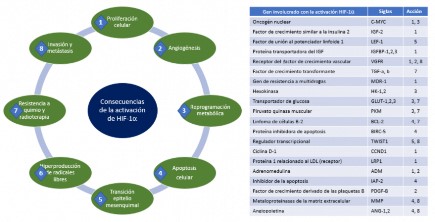
Fuente: ilustración propia del autor.
Figura 3 Genes activados por el factor inducible por hipoxia 1α en cáncer
Proliferación y apoptosis tumoral
En la mayoría de los tipos celulares, la hipoxia induce una disminución de la proliferación celular por el estrés hipóxico, sin embargo, algunas poblaciones mantienen la proliferación celular frente a la hipoxia, sobre todo en cáncer; por ende, cumplen una función fisiológica en el mantenimiento de las poblaciones de células madre que residen en un nicho hipóxico 24. Los genes regulados por el HIF en varios tumores incluyen VEGF, EPO, IGF-2 y el factor de crecimiento transformante-α (TGF-α); estos genes tienen injerencia en la progresión tumoral 25.
Existen evidencias que documentan el papel controversial del HIF-1 en la prevención de la muerte celular, al estimular la proliferación celular o incluso la inducción de la apoptosis en las células normales; la concentración de oxígeno y el nivel de ATP determinan si la célula entrará en apoptosis o no; además, la hipoxia puede inhibir la cadena de transporte de electrones en la mitocondria, provocar la activación de Bax o Bak, lo que lleva a la liberación de citocromo C y la activación de la caspasa-9 hacia la apoptosis 26. En los tumores sólidos, la hipoxia es un fenómeno común, sin embargo, las células se adaptan a este estrés ambiental, de modo que después de periodos repetidos de hipoxia, se produce la selección de resistencia a la apoptosis inducida por la hipoxia; es probable que estos tumores resistentes sean más agresivos e incluso opongan mayor resistencia al tratamiento. El HIF-1 puede inducir proteínas
antiapoptóticas, como IAP-2, mientras que la proteína proapoptótica Bax se puede regular negativamente; durante la hipoxia, existe un intrincado equilibrio entre los factores que inducen o contrarrestan la apoptosis, o incluso estimulan la proliferación. Comprender estos mecanismos regulatorios podría conducir a tratamientos más específicos para tumores sólidos 27.
Angiogénesis
Un tumor puede crecer unos pocos milímetros de diámetro usando vasos sanguíneos de las células adyacentes, sin embargo, el aumento de la proliferación celular y/o disminución de la apoptosis en los tumores sólidos produce hipoxia severa, regiones con pH bajo y menor llegada de nutrientes; por ello, el proceso de formación de nuevos vasos a partir de los ya existentes (angiogénesis) es fundamental para la progresión de los tumores sólidos 28. El HIF puede inducir la expresión de un gran número de factores proangiogénicos, incluidos el factor de crecimiento endotelial vascular (VEGF, por sus siglas en inglés) con sus correspondientes receptores factor de crecimiento B derivado de plaquetas (PDGF-B), inhibidor del activador del plasminógeno-1 (PAI-1), receptor TIE-2, metaloproteinasas de matriz (MMP-2 y MMP-9) y angiopoyetinas (ANG-1 y ANG-2)-. El VEGF-A es un potente mitógeno endotelial, el más importante en el contexto del cáncer, ya que está altamente expresado en muchos tumores humanos 29,30.
Reprogramación del metabolismo celular
Los cambios metabólicos de las células cancerosas, especialmente el favorecimiento del metabolismo glucolítico anaeróbico sobre la fosforilación oxidativa (OXPHOS) en la mitocondria en el proceso aeróbico en varios tipos de cáncer (aún con abundante oxígeno) -propuesto por Otto Warburg hace más de un siglo 31-, fue un hito importante en la diferenciación entre células diferenciadas y las cancerosas. En este proceso, conocido como "reprogramación metabólica", el microambiente tumoral desempeña un rol fundamental a través de la activación de oncogenes, transición epitelio-mesenquimal y resistencia a fármacos, todo lo cual son características del comportamiento agresivo del cáncer 32.
El HIF-1 estimula la expresión y activación de las isoformas de enzimas glucolíticas, apoyando así el efecto Warburg al potenciar la biosíntesis macromolecular y vías de producción de energía en cánceres humanos; entre estas enzimas se encuentran la piruvato quinasa M1 y 2, la hexoquinasa 1 y 2 (HK1-2), los transportadores de glucosa 1 y 3 (GLUT 1-3), la lactato deshidrogenasa-A (LDH-A), la aldolasa A y C, la fosfofructoquinasa, entre otras 33. La HIF-1α induce la glucólisis y restringe activamente la función mitocondrial y la utilización del oxígeno al inducir la actividad del piruvato deshidrogenasa quinasa-1 (PDK-1) 34. La consecuencia crítica de este cambio glucolítico es la acidosis del microambiente tumoral, el cual proporciona una mayor cantidad de intermediarios metabólicos que estimulan la progresión y la agresividad de los tumores 35.
El oncogén MYC codifica un factor de transcripción (c-Myc), que vincula el metabolismo celular alterado con la tumorigénesis; la proteína c-Myc regula varios genes relacionados a la reprogramación metabólica, como GLUT1, LDH-A y HK2. El HIF-1α inhibe la actividad de c-Myc en condiciones fisiológicas, pero en el cáncer c-Myc trabaja junto con el HIF-1 para inducir la expresión de PDK-1 y HK2 que conducen a la angiogénesis y la glucólisis aeróbica 36.
Invasión y metástasis
Los miembros de la familia HIF desempeñan funciones importantes en todas las etapas clave de la diseminación metastásica, que incluyen migración local en el tumor e invasión del tejido estromal circundante, a través de la inducción de un proceso similar a la transición epitelial-mesenquimatosa (EMT), remodelación de la matriz extracelular, intravasación y extravasación, supervivencia y diseminación a través de la circulación, la generación de nichos premetastásicos, etc., para apoyar el crecimiento tumoral y la colonización de órganos distantes y conservar la latencia de las células tumorales 37. Muchos informes han revelado que la expresión de HIF-1α en el cáncer aumenta la invasión e induce la pérdida de E-cadherina 38.
El HIF-1 dirige la expresión de muchos reguladores de EMT, y es uno de los factores que contribuyen con la metástasis tumoral. El grado de invasividad del tumor y la metástasis depende de la activación transcripcional regulada por el HIF-1 de algunas metaloproteinasas y la lisil oxidasa, que degradan y remodelan la matriz extracelular. Además, los genes diana del HIF-1 incluyen factores de permeabilidad como VEGF que promueven la intravasación de células cancerosas en los vasos sanguíneos 39.
Las células madre cancerosas (CSC) son una población de células con características similares a las células madre y están asociadas con la aparición, recurrencia, metástasis y resistencia a la quimiorradiación del cáncer. El HIF-1 parece desempeñar un papel importante, o incluso central, en la generación y el mantenimiento de CSC, pero el mecanismo explícito queda por dilucidar 40.
HIF como blanco terapéutico para cáncer
La sobreexpresión de HIF-1α en biopsias tumorales se asocia con una mayor mortalidad de pacientes con cánceres humanos de vejiga, cerebro, mama, cuello uterino, colon, endometrio, pulmón, orofaringe, páncreas, piel y estómago. Se están empezando a descubrir los posibles genes diana regulados por el HIF-1α, que pueden desempeñar un rol en la progresión tumoral; sin embargo, un subconjunto específico de genes diana de HIF-1α difiere según el tipo de cáncer 41. Se ha demostrado que muchos medicamentos en uso actual tienen injerencia en la actividad de esta vía importante para la génesis del cáncer, tales como la anfotericina B, la metformina, algunos antinflamatorios no esteroideos e incluso sustancias naturales como la cúrcuma 42; sin embargo, en este contexto, solo se hará una rápida revisión de las drogas que están actualmente en alguna fase de investigación clínica relevante o que han sido aprobadas por las autoridades regulatorias más importantes en el mundo.
Digoxina. Se sabe que el conocido glucósido cardíaco tiene un efecto anticancerígeno in vitro e in vivo en varios tumores sólidos, ya que inhibe la producción del HIF-1α 43; se encuentra en estudio de fase 2 en cáncer de mama (https://clinicaltrials. gov/ct2/show/NCT01763931).
Ganetespib. Se le conocía anteriormente como STA-9090. Es un inhibidor de Hsp90, chaperona molecular abundante y ubicua que desempeña un papel esencial en muchos procesos celulares, incluido el control del ciclo celular, la supervivencia celular, las hormonas y otras vías de señalización, muy importante en la respuesta al estrés celular y un actor clave en el mantenimiento de la homeostasis celular. Este fármaco aumenta la degradación de Hsp90 mediada por proteasomas e impide la activación de múltiples proteínas oncogénicas, incluida la HIF-1α 44. Actualmente está en un ensayo clínico fase 3 en pacientes con cáncer de pulmón de células no pequeñas avanzado junto con docetaxel (https://www.clinicaltrials.gov/ct2/show/NCT01798485).
SLC-0111 y DTP348. Son moléculas inhibidoras de la anhidrasa carbónica IX (CAIX), la cual es una enzima inducible por hipoxia que promueve la supervivencia, proliferación e invasión de células cancerosas a través de la activación del HIF; CAIX regula el pH celular y se expresa exclusivamente en la superficie celular de las células tumorales, y es uno de los factores clave que influyen en la supervivencia y metástasis de las células cancerosas 45. SLC-0111 se encuentra en un ensayo clínico de fase I (https://clinicaltrials.gov/ct2/ show/NCT02215850); DTP348 es un inhibidor y un radio sensibilizador de CAIX que se encuentra a prueba en cáncer en un ensayo clínico fase I (https://clinicaltrials.gov/ct2/show/ NCT02216669).
PX-478. Es un inhibidor experimental del HIF-1α que ha demostrado actividad antitumoral contra varios xenoinjertos de tumores humanos agresivos 46. Se encuentra en estudio de fase I como agente oral (https://clinicaltrials.gov/ct2/show/ NCT00522652), aunque queda por identificar el mecanismo preciso de mejora de la radiosensibilidad como potenciador de la radiación clínica 47.
Tanespimicina (17AAG). Antibiótico antineoplásico de benzoquinona derivado del antibiótico antineoplásico geldanamicina; esta molécula se une e inhibe las funciones de la proteína de choque térmico 90 (HSP90), lo que promueve la degradación proteosomal de proteínas de señalización oncogénicas que pueden estar sobreexpresadas por las células tumorales 48. Actualmente está en estudio en diferentes cánceres, en sus distintas fases. (https://clinicaltrials.gov/ct2/results?cond=&term=17AAG&cntry=&state=&city=&dist=).
Bortezomib. Es un inhibidor del proteasoma, el cual juega un papel vital en el recambio de proteínas celulares, esencial para la homeostasis de las células; se une de manera reversible a la subunidad similar a la quimotripsina del proteasoma 26S, y previene la degradación de varios factores de transcripción proapotóticos en la célula neoplásica, cuya acumulación activará la muerte celular programada a través de vías mediadas por caspasas; también promueve la hidroxilación de residuos de prolina en las posiciones 402 y 564 por la PHD, lo que conduce a la represión de la actividad transcripcional de HIF-1 y la inhibición de la eritropoyetina, el factor de crecimiento endotelial vascular y los genes de la anhidrasa carbónica IX 49. Está aprobado por la Administración de Alimentos y Medicamentos (FDA, por sus siglas en inglés) en el tratamiento del mieloma múltiple y del linfoma de células del manto 50.
Belzutifan (MK-6482). Es la segunda generación de una molécula pequeña que inhibe al complejo HIF-2α, de tal forma que retarda o detiene el crecimiento de tumores asociados con VHL. Belzutifan recibió la aprobación de la FDA para el tratamiento de determinados tipos de cáncer asociados con la enfermedad de von Hippel-Lindau (VHL) en agosto de 2021 51. El estudio MK-6482-004 (fase 2), con 61 pacientes con cáncer de células renales (CCR) asociado a VHL (algunos de los cuales tenían hemangioblastomas del SNC [HSNC] y/o tumores pancreáticos neuroendocrinos [pNET]), fue el ensayo pivotal para dicha aprobación. Para el CCR asociado a la enfermedad de VHL, hubo una tasa de respuesta global del 49 % (IC 95 %: 36-62) y el 56 % de los que respondieron tuvieron una duración de respuesta ≥12 meses. Los 24 pacientes con HSNC y los 12 pacientes con pNET medibles tuvieron 63 % de tasa de respuesta global (IC 95 %; 41-81) y 83 % (IC 95%, 52-98), respectivamente; las reacciones adversas más frecuentes, incluidas las anomalías de laboratorio, notificadas en ≥20 %, fueron anemia, fatiga, aumento de la creatinina, dolor de cabeza, mareos, aumento de la glucosa y náuseas 52.
Conclusiones
Desde el descubrimiento de la sobreexpresión del HIF-1α en cáncer, se ha investigado mucho sobre la importancia de esta vía de respuesta a la hipoxia en la biología humana, e incluso el Premio Nobel de Fisiología y Medicina del año 2019 se entregó a Kaelin, Ratcliffe y Semenza por su trabajo pionero sobre la detección de oxígeno y adaptación a la hipoxia 52. La hipoxia es una característica fundamental del microambiente tumoral en muchos tipos de cáncer, capaz de generar capacidades importantes en la célula que le permiten crecer en ambientes hostiles y que puede desarrollar resistencia tanto a la radioterapia como a la quimioterapia. Las células tumorales responden a los cambios del oxígeno a través del factor transcripcional HIF para orquestar un gran número de ataques y funciones celulares esenciales.
Sin embargo, a pesar de que se han estudiado cientos de compuestos, existen en la actualidad pocos inhibidores del HIF en estudios clínicos en sus distintas fases o aprobados en el mercado mundial. Se ha encontrado que varios inhibidores de HIF-1 mejoran la eficacia terapéutica de los medicamentos contra el cáncer, por tanto, ha superado la resistencia a los medicamentos contra el cáncer con sus ventajas y limitaciones. Sin embargo, se requiere con urgencia la identificación de marcadores hipóxicos y análisis genómicos para permitir que los inhibidores de HIF-1 se adapten a tipos de cáncer específicos y pacientes individuales.
Los futuros estudios del HIF-1α serán cruciales para mejorar nuestra comprensión de los distintos fenómenos, así como para desarrollar nuevas tecnologías, tratamientos e intervenciones. Sin investigación y exploración continuas, se corre el riesgo de quedarse estancados y de perder los avances potenciales que podrían tener implicaciones significativas para la sociedad. Los futuros estudios sobre HIF podrían brindar aportes significativos. En primer lugar, ayudarían a desarrollar nuevos tratamientos para enfermedades que comprenden la desregulación del HIF. En segundo lugar, podrían dar alguna luz sobre los mecanismos por los cuales el HIF regula varios procesos fisiológicos. Esto podría tener implicaciones importantes, de manera que se pueda comprender cómo responde el cuerpo a la hipoxia (niveles bajos de oxígeno) y cómo podrían mejorarse estas respuestas en determinados contextos. Finalmente, la investigación sobre el HIF podría tener implicaciones más amplias en lo que respecta a la comprensión de la señalización celular y la expresión génica en general, y su estudio podría ser un aporte para comprender mejor estas redes y desarrollar nuevos enfoques para manipularlas.











 texto en
texto en