Introducción
El embarazo normal involucra cambios metabólicos en la mujer 1. Los requerimientos de nutrientes y oxígeno se incrementan, lo que genera gran cantidad de especies reactivas del oxígeno (ERO) en los tejidos materno y fetal 2. Su equilibrio favorece un embarazo normal, pero su desequilibrio, aunado a factores genéticos, ambientales y nutricionales desfavorables, influencia la aparición de DMG 3. La DMG es una patología de alta prevalencia, similar a la diabetes mellitus tipo 2 (DMT2) y la obesidad a nivel mundial 4. Representa un estado transitorio con alteración en la sensibilidad a la insulina e intolerancia a los HCO 5, compromete la homeostasis de la glucosa 6 y ocasiona hiperglucemia materna. La hiperglucemia materna aumenta la autooxidación de la glucosa 7, la formación del radical superóxido (O₂), precursor del peróxido de hidrógeno (H₂O₂) 8, y la producción de ERO, entonces, se instaura el estrés oxidativo (EO) 9. Derivado de lo anterior, se reducen las defensas enzimáticas antioxidantes, como son superóxido dismutasa (SOD), glutatión peroxidasa (GxP) y catalasa (cat) 10. Este desequilibrio del sistema oxidante/antioxidante intensifica la resistencia a la insulina (RI) 11, que ocasiona descontrol metabólico e inflamatorio, con producción excesiva de citocinas proinflamatorias del tipo interleucina-1 (IL-1), interleucina-6 (IL-6), factor de necrosis tumoral alfa (TNF-α, por sus siglas en inglés), resistina, leptina y adiponectina 12; por tanto, se altera la inmunidad humoral, con consecuencias nocivas para la salud del binomio materno-fetal a corto y largo plazo 13.
La dieta desempeña un papel clave, particularmente el tipo y cantidad de HCO que se consumen e impactan en los niveles y control de la glucemia 14. La ingestión elevada de HCOS durante la gestación, como la sacarosa, azúcar de mesa, productos industrializados y bebidas con azúcares añadidos 15, contribuye al incremento acelerado de peso, al descontrol de la glucemia y al desarrollo de complicaciones como DMG, preeclampsia y parto prematuro 16. El consumo de HCO, particularmente de la sacarosa, y su relación con el sistema de defensa antioxidante y el EO en las pacientes con DMG ha sido poco estudiado. Por tal motivo, el objetivo de este estudio fue identificar la influencia del consumo de HCO sobre el estado oxidante en mujeres con y sin DMG.
Materiales y métodos
Diseño y población de estudio
Es un estudio transversal, observacional y comparativo. Se llevó a cabo en el Hospital Materno Perinatal "Mónica Pretellini Sáenz" en Toluca, México, de enero a diciembre del 2022. Se realizó un muestreo por conveniencia, no probabilístico. Se invitó a participar a un total de 100 pacientes que acudieron a consulta médica y nutricional, por primera vez, referidas por el centro de salud de su comunidad. Aceptaron participar un total de 42 mujeres embarazadas, quienes firmaron la carta de consentimiento informado y cumplieron con los criterios de inclusión. Se formaron dos grupos: a) grupo de mujeres embarazadas sin DMG (GsDMG, n = 21) y b) grupo de mujeres embarazadas con DMG (GcDMG, n = 21). Los criterios de inclusión fueron edad de 18-41 años, tener entre 22 y 34 semanas de gestación (SDG) e índice de masa corporal (IMC) pregestacional ≤30. La presencia o no de DMG se corroboró mediante la prueba sérica en ayunas con curva de tolerancia a la glucosa, realizada en el laboratorio del hospital. Se tomaron en cuenta las pautas de la Asociación Americana de Diabetes (ADA) 17 y la glucosa plasmática en ayunas ≥95 mg/dL. Los criterios de exclusión fueron pacientes con diagnóstico de diabetes mellitus tipo 1 (DMT1) o DMT2 previo al inicio del embarazo, hipertensión, enfermedades diagnosticadas previo al embarazo, IMC pregestacional >30, menores de 18 y mayores de 41 años.
Variables y mediciones
Variables dependientes: cat, SOD, capacidad antioxidante total, MDA. Variable independiente: consumo de hidratos de carbono. Variables independientes sociodemográficas: edad, IMC, SDG, escolaridad, ocupación, estado civil.
Una vez que las pacientes aceptaron participar en el estudio y firmaron su carta de consentimiento informado, se procedió a la recolección de los siguientes datos:
Historia clínica: datos sociodemográficos, antecedentes heredofamiliares (AHF), personales patológicos, no patológicos y obstétricos por medio del interrogatorio directo de cada participante.
Datos antropométricos: se cuantificó peso corporal y estatura. Para la toma de peso corporal se utilizó una báscula marca Tanita® , modelo BWB-800A, clase III (Tokio, Japón); y para la estatura, un estadímetro mecánico de pared marca Seca, modelo 206 (Hamburgo, Alemania). Con estos datos se calculó el IMC gestacional utilizando la siguiente fórmula: IMC = peso (kg)/estatura (m2).
Datos bioquímicos y marcadores oxidantes y antioxidantes: previo a la consulta, se realizó pruebas de glucemia, colesterol total (CT) y triglicéridos (TG); los resultados se obtuvieron del expediente clínico al momento de la consulta. La muestra para marcadores oxidantes y antioxidantes se recogió durante la consulta médica. Para ello, la paciente se presentó en ayunas (8 h). Se recolectaron 5 mL de sangre total por personal estandarizado del hospital con un tubo Vacutainer® sin anticoagulante de 6 mL, rotulado con número de folio identificable para cada participante. Las muestras fueron centrifugadas a 3000 r. p. m. por 10 minutos para aislar el suero, almacenadas en microtubos de 1,5 mL y congeladas a -80 °C hasta su posterior análisis.
Procesamiento de marcadores oxidantes y antioxidantes: a partir de los sueros obtenidos se cuantificaron los siguientes parámetros, por ensayo de ELISA-test y de acuerdo con las especificaciones del proveedor: cat (kit de ensayo de catalasa EnzyChrom, No. cat. ECAT-100, California, EUA), SOD (kit de ensayo de superóxido dismutasa EnzyChrom, No. Cat. ESOD-100, California, EUA), CAT (kit de ensayo de antioxidante EnzyChrom, No. Cat. DTAC-100, California, EUA) y MDA para determinar sustancias reactivas del ácido tiobarbitúrico (kit de ensayo TBARS [DTBA-100] QuantiChrom, California, EUA). Todos los kits fueron de la marca comercial BioAssay Systems. Para la lectura de las muestras, se utilizó un lector de ELISA con un rango de absorbancia de 400 a 750 nm de la marca BioTek ELx800TM (Friedrichshall, Alemania).
Evaluación dietética: se realizó por interrogatorio directo. Personal estandarizado y capacitado en perfil nutricional (nutricionista de formación), que forma parte del equipo, estuvo a cargo de la evaluación; se utilizó un recordatorio de 24 horas. Los alimentos se registraron según las cantidades en tazas y gramos, para categorizarlos usando el Sistema Mexicano de Equivalentes (SME) 18. Para el análisis de la dieta y cuantificación del consumo diario se empleó el programa Nutrikcal VO 19, con las siguientes variables: kilocalorías totales por día (kcal/día), HCOT, HCOS, HCOC, lípidos y proteínas en gramos. Para el cálculo de los HCOS por día se utilizó la lista de alimentos con contenido de sacarosa por cada 100 gramos de consumo, que utiliza el SME. Los alimentos con alto contenido de sacarosa fueron categorizados en gramos: a) 21 a 40 g de sacarosa, b) 11 a 20 g de sacarosa, c) 5 a 10 g de sacarosa y d) <5 g de sacarosa.
Análisis estadístico
Los datos se expresaron como media ± desviación estándar y mediana. Se evaluó la normalidad de los datos mediante la prueba de Shapiro-Wilk. Para comparar las diferencias entre los grupos homogéneos se utilizó la prueba t de Student para muestras independientes y U de Mann-Whitney para las variables no homogéneas. Se aplicó la correlación de Spearman. Los análisis se realizaron con el programa estadístico Statistical Package for the Social Sciences (SPSS, versión 19.0; SPSS Inc., Chicago, IL, USA). Se consideró estadísticamente significativo un valor de p ≤ 0,05.
Consideraciones éticas
El estudio fue aprobado por el Comité de Ética en Investigación de la Facultad de Medicina de la Universidad Autónoma del Estado de México y por el Comité de Investigación y Comité de Ética en Investigación del propio hospital (No. Reg. 2019-09-652). Los autores declararon su compromiso de confidencialidad y protección de la información recogida durante la investigación.
Resultados
Datos sociodemográficos y antropométricos
El GcDMG mostró una media de edad significativamente mayor, comparada con el GsDMG, como se muestra en la Figura 1. En el GsDMG, las pacientes tienen predominantemente escolaridad básica, dedicación al hogar, viven en unión libre, habitan en zona rural y cuentan con casa propia. En contraste, las pacientes del GcDMG tienen escolaridad media, también se dedican al hogar, habitan en zona rural y tienen casa propia, pero en su mayoría son casadas. Los antecedentes obstétricos en el GsDMG mostraron que un alto porcentaje de las pacientes son primíparas, no han tenido abortos previos ni antecedentes personales de DMG. Ahora bien, en el GcDMG, las pacientes fueron multíparas, sin antecedente
significativo de abortos previos y un pequeño porcentaje tuvo antecedente personal de DMG. Respecto a los AHF, el GcDMG tiene porcentaje elevado de DMT2, obesidad, hipertensión y dislipidemias, en comparación con el GsDMG (Figura 1).
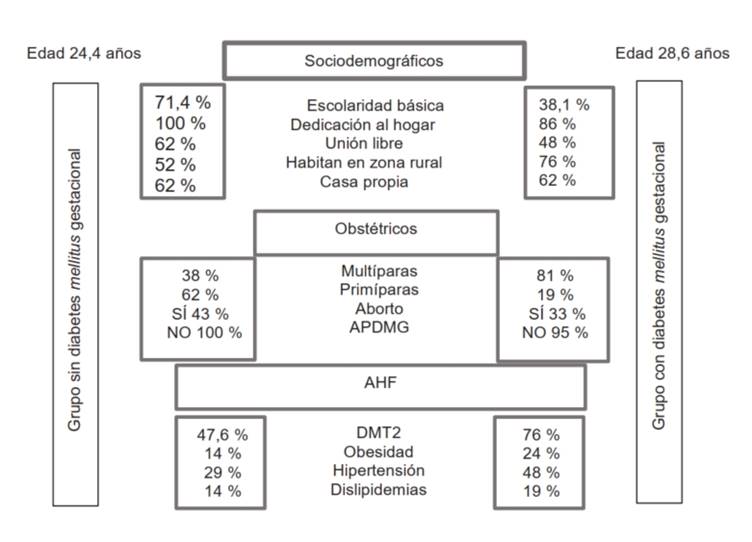
Figura 1 Comparación de los datos sociodemográficos, obstétricos y AHF de pacientes con y sin DMG. Los datos representan el porcentaje de cada grupo, n = 21 por grupo de mujeres embarazadas con y sin DMG.
En cuanto a las SDG al momento de diagnosticar la DMG, no hubo diferencias significativas (p > 0,903) entre los grupos, con una media de 29 ± 4 para el GsDMG y de 30 ± 4 para el GcDMG. El peso pregestacional y gestacional de las pacientes, así como el IMC pregestacional y gestacional fueron significativamente mayores en el GcDMG, en comparación con el GsDMG (Tabla 1).
Tabla 1 Características antropométricas y bioquímicas de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica
| GsDMGa Media ±DE (n = 21) | GcDMGb Media ±DE (n = 21) | Valor p | |
|---|---|---|---|
| Edad (años) | 24,4 ± 4 | 28,6 ± 6 | 0,026* |
| Peso pregestacional (kg) | 55,8 ± 7,5 | 61,5 ± 6,2 | 0,011* |
| Peso gestacional (kg) | 63,4 ± 8 | 69,5 ± 8 | 0,020* |
| IMCc pregestacional (kg/m2) | 22,5 ± 2,6 | 26,2 ± 2,6 | 0,001* |
| IMC gestacional (kg/m2) | 25,6 ± 2,6 | 29,6 ± 2,6 | 0,001* |
| Glucosa sanguínea gestacional (mg/dL) | 76,7 ± 6 | 121,7 ± 14,3 | 0,001* |
| Mediana | Mediana | ||
| CT (mg/dL) | 210 | 201 | 0,039* |
| TG (mg/dL) | 195 | 221 | 0,029* |
a Grupo sin diabetes mellitus gestacional.
b Grupo con diabetes mellitus gestacional.
c Índice de masa corporal.
Los valores representan la media ±DE y la mediana de los datos antropométricos y bioquímicos de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica Pretellini Sáenz". Para comparar los grupos, se utilizó t de Student para muestras independientes y U de Mann-Whitney (CT y TG) para los datos no homogéneos. Las diferencias se consideraron significativas con una p < 0,05.
Datos bioquímicos
Glucemia, CT y TG
La glucemia y los TG se encontraron elevados significativamente en el GcDMG en comparación con el GsDMG. En contraste, el CT tuvo concentraciones menores en el GsDMG en comparación con el GcDMG (Tabla 1).
Evaluación del estado oxidante/antioxidante
En relación con el estado antioxidante, el único parámetro que no tuvo diferencia entre los grupos fue la CAT (Tabla 2). Sin embargo, los valores obtenidos para cat y SOD fueron significativamente mayores en el GcDMG en comparación con el GsDMG. El mismo comportamiento se observó en la oxidación lipídica, donde la concentración en el GcDMG fue elevada en relación con el GsDMG (Tabla 2).
Tabla 2 Marcadores oxidantes/antioxidantes en suero de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica
| GsDMGa Mediana (n = 21) | GcDMGb Mediana (n = 21) | Valor p | |
| CAT (M) | 0,055 | 0,062 | 0,414 |
| SOD (U/mL) | 0,068 | 0,082 | 0,013* |
| Cat (U/L) | 344 | 357 | 0,011* |
| MDA ( M) | 22,49 | 23,68 | 0,039* |
a Grupo sin diabetes mellitus gestacional.
b Grupo con diabetes mellitus gestacional.
Los valores representan la mediana de los marcadores oxidantes y antioxidantes en suero de mujeres gestantes del Hospital Materno Perinatal "Mónica Pretellini Sáenz". Para comparar los grupos, se utilizó la prueba U de Mann-Whitney para observar las diferencias. Las diferencias se consideraron significativas, con una p < 0,05.
Evaluación dietética y consumo de HCO
En relación con la evaluación dietética, el GsDMG consumió significativamente más calorías, agua, HCOT a expensas de los HCOC. Respecto al GcDMG, el consumo fue menor, excepto en los HCOS, donde el consumo fue mayor con relación al GsDMG. En el consumo de proteínas y lípidos, no hubo diferencia entre los grupos (Tabla 3).
Tabla 3 Evaluación dietética de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica Pretellini Sáenz"
| GsDMGa Media ±DE (n = 21) | GcDMGb Media ±DE (n = 21) | Valor p | |
| Kilocalorías/día | 1,932 ± 5,2 | 1,700 ± 21 | 0,047* |
| Consumo de agua (ml/día) | 1,633 ± 47 | 1,302 ± 25 | 0,017* |
| Mediana | Mediana | ||
| HCOT (g/día) | 254 | 226 | 0,032* |
| HCOCc/día (g/día) | 208 | 168 | 0,015* |
| HCOSd/día (g/día) | 39 | 62 | 0,028* |
| % HCOS/día | 16 | 23 | 0,001* |
| Proteínas (g/día) | 77 | 66 | 0,061 |
| Lípidos (g/día) | 69 | 56 | 0,232 |
a Grupo sin diabetes mellitus gestacional.
b Grupo con diabetes mellitus gestacional. c Hidratos de carbono complejos por día.
d Hidratos de carbono simples por día.
Los valores representan la media ±DE y la mediana de consumo de macronutrimentos en mujeres gestantes con y sin DMG. Se realizó la comparación de los grupos, para las variables homogéneas se utilizó la prueba t de Student para muestras independientes y para las variables no homogéneas la prueba de U de Mann-Whitney. Las diferencias se consideraron significativas, con una p < 0,05.
En relación con la fuente de obtención de la sacarosa, el GcDMG consumió mayor cantidad de refrescos de cola y de sabor, leche, agua de sabor azucarada, azúcar de mesa y pan dulce en comparación con el GsDMG. De forma global, el GcDMG consumió 773,9 g de sacarosa por día en contraste con los 600,1 g consumidos en el GsDMG (Tabla 4).
Tabla 4 Consumo de sacarosa en gramos por día de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica Pretellini Sáenz"
| Sacarosa (g) | Sacarosa (g) | ||||
|---|---|---|---|---|---|
| Alimento | GsDMGa | GcDMGb | Alimento | GsDMGa | GcDMGb |
| 21 a >40 g de sacarosa | 11 a 20 g de sacarosa | ||||
| Refresco de cola (350 mL) | 0 | 105 | Yogurt (240 mL) | 33 | 11 |
| Refresco sabor (350 mL) | 30 | 30 | Plátano (1 pza.) | 153 | 85 |
| Galletas (100 g) | 22 | 0 | Papaya (100 g) | 44 | 33 |
| Chocolate en polvo (1 cda.) | 13 | 13 | |||
| Leche | 0 | 101 | |||
| Total | 52 | 135 | Total | 243 | 243 |
| Naranja (1 pza.) | 5 a 10 g de sacarosa | ||||
| Mango (1 pza.) | 14 | 43 | Mermelada (1 cda.) | 8 | 0 |
| Mandarina (1 pza.) | 0 | 8 | Azúcar de mesa | 134 | 151 |
| Total | 17 | 17 | Pan de dulce (100 g) | 57 | 78 |
| 31 g | 68 g | Total | 199 g | 229 g | |
| <5 g de sacarosa | |||||
| Queso Oaxaca (100 g) | 5 | 15 | Espinaca (100 g) | 0 | 0 |
| Manzana (1 pza.) | 26 | 18 | Aguacate (100 g) | 0,07 | 0 |
| Sandía (35 g) | 0 | 2 | Chícharos (100 g) | 5 | 10 |
| Pera (1 pza.) | 2 | 1 | Sopa de pasta cocida (50 g) | 0,86 | 0,97 |
| Huevo de gallina (1 pza.) | 0,21 | 0,48 | Avena (100 g) | 0,8 | 0 |
| Tocino (20 g) | 0 | 0,45 | Hojuelas de maíz (50 g) | 10 | 14 |
| Arroz (150 g) | 1 | 4 | Una cucharadita de crema | 0,1 | 0 |
| Papa o camote (1 pza.) | 5 | 3 | Mayonesa (1 cdita.) | 0,06 | 0 |
| Zanahorias (50 g) | 0 | 11 | Tortilla (1 pza.) | 19 | 19 |
| Total | 39,21 g | 54,93 g | Total | 35,89 g | 43,97 g |
| Total | 122,21 | 257,93 | Total | 477,89 | 515,97 |
| Total | GsDMG | 600,1 g | Total | GcDMG | 773,9 g |
a Grupo sin diabetes mellitus gestacional.
b Grupo con diabetes mellitus gestacional.
La tabla representa el consumo de sacarosa en gramos o porciones por día mediante frecuencia de consumo de alimentos de mujeres gestantes con y sin DMG del Hospital Materno Perinatal "Mónica Pretellini Sáenz". En proporción de medida: pieza (pza.), cucharadita (cdita. [se refiere a una cuchara cafetera]), cucharada (cda. [se refiere a una cuchara sopera]), taza (equivale a 240 mL).
La frecuencia y cantidad de consumo de sacarosa en el GcDMG fue a expensas de naranjas, agua de sabor, azúcar de mesa por día, pan dulce, queso Oaxaca, huevo, arroz, zanahoria, chícharos, sopa de pasta, hojuelas de maíz, leche y tortillas; por el contrario, el GsDMG consumió yogurt, plátano, papaya, mermelada, manzana, pera, papa o camote, avena, crema y mayonesa.
Se realizaron las correlaciones de consumo entre HCOT, HCOS y HCOC con las variables de estudio. El GsDMG muestra correlación significativa con los TG, kcal, lípidos y proteínas. Por otro lado, en el GcDMG, las correlaciones únicamente fueron significativas con variables como kcal, proteínas y la CAT, como se muestra en la Tabla 5. Las correlaciones entre el consumo de HCOT, HCOS y HCOC por día con la SOD, cat y MDA no mostraron significancia estadística (Tabla 5).
Tabla 5 Correlaciones positivas entre los grupos de mujeres embarazadas con y sin DMG
| GsDMGa | GcDMGb | |||||
|---|---|---|---|---|---|---|
| HCOTc | HCOCd | HCOSe | HCOT | HCOC | HCOS | |
| TG | 0,031 | 0,020 | -- | -- | -- | -- |
| kcal/día | 0,001 | 0,001 | 0,006 | 0,001 | 0,009 | 0,003 |
| Lípidos | 0,017 | 0,029 | -- | -- | -- | -- |
| Proteínas | 0,005 | 0,010 | 0,037 | 0,023 | -- | 0,008 |
| CATf | -- | -- | -- | -- | -- | 0,029 |
a Grupo sin diabetes mellitus gestacional.
b Grupo con diabetes mellitus gestacional.
c Hidratos de carbono totales.
d Hidratos de carbono complejos.
e Hidratos de carbono simples.
f Capacidad antioxidante total.
Se realizó correlación de Spearman, cuyos resultados en la tabla representan las correlaciones positivas entre las variables de mujeres embarazadas con y sin DMG y el consumo de HCOT, HCOC e HCOS. Las diferencias se consideraron significativas, con una p < 0,05.
Discusión
La DMG es transitoria con hiperglicemia espontánea de severidad variable durante el embarazo 20. La fisiopatología y etiología todavía no se comprenden por completo, pero se relacionan con cambios hormonales que afectan la sensibilidad a la insulina y la función de las células β pancreáticas 21. Los factores de riesgo comprenden origen étnico, edad, IMC pregestacional y antecedentes personales y familiares de diabetes 22. En este estudio, las mujeres con DMG provienen de zonas rurales, lo que denota nivel económico bajo, edad ≥28 años, peso e IMC pregestacional altos (Tabla 1, Figura 1), en contraste con el GsDMG. El GcDMG tiene AHF de DMT2, obesidad e hipertensión, TG elevados y CT bajo (Tabla 1), lo cual coincide con la literatura científica 23,24.
El tipo de nutrientes y contenido calórico que consumen las pacientes con DMG es poco vigilado previo al diagnóstico y al embarazo. El GsDMG consumió mayor cantidad de kilocalorías, agua, HCOT y HCOC, proteínas y lípidos en comparación con el GcDMG (Tabla 3). Metabólicamente, la calidad de la dieta impacta en la salud del individuo, por ejemplo, el tipo de HCO que consumen tiene impacto en el control de la glicemia 25. En este estudio, el GsDMG consumió mayor cantidad de HCOT y HCOC, en contraste con el GcDMG, que consumió alto porcentaje de HCOS como la sacarosa, pero menor cantidad de proteína por día. Esta rutina de consumo predispone a enfermedades metabólicas en las pacientes y su descendencia 26. La OMS recomienda idealmente un consumo de HCOS menor al 10 % del total de kilocalorías por día 27. En este estudio ambos grupos rebasaron esta recomendación y consumieron 16 % (GsDMG) y 23 % (GcDMG) de HCOS (Tabla 3). En proporción, se debe consumir más HCOC con bajo índice glicémico y menos HCOS para un óptimo control glicémico y prevención de complicaciones maternas y fetales 28, situación que no se observó en estas pacientes.
Estado de los antioxidantes enzimáticos y prooxidantes en la DMG
Con la finalidad de mantener un ambiente adecuado para el feto y el cuerpo materno, se debe lograr un balance entre las ERO, los oxidantes y antioxidantes 29. Este proceso fisiológico, bajo diversas condiciones, puede desbordarse y culminar con un desbalance entre el incremento de las ERO y la disminución del sistema antioxidante 30,31. En mujeres gestantes con antecedentes hereditarios y personales de DM con más de tres factores de riesgo presentes para DMG, este equilibrio frágil se rompe y conduce al debut de la enfermedad 32. La actividad antioxidante mantiene niveles estables de oxígeno en la placenta, y el agotamiento de la capacidad antioxidante derivado de la reducción en el consumo o suplementación afecta a las células y genera EO 33. Las pacientes del GcDMG consumieron alimentos con alto contenido de antioxidantes: zanahoria, naranja
y mango en mayor cantidad que el GsDMG, pero no la suficiente. El GcDMG en su historia clínica reporta no haber consumido ningún suplemento ya sea vitamínico, ácido fólico, etc., por lo menos al momento de haber realizado el estudio. Ahora bien, el deterioro de la actividad antioxidante durante la placentación conduce al aumento en la peroxidación de lípidos, daño endotelial y producción de MDA 34. Las pacientes del GcDMG mostraron concentraciones elevadas de CAT, SOD, cat y MDA. La CAT aumenta paulatinamente en el 2.o y 3.er trimestre del embarazo 35; niveles bajos de CAT en el embarazo se asocian con reducción de la actividad del SOD 36. En este estudio, ambos se encontraron elevados. En contraste, la disminución del SOD promueve bajos niveles de TG, CT y LDL en plasma 37; en este estudio, el SOD se encontró elevado con disminución del CT, pero no los TG (Tabla 1). Lo anterior demuestra la presencia de EO con incremento de SOD y MDA en estas pacientes a partir del 2.o trimestre del embarazo. Las pacientes con DMG en su etapa temprana de embarazo pudieron presentar deficiencia de antioxidantes y en un corto plazo ocasionar el debut de DMG 13. Esto coincide con reportes de mujeres embarazadas suplementadas en las primeras SDG con vitaminas, antioxidantes y minerales, donde se mejoró la actividad de la cat y CAT, por tanto, se registró una disminución de EO 38. Además, en las mujeres embarazadas se intensifica la RI, el desequilibrio oxidante/antioxidante con aparición de EO y un estado inflamatorio materno con daño al producto 39. La alteración del estado metabólico, sumado a la autooxidación de la glucosa conduce a la formación del O₂, precursor del H₂O₂, que favorece el incremento en los niveles de MDA 40. En este estudio se incrementaron los niveles del MDA en el GcDMG, lo que indica mayor peroxidación lipídica (MDA) y, por consiguiente, mayor EO (Tabla 2). Por otro lado, en el GcDMG se encontró la cat plasmática aumentada, lo que significa mayor producción de H₂HO₂ que estimula la activación de la enzima para
eliminarlo; sin embargo, la producción de H₂HO₂ supera la capacidad de la enzima, por tanto, ocasiona la presencia del EO 39. Esto se ha demostrado en estudios previos donde la MDA va acompañada de disminución de la actividad enzimática de la cat 41, lo que es consistente con este estudio. Sin embargo, en el embarazo, la generación fisiológica de ERO está relacionada con una variedad de procesos de desarrollo que van desde la maduración del ovocito hasta la luteólisis y la implantación del embrión 42.
Este estudio abre la pauta para relacionar la presencia de DMG y EO con otras variables no fisiológicas como son el consumo de HCOS y de HCOC. En el GcDMG, el consumo de sacarosa se correlacionó positivamente (r = 0,476, p < 0,05) con los valores de CAT, lo que sugiere que el consumo elevado de sacarosa por día aumenta las cifras de CAT en suero en las mujeres con DMG de este estudio.
En una investigación donde se compararon los valores de la CAT en mujeres embarazadas con y sin diabetes gestacional, se encontró que la concentración de antioxidantes en mujeres con DMG fue significativamente menor que en mujeres embarazadas sanas 43, lo que concuerda con los resultados de este estudio. Las participantes del GcDMG tuvieron cifras mayores de CAT, debido, quizá, a un esfuerzo fisiológico por mantener el equilibrio entre los oxidantes y antioxidantes 42, y así evitar el daño oxidativo durante la DMG.
El consumo crónico y habitual de HCOS como la sacarosa podría estar relacionado con la elevación de las cifras de enzimas antioxidantes para mantener el equilibrio con los oxidantes en la DMG.
En la Figura 2, se muestra la interacción entre las variables de este estudio en los grupos con y sin DMG.
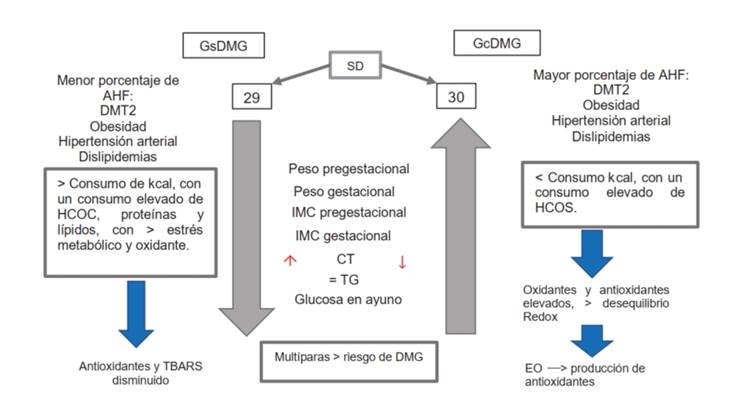
Figura 2 Comparativo de las variables sociodemográficas, antropométricas, bioquímicas, oxidantes/antioxidantes y SDG entre los grupos con y sin DMG
En cuanto a las limitaciones de este estudio, la muestra de pacientes fue limitada y solo se utilizó un recordatorio de 24 horas, debido a que el estudio se realizó durante los años de pandemia por COVID-19, motivo por el cual no fue posible ampliar el número de participantes ni contactarlas de manera subsecuente. Muchas de ellas no contaban con número de contacto, no tenían fácil acceso a internet, debido a que el mayor porcentaje era de zona rural, y la mayoría tenía cita médica abierta solo para el momento del parto.
Con el objetivo de reducir el sesgo de memoria, durante la evaluación dietética, se utilizaron imágenes y referencias de tazas y gramos de los alimentos para su registro durante el levantamiento del recordatorio de 24 horas, además, el interrogatorio se realizó a primera hora de la mañana. Otro factor que debe considerarse fue el control del ambiente y, para evitar el sesgo, se requirió de un lugar tranquilo, sin distracciones al momento del interrogatorio. Sin embargo, los datos resultaron interesantes y relevantes para el tipo de estudio que se propone y ello da apertura para realizar otros estudios con otros métodos de evaluación de la dieta como registros de alimentos, cuestionarios de frecuencia de consumo o más de dos recordatorios de 24 horas para relacionarlos con marcadores de EO en la DMG.
En conclusión, en el GcDMG se encuentran factores de riesgo presentes para DMG, por lo tanto, es aconsejable que las mujeres en edad reproductiva y embarazadas adopten estilos de vida saludables, mediante la práctica de ejercicio físico, una dieta equilibrada y el consumo de antioxidantes exógenos. Estos cambios podrán prevenir y mitigar el aumento de la MDA, así como restaurar el equilibrio entre la producción de oxidantes y los antioxidantes. El GcDMG mostró desequilibrio entre el estado oxidante/antioxidante: valores altos de cat, SOD, CAT y MDA en comparación con el GsDMG. Es necesario continuar estudiando la influencia de la sacarosa con otras variables de tipo inflamatorio en las pacientes con DMG. Cabe señalar que el GcDMG consumió menos kilocalorías totales a expensas de HCOS, pero con mayor cantidad de sacarosa; en contraste con el GsDMG, que consumió más kilocalorías totales, pero a expensas de HCOC con menor contenido de sacarosa. El consumo crónico y habitual de HCOS como la sacarosa se asoció con el incremento de las enzimas antioxidantes y de la MDA en el GcDMG.
Contribuciones de los autores: JGA participó en la implementación de la investigación, la recolección de datos, el análisis y la escritura del manuscrito. BEMC trabajó en la conceptualización de la investigación, metodología, adquisición de fondos, supervisión, escritura, revisión y edición del manuscrito. HMZ supervisó la recolección de datos clínicos a partir del expediente clínico, análisis formal de datos y revisión del manuscrito. RAJL realizó el análisis de muestras, la elaboración de base de datos y la recopilación de información. ISGS recolectó la muestra, los datos antropométricos y bioquímicos, y realizó su análisis. IMAM contribuyó con el procesamiento y análisis de muestras de estrés oxidativo. Todos los autores revisaron el artículo y las versiones anteriores del documento.
Fuentes de financiamiento: La investigación fue financiada por la Universidad Autónoma del Estado de México y por el Consejo Nacional de Humanidades, Ciencia y Tecnología (Conahcyt) por la beca de doctorado otorgada a la estudiante García-Alvarado para la culminación de sus estudios.















