Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.10 no.1 Lima ene./jul. 2003
Acción de la toxina Hl3 sobre músculo esquelético
Action of toxin Hl3 on skeletal muscle
Enrique Escobar*, Carlos Rivera y Luz Tincopa
Laboratorio de Bioquímica y Genética Molecular. Facultad de Ciencias Biológicas. UNMSM.
Presentado: 13/06/2003
Aceptado: 10/07/2003
Resumen
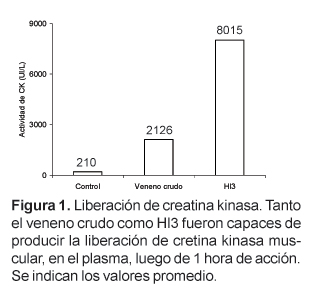
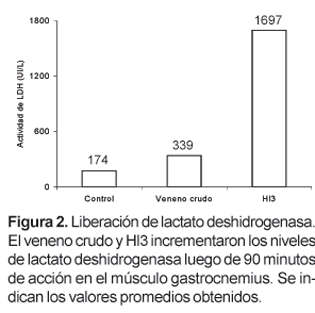
Hl3 es una toxina que, en un trabajo anterior, fue aislada por nuestro grupo de investigación a partir del veneno del escorpión Hadruroides lunatus mediante cromatografía de intercambio iónico en CM-Sephadex C-25 a pH 7, y que se caracteriza por producir contracción y parálisis en la extremidad inoculada de ratones albinos. En este trabajo se ha determinado que la inoculación de Hl3 (26 mg) en el músculo gastrocnemius produce la liberación, en el plasma, de creatina kinasa (CK) y lactato deshidrogenasa (LDH). La actividad de CK se incrementa desde 210 UI/L hasta 8015 UI/L luego de 60 minutos, mientras que la actividad de LDH aumenta desde 174 UI/L hasta 1697 UI/L luego de 90 minutos.
Por PAGE-SDS, se ha demostrado que la incubación de Hl3 (26 mg) con el músculo gastrocnemius aislado de ratones albinos, en medio fisiológico a pH 7, provoca también la liberación de otras proteínas musculares. Además, Hl3 es capaz de incrementar mas de 3,5 veces los niveles normales de calcio intramuscular, luego de 45 minutos de acción.
Nuestros resultados sugieren que Hl3 actúa específicamente a nivel muscular, afectando la permeabilidad del sarcolema y provocando la fuga de proteínas musculares. Además el incremento de los niveles de calcio podría generar hipercontracción y la destrucción de fibras musculares.
Palabras clave: Hadruroides lunatus, veneno de escorpión, Hl3, músculo, calcio.
Abstract
Hl3 is a toxin isolated by our investigation group from Hadruroides lunatus scorpion venom by ion-exchange chromatography on CM-Sephadex C-25 to pH 7, and which produce contraction and paralysis in the inoculated limb of white mice. In this work we have determined that inoculation of Hl3 (26 mg) in gastrocnemius muscle from mice produces the release in plasma of creatine kinase and lactate deshidrogenase. The creatine kinase activity increases from 210 UI/L to 8015 UI/L in 60 minutes, whrereas the LDH activity increases from 174 UI/L to 1697 UI/L in 90 minutes.
By PAGE-SDS it, was demonstrated that incubation of Hl3 with gastrocnemius muscle isolated from white mice, in physiological solution to pH 7, produces the release of other different muscular proteins as well. In addition Hl3 can increase the calcium intramuscular 3,5 fold, after 45 minutes of action.
Our results suggest that Hl3 has specific action on the muscle, affecting the sarcolema permeability and producing the release of muscle proteins. In addition the increase of calcium could produce hipercontraction and destruction of muscular fibers.
Keywords: Hadruroides lunatus, scorpion venom, Hl3, muscle, calcium.
Introducción
Todos los escorpiones son arácnidos que producen un veneno constituido principalmente por toxinas que paralizan a insectos y pequeños crustáceos; sin embargo algunas toxinas de estos venenos también afectan a mamíferos, por lo que el veneno de algunas especies de escorpiones puede ser incluso letal para el hombre. En general, estas toxinas afectan canales iónicos de Na+, K+ Ca++ y Cl-(Borges et al., 1990; Ramírez-Domínguez et al., 2002).
Los primeros reportes sobre venenos de escorpiones de nuestro país datan de hace mas de 30 años y en ellos se describieron algunos efectos tóxicos y farmacológicos de ciertos venenos, sin que las proteínas responsables de la toxicidad fueran aisladas ni identificadas (Aguilar, 1968; Cáceres et al., 1972; Arboleda et al., 1973; Calderón y Aguilar, 1988; Zavaleta, 1983). Sin embargo, pese a que incluso nuevas especies de escorpiones han sido descubiertas para nuestro país (Acosta y Ochoa, 2000; Acosta y Ochoa, 2001; Ochoa y Acosta, 2002), el único estudio sobre la separación de proteínas de algún veneno de nuestra fauna escorpiónica es recién del año 2002, habiéndose descrito en el veneno de H. lunatus, la identificación y purificación parcial de tres toxinas, una de ellas con acción específica en ratones albinos (Escobar et al., 2002). Esta toxina, capaz de producir contracción y parálisis reversible de la extremidad inoculada de los roedores y que fue denominada Hl3, resultó ser la proteína responsable del mismo efecto que ya en 1972 se había descrito por primera vez para el veneno crudo de H. lunatus (Cáceres et al., 1972).
Como parte del interés en conocer la acción de esta toxina, en este trabajo se ha estudiado el efecto de Hl3 en músculo gastrocnemius de ratones albinos y se ha encontrado que la toxina provoca la fuga de diversas proteínas musculares y que además incrementa los niveles de calcio intramuscular, el cual, como se sabe, es un segundo mensajero involucrado en procesos de destrucción celular (Trump et al., 1981).
Material y métodos
1) Toxina Hl3.
La toxina Hl3 fue aislada del veneno de Hadruroides lunatus de acuerdo al método de Escobar et al. (2002).
2) Cuantificación de proteína.
En todos los ensayos el contenido proteico se determinó por el método de Lowry et al. (1951), usando albúmina bovina como proteína estándar.
3) Liberación de creatina kinasa (CK).
Tres grupos de cuatro ratones albinos cada uno y 20 g de peso por animal, fueron inoculados en el músculo gastrocnemius con 100 mL de buffer acetato de amonio 0,05 M pH 7, 100 mL de veneno crudo (100 mg) o 100 mL de Hl3 (26,8 mg), respectivamente. Después de 1 hora, los ratones fueron anestesiados con éter e inmediatamente se colectó 0,4 mL de sangre del corazón, y se mezcló con 40 mL de citrato de sodio 3,8%, luego de lo cual se centrifugó durante 10 minutos a 300 × g para separar el plasma.
Para medir la actividad de CK, se aplicaron 25 mL de plasma a 1 mL del kit de creatina kinasa de Pointe Scientific, registrándose el incremento en la absorbancia a 340 nm durante 4 minutos. La actividad fue expresada en UI/L, que es la cantidad de enzima que cataliza la transformación de 1 mmol de substrato por minuto.
4) Liberación de lactato deshidrogenasa (LDH).
Tres grupos de cuatro ratones albinos cada uno y 20 g de peso por animal, fueron inoculados en el músculo gastrocnemius con 100 mL de buffer acetato de amonio 0,05 M pH 7, 100 mL de veneno crudo (300 mg) ó 100 mL de Hl3 (26,8 mg), respectivamente. Después de 90 minutos, los ratones fueron anestesiados con éter e inmediatamente se colectó 0,4 mL de sangre del corazón, y se mezcló con 40 mL de citrato de sodio 3,8%, luego de lo cual se centrifugó durante 10 minutos a 300 × g para separar el plasma.
Para medir la actividad de LDH, se aplicaron 25 mL de plasma a 1 mL del kit de lactato deshidrogenasa de Pointe Scientific, y se registró el incremento en la absorbancia a 340 nm durante 3 minutos. La actividad fue expresada en UI/L que es la cantidad de enzima que cataliza la transformación de 1 mmol de substrato por minuto.
5) Liberación de otras proteínas musculares.
La acción de Hl3 en el tejido muscular también fue evaluada in vitro, para lo cual se aisló el músculo gastrocnemius y se incubó con 50 mg de Hl3 en 1 mL de buffer fisiológico, bajo aireación constante. A diferentes tiempos (0, 30 y 60 min), se tomaron alícuotas de 20 mL de la solución, para su análisis por PAGE-SDS (Laemmli, 1970) a fin de evaluar la liberación de proteínas musculares (Pantigoso et al., 2002). En el experimento control se procedió de la misma manera, excepto que no se utilizó Hl3. El buffer fisiológico empleado contenía NaCl 6,92 g/L, KCl 0,35 g/L, MgSO4 0,29 g/L, CaCl2 0,28 g/L, KH2PO4 0,16 g/L, NaHCO3 2,1 g/L y glucosa 2 g/L a pH 7,2.
6) Variación en los niveles de calcio intramuscular.
Se trabajó con tres grupos de cuatro ratones albinos cada uno y 20 g de peso por animal. A los animales del primer y segundo grupo se les inyectó en el músculo gastrocnemius 100 mL de Hl3 (26,8 mg), y luego de 45 y 90 minutos se sacrificaron los ratones de cada grupo, respectivamente. Se separó 100 mg de músculo gastrocnemius y se colocó en 3 ml de buffer Imidazol 10 mM, pH 7,1, conteniendo NaCl 140 mM, KCl 5 mM, digitonina 200 mg/ml y Antipirilazo III 0,2 mM. Inmediatamente después de 8 minutos, el músculo se retiró y se leyó la diferencia en la absorbancia a 710 y 790 nm (Murphy et al., 1980). Estos valores fueron convertidos a nmoles de calcio, dividiéndolos entre un factor de calibración correspondiente a 0,0031 nmoles-1. Con los ratones del tercer grupo se procedió de manera similar, pero fueron inyectados con buffer acetato de amonio 0,05 M pH 7 y usados como control.
Resultados y discusión
1) Liberación de creatina kinasa (CK), lactato deshidrogenasa (LDH) y otras proteínas musculares.
La medida de los niveles de CK en el plasma de los ratones tratados durante 1 hora con el veneno crudo o con Hl3 mostró que esta actividad alcanza valores promedio de 2126 UI/L en los ratones tratados con veneno crudo y 8015 en los ratones tratados con Hl3. La actividad de CK en el plasma de los ratones usados como control fue 210 UI/L (Fig. 1). Por otro lado los niveles de LDH en los ratones tratados durante 90 minutos con veneno crudo o Hl3 fueron, 339 UI/L y 1697, respectivamente. Los valores normales de LDH en ratones no tratados estuvieron alrededor de 174 (Fig. 2).
Asimismo, la evaluación por PAGE-SDS, del daño in vitro producido por Hl3 sobre el músculo gastrocnemius aislado demostró que Hl3 es capaz de provocar la liberación de diferentes proteínas musculares al medio de incubación. Este efecto es rápido, ya que se hace evidente desde los 30 minutos. En la Figura 3 se pueden ver estos resultados, y cabe señalar que si bien en los controles también se observan algunas proteínas musculares liberadas, producto del daño natural que ocurre como consecuencia del aislamiento, siempre en el músculo incubado con Hl3 la cantidad de proteínas liberadas es mayor.
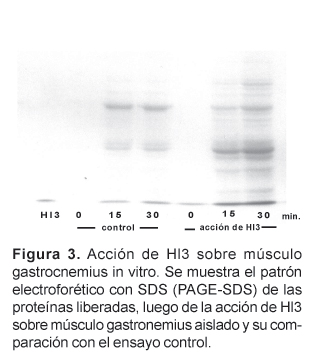
Estos resultados demuestran claramente que Hl3 es capaz de alterar la permeabilidad del sarcolema produciendo como muchas otras miotoxinas la liberación no sólo de las enzimas CK y LDH, sino además de muchas otras proteínas musculares. Sin embargo, no sabemos si este efecto de Hl3 es a través de una acción directa en el sarcolema o indirectamente a través de algunos intermediarios que generan el daño en el sarcolema y la fuga de estas proteínas musculares. Del veneno de Tityus serrulatus se ha aislado una neurotoxina (Ts1) letal para roedores que también provoca la fuga de CK y varias proteínas musculares. Sin embargo, ya que la acción primaria de Ts1 es bloquear canales de sodio, se cree que la liberación de proteínas musculares que produce ocurre a través de ciertos mediadores químicos (Correa et al., 1997).
2) Variación en los niveles de calcio.
Al evaluar los niveles de calcio intramuscular en los ratones inyectados con Hl3, se encontró un valor promedio de 47 nmoles de calcio, 45 minutos después de la inyección, y un valor de 53,8 nmoles a los 90 minutos, lo cual respecto del valor encontrado en los controles (13,2 nmoles), representa un incremento de hasta 4 veces (figura 4). Debemos señalar que en estos ensayos es importante el tiempo que se mantiene el músculo aislado en el buffer imidazol que contiene digitonina y antipirilazo III, pues durante ese tiempo se produce la desorganización del sarcolema por la acción detergente de la digitonina, y de este modo el calcio liberado, que puede ser detectado por el antipirilazo III, es esencialmente del citosol de la fibras musculares. Si se incuba demasiado tiempo, la acción detergente de la digitonina podría extenderse incluso a las membranas del retículo sarcoplasmático y de este modo no se observarían diferencias entre el calcio liberado de los músculos tratados con toxina y los controles.
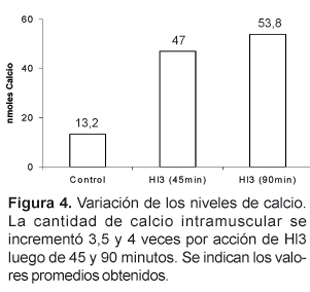
El aumento de calcio producido por Hl3 es particularmente interesante, debido a que podría estar relacionado con la hipercontracción que se observa en la extremidad del ratón después de haber sido inoculado con la toxina; asimismo el incremento de calcio podría activar a proteasas dependientes de Ca++ (Duncan, 1978) y fosfolipasas (Trump et al., 1981). Sin embargo, el mecanismo exacto de cómo se genera y mantiene elevado los niveles de este ion es un aspecto que aún desconocemos. Por otro lado se sabe que el calcio actúa como un segundo mensajero disparando diferentes cascadas, algunas de ellas relacionadas con procesos de destrucción y muerte celular, por lo que es posible que también Hl3 genere cierto grado de necrosis muscular.
Literatura citada
Acosta, L. y J. Ochoa. 2000. Nueva especie de Orobothriurus Mauty del Perú. Revue Arachnologique 13 (10): 135-144. [ Links ]
Acosta, L. and J. Ochoa. 2001. Two new species of Orobothriurus Maury 1976 from Argentina and Peru, with comments on the systematics of the genus (Scorpiones : Bothriuridae). Scorpions 2001. In Memoriam Gary A. Polis. V. Fet & P. A. Selden (eds.). 203-214. [ Links ]
Aguilar, P. 1968. Nota sobre los escorpiones de Lima. Anales Científicos Universidad Nacional Agraria La Molina. VI (3): 165-172. [ Links ]
Arboleda, E.; O. Meneses y P. Aguilar. 1973. Escorpiones y escorpionismo en el Perú. III. El veneno del "escorpión de Lambayeque". Revista Peruana de Entomología. 16 (1): 78-82. [ Links ]
Borges, A.; Arantes, E. and Giglio, J. 1990. Isolation and characterization of toxic proteins from the venom of the Venezuelan scorpion Tityus discrepans (Karsch). Toxicon 28 (9) : 1011-1017. [ Links ]
Cáceres, I.; P. Aguilar, P. y O. Meneses. 1972. Escorpiones y escorpionismo en el Perú. II. Efectos del veneno del "escorpión de los pedregales" en la costa central. Revista Peruana de Entomología. 15 (1) : 38-43. [ Links ]
Calderón, S. y P. Aguilar. 1988. Escorpiones y escorpionismo en el Perú. X: Efecto del veneno de Brachistosternus ehrenbergi sobre ratones albinos. Revista Peruana de Entomología. 30 : 91-93. [ Links ]
Correa, M.; S. Sampaio, R. Lopes, L. Mancuso, O. Cunha, J. Franco and J. Giglio. 1997. Biochemical and histopathological alterations induced in rats by Tityus serrulatus scorpion venom and its major neurotoxin tityustoxin-I. Toxicon 35 (7) : 1053-1067. [ Links ]
Duncan, C. 1978. Role of intracellular calcium in promoting muscle damage: a strategy for controlling the dystrophic condition. Experientia 34, 1531. [ Links ]
Escobar, E.; C. Rivera, L. Tincopa y D. Rivera. 2002. Purificación parcial de las toxinas Hl1, Hl2 y Hl3 del veneno del escorpión Hadruroides lunatus Koch, 1867 (Scorpionida: Vejovidae). Revista Peruana de Biología 9 (1): 3-10. [ Links ]
Laemmli, U. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685. [ Links ]
Lowry, O.; N. Rosebrough, A. Farr and R. Randall. 1951. Protein measurement with the Folinphenol reagent. J. Biol. Chem. 193 : 265-275. [ Links ]
Ochoa, J. and L. Acosta. 2002. Two new andean species of Brachistosternus Pocock (Scorpiones: Bothriuridae). Euscorpius Occasional Publications in Scorpiology (2) : 1-13. [ Links ]
Pantigoso, C.; E. Escobar y A. Yarlequé. 2002. Acción de la miotoxina del veneno de Bothrops brazili Hoge, 1953 (Ophidia : Viperidae). Revista Peruana de Biología 9 (2): 74-83. [ Links ]
Ramírez-Domínguez, M.; T. Olamendi-Portugal, U. García, C. García, H. Arechiga and L. Posani. 2002. Cn11, the first example of a scorpion toxin that is a true of Na+ currents in crayfish neurons. The Journal of Experimental Biology 205, 869-876. [ Links ]
Trump, B.; I. Berezesky and A. Osornio-Vargas. 1981. Cell death and the disease process. The role of calcium. In: Cell death in biology and pathology (Bowen, I. and Lockshim, R. Eds.) London: Chapman and Hall. [ Links ]
Zavaleta, A. 1983. El veneno del escorpión: Bioquímica y Farmacología. Boletín de Lima, N.o 30 , 75-88. [ Links ]
Correspondencia
* Laboratorio de Bioquímica y Genética Molecular. Facultad de Ciencias Biológicas. UNMSM. Apdo. 11-0058, Lima 11, Perú.
E-mail: Enrique Escobar eescobarg@unmsm.edu.pe













