Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.10 n.2 Lima jul./dic. 2003
Actividad antibacteriana de extractos etanólicos de macroalgas marinas de la costa central del Perú
1 Laboratorio de Ficología Marina, Facultad de Ciencias Biológicas, UNMSM.
2 Laboratorio de Microbiología, Instituto del Mar del Perú.
Aceptado: 20/12/2003
Resumen
Se evaluó la actividad antibacteriana de extractos etanólicos de 12 especies de macroalgas marinas. Los extractos fueron obtenidos de acuerdo al protocolo modificado de Vlachos et al. (1996). Cada extracto se enfrentó contra 5 cepas bacterianas de origen clínico y 6 no clínico perteneciente a los géneros Staphylococcus, Enterococcus, Pseudomonas, Escherichia, Salmonella, Aeromonas y Vibrio. De 12 especies de algas ensayadas solamente 5 (Grateloupia doryphora, Ahnfeltiopsis durvillaei, Prionitis decipiens, Petalonia fascia y Bryopsis plumosa) presentaron algún efecto antibacteriano. Asimismo, de 11 cepas bacterianas probadas solamente las cepas clínicas Staphylococcus aureus ATCC 25923 y Enterococcus faecalis ATCC 29212 y la cepa no clínica Staphylococcus aureus ATCC 6633 fueron sensibles a los extractos algales. El extracto etanólico de B. plumosa presentó el mayor efecto antibacteriano contra las dos cepas de S. aureus, manifestándose en el mayor tamaño de sus halos de inhibición, mientras que el extracto de P. fascia mostró mayor espectro antibacteriano, inhibiendo a las 3 cepas mencionadas.
Palabras clave: macroalga, antibiosis, metabolito, actividad antibacteriana, bioactividad.
Abstract
Antibacterial activity of ethanolic extracts from 12 macroalgae were evaluated. Extracts were obtained according to the protocol of Vlachos et al. (1996). Extracts were tested against with 5 clinic strains and 6 no clinic strains of the genus Staphylococcus, Enterococcus, Pseudomonas, Escherichia, Salmonella, Aeromonas y Vibrio. Only Grateloupia doryphora, Ahnfeltiopsis durvillaei, Prionitis decipiens (Rhodophyta), Petalonia fascia (Phaeophyta) and Bryopsis plumosa (Chlorophyta) showed some antibacterial activity against the clinic strains Staphylococcus aureus ATCC 25923 and Enterococcus faecalis ATCC 29212 and the no clinic strain Staphylococcus aureus ATCC 6633. Ethanolic extract of B. plumosa presented the highest antibacterial activity against S. aureus strains. The extract of P. fascia showed the highest antibacterial activity against the three sensible strains.
Keyword: macroalgae, antibiosis, metabolite, antibacterial activity, bioactivity.
Introducción
Los organismos marinos son considerados una importante fuente de sustancias con potencial bioactivo. En este sentido, numerosas revisiones señalan a las algas como uno de los principales productores de estos compuestos (Bhakuni y Silva, 1974; Faulkner, 1984; Stein y Borden, 1984; Glombitza y Koch, 1989; Hay, 1996; González y Silva, 2001).
Los principales compuestos bioactivos producidos por las algas marinas están formados por una amplia gama de metabolitos secundarios, cada uno con una función específica dentro de su medio, atribuyéndoseles entre otras, la defensa química contra herbívoros marinos(Hay et al., 1987a; 1987b; Paul et al., 1987; Pereira et al., 1994). Estos metabolitos también están asociados a la disminución de epífitos, inhibiendo a los organismos competidores y patógenos microbianos (Hay, 1996; Vlachos et al., 1997).
El potencial antibacteriano de las algas se debe a su capacidad para sintetizar, entre otros, a los diterpenos en las algas verdes, terpenos halogenados en las algas rojas y metabolitos mixtos de origen terpeno-aromático en las algas pardas (Bhakuni y Silva, 1974; Fenical, 1975; Vlachos et al., 1997; Carvalho y Roque, 2000).
Estudios realizados en diferentes partes del mundo confirman que los exudados de algunas especies de Chlorophyta, Phaeophyta y Rhodophyta presentan actividad antimicrobiana (Caccamese et al., 1980; Rao y Parekh, 1981; Vlachos et al., 1996; 1997). Aunque el número de especies de macroalgas estudiadas únicamente alcanza alrededor de un 2% del total de las conocidas, en la actualidad los compuestos químicos caracterizados son aproximadamente dos mil, pero solamente en algunos se ha podido establecer claramente el mecanismo de acción (González y Silva, 2001).
En el Perú, las macroalgas Enteromorpha intestinalis (Chlorophyta) y Polysiphonia paniculata (Rhodophyta), han sido reportadas como especies con capacidad antibacteriana (Balta, 1988).
El objetivo del presente trabajo es determinar en 12 especies de macroalgas la presencia de sustancias antibacterianas.
Lugares de recolección
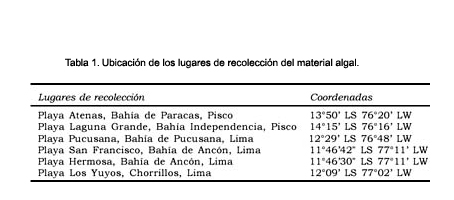
El material algal empleado en el presente estudio se recolectó durante las horas de baja marea en la zona intermareal de seis playas de la costa central: playa Atenas, Laguna Grande, Pucusana, San Francisco, playa Hermosa y Los Yuyos (Tabla 1).
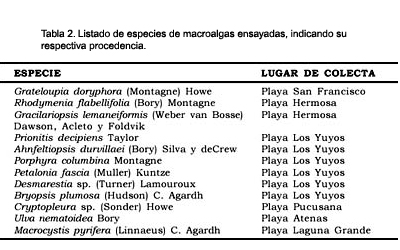
Se recolectaron manualmente plantas completas, incluyendo el disco de fijación de 12 especies de macroalgas marinas representativas de las Rhodophyta, Phaeophyta y Chlorophyta (Tabla 2).
En el presente estudio se trabajó con 11 cepas bacterianas (Tabla 3), cinco cepas de origen clínico proporcionadas por el Laboratorio de Microbiología Molecular de la Facultad de Ciencias Biológicas de la Universidad Nacional Mayor de San Marcos y 6 cepas no clínicas proporcionadas por el Laboratorio de Microbiología del Instituto del Mar del Perú.

Las algas secas fueron premolidas en un molinillo eléctrico, luego endurecidas con nitrógeno líquido y molidas en un mortero hasta obtener un polvo fino. Cada muestra se almacenó a -25 °C hasta el momento de su empleo.
El proceso inicial de extracción (protocolo I) se realizó siguiendo la metodología propuesta por Vlachos et al. (1996). Se mezclaron 10 g de polvo de alga y 20 ml de etanol al 80%, luego se calentó a 80 °C en una manta eléctrica durante 4 horas, luego se filtró en papel Whatman # 1 y el volumen de extracto recuperado se enrasó a 5 ml adicionando etanol al 80%.
Adicionalmente, para obtener un mayor volumen final del extracto, se ensayaron 3 variantes del protocolo inicial. Las variantes realizadas consistieron en modificar la cantidad y los tiempos de adición del etanol. En el primero, se adicionó 10 ml de etanol al 80% dos horas después de iniciado el proceso (protocolo II); en el segundo, se agregó 5 ml de etanol cada hora (protocolo III), y finalmente, en el tercero se adicionó 5 ml una hora antes de culminar el proceso (protocolo IV).
Para evaluar la efectividad de los protocolos se realizó un ensayo experimental a fin de estandarizar un único protocolo de extracción. El ensayo se llevó a cabo con el extracto del alga roja G. doryphora contra la cepa S. aureus ATCC 6633, con tres réplicas por cada protocolo.
La actividad antibacteriana de los extractos etanólicos se evaluó empleando la técnica de difusión en agar. La siembra de las cepas bacterianas se realizó mediante el método de doble capa. Se adicionó 10 ml de medio TSA (agar tripticase de soya) en placas petri, luego de solidificado el medio se agregó una segunda capa de agar que consistía de 5 ml de agar TSA licuado (5 ml), previamente inoculado con la cepa patrón (0,1 ml de caldo TSB de 24 horas). Esta segunda capa se suplementó con 1% (p/v) de NaCl para las especies de Aeromonas y Vibrio. Posteriormente, con un sacabocado estéril se hicieron pocillos de 6 mm de diámetro sobre el agar. En cada pocillo se adicionaron 50 µl del extracto algal. Además, se utilizó un pocillo con etanol 80% como control en cada ensayo. Las placas se dejaron por 30 minutos a temperatura ambiente para permitir la difusión del extracto. Finalmente, las placas se incubaron a 30 °C (especies de Vibrio) y a 37 °C (las otras cepas) por 24 horas.
Las pruebas se realizaron por triplicado para cada cepa y extracto ensayado. La presencia de un halo de inhibición definido alrededor del pocillo con extracto indicó actividad antibacteriana positiva.
La lectura de las placas se realizó después de 24 horas. Se midieron tres diámetros de cada halo de inhibición empleando un vernier. Los valores obtenidos se promediaron hallándose el diámetro promedio que fue utilizado como índice de actividad antibacteriana.
El análisis de varianza (ANOVA) se realizó para los dos protocolos que evidenciaron actividad antibacteriana. Se aplicó ANOVA unifactorial a los diámetros totales y la significancia se reportó con un nivel de confianza del 95%.
Extracción de sustancias bioactivas de macroalgas
El resultado de cada uno de los extractos etanólicos obtenidos con los cuatro protocolos ensayados se resumen en la Tabla 4.


Del total de los extractos de macroalgas ensayadas, solamente 5 (42%) dieron actividad antibacteriana positiva contra las especies grampositivas (Tabla 6).
En lo referente a la distribución de la actividad antibacteriana, se encontró que la producción de sustancias bioactivas era cubierta por los tres grupos de macroalgas. En las Rhodophyta, fueron G. doryphora, P. decipiens (Cryptonemiales) y A. durvellaei (Gigartinales) las especies con efecto antibacteriano. En las Phaeophyta, se registró actividad en el alga P. fascia (Scytosiphonales); y en las Chlorophyta, en la especie B. plumosa (Briopsidales).
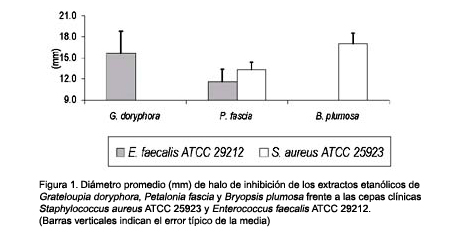
La cepa clínica S. aureus ATCC 25923 fue inhibida por el extracto etanólico de P. fascia(Phaeophyta) y B. plumosa (Chlorophyta) con halos de 13,3 mm y 17,1 mm, respectivamente. Los extractos de G. doryphora y P. fascia también inhibieron el crecimiento de E. faecalis ATCC 29212 con halos de 15,7 mm y 11,7 mm respectivamente (Fig. 1).
Los trabajos dirigidos a evaluar el potencial antibacteriano de extractos algales, mencionan que el proceso de extracción en caliente con etanol ofrece mayores ventajas en la obtención de sustancias bioactivas (Rao y Parekh, 1981; Vlachos et al., 1996; 1997; González et al., 2001). Así también, la adición del extracto en pocillos realizados en el agar es un método, que a diferencia del uso de discos de papel, concentra una mayor cantidad de extracto, facilitando la evaluación de su potencial antibacteriano (Vlachos et al., 1996; 1997).
Los resultados del presente trabajo permiten afirmar que G. doryphora, A. durvillaei, P. decipiens (Rhodophyta), P. fascia (Phaeophyta) y B. plumosa (Chlorophyta) son productoras de sustancias bioactivas con efecto antibacteriano. Estas especies se sumarían a las ya reportadas previamente para el Perú por Balta (1988), Enteromorpha intestinales y Polysiphonia paniculata, como algas promisorias por su potencial bioactivo.
La mayoría de las investigaciones realizadas con extractos crudos de algas marinas (Rao y Parekh, 1981; Caccamese et al., 1985; Vlachos et al., 1996; 1997; González et al., 2001) mencionan gran actividad contra bacterias grampositivas. Entre ellas, S. aureus es considerada como una de las especies más susceptibles a los exudados y extractos algales (Hornsey y Hide, 1974; 1976a; 1976b; Rao y Parekh, 1981; Balta, 1988; Vlachos et al., 1996; 1997; 2001). Esto concuerda con nuestros resultados, los cuales evidenciaron inhibición de las cepas clínicas S. aureus ATCC 25923 y E. faecalis ATCC 29212 y de la cepa no clínica S. aureus ATCC 6633.
Trabajos realizados en diversas partes del mundo con especies algales afines y empleando diversos protocolos de extracción han obtenido variados resultados. Así, los extractos de Grateloupia proteus (Caccamese et al., 1980) y G. filicina (Vlachos et al., 1997) demostraron no tener actividad antibacteriana contra las bacterias grampositivas y gramnegativas ensayadas. A diferencia de lo registrado en nuestro trabajo, González et al. (2001) y Vlachos et al. (1997), encontraron respectivamente que G. doryphora y Prionitis nodifera no presentan actividad antibacteriana.
De acuerdo a nuestros resultados, el alga parda P. fascia es la especie con mayor espectro de actividad antibacteriana entre los tres grupos de macroalgas ensayados. Esto difiere de lo manifestado por Caccamese et al. (1985), quienes para esta misma especie no encontraron actividad cuando enfrentaron su extracto a B. subtilis y Escherichia coli.
En nuestro trabajo, el alga verde B. plumosa demostró tener capacidad inhibitoria frente a ambas cepas de S. aureus. Esto concuerda con los resultados de Hornsey y Hide (1974), quienes reportaron que B. plumosa tiene un gran espectro de actividad antibacteriana; pero en su caso además registraron actividad contra bacterias gramnegativas.
Estudios realizados al sur de África e Italia, consideran a las algas pardas y rojas como los grupos con mayor número de especies con potencial antibacteriano (Caccamese et al., 1985; Vlachos et al., 1997). Esto coincide con la distribución de la capacidad antibacteriana registrada para las especies de macroalgas estudiadas. Aunque, en nuestro caso, fue B. plumosa (Chlorophyta) la especie que presentó los mayores halos de inhibición.
Los resultados del presente trabajo confirman la existencia de macroalgas productoras de sustancias bioactivas con efecto antibacteriano. Por esta razón, es necesaria la realización de estudios orientados a registrar las especies algales peruanas productoras de sustancias bioactivas, así como caracterizar e identificar químicamente estas sustancias.
A los miembros del grupo DePSEA de la Facultad de Ciencias Biológicas - UNMSM por toda la colaboración brindada. A los profesores: Martha Valdivia C., Débora Alvarado I., Juan Tarazona B. y José Pino G. por su apoyo en el desarrollo del trabajo. Al Profesor Marco Guerrero A. de la Facultad de Química e Ing. Química por toda la ayuda prestada. A la Srta. Patricia Carbajal E. por el apoyo brindado durante la colecta del material biológico y en la revisión de este manuscrito. Esta investigación contó con el apoyo económico del CSI (Proyecto 021001131) y del Consejo Nacional de Ciencia y Tecnología.
Balta, M. (1988) Producción de compuestos antimicrobianos en algas marinas peruanas. En: Enteromorpha intestinales (Chlorophyta) y Polysiphonia paniculata (Rhodophyta). Tesis para optar el grado académico de Bachiller en Ciencias Biológicas. Facultad de Ciencias Biológicas, UNMSM, Perú. 24 pp. [ Links ]
Bhakuni, D. y M. Silva (1974) Biodynamic substances from marine flora. Bot. Mar. 27 (1): 40-51. [ Links ]
Caccamese, S.; R. Azzolina, G. Furnari, M. Cormaci y S. Grasso (1980) Antimicrobial and antiviral activities of extracts from mediterranean algae. Bot. Mar. 23 (5): 285-288. [ Links ]
Caccamese, S.; R. Toscano, G. Furnari y M. Cormaci (1985) Antimicrobial activities of red and brown algae from southern Italy coast. Bot. Mar. 28 (11): 505-507. [ Links ]
Carvalho, L. y N. Roque (2000) Fenóis halogenados e/ou sulfatados de macroalgas marinhas. Quimica Nova, 23(6): 757-763. [ Links ]
Faulkner, D. (1984) Marine natural products: metabolites of marine algae and herbivorous marine molluscs. Nat. Prod. Rep. 1: 251-280. [ Links ]
Fenical, W. (1975) Halogenation in the Rhodophyta: a review. J. Phycol. 11: 245-259. [ Links ]
Glombitza, K. y M. Koch (1989) Secondary metabolites of pharmaceutical potential. In: Cresswell, R.; T. Rees y N. Shah (eds.), Algal and Cyanobacterial Biotechnology. Great Britain. 338 pp. [ Links ]
González, A.; G. Platas, A. Basilio, A. Cabello, J. Gorrochategui, I. Suay, F. Vicente, E. Portillo, M. Jiménez, G. García y F. Peláez (2001) Screening of antimicrobial activities in red, green and brown macroalgae from Gran Canaria (Canary Islands, Spain). Int. Microbiol. 4: 35-40. [ Links ]
González, F. y M. Silva (2001) Biodiversidad química de macroalgas marinas. In: Alveal, K. y T. Antezana (eds.) Sustentabilidad de la biodiversidad, un problema actual. Bases científico-técnicas, teorizaciones y proyecciones. Chile. 896 pp. [ Links ]
Hay, M.; J. Duffy, W. Fenical y K. Gustafson (1987a) Chemical defense against different marine herbivores: are amphipods insect equivalents? Ecology. 68 (6): 1567-1580. [ Links ]
Hay, M.; W. Fenical y K. Gustafson (1987b). Chemical defense against diverse coral-reef herbivores. Ecology. 68 (6): 1581-1591. [ Links ]
Hay, M. (1996) Marine chemical ecology: what´s known and what´s next? J. Exp. Mar. Biol. Ecol. 200: 103-134. [ Links ]
Hornsey, I. y D. Hide (1974) The production of antimicrobial compounds by British marine algae I. Antibiotic-producing marine algae. Br. Phycol. J. 9: 353-361. [ Links ]
Hornsey, I. y D. Hide (1976a). The production of antimicrobial compounds by British marine algae II. Seasonal variation in production of antibiotics. Br. Phycol. J. 11: 63-67. [ Links ]
Hornsey, I. y D. Hide (1976b) The production of antimicrobial compounds by British marine algae III. Distribution of antimicrobial activity within the algal thallus. Br. Phycol. J. 11: 175-181. [ Links ]
Paul, V.; M. Littler, D. Littler y W. Fenical (1987) Evidence for chemical defense in tropical green alga Caulerpa ashmeadii (Caulerpaceae: Chlorophyta). J. Chem. Ecol. 13 (5): 1171-1185. [ Links ]
Pereira, R.; V. Teixeira y A. Kelecom (1994) Chemical defenses against herbivores in marine algae. 1. The brown alga Dictyota dichotoma (Hudson) Lamouroux from Brazil. An. Acad. Bras. Ci. 66 (2): 229-235. [ Links ]
Rao, P. y K. Parekh (1981) Antibacterial activity of Indian seaweed extracts. Bot. Mar. 24 (11): 577-582. [ Links ]
Stein, J. y C. Borden (1984) Causative and benefical algae in human disease conditions: a review. Phycologia. 23 (4): 485-501. [ Links ]
Vlachos, V.; A. Critchley y A. von Holy (1996) Establishment of protocol for testing antimicrobial activity in southern African macroalgae. Microbios. 88: 115-123. [ Links ]
Vlachos, V.; A. Critchley & A. von Holy (1997) Antimicrobial activity of extracts from selected southern African marine algae. South African Journal of Science. 93: 328-332. [ Links ]
Vlachos, V.; A. Critchley y A. von Holy (2001) Effect of post-collection storage time and season on the antibacterial activity of selected southern African marine macroalgae. In: Chen, S. (ed.) Algae and their biotechnological potential. Kluwer Academic Publishers B. V. Belgium. [ Links ]
Correspondencia
1 Laboratorio de Ficología Marina, Facultad de Ciencias Biológicas, UNMSM. Apartado 14-002, Lima - Perú.
Email Claudio Magallanes: claudiomaga@hotmail.com
Antibacterial activity of ethanolic extracts of marine algae from central coast of Peru
Claudio Magallanes1, César Córdova1 y Rita Orozco2
1 Laboratorio de Ficología Marina, Facultad de Ciencias Biológicas, UNMSM.
2 Laboratorio de Microbiología, Instituto del Mar del Perú.
Presentado: 01/07/2003
Aceptado: 20/12/2003
Resumen
Se evaluó la actividad antibacteriana de extractos etanólicos de 12 especies de macroalgas marinas. Los extractos fueron obtenidos de acuerdo al protocolo modificado de Vlachos et al. (1996). Cada extracto se enfrentó contra 5 cepas bacterianas de origen clínico y 6 no clínico perteneciente a los géneros Staphylococcus, Enterococcus, Pseudomonas, Escherichia, Salmonella, Aeromonas y Vibrio. De 12 especies de algas ensayadas solamente 5 (Grateloupia doryphora, Ahnfeltiopsis durvillaei, Prionitis decipiens, Petalonia fascia y Bryopsis plumosa) presentaron algún efecto antibacteriano. Asimismo, de 11 cepas bacterianas probadas solamente las cepas clínicas Staphylococcus aureus ATCC 25923 y Enterococcus faecalis ATCC 29212 y la cepa no clínica Staphylococcus aureus ATCC 6633 fueron sensibles a los extractos algales. El extracto etanólico de B. plumosa presentó el mayor efecto antibacteriano contra las dos cepas de S. aureus, manifestándose en el mayor tamaño de sus halos de inhibición, mientras que el extracto de P. fascia mostró mayor espectro antibacteriano, inhibiendo a las 3 cepas mencionadas.
Palabras clave: macroalga, antibiosis, metabolito, actividad antibacteriana, bioactividad.
Abstract
Antibacterial activity of ethanolic extracts from 12 macroalgae were evaluated. Extracts were obtained according to the protocol of Vlachos et al. (1996). Extracts were tested against with 5 clinic strains and 6 no clinic strains of the genus Staphylococcus, Enterococcus, Pseudomonas, Escherichia, Salmonella, Aeromonas y Vibrio. Only Grateloupia doryphora, Ahnfeltiopsis durvillaei, Prionitis decipiens (Rhodophyta), Petalonia fascia (Phaeophyta) and Bryopsis plumosa (Chlorophyta) showed some antibacterial activity against the clinic strains Staphylococcus aureus ATCC 25923 and Enterococcus faecalis ATCC 29212 and the no clinic strain Staphylococcus aureus ATCC 6633. Ethanolic extract of B. plumosa presented the highest antibacterial activity against S. aureus strains. The extract of P. fascia showed the highest antibacterial activity against the three sensible strains.
Keyword: macroalgae, antibiosis, metabolite, antibacterial activity, bioactivity.
Introducción
Los organismos marinos son considerados una importante fuente de sustancias con potencial bioactivo. En este sentido, numerosas revisiones señalan a las algas como uno de los principales productores de estos compuestos (Bhakuni y Silva, 1974; Faulkner, 1984; Stein y Borden, 1984; Glombitza y Koch, 1989; Hay, 1996; González y Silva, 2001).
Los principales compuestos bioactivos producidos por las algas marinas están formados por una amplia gama de metabolitos secundarios, cada uno con una función específica dentro de su medio, atribuyéndoseles entre otras, la defensa química contra herbívoros marinos(Hay et al., 1987a; 1987b; Paul et al., 1987; Pereira et al., 1994). Estos metabolitos también están asociados a la disminución de epífitos, inhibiendo a los organismos competidores y patógenos microbianos (Hay, 1996; Vlachos et al., 1997).
El potencial antibacteriano de las algas se debe a su capacidad para sintetizar, entre otros, a los diterpenos en las algas verdes, terpenos halogenados en las algas rojas y metabolitos mixtos de origen terpeno-aromático en las algas pardas (Bhakuni y Silva, 1974; Fenical, 1975; Vlachos et al., 1997; Carvalho y Roque, 2000).
Estudios realizados en diferentes partes del mundo confirman que los exudados de algunas especies de Chlorophyta, Phaeophyta y Rhodophyta presentan actividad antimicrobiana (Caccamese et al., 1980; Rao y Parekh, 1981; Vlachos et al., 1996; 1997). Aunque el número de especies de macroalgas estudiadas únicamente alcanza alrededor de un 2% del total de las conocidas, en la actualidad los compuestos químicos caracterizados son aproximadamente dos mil, pero solamente en algunos se ha podido establecer claramente el mecanismo de acción (González y Silva, 2001).
En el Perú, las macroalgas Enteromorpha intestinalis (Chlorophyta) y Polysiphonia paniculata (Rhodophyta), han sido reportadas como especies con capacidad antibacteriana (Balta, 1988).
El objetivo del presente trabajo es determinar en 12 especies de macroalgas la presencia de sustancias antibacterianas.
Material y métodos
Lugares de recolección
El material algal empleado en el presente estudio se recolectó durante las horas de baja marea en la zona intermareal de seis playas de la costa central: playa Atenas, Laguna Grande, Pucusana, San Francisco, playa Hermosa y Los Yuyos (Tabla 1).

Recolección y procesamiento del material biológico
Se recolectaron manualmente plantas completas, incluyendo el disco de fijación de 12 especies de macroalgas marinas representativas de las Rhodophyta, Phaeophyta y Chlorophyta (Tabla 2).

La recolección se realizó durante el periodo comprendido entre agosto y octubre del 2001 y en marzo del 2002. El material algal recién extraído se transportó fresco al laboratorio, donde cada muestra se sometió a una limpieza manual para eliminar arena, epífitos y fauna acompañante; se lavó con agua corriente y enjuagó con agua destilada. Luego, las algas se secaron durante 24 horas bajo luz artificial a 24 °C y finalmente durante 24 horas en una estufa a 40 °C.
Cepas bacterianas de referencia
En el presente estudio se trabajó con 11 cepas bacterianas (Tabla 3), cinco cepas de origen clínico proporcionadas por el Laboratorio de Microbiología Molecular de la Facultad de Ciencias Biológicas de la Universidad Nacional Mayor de San Marcos y 6 cepas no clínicas proporcionadas por el Laboratorio de Microbiología del Instituto del Mar del Perú.

Extracción etanólica de sustancias bioactivas de macroalgas marinas
Las algas secas fueron premolidas en un molinillo eléctrico, luego endurecidas con nitrógeno líquido y molidas en un mortero hasta obtener un polvo fino. Cada muestra se almacenó a -25 °C hasta el momento de su empleo.
El proceso inicial de extracción (protocolo I) se realizó siguiendo la metodología propuesta por Vlachos et al. (1996). Se mezclaron 10 g de polvo de alga y 20 ml de etanol al 80%, luego se calentó a 80 °C en una manta eléctrica durante 4 horas, luego se filtró en papel Whatman # 1 y el volumen de extracto recuperado se enrasó a 5 ml adicionando etanol al 80%.
Adicionalmente, para obtener un mayor volumen final del extracto, se ensayaron 3 variantes del protocolo inicial. Las variantes realizadas consistieron en modificar la cantidad y los tiempos de adición del etanol. En el primero, se adicionó 10 ml de etanol al 80% dos horas después de iniciado el proceso (protocolo II); en el segundo, se agregó 5 ml de etanol cada hora (protocolo III), y finalmente, en el tercero se adicionó 5 ml una hora antes de culminar el proceso (protocolo IV).
Para evaluar la efectividad de los protocolos se realizó un ensayo experimental a fin de estandarizar un único protocolo de extracción. El ensayo se llevó a cabo con el extracto del alga roja G. doryphora contra la cepa S. aureus ATCC 6633, con tres réplicas por cada protocolo.
Determinación de la actividad antibacteriana de los extractos algales
La actividad antibacteriana de los extractos etanólicos se evaluó empleando la técnica de difusión en agar. La siembra de las cepas bacterianas se realizó mediante el método de doble capa. Se adicionó 10 ml de medio TSA (agar tripticase de soya) en placas petri, luego de solidificado el medio se agregó una segunda capa de agar que consistía de 5 ml de agar TSA licuado (5 ml), previamente inoculado con la cepa patrón (0,1 ml de caldo TSB de 24 horas). Esta segunda capa se suplementó con 1% (p/v) de NaCl para las especies de Aeromonas y Vibrio. Posteriormente, con un sacabocado estéril se hicieron pocillos de 6 mm de diámetro sobre el agar. En cada pocillo se adicionaron 50 µl del extracto algal. Además, se utilizó un pocillo con etanol 80% como control en cada ensayo. Las placas se dejaron por 30 minutos a temperatura ambiente para permitir la difusión del extracto. Finalmente, las placas se incubaron a 30 °C (especies de Vibrio) y a 37 °C (las otras cepas) por 24 horas.
Las pruebas se realizaron por triplicado para cada cepa y extracto ensayado. La presencia de un halo de inhibición definido alrededor del pocillo con extracto indicó actividad antibacteriana positiva.
La lectura de las placas se realizó después de 24 horas. Se midieron tres diámetros de cada halo de inhibición empleando un vernier. Los valores obtenidos se promediaron hallándose el diámetro promedio que fue utilizado como índice de actividad antibacteriana.
Análisis estadístico de los datos
El análisis de varianza (ANOVA) se realizó para los dos protocolos que evidenciaron actividad antibacteriana. Se aplicó ANOVA unifactorial a los diámetros totales y la significancia se reportó con un nivel de confianza del 95%.
Resultados
Extracción de sustancias bioactivas de macroalgas
El resultado de cada uno de los extractos etanólicos obtenidos con los cuatro protocolos ensayados se resumen en la Tabla 4.

Considerando estos resultados, se evaluaron los protocolos I y IV. El diámetro promedio de los halos de inhibición obtenidos con el extracto etanólico de G. doryphora frente a la cepa patrón S. aureus ATCC 6633 en ambos protocolos fue de 7,9 mm (Tabla 5).

El análisis de varianza (ANOVA) determinó que no existen diferencias significativas entre los diámetros promedio de ambos protocolos. Sin embargo, debido a que el protocolo IV permitía recuperar un mayor volumen final de extracto se optó por emplearlo en todas las pruebas posteriores.
Determinación de actividad antibacteriana en los extractos algales
Del total de los extractos de macroalgas ensayadas, solamente 5 (42%) dieron actividad antibacteriana positiva contra las especies grampositivas (Tabla 6).

Las bacterias que reportaron sensibilidad fueron las cepas clínicas S. aureus ATCC 25923 y E. faecalis ATCC 29212 y la cepa no clínica S. aureus ATCC 6633.
En lo referente a la distribución de la actividad antibacteriana, se encontró que la producción de sustancias bioactivas era cubierta por los tres grupos de macroalgas. En las Rhodophyta, fueron G. doryphora, P. decipiens (Cryptonemiales) y A. durvellaei (Gigartinales) las especies con efecto antibacteriano. En las Phaeophyta, se registró actividad en el alga P. fascia (Scytosiphonales); y en las Chlorophyta, en la especie B. plumosa (Briopsidales).
La cepa clínica S. aureus ATCC 25923 fue inhibida por el extracto etanólico de P. fascia(Phaeophyta) y B. plumosa (Chlorophyta) con halos de 13,3 mm y 17,1 mm, respectivamente. Los extractos de G. doryphora y P. fascia también inhibieron el crecimiento de E. faecalis ATCC 29212 con halos de 15,7 mm y 11,7 mm respectivamente (Fig. 1).

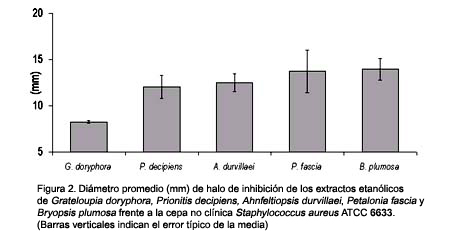
En el caso de la cepa no clínica S. aureus ATCC 6633, las especies P. fascia (Phaeophyta) y B. plumosa (Chlorophyta) presentaron los mayores halos de inhibición, con 13,8 mm y 13,9 mm de diámetro promedio, respectivamente. Entre las Rhodophyta se encontraron tres especies con potencial antibacteriano contra esta cepa, G. doryphora, A. durvillaei y P. decipiens, con halos de inhibición de 8,2 mm, 12,5 mm y 12,1 mm, respectivamente (Fig. 2).

Discusión
Los trabajos dirigidos a evaluar el potencial antibacteriano de extractos algales, mencionan que el proceso de extracción en caliente con etanol ofrece mayores ventajas en la obtención de sustancias bioactivas (Rao y Parekh, 1981; Vlachos et al., 1996; 1997; González et al., 2001). Así también, la adición del extracto en pocillos realizados en el agar es un método, que a diferencia del uso de discos de papel, concentra una mayor cantidad de extracto, facilitando la evaluación de su potencial antibacteriano (Vlachos et al., 1996; 1997).
Los resultados del presente trabajo permiten afirmar que G. doryphora, A. durvillaei, P. decipiens (Rhodophyta), P. fascia (Phaeophyta) y B. plumosa (Chlorophyta) son productoras de sustancias bioactivas con efecto antibacteriano. Estas especies se sumarían a las ya reportadas previamente para el Perú por Balta (1988), Enteromorpha intestinales y Polysiphonia paniculata, como algas promisorias por su potencial bioactivo.
La mayoría de las investigaciones realizadas con extractos crudos de algas marinas (Rao y Parekh, 1981; Caccamese et al., 1985; Vlachos et al., 1996; 1997; González et al., 2001) mencionan gran actividad contra bacterias grampositivas. Entre ellas, S. aureus es considerada como una de las especies más susceptibles a los exudados y extractos algales (Hornsey y Hide, 1974; 1976a; 1976b; Rao y Parekh, 1981; Balta, 1988; Vlachos et al., 1996; 1997; 2001). Esto concuerda con nuestros resultados, los cuales evidenciaron inhibición de las cepas clínicas S. aureus ATCC 25923 y E. faecalis ATCC 29212 y de la cepa no clínica S. aureus ATCC 6633.
Trabajos realizados en diversas partes del mundo con especies algales afines y empleando diversos protocolos de extracción han obtenido variados resultados. Así, los extractos de Grateloupia proteus (Caccamese et al., 1980) y G. filicina (Vlachos et al., 1997) demostraron no tener actividad antibacteriana contra las bacterias grampositivas y gramnegativas ensayadas. A diferencia de lo registrado en nuestro trabajo, González et al. (2001) y Vlachos et al. (1997), encontraron respectivamente que G. doryphora y Prionitis nodifera no presentan actividad antibacteriana.
De acuerdo a nuestros resultados, el alga parda P. fascia es la especie con mayor espectro de actividad antibacteriana entre los tres grupos de macroalgas ensayados. Esto difiere de lo manifestado por Caccamese et al. (1985), quienes para esta misma especie no encontraron actividad cuando enfrentaron su extracto a B. subtilis y Escherichia coli.
En nuestro trabajo, el alga verde B. plumosa demostró tener capacidad inhibitoria frente a ambas cepas de S. aureus. Esto concuerda con los resultados de Hornsey y Hide (1974), quienes reportaron que B. plumosa tiene un gran espectro de actividad antibacteriana; pero en su caso además registraron actividad contra bacterias gramnegativas.
Estudios realizados al sur de África e Italia, consideran a las algas pardas y rojas como los grupos con mayor número de especies con potencial antibacteriano (Caccamese et al., 1985; Vlachos et al., 1997). Esto coincide con la distribución de la capacidad antibacteriana registrada para las especies de macroalgas estudiadas. Aunque, en nuestro caso, fue B. plumosa (Chlorophyta) la especie que presentó los mayores halos de inhibición.
Los resultados del presente trabajo confirman la existencia de macroalgas productoras de sustancias bioactivas con efecto antibacteriano. Por esta razón, es necesaria la realización de estudios orientados a registrar las especies algales peruanas productoras de sustancias bioactivas, así como caracterizar e identificar químicamente estas sustancias.
Agradecimientos
A los miembros del grupo DePSEA de la Facultad de Ciencias Biológicas - UNMSM por toda la colaboración brindada. A los profesores: Martha Valdivia C., Débora Alvarado I., Juan Tarazona B. y José Pino G. por su apoyo en el desarrollo del trabajo. Al Profesor Marco Guerrero A. de la Facultad de Química e Ing. Química por toda la ayuda prestada. A la Srta. Patricia Carbajal E. por el apoyo brindado durante la colecta del material biológico y en la revisión de este manuscrito. Esta investigación contó con el apoyo económico del CSI (Proyecto 021001131) y del Consejo Nacional de Ciencia y Tecnología.
Literatura Citada
Balta, M. (1988) Producción de compuestos antimicrobianos en algas marinas peruanas. En: Enteromorpha intestinales (Chlorophyta) y Polysiphonia paniculata (Rhodophyta). Tesis para optar el grado académico de Bachiller en Ciencias Biológicas. Facultad de Ciencias Biológicas, UNMSM, Perú. 24 pp. [ Links ]
Bhakuni, D. y M. Silva (1974) Biodynamic substances from marine flora. Bot. Mar. 27 (1): 40-51. [ Links ]
Caccamese, S.; R. Azzolina, G. Furnari, M. Cormaci y S. Grasso (1980) Antimicrobial and antiviral activities of extracts from mediterranean algae. Bot. Mar. 23 (5): 285-288. [ Links ]
Caccamese, S.; R. Toscano, G. Furnari y M. Cormaci (1985) Antimicrobial activities of red and brown algae from southern Italy coast. Bot. Mar. 28 (11): 505-507. [ Links ]
Carvalho, L. y N. Roque (2000) Fenóis halogenados e/ou sulfatados de macroalgas marinhas. Quimica Nova, 23(6): 757-763. [ Links ]
Faulkner, D. (1984) Marine natural products: metabolites of marine algae and herbivorous marine molluscs. Nat. Prod. Rep. 1: 251-280. [ Links ]
Fenical, W. (1975) Halogenation in the Rhodophyta: a review. J. Phycol. 11: 245-259. [ Links ]
Glombitza, K. y M. Koch (1989) Secondary metabolites of pharmaceutical potential. In: Cresswell, R.; T. Rees y N. Shah (eds.), Algal and Cyanobacterial Biotechnology. Great Britain. 338 pp. [ Links ]
González, A.; G. Platas, A. Basilio, A. Cabello, J. Gorrochategui, I. Suay, F. Vicente, E. Portillo, M. Jiménez, G. García y F. Peláez (2001) Screening of antimicrobial activities in red, green and brown macroalgae from Gran Canaria (Canary Islands, Spain). Int. Microbiol. 4: 35-40. [ Links ]
González, F. y M. Silva (2001) Biodiversidad química de macroalgas marinas. In: Alveal, K. y T. Antezana (eds.) Sustentabilidad de la biodiversidad, un problema actual. Bases científico-técnicas, teorizaciones y proyecciones. Chile. 896 pp. [ Links ]
Hay, M.; J. Duffy, W. Fenical y K. Gustafson (1987a) Chemical defense against different marine herbivores: are amphipods insect equivalents? Ecology. 68 (6): 1567-1580. [ Links ]
Hay, M.; W. Fenical y K. Gustafson (1987b). Chemical defense against diverse coral-reef herbivores. Ecology. 68 (6): 1581-1591. [ Links ]
Hay, M. (1996) Marine chemical ecology: what´s known and what´s next? J. Exp. Mar. Biol. Ecol. 200: 103-134. [ Links ]
Hornsey, I. y D. Hide (1974) The production of antimicrobial compounds by British marine algae I. Antibiotic-producing marine algae. Br. Phycol. J. 9: 353-361. [ Links ]
Hornsey, I. y D. Hide (1976a). The production of antimicrobial compounds by British marine algae II. Seasonal variation in production of antibiotics. Br. Phycol. J. 11: 63-67. [ Links ]
Hornsey, I. y D. Hide (1976b) The production of antimicrobial compounds by British marine algae III. Distribution of antimicrobial activity within the algal thallus. Br. Phycol. J. 11: 175-181. [ Links ]
Paul, V.; M. Littler, D. Littler y W. Fenical (1987) Evidence for chemical defense in tropical green alga Caulerpa ashmeadii (Caulerpaceae: Chlorophyta). J. Chem. Ecol. 13 (5): 1171-1185. [ Links ]
Pereira, R.; V. Teixeira y A. Kelecom (1994) Chemical defenses against herbivores in marine algae. 1. The brown alga Dictyota dichotoma (Hudson) Lamouroux from Brazil. An. Acad. Bras. Ci. 66 (2): 229-235. [ Links ]
Rao, P. y K. Parekh (1981) Antibacterial activity of Indian seaweed extracts. Bot. Mar. 24 (11): 577-582. [ Links ]
Stein, J. y C. Borden (1984) Causative and benefical algae in human disease conditions: a review. Phycologia. 23 (4): 485-501. [ Links ]
Vlachos, V.; A. Critchley y A. von Holy (1996) Establishment of protocol for testing antimicrobial activity in southern African macroalgae. Microbios. 88: 115-123. [ Links ]
Vlachos, V.; A. Critchley & A. von Holy (1997) Antimicrobial activity of extracts from selected southern African marine algae. South African Journal of Science. 93: 328-332. [ Links ]
Vlachos, V.; A. Critchley y A. von Holy (2001) Effect of post-collection storage time and season on the antibacterial activity of selected southern African marine macroalgae. In: Chen, S. (ed.) Algae and their biotechnological potential. Kluwer Academic Publishers B. V. Belgium. [ Links ]
Correspondencia
1 Laboratorio de Ficología Marina, Facultad de Ciencias Biológicas, UNMSM. Apartado 14-002, Lima - Perú.
Email Claudio Magallanes: claudiomaga@hotmail.com













