Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.11 n.2 Lima jul./dic. 2004
Luz Velásquez y Enrique Escobar1
(1) Laboratorio de Bioquímica y Genética Molecular. Facultad de Ciencias Biológicas. Universidad Nacional Mayor de San Marcos.
Presentado: 14/11/2004
Aceptado: 30/12/2004
Resumen
Se ha purificado una toxina (Hm3) del veneno del escorpión Hadruroides mauryi, por cromatografía de intercambio iónico en CM-Sephadex C-25 con buffer acetato de amonio 0,05M, pH 7. La toxina produce contracción y parálisis en la extremidad inoculada de ratones albinos y se caracteriza por ser de naturaleza básica y tener un peso molecular de 4,5 kDa. Después de 45 minutos de ser inoculada en el músculo gastrocnemius de ratones albinos, Hm3 (30,4 mg) aumenta los niveles plasmáticos de creatina kinasa desde 252,6 UI/L hasta 3779,3 UI/L y de lactato deshidrogenasa, desde 142,7 UI/L hasta 248,2 UI/L; igualmente incrementa los niveles de calcio intramuscular desde 34,1 nmoles hasta 69,3 nmoles. Esta toxina carece de actividad proteolítica y fosfolipásica.
Palabras claves: Toxina, Hadruroides mauryi, escorpión, veneno de escorpión.
Abstract
A toxin (Hm3) was purified from the scorpion venom Hadruroides mauryi, by ion-exchange chromatography on CM-Sephadex C-25 with 0,05M ammonium acetate buffer pH 7. The toxin produce contraction and immobilize the inoculated limb of white mice, and is a basic protein with a molecular weight of 4,5 kDa. After of 45 minutes inoculated in gastrocnemius muscle of white mice, Hm3 (30,4 mg) increases the plasmatic level of creatine kinase from 252,6 UI/L to 3779,3 UI/L and lactate deshidrogenase from 142,7 UI/L to 248,2 UI/L; likewise increases the level of intramuscular calcium from 34,1 nmoles to 69,3 nmoles. This toxin have not proteolitic or phospholipase activity.
Keywords: Toxin, Hadruroides mauryi, scorpion, scorpion venom.
Introducción
Los escorpiones son arácnidos venenosos que viven en regiones tropicales y subtropicales, tanto en zonas desérticas como de abundante vegetación. El veneno de escorpión es una mezcla de toxinas que producen la parálisis de presas como insectos, arañas y crustáceos. Adicionalmente estos venenos también contienen toxinas específicas para mamíferos; sin embargo en el hombre, la letalidad del veneno depende de la especie de escorpión.
Entre 1968 y 1988, se dieron los primeros estudios sobre los escorpiones del Perú y ellos permitieron conocer parcialmente la diversidad y distribución geográfica de estos animales, así como identificar el efecto del veneno total de al menos tres especies (Aguilar, 1968; Aguilar y Meneses, 1970; Cáceres et al., 1972; Arboleda et al., 1973; Francke, 1977; Maury, 1978; Castro et al., 1981; Zavaleta, 1983; Calderón y Aguilar, 1988). Sin embargo entre 1989 y 1999, no hubieron nuevos reportes en este campo y es recién a partir del año 2000, que se describen nuevas especies para nuestro país (Acosta y Ochoa, 2000, 2001; Ochoa, 2002; Ochoa y Acosta, 2002), llegándose a considerar en la actualidad la existencia de por lo menos 41 especies de escorpiones distribuidas en seis familias: Bothriuridae, Buthidae, Chactidae, Euscorpiidae, Ischnurida e Iuridae (Ochoa, comunicación personal 2003). Asimismo, en nuestro medio, hace sólo dos años se han reportado los primeros estudios sobre el aislamiento y caracterización de proteínas de algunos venenos de escorpión como los de Hadruroides lunatus, Centruroides margaritatus y Brachistosternus ehrenbergii (Escobar et al., 2002; Escobar et al., 2003; Rivera et al., 2004). En general las toxinas aisladas de venenos de escorpión han mostrado tener acción sobre crustáceos, insectos y mamíferos, y la mayoría de ellas son toxinas que bloquean canales de sodio o de potasio (Garcia, et al., 2001).
Recientemente nuestro laboratorio ha empezado a estudiar el veneno de Hadruroides mauryi. Este escorpión, que es una especie de la familia Iuridae, tiene una amplia distribución en Cuzco, Huancavelica y Ayacucho (Francke y Soleglad, 1980), y alcanza una longitud de hasta 5 cm. El cuerpo es en general de color marrón oscuro; mientras que sus patas, de color amarillo, son ligeramente pigmentadas.
En este trabajo reportamos la separación cromatográfica de las proteínas del veneno de Hadruroides mauryi y la caracterización de una proteína que en roedores produce parálisis y contracción muscular en la extremidad inoculada. La toxina responsable de este efecto, ha sido estudiada y denominada Hm3 atendiendo a la nomenclatura planteada por Becerril quien ha propuesto denominar a cada toxina por las iniciales del nombre científico de la especie (en este caso Hm de Hadruroides mauryi) seguido por un número específico de la toxina (en este caso 3, por ser la tercera toxina que hemos identificado en el veneno de esta especie) (Becerril et al., 1996). El estudio de esta toxina permitirá conocer aspectos sobre su rol durante el envenenamiento y modo de acción a nivel muscular.
En este sentido los objetivos de esta investigación fueron: Aislar del veneno de Hadruroides mauryi, la toxina responsable de contraer y paralizar la extremidad inoculada de ratones albinos. Determinar su peso molecular y naturaleza ácido-básica. Evaluar su acción sobre el tejido muscular midiendo la liberación de proteínas musculares como creatina kinasa y lactato deshidrogenasa. Determinar las variaciones en los niveles de calcio intramuscular, producidos por la toxina. Determinar la probable actividad proteolítica o fosfolipásica de la toxina.
Materiales y métodos
1. Material biológico
- Escorpiones: Se utilizaron 105 escorpiones adultos de ambos sexos de la especie Hadruroides mauryi capturados en la localidad de Huari (Ayacucho) durante el mes de febrero del 2002. Los ejemplares fueron mantenidos en el laboratorio, individualmente, en vasos de plástico.
- Ratones: Mus musculus de 18 a 20 g de peso.
2. Obtención y preparación del veneno.
El veneno fue obtenido por estimulación manual de las glándulas venenosas y fue colectado en microcapilares de 1,2 mm de diámetro (Zlotkin y Shulov, 1969). El veneno extraído fue desecado y luego pesado, obteniéndose 49,6 mg que se disolvieron en 1,4 ml de buffer acetato de amonio 0,05M pH 7. Los restos insolubles fueron separados y eliminados por centrifugación a 3000 rpm, durante 15 minutos.
3. Fraccionamiento del veneno y aislamiento de la toxina.
El sobrenadante (1 ml) fue aplicado a una columna de intercambio catiónico de CM Sephadex C-25 (1.1x17 cm) equilibrada en buffer acetato de amonio 0,05M pH 7. La cromatografía se realizó a temperatura ambiente y a un flujo de 10 ml/h. Se colectaron fracciones de 2 ml y la elución de las proteínas retenidas en la columna se realizó con el mismo buffer conteniendo NaCl 0,25M y 0,6M (Escobar et al., 2002).
4. Cuantificación de proteína.
En todos los ensayos la concentración de proteína fue estimada por el método de Lowry (Lowry et al., 1951). Se mezcló 0,2 ml de muestra con 0,3 ml de agua bidestilada y 2 ml de la solución alcalina (carbonato de sodio 4%, sulfato de cobre 2%, tartrato de sodio y potasio 4%, 100:1:1) incubándose a temperatura ambiente por 15 minutos, luego de lo cual se añadió 0,5 ml del reactivo de Folin Ciocalteus 1:6, continuándose la incubación por 15 minutos más. Finalmente se midió la absorbancia a 750 nm y se determinó la concentración de proteína con respecto a un estándar de albúmina bovina.
5. Electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (PAGE - SDS).
Con la finalidad de evaluar la pureza de la toxina, se empleó PAGE-SDS de acuerdo al método de Schagger y von Jagow (1987), el cual es un método de gran resolución para proteínas de bajo peso molecular. Como proteínas estándares se utilizaron citocromo c (14,3 kDa) e insulina (cadena A 2,5 kDa y cadena B 3,5 kDa). La corrida electroforética se realizó a voltaje constante, empleando 68 voltios durante 90 minutos. Las proteínas se tiñeron con azul brillante de coomassie 0,1% por 5 minutos. Luego se procedió a su decoloración en una solución decolorante (metanol, ácido acético y agua, 3:1:8,5) hasta visualizar las bandas de proteína.
6. Acción de la toxina.
Durante el proceso de purificación, ratones albinos de 20 g de peso fueron inoculados en el músculo gastrocnemius con 100 ml de veneno crudo o de las fracciones colectadas, e inmediatamente se evaluó la contracción y parálisis producida en la extremidad inoculada. Adicionalmente, luego de identificada la ubicación de la toxina Hm3, se evaluó su actividad miotóxica de la siguiente manera:
6.1. Dosaje de creatina kinasa (CK) y lactato deshidrogenasa (LDH).
Cuatro ratones albinos de 20 g de peso, fueron inyectados en el músculo gastrocnemius con 0,1 ml de la toxina (30,4 μg). Luego de 45 minutos, los animales fueron sacrificados y se les extrajo 0,4ml de sangre del corazón. La sangre fue tratada con 0,04 ml de citrato de sodio 3,8% y se centrifugó a 2000 rpm por 10 minutos para obtener el plasma.
La actividad de CK fue evaluada aplicando 25μl del plasma sobre 1ml del kit para CK de Pointe Scientific y midiendo los incrementos en la absorbancia a 340 nm. La actividad se expresó en UI/L. Bajo condiciones similares se midió la actividad de LDH utilizando el kit correspondiente.
6.2 Liberación de proteínas musculares in vitro.
Se aisló músculo gastrocnemius de ratones albinos de 20 g de peso y se colocó en 1ml de buffer fisiológico a pH 7,2 (6,74 μg de cloruro de sodio, 0,35 μg de cloruro de potasio, 0,593 μg de sulfato de manganeso, 0,3708 mg de cloruro de calcio, 0,16 μg de fosfato ácido de potasio, 2,1 μg de bicarbonato de sodio y 2 μg de glucosa), bajo aireación constante. Inmediatamente se agregó 0,1 ml de la toxina (17,4 μg) y posteriormente alícuotas de 10 μl fueron extraídas a los 0, 15, 30, 60 y 90 minutos para ser analizados por PAGE- SDS, a fin de evidenciar la liberación de proteínas musculares con respecto a un control sin toxina (Pantigoso et al., 2002).
7. Variación de los niveles de calcio producidos por Hm3.
Ratones albinos de 20 g de peso fueron inyectados en el músculo gastrocnemius con 0,1ml de la toxina (30,4 μg). Luego de 45 minutos los ratones fueron sacrificados y se les extrajo el músculo gastrocnemius, el cual fue sumergido en 3ml de buffer Imidazol 10mM a pH 7,1 conteniendo NaCl 140 mM, KCl 5 mM, digitonina 200 mg/ml y antipirilazo III 0,2 mM. Luego de incubar por 8 minutos a temperatura ambiente, el tejido fue retirado y se midió la absorbancia de la solución a 710 y 790 nm. Las diferencias en las absorbancias (A710 - A790) fueron convertidas a nmoles de calcio, dividiéndolas entre un factor de 0,0031 nmol-1 obtenido a partir de una curva estándar de calcio con antipirilazo III (Murphy et al., 1980).
8. Actividad de fosfolipasa.
Se empleó 3 ml de una emulsión de yema de huevo (100 μl de yema de huevo en 80ml de buffer acetato de amonio 0,05M a pH 7), a la que se aplicó 0,1 ml de veneno crudo (650 μg) ó Hm3 (17,4 μg). Inmediatamente se midió la disminución de la absorbancia a 920 nm durante 2 minutos (Marinetti, 1965).
9. Actividad proteolítica.
La probable actividad proteolítica del veneno crudo y de la toxina aislada, fue evaluada por el método de Chavira et al. (1984), para lo cual se mezcló 0,2ml de Azocoll 0.025 mg/ml, 0,2 ml de buffer acetato de amonio 0,05M a pH 7 y 50 μl de la toxina (6,5 mg/ml). Luego se incubó a 37 ºC por 30 minutos y se agitó cada tubo para facilitar la reacción. Finalmente para detener la reacción se adicionó 2,5 ml de NaOH 0,1N y se midió la absorbancia a 540 nm.
Resultados
1. Purificación de la toxina.
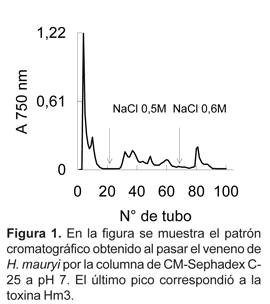
Cuando se pasó el veneno crudo de H. mauryi, por la columna de CM Sephadex C-25 se obtuvieron inicialmente 2 picos de proteína, mientras que al utilizar el buffer de elución conteniendo NaCl 0,25M, se obtuvieron 4 picos más. Finalmente al emplear NaCl 0,6 M se obtuvo un último pico. La actividad de Hm3, que se evidenció por la capacidad de producir una brusca contracción y parálisis en la extremidad inoculada de ratones albinos, se encontró en el último pico, representando un 4,5% de la proteína total del veneno (Figura 1).
2. Electroforesis en gel de poliacrilamida con SDS (PAGE-SDS).
El patrón electroforético de la toxina Hm3 mostró la presencia de una sola banda proteica de aproximadamente 4,5 kDa (Fig. 2).
3. Dosaje de creatina kinasa (CK) y lactato deshidrogenasa (LDH).
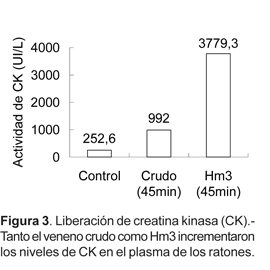
Al medir los niveles de CK liberada en el plasma de ratones albinos tratados con veneno crudo o Hm3 durante 45 minutos, se encontraron valores de 992 y 3779,3 UI/L, respectivamente, mientras que en el control se registró un valor de 252,6 UI/L (Fig. 3).
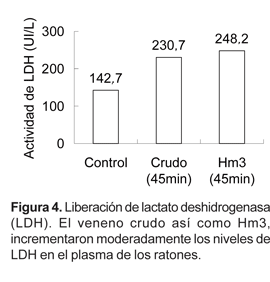
La evaluación de los niveles de LDH liberada en el plasma de ratones albinos tratados de manera similar, mostraron valores de 230,7 y 248,2 UI/L para el veneno total y Hm3, respectivamente. En el control se registró un valor de 142,7 UI/L (Fig. 4).
4. Liberación de proteínas musculares in vitro.
La evaluación por PAGE-SDS, de las proteínas liberadas del músculo gastrocnemius aislado e incubado con Hm3, demostró la capacidad de la toxina de provocar la liberación de proteínas musculares al medio de incubación desde los 15 minutos de acción.
5. Variación de los niveles de calcio.
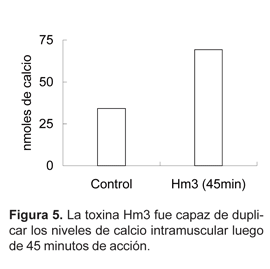
Los niveles de calcio intramuscular en los animales tratados con Hm3 alcanzaron un valor de 69,3 nmoles, después de 45 minutos, mientras que en los controles se registró un valor de 34,1 nmoles (Fig. 5).
6. Actividad fosfolipásica y proteolítica.
La toxina Hm3 del veneno de H. mauryi no mostró tener actividad de fosfolipasa ni proteolítica, mientras que el veneno total mostró sólo actividad de fosfolipasa.
Discusión
La toxina (Hm3) del veneno de H.mauryi fue purificada en un sólo paso cromatográfico empleando una columna de CM-Sephadex C-25 a pH 7. En este sistema la toxina interactuó con las cargas negativas del gel y fue eluida sólo después de adicionar en el buffer de elución NaCl 0,6M. Esto nos indica que la toxina a pH 7, tiene carga neta positiva y por lo tanto su punto isoeléctrico (pI) es mayor que 7, tratándose de una proteína básica.
Muchas toxinas aisladas de venenos de escorpión se caracterizan por ser de naturaleza básica, y es esta propiedad la que se utiliza para separarlas en sistemas de intercambio catiónico. Así por ejemplo, podemos mencionar las toxinas aisladas del veneno de H. lunatus (Escobar et al., 2002); las toxina Cn2 de Centruroides noxius y la toxina AaHII de Androctonus australis (Possani et al., 1999).
Hm3 representa el 4,5% de la proteína total del veneno y por PAGE-SDS mostró una sola banda proteica de aproximadamente 4,5 kDa. Del veneno de H. lunatus se ha aislado una toxina similar que se ha denominado Hl3 y que constituye el 10,4% de la proteína total del veneno (Escobar et al., 2002).
El efecto característico de Hm3 es su capacidad de producir contracción y parálisis en la extremidad inoculada de ratones albinos, sin embargo los otros resultados obtenidos in vivo indican que también afecta la permeabilidad de la membrana del músculo esquelético provocando así la liberación de creatina kinasa y lactato deshidrogenasa. Por otro lado, el análisis por PAGE-SDS, de las proteínas liberadas del músculo gastrocnemius, luego de su incubación con Hm3 evidencian que además de creatina kinasa y lactato deshidrogenasa, otras proteínas musculares son liberadas también, lo cual denota el daño producido por Hm3 a nivel del sarcolema con la consecuente pérdida de proteínas musculares. Asimismo este efecto es rápido y dependiente del tiempo, ya que la liberación de proteínas se observa desde los 15 minutos de incubación, incrementándose a mayores tiempos. La toxina Hl3 del veneno de H. lunatus, tiene similares características en sus efectos (Escobar et al., 2003).
Actualmente se sabe que las toxinas de escorpión que afectan a mamíferos, se caracterizan por unirse a canales de sodio y tener de 60 a 76 aminoácidos estabilizados por cuatro puentes disulfuro. Además esta familia de proteínas mantienen un motivo estructural conservado que está dado por un núcleo compacto formado por una α hélice y tres hojas plegadas β.
Estas toxinas, de acuerdo a la modificación causada en los canales de sodio, se diferencian en dos tipos: Las α -toxinas, que bloquean la inactivación de los canales de sodio, y las β-toxinas que activan los canales de sodio en nervios y músculos. En ambos casos los canales de sodio permanecen abiertos mas tiempo y de esta manera se prolongan los potenciales de acción en músculos y nervios.
La toxina AaHII de Androctonus australis Hector es una α-toxina clásica, mientras que la Cn2 de Centruroides noxius, es una β-toxina (Possani et al., 1999).
El otro grupo importante de toxinas de venenos de escorpión, comprende una familia de toxinas que se unen a canales de potasio y que está constituida por péptidos de 30 a 40 aminoácidos, todos estabilizados por 3 enlaces disulfuro. El efecto general de estas toxinas es que se unen y bloquean a los canales de potasio y de este modo prolongan la fase de caída del potencial de acción (Tytgat et al., 1999).
La acción ejercida por Hm3 sobre el músculo gastrocnemius, debe también estar prolongando el potencial de acción o prolongando la fase de caída de dicho potencial, lo cual generaría una mayor liberación de Ca2+ en la fibra muscular, tal como en este trabajo se ha demostrado con el uso de antipirilazo III. Por otro lado esta mayor liberación de Ca2+ permitiría explicar la característica contracción y parálisis muscular producida por Hm3. Nosotros no tenemos evidencia directa sobre cual de estos efectos produce Hm3 (prolongación del potencial de acción o prolongación de la fase de caída de dicho potencial), sin embargo el bajo peso molecular determinado para Hm3 (4,5 kDa) corresponde típicamente al grupo de toxinas que se unen a canales de potasio, por lo que quizá Hm3 ejerza su acción uniéndose y bloqueando los canales de potasio a nivel de la fibra muscular.
En Tityus serrulatus se ha demostrado que la Ts1 (tityustoxina-I), una neurotoxina que bloquea canales de sodio y que es letal para roedores, también provoca la liberación de creatina kinasa y otras proteínas musculares. Se cree que el incremento de la concentración de estas proteínas en el plasma podría deberse a un daño del tejido y/o a una estimulación de mediadores químicos que podrían disparar su liberación (Correa et al., 1997).
En un trabajo previo, la observación al microscopio de cortes histológicos de músculo gastrocnemius de ratones albinos tratados con Hm3, nos ha mostrado que la toxina es capaz de producir parcialmente la desorganización y destrucción de las fibras musculares (Velásquez, et al., 2004). Ya que en este estudio se ha determinado que, Hm3 carece de actividad proteolítica y de fosfolipasa, la mionecrosis que ocasiona no sería una consecuencia directa de su acción sobre las miofibrillas; sino mas bien una consecuencia de su capacidad de incrementar los niveles de calcio intramuscular. Es sabido que el aumento de calcio citosólico puede activar proteasas y lipasas endógenas dependientes de calcio, con la consecuente destrucción o muerte celular (Trump et al., 1982).
Cabe señalar que en el veneno crudo tampoco se ha detectado actividad proteolítica pero sí actividad de fosfolipasa. Así, el veneno de H.mauryi se parece a otros venenos como los de H. lunatus, Nebo hierichonticus y Vejovis spinigerus que también carecen de proteasas (Escobar et al., 2002; Rosin, 1972; Russell et al., 1968), pero es diferente del veneno de Scorpio marus palmatus, en el cual sí se ha detectado actividad proteolítica (Zlotkin et al.,1972). La falta de actividad proteolítica en la mayoría de venenos de escorpiones, apoya la idea que estos venenos no participan en la digestión proteolítica de la presa.
Agradecimientos
Este trabajo formó parte de la tesis para optar el Título Profesional de Biólogo de Luz Velásquez. Contó con el financiamiento del Consejo Superior de Investigaciones de la Universidad Nacional Mayor de San Marcos,Proy. 031001211 y 041001221.
Literatura citada
Acosta, L. y J. Ochoa. 2000. Nueva especie de Orobothriurus Maury del Perú (Scorpiones: Bothriuridae). Revue Arachnologique, 13 (10) : 135-144. [ Links ]
Acosta, L. and J. Ochoa. 2001. Two news species of Orobothriurus Maury 1976 from Argentina and Perú, with comments on the systematics of the genus (Scorpiones: Bothriuridae). Scorpions 2001 In Memorian Gary A. Polis. Fet & Selden (eds.) : 203-214. [ Links ]
Aguilar, P. 1968. Nota sobre los escorpiones de Lima. Anales Científicos Univ. Agraria La Molina . VI (3): 165 -172. [ Links ]
Aguilar, P. y O. Meneses. 1970 escorpiones y Escorpionismo en el Perú: I, nota preliminar sobre los Scorpionida peruanos. Anales Científicos Univ. Agraria La Molina. VI (8) : Enero , Junio Nº 1-2. [ Links ]
Arboleda, E., O. Meneses y P. Aguilar. 1973. Escorpiones y Escorpionismo en el Perú. III: El veneno del escorpión de Lambayeque. Rev. Per. Ent. 16 (1) : 78-82. [ Links ]
Becerril, B., M. Corona, F. Coronas, F. Zamudio, E. Calderón-Arana, P. Fletcher, B. Martin and L. Possani. 1996. Toxic peptides and genes encoding toxin gamma of the brazilian scorpions Tityus bahiensis and Tityus stigmuris. Biochem J. 313 : 753-760. [ Links ]
Cáceres, I., P. Aguilar y O. Meneses. 1972. Escorpiones y escorpionismo en el Perú. II: Efectos del veneno de escorpión de los pedregales en la costa central. Rev. Per. Ent. 15 (1) : 38-43. [ Links ]
Calderón, S. y P. Aguilar. 1988. Escorpiones y escorpionismo en el Perú. X: Efecto del veneno de Brachistosternus ehrenbergi sobre ratones albinos. Rev. Per. Ent. 30 : 91-93. [ Links ]
Castro, G., A. Zavaleta y R. Castro de la Mata. 1981. Variación estacional del veneno de Hadruroides lunatus (koch) (Scorpionidae; Vejovidae) y su actividad paralizante sobre Porcellio laevis Koch (Crustacea Isopoda). Rev. peru. ent. 24(2): 71-74. [ Links ]
Chavira, R., T. Burnett and J. Hageman. 1984. Highly Efficient and Simple Methods for the Preparation of Peroxidase and Active Peroxidase - Antibody Conjugates for Enzyme Immunoassays. Anal Biochem. 136, 446 - 450. [ Links ]
Correa, M., S. Sampaio, R. Lopes, L. Mancuso, O. Cunha, J. Franco and J. Giglio. 1997. Biochemical and histopathological alterations induced in rats by Tityus serrulatus scorpion venom and its major neurotoxin tityustoxin-I. Toxicon 35 (7) : 1053-1067. [ Links ]
Escobar, E., C. Rivera, L. Tincopa y D. Rivera. 2002. Purificación parcial de las toxinas Hl1, Hl2 y Hl3 del veneno del escorpión Hadruroides lunatus koch, 1867 (scorpionida : vejovidae). Rev. Peru. Biol. 9 (1) : 3-10. [ Links ]
Escobar, E., C. Rivera y L. Tincopa. 2003. Acción de la toxina Hl3 sobre músculo esquelético. Rev. Peru. Biol. 10 (1) : 88-92. [ Links ]
Francke, O. 1977. Escorpiones y Escorpionismo en el Perú. VI: Lista de especies y claves para identificar las familias y los géneros. Rev. Per. Ent. 20 (1) : 73-76. [ Links ]
Francke, O. and M. Soleglad. 1980. Two new Hadruroides Pocock, from Peru (Scorpiones, Vaejovidae). Occasional papers the museum Texas Tech. University 1-13. [ Links ]
Garcia, M., Y. Gao, O. Mc Manus and G. Kaczorowiski. 2001. Potassium channels: from scorpion venom to high - resolution structure. Toxicon 39 :740-747. [ Links ]
Lowry, O., N. Rosenbrough, A. Farr and R. Randall. 1951. Protein measurement with the Folinphenol reagent. J Biol. Chem. 193 : 265 - 275. [ Links ]
Marinetti, G. 1965. The action of phospholipase A on lipoproteins. Biochim. Biophys. Acta (Amst.). 98 : 554-565. [ Links ]
Maury, E. 1978. Escorpiones y Escorpionismo en el Perú. VII: Nuevos hallazgos y redescripción de Brachistosternus andinus. Rev. Per. Ent. 21 (1): 23-26. [ Links ]
Murphy, E., K. Coll, T. Rich and J. Williamson. 1980. Hormonal effects on calcium homeostasis in isolated hepatocytes. J. Biol. Chem. 255 : 6600 [ Links ]
Ochoa, J. 2002. Nueva especie de Brachistosternus Pocock (Scorpiones: Bothriuridae) del Perú. Rev. Per. Biol. 9 (2) : 55-63. [ Links ]
Ochoa, J. and L. Acosta. 2002. Two new andean species of Brachistosternus Pocock (Scorpiones: Bothriuridae). Euscorpius Occasional publications in Scorpiology 2 : 1-13. [ Links ]
Pantigoso, C., E. Escobar y A. Yarlequé. 2002. Acción de la miotoxina del veneno de Bothrops brazili Hoge, 1953(Ophidia: Viperidae). Rev. Perú. Biol. 19 (12): 74 -73. [ Links ]
Possani, L., B. Becerril, M. Delepierre and J. Tytgat. 1999. Scorpion toxins specific for Na+ - channels. Eur. J. Biochem. 264. 287-300. [ Links ]
Rivera, C., L. Tincopa, C. Ramos, W. Manya y E. Escobar. 2004. Estudio preliminar del veneno de Brachistosternus ehrenbergii Gervais, 1841 (Scorpiones : Bothriuridae). Libro de resúmenes de la XIII Reunión Científica ICBAR. p.72. [ Links ]
Rosin, R. 1972. Venom, venom effects and poison gland of the scorpion Nebo hierichonticus. Cienc. Cult. 24, 246. [ Links ]
Russel, F., C. Alender and F. Buess. 1968. Venom of the scorpion Vejoris spinigerus. Science 159, 90. [ Links ]
Schägger, H. and G. von Jagow. 1987. Tricine - Sodium Dodecyl Sulfate-Polyacrylamide gel Electrophoresis for the Separation of Proteins in the Range from 1 to 100 kDa. Analitical Biochemistry . 166: 368- 379. [ Links ]
Tytgat, J., G. Chandy, M. Garcia, G. Gutman, M-F. Martin-Euclaire, J. Walt and L. Possani. 1999. A unified nomenclature for short-chain peptides isolated from scorpion venoms: a-KTx molecular subfamilies. TiES 20 : 444-447. [ Links ]
Trump, B., I. Berzesky and R. Cowley. 1982. The cellular and subcellular characteristics of acute and chronic injury with emphasis on the role of calcium. In: Pathophysiology of shock, anoxia and ischemia, P.G. Cowley, R.A. and Trump, B.F. Eds. Williams and Wilkins. Baltimore. 6-46. [ Links ]
Velásquez, L., N. Rojas y E. Escobar. 2004. Purificación y propiedades de una toxina (Hm3) del veneno del escorpión Hadruroides mauryi Francke y Soleglad, 1980 (Scorpiones : Iuridae). Libro de resúmenes XIII Reunión Científica ICBAR. p. 62 [ Links ]
Zavaleta, A. 1983. El veneno del escorpión: Bioquímica y Farmacología. Boletín de Lima. No. 30, 76. [ Links ]
Zlotkin, E y A. Shulov. 1969. A simple device method for collecting scorpion venom. Toxicon, 7 : 331. [ Links ]
Zlotkin, E., N. Lebovits and A. Shulov. 1972. Toxic effects of the venom of the scorpion Scorpio maurus palmatus (scorpionidae). Riv. Parasitol. 33, 237. [ Links ]
(1) Laboratorio de Bioquímica y Genética Molecular. Facultad de Ciencias Biológicas. UNMSM.
Email: Enrique Escobar eescobarg@unmsm.edu.pe