Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.11 no.2 Lima Jul./Dec. 2004
Antonieta Miñano1, Julio Chico1, Eloy López1, Manuel Sisniegas2 y Miguel Bobadilla3
(1) Laboratorio de Fisiología y Cultivo de Tejidos Vegetales. Facultad de Ciencias Biológicas. Universidad Nacional de Trujillo. Perú.
(2) Departamento de Estadística. Facultad de Ciencias Físicas y Matemáticas. Universidad Nacional de Trujillo. Perú
(3) Sección de Biología. Facultad de Ciencias. Universidad Nacional de Ancash Santiago Antunez de Mayolo. Perú.
Presentado: 29/11/2003
Aceptado: 22/11/2004
Resumen
El cultivo de Vitis vinifera «vid» constituye una de las actividades agrícolas de mayor importancia en nuestra alimentación y en la medicina por presentar unos compuestos bioactivos llamados antocianinas conocidas por tener propiedades antioxidantes, anticancerígenas y cardiotónicas. Con la finalidad de aportar con una alternativa diferente a su extracción tradicional se estableció un sistema de cultivos celulares en suspensión con el propósito de determinar la concentración óptima de sacarosa para obtener mayor producción de antocianinas a partir de cultivos celulares de Vitis vinifera «vid» var. red globe. Se adicionaron diferentes concentraciones de sacarosa (0 mM, 58 mM, 132 mM y 175 mM) al medio de cultivo basal (MB) suplementado con concentraciones separadas de ácido naftalenacético y kinetina como medio inductor (MI). El contenido de antocianinas aumentó a medida que se incrementó la concentración de sacarosa (132 mM) en el medio de cultivo, encontrándose diferencias significativas entre los tratamientos.
Palabras clave: Vitis vinifera, antocianinas, sacarosa, cultivos celulares.
Abstract
Vitis vinifera «grape» is one edible fruit vine of importance in agriculture activities, besides to have medical properties related to bioactive natural products knowing as anthocyanins, that, they exhibit antioxidative, anticancerigen and cardiotonic activities. In this paper, a system of suspension cell cultures from Vitis vinifera «vid» var. red globe was established to determine the effect of the concentration of sucrose on anthocyanins yield. Different concentrations of sucrose (0 mM, 58 mM, 132 mM and 175 mM) into Basal culture Media (BM) supplemented with separated concentrations of naftalnacetic acid and kinetine as Inductor Media (IM), were applied. Anthocyanins yield were increased in according to increment of sucrose concentration (132mM) in the cell culture. Significant differences among the treatments were founded.
Keywords: Vitis vinifera, anthocyanins, sucrose, cell cultures.
Introducción
Vitis vinifera, es intensamente cultivado y reconocido en la alimentación humana por su alto valor energético en azucares, sales minerales y vitaminas. Desde un punto de vista médico-farmacológico, su utilidad se ha incrementado notablemente, ya que se ha demostrado que poseen marcadas propiedades cardiotónicas gracias a unos compuestos glucosídicos llamados antocianinas, que están presentes en hojas, frutos y el aceite de la semilla (Decendit y Mérillon, 1996), y cuya función biológica radica en proporcionar permeabilidad y resistencia a los capilares sanguineos (Bruneton, 1991). Asimismo, las antocianinas constituyen colorantes atóxicos que se utilizan actualmente en la industria alimentaria y de medicamentos (Lock, 1997).
El potencial de los cultivos de células vegetales para la producción de antocianinas es todavía limitado, debido fundamentalmente a factores que determinan una baja productividad de compuestos de interés. Sin embargo, este problema se ha visto parcialmente superado por la selección de líneas celulares altamente productivas, optimización de condiciones físicas y químicas del medio de cultivo, adición a dichos medios de precursores biosintéticos y elicitores, la sobreexpresión de genes codificantes de enzimas claves en las rutas biosintéticas implicadas y a un aumento en la excreción de compuestos deseados al medio (Piñol, 1999; Endress, 1994). Por ello, no es de extrañar el gran interés por la producción biotecnológica a gran escala de estos metabolitos secundarios (Serrano y Piñol, 1991; Evans, 1998).
Además de los reportes sobre la producción de antocianinas en cultivos de células de Fragaria vesca «fresa» (Mori y Sakurai, 1994), Ipomoea batata «camote», (Xu et al., 2001; Xu et al., 2000); Ajuga reptans, (Callebaut et al., 1990), en V. vinifera, se han tratado de enfocar algunas investigaciones dedicadas no sólo a estimular su producción (Decendit y Mérillon, 1996); sino también a su acumulación a través del empleo de diferentes niveles de temperatura (Zhang et al., 1998), luz (Sato et al., 1998); concentraciones de amonio (Do y Cormier, 1991), sacarosa y nitrógeno (Kim y Kim, 2002 a y b), y también empleando biorreactores con cultivos celulares para la producción de catequinas, taninos condensados y antocianinas (Decendit et al., 1996). Otra propuesta es la de preparar suspensiones celulares en dos medios, uno de mantenimiento y otro promotor de antocianinas, en el que se incrementen notablemente su producción (Bailly et al., 1996). Al respecto, Nozue et al. por referencia de Cormier et al. (1989), señalan reportes en cultivos celulares indicando que un aumento en la concentración de sacarosa de 2 a 6% e incluso hasta de 12% al medio de cultivo (Pierik, 1990; Lindsey y Jones, 1992; Hurtado y Merino, 1994), estimulan la producción de antocianinas al desarrollar una osmolaridad en el medio inducida precisamente por las altas concentraciones de azúcar (Cormier por referencia de Kim y Kim, 2002a).
Las antocianinas conservan estructuras químicas muy complejas que originan que su síntesis química sea económicamente inviable (Serrano y Piñol, 1991; Lindsey y Jones, 1992; Evans, 1998; Piñol, 1999), razón mas que suficiente para proponer como alternativa el cultivo de células y órganos vegetales con la finalidad de aumentar la cantidad de antocianinas (Evans, 1998). En el presente trabajo nos proponemos determinar la concentración de sacarosa que permita obtener la mayor producción de antocianinas en cultivos celulares de V. vinifera L. var. red globe .
Material y métodos
Material Biológico
Se utilizaron explantes (hojas) de plántulas in vitro de V. vinifera var. red globe obtenidas en el laboratorio de Fisiología y Cultivo de Tejidos Vegetales de la Universidad Nacional de Trujillo.
Obtención de Callos
En una cámara de siembra en condiciones de asepsia y esterilización, se procedió a introducir en viales de vidrio de 10 ml, segmentos de hojas de 1 cm de lado en el Medio de cultivo Basal (MB), conteniendo macroelementos (Gamborg et al.,1968), microelementos (Murashige y Skoog, 1962), vitaminas (Morel, 1965) suplementado con 3 g de sacarosa, 0,3 g de fitagel y 0,01 mL de 2,4-D (2,4-diclorofenoxiacetico), a la mitad de su concentración, y a pH 5,8. Los cultivos se mantuvieron en incubación, con un fotoperíodo de 16 horas luz proporcionada por fluorescentes de 40 wats, a la temperatura de 25 ± 1 ºC, 8 horas de oscuridad y humedad relativa de 85%. A los 30 días se procedieron a cultivar las células a partir de los callos obtenidos.
Cultivos Celulares
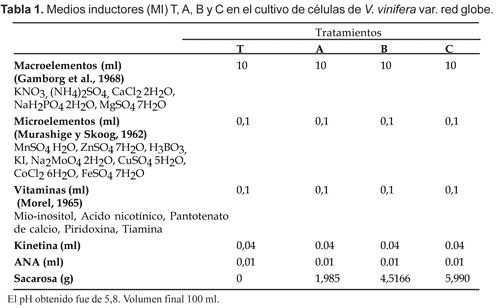
En los cultivos celulares se utilizaron 2 medios líquidos: El Medio de Mantenimiento (MM; cuya base fue el MB y el Medio Inductor (MI) (Tabla 1), que fue suplementado con kinetina, ANA (Acido naftalenacético) y sacarosa a diferentes concentraciones: 0 mM (T), 58 mM (A), 132 mM(B) y 175 mM (C).
En la cámara de siembra aséptica, se procedió a escoger callos de 1,5 cm de diámetro con coloración rojiza. Luego, se colocaron dos unidades de callo por matraz en 20 mL del MM. Los callos se desintegraron utilizando una bagueta estéril y se filtraron con un tamiz nylon, con la finalidad de obtener células libres. Posteriormente, el contenido se distribuyó en cuatro matraces, iniciándose con un volumen celular de 2 x 105 cel/mL aproximadamente. Dichos matraces, de 125 mL de capacidad, se colocaron en un agitador orbital (100 rpm) con luz continua proporcionada por un fluorescente luz blanca de 40 wats, temperatura de 25 ± 1 ºC, humedad relativa de 85% y durante siete días.
Luego de este periodo las células cultivadas en MM fueron transferidas a MI para ser sometidas a los tratamientos A, B y C (Tabla 1) comparados con un testigo el cual consistió en el MM sin sacarosa e identificado con la letra T. La siembra en MI se realizó en la cámara aséptica colocándose en matraces, 3 mL de células suspendidas en MM (2 x 105 cel/mL aproximadamente), a cada uno de los tratamientos y al testigo. Cada matraz con 15 mL de MI, se colocaron en el agitador orbital (100 rpm), con luz blanca continua proporcionada por fluorescentes con intensidad lumínica de 5000 lux, temperatura de 25 ± 1 ºC, humedad relativa de 85%, durante 4 semanas. Se realizaron evaluaciones semanales para analizar su crecimiento, formas celulares, contenido y presencia de antocianinas a la vez que se renovaban los medios de cultivo. Cada ciclo se repitió 3 veces y las lecturas de los extractos se realizaron al final de cada ciclo.
Evaluación del crecimiento celular
Se utilizó una cámara de Neubauer American Optical adpatada para el conteo de células de vid, según la siguiente formula:
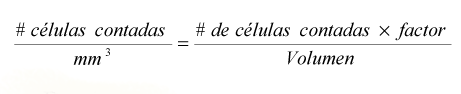
Donde:
Factor = 5 y Volumen = 0,4 mm3
Además se colorearon las células con azul de metileno para determinar su viabilidad.
Cosecha de las células
Después de 4 semanas las células en suspensión fueron separadas utilizando papel de filtro Watman Nº 10 y expuestas a la estufa por 24 horas.
Extracción y lectura de antocianinas
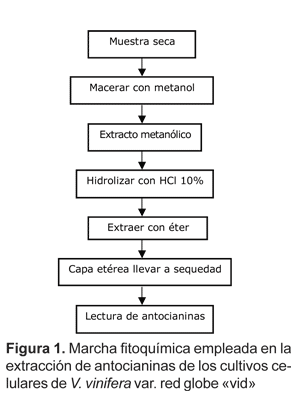
La extracción de antocianinas se realizó utilizando la marcha fitoquímica de Lock (1994) (Fig. 1) y la lectura de los extractos mediante un espectrófotometro UV Hewlett Packard a 535 nm.
Cuantificación de antocianinas
La cantidad de antocianinas en los extractos se calculó de acuerdo a Vitrac et al. (2000). La curva patrón se construyó utilizando el coeficiente de extinción molar (log e 4,53) y la ley de Beer (Willard et al., 1986).
Análisis estadístico
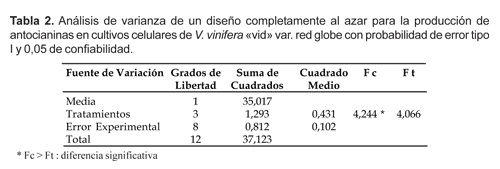
Los datos obtenidos de la cuantificación de antocianinas a las cuatro semanas se analizaron estadísticamente de acuerdo a un análisis de varianza (ANAVA) de un diseño completamente al azar, prueba de rango múltiple de Duncan y análisis de regresión polinómica con una probabilidad de error tipo I y con 0,05 de confiabilidad.
Resultados
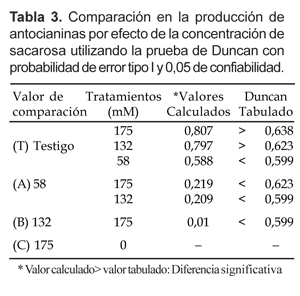
El análisis de varianza (Tabla 2) muestra que existen diferencias significativas en la producción de antocianinas entre cada uno de los tratamientos a los que fueron sometidas las células de V. vinifera; y según la prueba de Duncan (Tabla 3) existen diferencias significativas entre los tratamientos B y C con respecto al testigo, siendo la producción de antocianinas halladas a 132 mM (B) y 175 mM (C) de sacarosa significativamente mayores que el testigo.
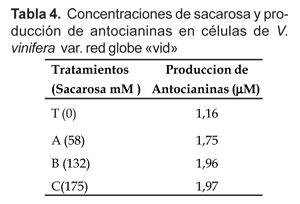
Asimismo, la producción de antocianinas van aumentando conforme se incrementa la concentración de sacarosa (Tabla 4), siendo la máxima producción de 1,97 mM a 175 mM de sacarosa (tratamiento C).
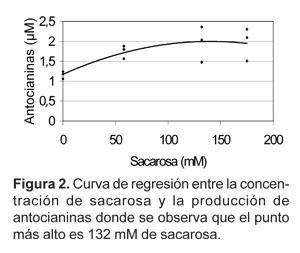
El análisis de regresión (Fig. 2) identifica el punto de mayor producción de antocianinas el obtenido con el tratamiento B, a 132 mM de sacarosa.
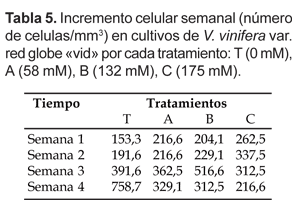
El crecimiento y viabilidad celular se monitorearon semanalmente en vista de los diferentes tratamientos sometidos, desarrollándose un patrón relativamente estable en las cuatro semanas en A con 329,1 cel./mm3, B con 312,5 cel./mm3 y C con 216,6, cel./mm3, y un aumento continuo de crecimiento celular en T, alcanzando 758, 7 cel./mm3 (Tabla 5).
Discusión
En este trabajo se ha determinado que la producción de antocianinas aumenta a 1,97mM a medida que se incrementa la concentración de sacarosa hasta 175 mM (Tabla 4), lo que indica que las células aumentan su capacidad de sintetizar antocianinas a concentraciones crecientes de sacarosa. Cabe señalar que Cormier et al. (1989); Decendit (1996) y Kim y Kim (2002a) reportan resultados coincidentes a los encontrados en el presente trabajo. Sin embargo, cuando la concentración de sacarosa alcanzó 58 mM estimuló una menor producción de antocianinas en 1,75 mM y ninguna producción en el grupo testigo con 0 mM de sacarosa. Decendit y Mérillon (1996) y Kim y Kim (2002b) llegaron a similares conclusiones en cultivos celulares de Vitis sp.
En general concentraciones crecientes de sacarosa favorecen la producción de antocianinas (Cormier et al., 1989; Do y Cormier, 1991; y Kim y Kim, 2002a) sin embargo la declinación de la curva observada en la figura 5 se debería a que elevados niveles de sacarosa crean condiciones de estrés osmótico lo cual inhibe el crecimiento celular, pero a su vez, mejora la acumulación de antocianinas (Cormier et al., 1989; Do y Cormier, 1991). Asímismo, Kim y Kim (2002b), explican que el estrés osmótico o alta viscosidad del medio, inhibe la captación del nutriente bloqueando las rutas metabólicas responsables de la síntesis de antocianinas y activándose otras.
En cada especie de Vitis, la concentración de sacarosa debe variar para obtener una máxima producción de antocianinas. Kim y Kim (2002a), encontraron que la concentración de sacarosa con una apropiada producción de antocianinas fue a 204 mM y la concentración más conveniente para el incremento de las antocianinas totales fue 146 mM en Vitis vinifera var. sheridan; sin embargo, en el presente trabajo, la producción máxima de antocianinas se obtuvo a una concentración de 175 mM de sacarosa (Tratamiento C) y el punto óptimo de sacarosa para la producción de antocianinas fue 132 mM (Tratamiento B), esta diferencia en los resultados puede atribuirse a la variedad red globe de Vitis vinifera utilizada en el presente trabajo.
Literatura citada
Bailly, C.; F. Cormier, y C. Do. 1996. Characterization and activities of S-adenosyl-1-methionine: cyanidin 3-glucoside 3'-O-methyltransferase in relation to anthocyanin accumulation in Vitis vinifera cell suspension cultures. Plant Science 122(1): 81-89. [ Links ]
Bruneton, J. 1991. Elementos de Fitoquímica y Farmacognosia. Edit. Acribia S.A. Zaragoza. España. [ Links ]
Callebaut, A.; A. Voets and J. Motte. 1990. Anthocyanin production by plant cell cultures on media based on milk whey. Biotechnology Letters 12: 215-218. [ Links ]
Cormier, F.; H. Crevier and Ch. Do. 1989. Effects of sucrose concentration on the accumulation of anthocyanins in grape (Vitis vinifera) cell suspension. Journal of Botanic 98: 1822-1825. [ Links ]
Decendit, A. and J. Mérillon. 1996. Condensed tannin and anthocyanin production in Vitis vinifera cell suspension cultures. Plant cell reports 15:762 765. [ Links ]
Do, Ch. and F. Cormier. 1991. Effects of low nitrate and high sugar concentrations on anthocyanins content and composition of grape (Vitis vinifera L.) cell suspension. Plant Cell Reports 9: 500-504. [ Links ]
Endress, R. 1994. Plant cell biotechnologies. 2º Ed. Springer Verlg. Washington D. C. [ Links ]
Evans, W. 1998. Farmacognosea. 13º Edic. Edit. Nueva editorial Interamericana Mc. Graw Hill S.A. de C.V. México. [ Links ]
Gamborg, O.; R. Miller & K. Ojima. 1968. Nutrient requirements of suspension cultures of soybean root cells. Experimental Cell Research. 50: 151. [ Links ]
Hurtado M, y M. Merino. 1994. Cultivo de Tejidos Vegetales. 3º Ed Trillas. México D. F. México. [ Links ]
Kim, Seung-Heui & S. K, Kim. 2002. Effects of sucrose level and nitrogen sourve on fresh weigh and anthocyanin production in cell suspension culture of «Sheridan» grape (Vitis spp.). Journal of Plant Biotechnology 4(1):23-27 [ Links ]
Kim, Seung-Heui. & S. K, Kim. 2002. Effects of 2,4-D, BA, and sucrose on growth, production of anthocyanin, pH, and sugar content in «sheridan» grape cell suspension cultures. Journal of Plant Biotechnology 4(2): 77-82. [ Links ]
Lindsey, K. y M. Jones. 1992. Biotecnología Vegetal Agrícola. Ed. Acribia S.A. Zaragoza. España. [ Links ]
Lock, O. 1997. Colorantes Naturales. Edit. Fondo Editorial de la Pontificia Universidad Católica del Perú. Lima. Perú. [ Links ]
Morel, G.1965. Clonal propagation of orchids by meristems culture. Cymbidium Soc News 20: 3. [ Links ]
Mori, T. and M. Sakurai. 1994. Production of anthocyanin from strawberry cell suspension cultures; effects of sugar and nitrogen. Journal of Food Science 59(3): 588-593. [ Links ]
Murashige, T. and F. Skoog. 1962. A revised medium for rapid growth and bioassays with tobacco tissue cultures. Physiology Plant 15: 473. [ Links ]
Pierik, R. 1990. Cultivo In Vitro de las Plantas Superiores. 3º Edic. Edit. Ediciones Mundi-Prensa. Madrid. España. [ Links ]
Piñol, M. 1999. Aplicación de las Nuevas Tecnologías para la Producción de Metabolitos Secundarios. XIII Reunion Nacional de la Sociedad Española de Fisiologia Vegetal. VI Congreso Hispano - Uso de la Fisiologia Vegetal. Sevilla. España.
Sato, K.; M. Nakayama and J. Shigueta. 1998. Culturing conditions affecting the production of anthocyanin in suspended cell cultures of strawberry. Plant Science 113(1): 91-98. [ Links ]
Serrano, M. Y M. Piñol. 1991. Biotecnología Vegetal. Ed. Síntesis. Madrid. España. [ Links ]
Vitrac, X.; F. Larronde; S. Krisa; A. Decendit; G. Deffieux; J.M. Mérillon. 2000. Sugar sensing and Ca 2+-calmodulin requeriment in Vitis vinifera cells producing anthocyanins. Phytochemistry 53: 659-665. [ Links ]
Willard, H.; L. Merrit; J. Dean y F. Settle. 1986. Métodos instrumentales y de análisis. Compañía editorial Continental S.A. de C. V. México. [ Links ]
Xu, W.; K. Moriya; K. Yamada; M. Kondo; M. Nishimura; H. Shioiri; M. Kojima and M. Nozue. 2000. Detection and characterization of a 36-Kda Peptide dereived from a 24-kDa vacuolar protein (VP24) precursor in anthocyaninproducing sweet potato cells in suspension culture. [ Links ]
Xu, W.; H. Shioiri, M. Kojima and M. Nozue. 2001. Primary structure and expression of a 24-KD vacuolar protein (VP24) precursor in anthocyanin-producing cells of sweet potato in suspension culture. Plant Physiology 125:447-455. [ Links ]
Zhang, W.; M. Seki and S. Furusaki. 1998. Effect of temperature and its shift on growth and anthocyanin production in suspension cultures of strawberry cells. Plant Science 127(2) pp. 207-214. [ Links ]
(1) Laboratorio de Fisiología y Cultivo de Tejidos Vegetales. Facultad de Ciencias Biológicas. Universidad Nacional de Trujillo. Perú.
Email: Antonieta Miñano aminanoz@terra.com.pe