Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.12 no.1 Lima Jan./jul. 2005
Gregorio Pérez-Cordón*, M. José Rosales-Lombardo y Manuel Sánchez-Moreno
(*) Departamento de Parasitología, Instituto de Biotecnología, Universidad de Granada, España.
Presentado: 11/05/2005
Aceptado: 14/06/2005
Resumen
El presente trabajo describe un protocolo aplicado a muestras de heces de ganado bovino para el aislamiento y purificación de ooquistes de Cryptosporidium sp. y el eventual uso de los mismos para estudios genéticos mediante PCR.
Palabras clave: Criptosporidiosis, ADN, PCR , ooquistes, purificación.
Abstract
The present paper describes a protocol applied to fecal samples of cattle for the isolation and purification of Cryptosporidium sp. oocysts and the possible use of the same ones for genetic studies by means of PCR.
Keywords: Cryptosporidium, DNA, PCR , oocysts, purification.
Los organismos pertenecientes al género Cryptosporidium son protozoos parásitos intracelulares obligados del phylum Apicomplexa. Desde que el género fue descrito por Tyzzer (1907) más de 20 especies del género Cryptosporidium fueron descritas en varios mamíferos hospedadores, pero actualmente sólo diez especies son consideradas especies válidas de Cryptosporidium para la mayoría de los investigadores (Fayer et al., 2000). C. parvum es la especie considerada como responsable de criptosporidiosis en la mayoría de los mamíferos incluidos el hombre. La criptosporidiosis es un proceso diarreico agudo autolimitado en individuos inmunocompetentes con una duración aproximada de dos semanas y una patología crónica en pacientes inmunodeprimidos, no autolimitada y con diseminación del parásito a localizaciones extraintestinales (Ma et al.,1983).
La identificación de especies de este género Cryptosporidium basadas en técnicas como la morfometría son poco fiables, esto hace necesario el uso de técnicas más depuradas y específicas para la identificación de especies. En este sentido en el presente trabajo se describe un protocolo desarrollado para la detección de Cryptosporidium en heces mediante el uso de la PCR.
Las muestras fecales se obtuvieron de terneros tipo Holstein neonatos y de pocos días de edad, con parasitosis adquirida de forma natural en granjas lecheras de la provincia de Granada (España), por ser estos, hospedadores con elevada prevalencia de criptosporidiosis y a partir de los cuales se puede obtener gran volumen de muestra. Las muestras fecales se seleccionaron en función de la sintomatología del ternero ( presencia o no de diarrea). Las muestras se recogieron en bolsas de plástico no estériles y transportadas al laboratorio para su diagnóstico y procesamiento; éstas fueron observadas por en microscopio óptico para determinar la presencia de Cryptosporidium mediante examen en fresco y/o mediante tinción Ziehl-Neelsen modificada. A las tres muestras positivas de las 15 muestras colectadas en total, se le adicionó agua para diluir todo el material fecal, eliminar el material grosero y facilitar su filtrado a través de malla metálica. El filtrado fue lavado varias veces mediante centrifugación durante 15 minutos a 3830 g para eliminar la materia grasa, y luego preservadas a 4 °C para la posterior purificación de los ooquistes.
Los ooquistes fueron purificados mediante gradiente discontinuo de KBr según Entrala et al. (2000). Los ooquistes purificados fueron resuspendidos en tampón PBS con adición de timerosal al 0,02% y preservados a 4 °C para la posterior extracción y purificación de ADN. El número de ooquistes utilizados fue determinado por recuento en cámara de Neubauer. Todo el proceso anterior se llevo a cabo con cada muestra por separado. La extracción y purificación de ADN se realizó a partir de la liberación de los esporozoitos mediante digestión artificial de 5x106 ooquistes (Robertson et al., 1993). La verificación de la digestión se realizó con microscopio óptico por visualización de los restos de los mismos y la presencia de numerosos esporozoitos móviles. La suspensión resultante de dicha digestión artificial fue centrifugada a 5107 g durante 15 minutos y resuspendida en tampón PBS. La extracción y purificación de ADN fue llevada a cabo según la técnica de Ward et al. (2001), en virtud de los satisfactorios resultados obtenidos utilizando el método estándar de extracción y purificación de ADN mediante fenol-cloroformo-isoamílico.
Para la PCR nos basamos en la técnica según Xiao et al. (2000), llevándose a cabo la amplificación de un fragmento de unas 1325 pb contenido en el gen 18S ribosomal, para lo cual, utilizamos los siguientes cebadores: 5'TTCTAGAGCTAATACATGCG-3' y, como reverso, 5'CCCATTTCCTTCGAAACAGGA-3'. El resultado fue evaluado mediante electroforesis en gel de agarosa al 2% p/v en tampón TAE (Tris-ácido acético-EDTA). En cada pocillo se aplicaron 8 mL más 2 mL de tampón de corrido (glicero-azul de bromofenol al 0,25% en agua destilada. Para verificar el tamaño de banda del fragmento amplificado utilizamos un patrón de peso molecular (SIGMA) conteniendo diez bandas de 500 pb cada una. La electroforesis fue desarrollada durante 90 minutos a 115V. El gel fue teñido durante 30 minutos en bromuro de etidio (0,75 ug/ml), visualizado y fotografiado bajo luz ultravioleta. Como resultado obtuvimos una banda, que basándonos en el patrón de peso molecular, correspondía al tamaño esperado, aproximadamente 1325 pb (Fig. 1).
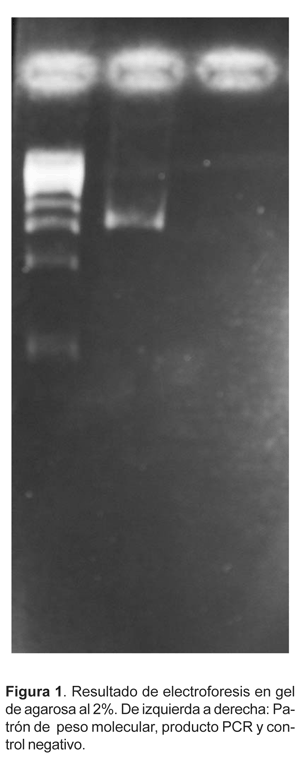
Se puede concluir que el protocolo de trabajo descrito constituye una herramienta útil para la amplificación de ADN de Cryptosporidium sp. aislado y purificado a partir de muestras fecales. La previa purificación de los ooquistes mediante gradiente discontinuo de densidad con KBr permitió el uso de la PCR a pesar de los inhibidores de esta técnica presentes en las heces y que reduce la sensibilidad de ésta cuando el ADN es extraído directamente a partir de heces (Johnson et al., 1995; Mayer y Palmer, 1996). Esta técnica evita el uso de kits de extracción de ADN con cebadores altamente específicos que permiten detectar la presencia de un único ooquiste (Sturbaum et al., 2001), pero muy costosos, y comprobamos que el método estándar de extracción y purificación de ADN permite resultados satisfactorios para tal fin. En ensayos previos comprobamos que la cantidad de ooquistes citada en el presente trabajo es la mínima cantidad a partir de la cual se consiguió una extracción y purificación eficiente de ADN útil para PCR. Si bien, la técnica descrita no es tan eficiente como el uso de kits de extracción y purificación de ADN, si es en cambio, la técnica que reporta mejores resultados cuando se prescinde de los citados kits.
Literatura citada
Entrala E., J.M. Molina-Molina, M.J. Rosales, M. Sánchez-Moreno & C. Mascaro. 2000. Cryptosporidium parvum: oocystis purification using potassium bromide discontinuous gradient. Veterinary parasitology. 92: 223-226. [ Links ]
Fayer, R., U. Morgan, J.S. Upton. 2000. Epidemiology of Cryptosporidium: transmission, detection and identification. International Journal for Parasitology. 30:1305-1322.
Johnson, D.W., N.J. Pieniazek, D.W. Griffin, L. Misener, & J.B. Rose. 1995. Development of PCR protocol for sensitive detection of Cryptosporidium oocysts in water sample. Appl. Environ. Microbiol. 62:3849-3855.
Ma, P. & R. Soave. 1983. Three step stool examination for cryptosporidiosis in ten homosexual men with protracted watery diarrhea. J. Infect. Dis. 147:824-8.
Mayer, C., & Palmer, C.(1996). Evaluation of PCR, nested PCR, and fluorescent antibodies for detection of Giardia and Cryptosporidiosis species in wastewater. Appl. Environ. Microbiol., 62:2081-2085.
Robertson, L.J., A.T. Campbell, and H.V. Smith. 1993. Survival of Cryptosporidium parvum oocystes under various environmental pressures. Appl. Environ. Microbiol. 58:3494-3500.
Sturbaum, G.D., C. Reed, P.J. Hoover, B.J. Helen, M.M. Marilyn & R.S. Charles. 2001. Species-Specific, Nested PCR-Restdriction Fragment Length Polymorphism Detection of Single Cryptosporidium parvum oocysts. Appl. Environ. Microbiol. 67: 2665-2668.
Tyzzer, E.E. 1907. A sporozoan found in the peptic glands of the common mouse. Proc. Soc. Exp. Biol. 5:12-13.
Ward, L.A., and Y. Wang. 2001. Rapid methods to isolate Cryptosporidium from frozen feces for PCR. Diag. Microbiol. Infec. Dis. 41:37-42.
Xiao, L., K. Alderisio, J. Limor, M. Royer, & A. Lal. Altaf 2000. Identificatión of species and sources of Cryptosporidium oocysts in storm waters with a small-subunit Rrna-Based diagnostic and genotyping toll. Appl. Environ. Microbiol. 66:5492-5498.
Correspondencia
(*) Departamento de Parasitología, Instituto de Biotecnología, Universidad de Granada, España. Dirección del autor: Gregorio Pérez Cordón. Pablo Picasso,589 2°A. Urb. El Bosque. Trujillo (Peru).
e-mail:grego@correo.ugr.es













