Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.12 n.3 Lima oct./dic. 2005
Alejandro Estrada-Cuzcano, José Sandoval, María L. Guevara-Fujita y Ricardo Fujita1
1 Instituto de Genética y Biología Molecular, Facultad de Medicina Humana, Universidad de San Martín de Porres.
Presentado: 07/07/2005
Aceptado: 02/02/2006
Resumen
En el presente trabajo se evalúa la técnica de SSCP (polimorfismo de conformación de cadena individual de ADN) para detectar mutaciones puntuales, tanto por su sensibilidad en la detección (alrededor 80% en condiciones ideales), como por su implementación fácil y económica. Se utilizaron como controles positivos y negativos, ADN de voluntarios caracterizados previamente para las mutaciones puntuales de 5 RFLPs mitocondriales. Para la optimización de la prueba fueron ensayadas concentraciones variables del tampón TBE (1X y 0,5X) y del glicerol (10%, 5% y 0) en geles de poliacrilamida. Cuatro de los 5 RFLPs fueron detectados en las condiciones utilizadas y pueden ser usados en estudios de rutina sin usar enzimas de restricción. Además, la técnica SSCP permitió determinar mutaciones desconocidas en un segmento de 394 nucleótidos de la región hipervariable (HVI) del ADNmt. Diferencias en correspondencia a los distintos haplotipos fueron detectados e incluso permitió discernir grupos dentro del mismo subtipo. La secuenciación de dos muestras del subtipo B1 con migración diferencial en SSCP, corroboró la existencia de siete nucleótidos distintos.
Palabras clave: SSCP, ADNmt (ADN mitocondrial), mutaciones puntuales, SNP (polimorfismo de un solo nucleótido).
Abstract
We evaluate the use of SSCP (single strand conformational polymorphism), a relatively easy and inexpensive technique for the detection of point mutations with a sensibility around 80% under ideal conditions. To test the technique, we used samples of volunteers whose DNA had been previously characterized for the presence or absence of 5 mitochondrial RFLPs. Optimization of the tests included variations in TBE (1X and 0,5X) and of glycerol concentration (10%, 5% and no glycerol) in polyacrylamide gels. Four out of five RFLPs were detected under the conditions used and could be applied routinely without using restriction enzymes. In addition, the SSCP technique allowed detection of unknown mutations in a 394 bp nucleotide segment of the hypervariable (HVI) region of mtDNA. Differences corresponding to different haplotypes were detected, helping to distinguish groups within the same subtype. Sequencing of two samples of subtype B1 with differential migration on SSCP gels, proved the existence in seven different nucleotides.
Keywords: SSCP, mtDNA, point mutation, SNP.
Introducción
La comparación del genoma de dos individuos del mismo sexo revelaría millones de mutaciones esparcidas a lo largo de todas las regiones cromosómicas. La mayoría de las mutaciones cambian una sola base de cada 500-1000, frecuentemente en segmentos no codantes y eventualmente en los codantes. Por esta razón la mayor parte de éstas no tiene efectos fenotípicos. Sin embargo algunas pueden provocar o estar asociadas a enfermedades. Cuando una mutación puntual está en una frecuencia mayor al 1% en la población, se le conoce como SNP (single nucleotide polymorphism-polimorfismo de un nucleótido).
Con el estudio del genoma humano se ha incrementando el conocimiento del número de genes involucrados en diversas enfermedades hereditarias. Actualmente se registran cerca de 5700 diferentes enfermedades con componente genético (OMIM-On-Line Mendelian Inheritance in Man, 2004). Se han identificado mutaciones que causan o predisponen a enfermedades y su caracterización sirve para el diagnóstico, pronóstico, tratamiento y eventualmente prevención de la enfermedad. Algunos SNPs también son útiles como marcadores genéticos porque constituyen la mutación que predispone o porque están físicamente cerca a la mutación causal de la enfermedad.
En la búsqueda de mutaciones puntuales, se emplean métodos como el secuenciamiento directo, RFLPs (Southern, 1975), clivaje químico, CCM (Cotton et al., 1988), clivaje por RNAsa (Goldrick et al., 1996) u oligonucleótidos alelo específicos para hibridación (ASO) (Nollau & Wagener, 1997), entre otros. Estos métodos presentan diferentes rangos de sensibilidad, además de requerir reactivos y equipos sofisticados, que aumentan su complejidad y costo operativo. Frente a ellos, el método de SSCP es fácil y económico, pues usa segmentos amplificados por PCR visualizados en geles de acrilamida con adyuvantes (Orita et al., 1989). El SSCP es un método capaz de identificar la variación de un sólo nucleótido en un segmento de ADN, típicamente entre 150 a 200 nucleótidos de largo. En condiciones ideales el rango de sensibilidad del SSCP varía entre 80-90% para detectar mutaciones en fragmentos menores de 200 pares de bases (Sheffield et al., 1993). El método del SSCP se basa en que bajo condiciones no desnaturalizantes una hebra individual de ADN adopta una conformación espacial que es específica de la composición de su secuencia nucleotídica (Fig. 1). Esta conformación sería dependiente de la hibridación entre distintas regiones de un segmento de ADN replegado sobre sí mismo. La configuración diferente es provocada por el cambio de una sola base, entonces podría ser detectada en algunas condiciones de migración electroforética en una matriz de poliacrilamida (Orita et al., 1989, Humphries et al., 1997). La técnica es simple, versátil y económica, pero exige la optimización de parámetros en la composición del gel para cada fragmento a evaluar.
Los polimorfismos del ADN mitocondrial (ADNmt) son utilizados usualmente para el estudio de la diversidad del genoma humano. Esto permite la comparación entre individuos de diferentes poblaciones e incluso entre individuos de distintas épocas. El método más usado para determinar subtipos de ADNmt en nativos americanos (amerindios) consiste en la detección de 8 sitios polimórficos en diferentes regiones del ADNmt. Siete son SNPs detectados por el método llamado RFLP (polimorfismos de longitud de fragmentos de restricción) y uno es la inserción/deleción de un segmento de 9 pares de bases. El RFLP es un SNP que coincide en el sitio de reconocimiento de una enzima de restricción. Su presencia o ausencia determina que la enzima corte o no el segmento de ADN. Evidentemente solo una pequeña porción de SNPs serán detectadas por la técnica RFLPs. A partir de la combinación de los sitios polimórficos en cada individuo se confeccionan haplotipos que definirán tipos y subtipos de ADNmt. Los ADNmt amerindios han sido definidos en 4 tipos (haplogrupos) más frecuentes A, B, C y D (Schurr et al., 1990). La adición de un sitio polimórfico diseca los haplogrupos en subtipos A1, A2, B1, B2, C1, C2 y D1 y D2 (Bailliet et al., 1994).
En el ADNmt existe la región D-loop, que tiene 2 segmentos muy variables denominadas HVI (región hipervariable I) y HVII (región hipervariable II). Debido a que contienen secuencias no codantes y no tienen el sistema de reparación tan eficiente como el nuclear, acumulan rápidamente mutaciones en pocas generaciones. Por esta razón HVI y HVII están siendo usados paulatinamente para obtener un análisis más refinado de SNPs del ADNmt.
En este trabajo presentamos los resultados de la implementación del método SSCP utilizando como controles, SNPs de 5 RFLPs del ADNmt. Subsecuentemente la metodología nos permitió detectar mutaciones dentro de la región D-loop. Esta región fue escogida por su conocida variabilidad y que permite refinar el análisis de los diferentes linajes mitocondriales en las poblaciones que estamos estudiando.
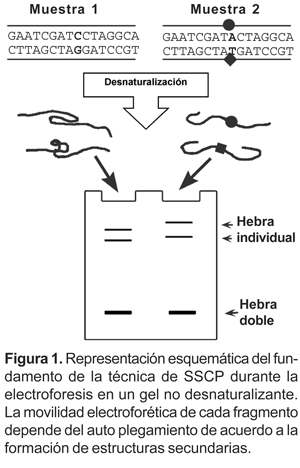
Material y métodos
Material humano
Las muestras de ADN fueron obtenidas de sangre periférica de 16 isleños voluntarios del Lago Titicaca (Uros-Torani, Taquile, Amantaní, Anapia) y 8 pobladores de la ciudad de Lima, luego del consentimiento pertinente (Sandoval et al., 2002).
Amplificación por Reacción en cadena de la polimerasa (PCR)
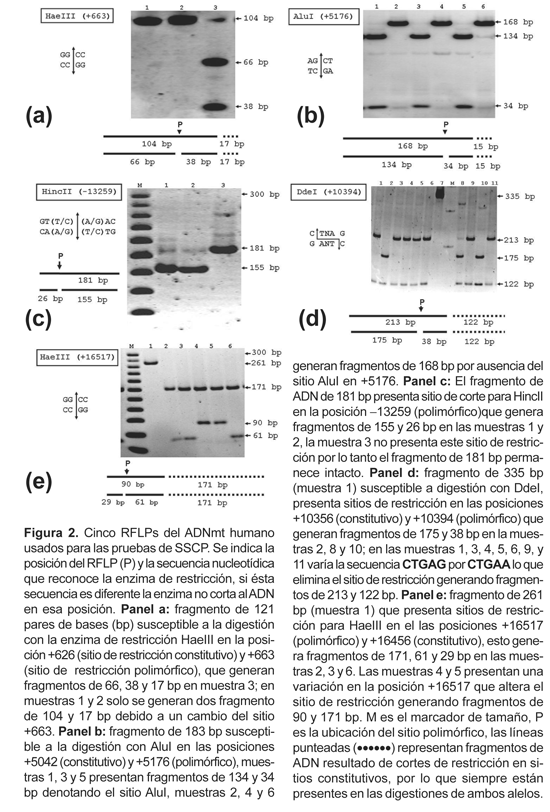
Para las pruebas de estandarización de la técnica SSCP, usamos como controles ambos alelos de 5 RFLPs del ADNmt (ver Tabla 1) que fueron analizados siguiendo las indicaciones de Sandoval et al. (2004) (Figura 2). Subsecuentemente evaluamos un segmento de 394 pares de bases cubriendo la región hipervariable HVI (ver Tabla 1), sobre la que no teníamos información previa de posibles diferencias entre las muestras. La amplificación por PCR se realizó en un volumen total de 20 microlitros (ml), 0,2 micromolar (mM) de cada par de oligonucleótidos cebadores (primers) correspondientes (Operon Technologies Inc, California), 2,5 mM de cada uno de los deoxinucleótidos trifosfatados (dNTP) (Applied Biosystems™,California); 50 mM KCl, 10 mM Tris-HCl, pH 8,3; 2,5 mM MgCl2, 1 unidad de Taq polimerasa (Applied Biosystems™, California) y 40 nanogramos (ng) de ADN.
Los segmentos fueron amplificados en un termociclador AmplitronII (Thermolyne™) con un programa de amplificación de 35 ciclos: desnaturalización a 94 °C por 30 segundos; hibridación por 30 segundos a una temperatura específica acorde al par de cebadores utilizados (Tabla 1) y replicación a 72 °C por 45 segundos.

Condiciones de los geles de poliacrilamida
Cinco ml de producto PCR se mezclaron con igual cantidad de tampón de carga (95% de formamida, 89 mM Tris base, 89 mM ácido bórico y 2 mM EDTA (ethylene diamine tetra acetic acid), 0,1% de Azul de Bromofenol, 0,1% de Cianol-xileno); luego fueron desnaturalizados a 95 °C por 5 min. y se mantuvieron en hielo durante 10 min. Se cargaron 6 ml de la mezcla en los cuatro diferentes geles tipo secuenciamiento (20 cm x 40 cm x 0,4 mm). En todos los casos, los ensayos electroforéticos se realizaron a 280 voltios, durante 16 horas a temperatura ambiente. Para la visualización de los segmentos amplificados se tiñó el gel con la técnica de nitrato de plata (Creste et al., 2001). Los geles se prepararon con poliacrilamida al 8% (49:1, acrilamida : bisacrilamida) y con cuatro diferentes proporciones de glicerol y de tampón TBE (89 mM Tris base, 89 mM ácido bórico y 2 mM EDTA) obteniéndose cuatro tipos de geles:
I) 10% de glicerol y TBE 1 X.
II) 10% de glicerol y TBE 0,5 X.
III) 5% de glicerol, TBE 0,5 X.
IV) Sin glicerol, TBE 0,5 X.
Secuenciamiento
Las muestras amplificadas de ADN se extrajeron cortando el fragmento de un gel de agarosa y filtrándolo a través de un tubo purificador Coastar. El segmento purificado se insertó en un vector plásmido pCR2.1 (InvitrogenÔ Life Technologies, CA), luego se realizó la transformación bacteriana en E. coli y los clones fueron seleccionados de placas petri con ampicilina. Colonias selectas fueron cultivadas en 5 mL de medio Luria-Bertani, se extrajo el ADN plasmídico con métodos convencionales (Sambrook et al., 1989) y se procedió a secuenciarlo utilizando el kit de secuenciamiento Silver Sequence DNA Sequencing System (Promega, WI, USA), pero modificado con cebadores marcados por kinasa con 1 microcurie (mCi) de fósforo 33 g-dATP (Amershan, Il, USA). Una vez separadas las muestras por electroforesis y secado el gel, éste se expuso a un film Bio-max (Kodak) por 12 horas.
Análisis de las secuencias nucleotídicas
Las lecturas de los geles de secuencia se realizaron entre 2 personas y al menos 2 veces para evitar ambigüedades o errores de lectura. Los alineamientos de ADN se realizaron utilizando el programa Bioedit (www.mbio.ncsu.edu/BioEdit/bioedit.html).
Resultados
Determinación de condiciones para detectar mutaciones por SSCP en algunos RFLPs del ADNmt
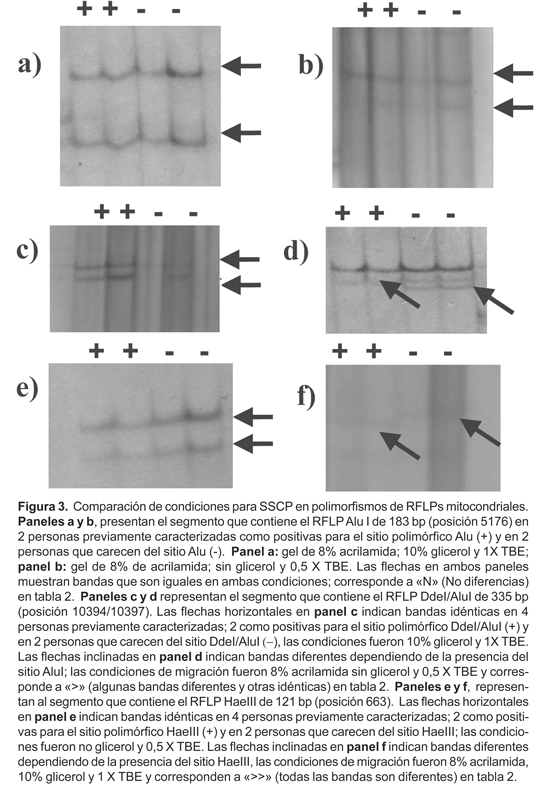
Se evaluaron varias condiciones experimentales variando la composición de los geles de SSCP con controles positivos y negativos para 5 polimorfismos conocidos (RFLPs del ADNmt). Las variables fueron la concentración del tampón de electroforesis, TBE y la concentración de glicerol (Tabla 2). Cuatro de los 5 fragmentos analizados mostraron diferencias en la migración electroforética, aunque sea en una de las condiciones probadas. Solo el fragmento de 183 pares de bases (AluI, +5176) no mostró diferencias en ninguna de las condiciones (Fig. 3a y b). Para el segmento de 335 pares de bases se obtuvo mejor diferenciación en condiciones de baja concentración de TBE (0,5X) y sin glicerol (Fig. 3c y d). Sin embargo para los otros 3 segmentos restantes, las mejores condiciones de detección estaban asociadas a la mayor concentración de glicerol (10%) y a una concentración de 1X del tampón TBE (Tabla 2), ver como ejemplo la figura 3e y f.
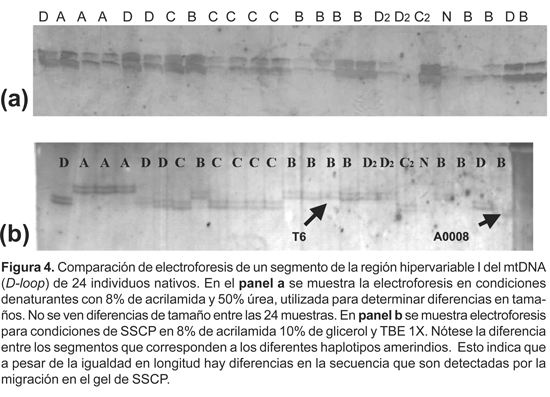
Diferenciación de segmentos polimórficos de la región hipervariable (HVI) del D-loop mitocondrial por SSCP
Amplificamos un segmento diseñado para 394 bases de la región hipervariable I (HVI) en el ADN de 24 muestras pertenecientes a individuos previamente caracterizados con diferentes haplotipos mitocondriales (A, B, C, D). Un análisis de longitud de segmentos en condiciones desnaturalizantes sugiere tamaño uniforme en las muestras (Fig. 4a). La migración de las mismas en condiciones de SSCP 10% glicerol y 1X TBE mostraron diferencias notables entre los individuos pertenecientes a distintos haplogrupos mitocondriales. La mayoría de muestras del mismo haplogrupo tenían migración similar; pero algunas presentaban diferencias. Por ejemplo, la muestra A0008 de un poblador de Lima, presentó una migración diferente a las demás muestras de su mismo haplogrupo B (subtipo B1). Esta diferencia fue corroborada por la secuenciación directa del segmento en A0008 y la muestra T6 (de la isla Taquile) con migración similar al resto de individuos de haplotipo B subtipo B1 (Fig. 4).
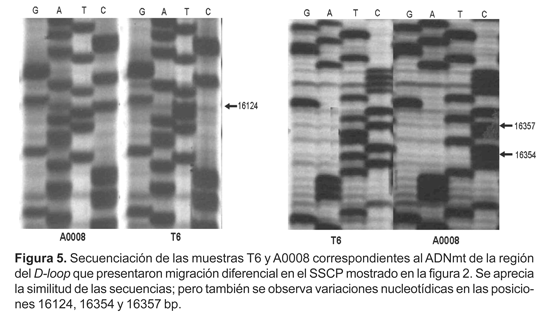
Se obtuvo la secuencia de estas dos muestras (Fig. 5), encontrándose siete diferencias en su composición nucleotídica (Tabla 3), cinco fueron transiciones, una fue transversión y una sola inserción no detectada por gel desnaturalizante. Posteriormente se utilizó el software Bioedit, se comparó las secuencias T6 y A0008 con secuencias de referencia estándar humano (Anderson et al., 1981), y con las de grupos Yanomami (Easton et al., 1996), Brasil (Alves-Silva et al., 2000) y Arequipa y Tayacaja (Fuselli et al., 2003), que pertenecen al haplogrupo B subtipo B1. Al compararlas, pudimos observar que las variaciones T®C en las posiciones 16189 y 16217 eran comunes en estas muestras (Tabla 3). No apreciamos estas variaciones al compararlas con las secuencias de diferentes haplotipos, lo cual nos indica que estas son exclusivas del subtipo B1. La secuencia A0008 muestra la inserción de una citosina en la posición 16194, la cual no es frecuente en secuencias de subtipo B1.

Discusión
La mejor técnica para detectar las mutaciones desconocidas es la secuenciación directa, pero es laboriosa y costosa para ser usada rutinariamente. Frente a esta, la técnica SSCP es comparativamente económica, rápida y fácil, habiéndose empezado a usar en muchos laboratorios de investigación en el mundo. Uno de los principales inconvenientes de esta técnica, es que aún no se ha podido determinar con precisión los efectos de algunos parámetros que afectan la sensitividad del análisis de SSCP, como por ejemplo: la composición del gel, el tamaño del fragmento de ADN, la composición del tampón, los aditivos como el glicerol, la concentración de ADN y el contenido de guanina/citosina (G+C) del ADN.
En el presente trabajo se encontró que las concentraciones altas de glicerol proporcionan las mejores condiciones de sensitividad en las muestras analizadas (Tabla 2). Sin embargo en las muestras de 183 y 335 pares de bases se observó dificultades en la detección, probablemente debido a que presentan un contenido de G+C inferior al 40% (Tabla 1). Estudios previos han demostrado que una sustitución en regiones ricas en G+C pueden tener un mayor efecto en su movilidad. Nataraj et al. (1999) compararon fragmentos de 100-300 nucleotidos de longitud conteniendo 60% de G+C que fueron fácilmente resueltos por SSCP a temperatura ambiente, mientras otras secuencias de similar tamaño con un contenido de 40% de G+C no pudieron ser detectados. Probablemente por que los enlaces de hidrógeno influencian la complejidad de la estructura terciaria de una hebra individual de ADN en un gel no desnaturalizante.
Por otro lado se ha señalado que SNPs en fragmentos mayores de 200 nucleótidos son menos sensibles a ser detectados por SSCP (Sheffield et al., 1993), sin embargo, el presente trabajo ha demostrado que en condiciones adecuadas alelos de 261 y 335 pares de bases pueden ser detectados.
En el caso del fragmento de 394 pares de bases del HVI del D-loop, no sabemos si se podría detectar una mutación de una sola base. En la única oportunidad que se pudo secuenciar, se comparó 2 muestras del haplotipo B subtipo B1 (A0008 y T6) que presentaban diferencias en la migración en SSCP, entre ellas se detectaron siete bases nucleotídicas diferentes.
El secuenciamiento de los fragmentos A0008 y T6 de la región HVI del D-loop mitocondrial y su comparación con otras secuencias similares del haplotipo B, nos ha permitido establecer variaciones (T®C) exclusivas de este haplotipo en las posiciones 16189 y 16217, además, en la secuencia del fragmento A0008 en la posición 16194 muestra la inserción de una citosina, que al compararla con otras secuencias, se constata que es una variación muy rara en el subtipo B1, lo que nos permitiría establecer subgrupos dentro del subtipo B1 basados en la secuencia de la región HVI y los sitios de restricción a lo largo del ADNmt.
Nuestros resultados muestran la factibilidad de utilizar la técnica SSCP para detectar mutaciones puntuales conocidas o las desconocidas, estas últimas, las más numerosas entre todas las mutaciones del genoma y las más difíciles de reconocer.
Es sorprendente la correlación fortuita entre los haplotipos mitocondriales y los SSCP de la región HVI del ADNmt. Los haplotipos están constituidos de ocho polimorfismos, distribuidos de manera casi uniforme en los 16569 pares de bases (promedio) del ADNmt. Mientras que el SSCP de la región HVI se realiza en un segmento de 394 pares de bases (ver figura 1 en Sandoval et al., 2004). A pesar de tener diferentes «relojes moleculares» en su tasa de mutación, la correlación es mantenida a través del tiempo.
Desde el punto de vista práctico, en el establecimiento de haplotipos del ADNmt, el método SSCP podría ahorrar tiempo y dinero. Primero, porque algunos RFLP pueden ser detectados directamente sin necesidad de digerir los segmentos amplificados con la respectiva enzima de restricción. Segundo y más interesante, es el hecho que en la mayor parte de las reacciones probadas aquí para la región HVI, podrían discriminar los cuatro haplotipos mayores del ADNmt amerindio en un solo experimento. Esto implica menos trabajo que la identificación seriada y secuencial de los ocho polimorfismos utilizados para determinar los haplotipos de cada individuo. Lo que podría hacer accesible el estudio del ADNmt a laboratorios con escasos recursos. Cabe la posibilidad que el análisis con SSCP pueda ser extensivo a otros haplotipos definidos con RFLPs prevalecientes en otros continentes.
Agradecimientos
Este trabajo ha sido financiado con fondos de la Universidad de San Martín de Porres y cofinanciamiento del Consejo Nacional de Ciencia y Tecnología del Perú (CONCYTEC). Nuestro reconocimiento al Dr. Marc Ghislain del Centro Internacional de la Papa por su valioso apoyo.
Literatura Citada
Alves-Silva J.; M. Da Silva Santos, P. Guimarães, P. Ferreira, H. Bandelt, S. Pena, V. Ferreira Prado. 2000. The ancestry of brazilian mtDNA lineages, Am. J. Hum. Genet. (67): 444-461. [ Links ]
Anderson S., A. T. Bankier, B.G. Barrel, M. H. L. deBrujin , A. R. Coulson, J. Douin, et al. 1981. Sequence and organization of the human mitochondrial genome. Nature. (290): 457-465.
Bailliet A., F. Rothhammer, F. Carnese , C. Bravi & N. Bianchi. 1994. Founder mitochondrial haplotypes in Amerindian population. Am. J. Hum. Genet. (54): 27-33.
Cotton R. G., N. R. Rodrigues and R. D. Campbell. 1988. Reactivity of cytosine and thymine in single-base-pair mismatches with hydroxylamine and osmium tetroxide and its application to the study of mutations. Proc. Natl. Acad. Sci. USA. (85): 4397-4401.
Creste S., A. Tullman-Neto & A. Figueira. 2001. Detection of Single Sequence Repeat Polymorphisms in Denaturing Polyacrilamide Sequencing Gels by Silver Staining. Plant Molecular Biology Reporter. (19): 299-306.
Easton R., A. Merriwether, D. Crews, & R. Ferrel. 1996. mtDNA variation in the Yanomami: evidence for additional new world founding lineages. Am. J. hum. Genet. (59): 213-225.
Fuselli S., E. Tarazona-Santos, I. Dupanloup, A. Soto, D. Luiselli & D. Pettener. 2003. Mitochondrial DNA diversity in South America and the genetic history of andean highlanders. Mol. Biol. Evol. (10): 1682-1691.
Goldrick M., G. Kimball, Q. Liu, L. Martin, S. Sommer & J. Tseng. 1996. Nirca(Tm) - A Rapid Robust Method For Screening For Unknown Point Mutations. Biotechniques (21): 106-12.
Humphries S., V. Gudnadson, R. Whitall & I. Day. 1997. Single strand conformation polymorphism analisi with high throughtput modifications and its use in mutation detection in familial hypercholesterolemia. Clinical Chemistry. (43): 427-435.
Nataraj, A., I. Olivos-Glander, N. Kusukawa, & E. Highsmith. 1999. Single-strand conformation polymorphism and heteroduplex analysis for gel-based mutation detection. Electrophoresis. (20): 1117-1185.
Nollau P. & C. Wagener. 1997. Methods for detection of point mutation: performance and quality assesment. Clinical Chemistry. (43): 1114-1128.
OMIN(TM), Online Mendelian Inheritance in Man, McKusick-Nathans Institute for Genetic Medicine, Johns Hopkins University (Baltimore, MD) and National Center for Biotechnology Information, National Library of Medicine (Bethesda, MD), 2004. World Wide Web URL: http://www.ncbi.nlm.nih.gov/Omim/mimstats.html
Orita M., H. Iwahana, H. Kanazana, K. Hayashi & T. Sekiya. 1989. Detection of polymorphisms of human DNA by electrophoresis as single-strand conformation polimorphisms. Proc. Natl. Acad. Sci. USA. (86): 2766-2770.
Sambrook, J., E. F. Fritsch & T. Maniatis. 1989. Molecular Cloning. A laboratory manual. 2º ed. Cold Spring Harbor Laboratory Press. New York.
Sandoval J., H. Madsen, P. Garred & R. Fujita. 2002. Mannose-.binding lactin and mt DNA Genotypes in Peruvian islanders (Quechua and Aymara) of the lake Titicaca. American Journal of Human Genetics. (71): 358.
Sandoval J., B. Delgado, L. Rivas, B. Bonilla, D. Nugent & R. Fujita. 2004. Variantes del ADNmt en isleños del lago Titicaca: máxima fercuencia del haplotipo B1 y evidencia de efecto fundador. Rev. Peru. Biol. (11): 168 168.
Schurr T., S. Bellinger, Y. Gam, J. Hodge, D. Merriwether, D. Lawrence, W. Kwoler, K .Weriss & D. Wallace. 1990. Amerindian mitochondrial DNAs have rare Asian variants at high frecuencies, suggesting they derived from four primary maternal linages. American Journal of Human Genetics (63): 1473-1492.
Sheffield V., J. Beck, A. Kwitek, D. Sandstrom & E. Stone. 1993. The sensitivity of single strand conformation polymorphism analysis for detection of single base substitutions. Genomics. (16): 325-332.
Southern, E. 1975. Detection of specific sequences among DNA fragments separated by gel electrophoresis. J. Mol. Biol. (98): 50317.
Correspondencia:
(*) Instituto de Genética y Biología Molecular, Facultad de Medicina Humana, Universidad de San Martín de Porres, Alameda del Corregidor 1531, La Molina, Lima, Perú. Tel: (511) 3652300 / 365-2574 anexo 152, fax: (511) 3650487.
E-mail Ricardo Fujita:rfujita@amauta.rcp.net.pe













