Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.12 no.3 Lima Oct./dic 2005
Carlos E. Tipismana1, Lilian R. Astudillo y Juan J. Guillermo
1 Laboratorio de Microbiología y Parasitología. Escuela Académica Profesional de Biología. Facultad de Ciencias. Universidad Nacional San Luis Gonzaga de Ica, Perú.
I Congreso Latinoamericano de Estudiantes de Microbiología y Parasitología
I Congreso Nacional de Estudiantes de Microbiología y Parasitología
del 8 al 12 de agosto de 2005, Lima, Perú
Resumen
El objetivo del presente trabajo fue aislar e identificar hongos de especímenes de moscas de la fruta de los géneros Ceratitis (Macleay) y Anastrepha (Schiner), del valle de Ica, Perú. Se aislaron hongos pertenecientes a los géneros Alternaria, Aspergillus, Cladosporium, Mucor, Penicillium, Rhizoctonia, Rhizopus y Trichoderma; así como levaduras y micelios estériles. Los recuentos de hongos presentaron rangos entre 8x103 a 8x104 UFC/g para el género Ceratitis; y 7x103 a 7x104 UFC/g para el género Anastrepha. El IVI% (Índice de Valor de Importancia) demostró que Cladosporium es el género con mayor valor ecológico con un 78,05%. El Índice de Similitud de especies de hongos entre ambos géneros de mosca de la fruta analizados fue 0,5. Los resultados obtenidos confirman la presencia de hongos en moscas de la fruta; y se deduce el posible impacto de estos dípteros en el área agrícola como potenciales agentes vectores de enfermedades fúngicas para los cultivos locales de importancia económica.
Palabras clave: Hongos, Anastrepha, Ceratitis, agrícola, Ica.
Abstract
The present work reports the fungi isolated from specimens of the fruit flies of the genus Ceratitis (Macleay) and Anastrepha (Schiner) come from Ica valley, Peru. Fungi isolated were the genus Alternaria, Aspergillus, Cladosporium, Mucor, Penicillium, Rhizoctonia, Rhizopus, Trichoderma, as well as yeasts and sterile micelios. Counting was made in plate and it shows ranks between 8x103 to 8x104 UFC/g for Ceratitis; and 7x103 to 7x104 UFC/g for Anastrepha. The IVI% (Importance Value Index) indicated that Cladosporium has the greater ecological (78,05%). The Similarity Index between both genuses of analyzed fruit fly was 0,5. Results confirm fungi presence in fruit flies, and its possible impact to agricultural as vector agents of fungal diseases to local cultures.
Keywords: Fungi, Anastrepha, Ceratitis, agricultural, Ica.
El complejo de especies biológicas «moscas de la fruta» incluye los géneros Anastrepha (Schiner) y Ceratitis (Macleay), (Diptera: Tephritidae); que constituyen las plagas más importantes en las diferentes zonas hortifrutícolas del valle de Ica. Los estadíos larvales de estas moscas se establecen en el interior de frutos, alterando su calidad y causando pudriciones y lesiones como producto de la oviposición y desarrollo larvario. Sin embargo se han realizado pocos estudios implicando a estas moscas como portadoras de hongos, sobretodo de hongos fitopatógenos, que las convertirían en vectores potenciales para la transmisión de enfermedades fúngicas a cultivos de frutales y hortalizas.
Quezada (1992) describe en Costa Rica insectos portadores de la bacteria causante del «cáncer del mango» Erwinia mangifera (Doidge), señalando a los estadíos larvales de las especies Anastrepha spp. y Ceratitis capitata (Wiedemann) como las posibles trasmisoras de la enfermedad. En Venezuela se asoció la pudrición bacteriana del tallo de la yuca con las perforaciones ocasionadas por Anastrepha manihoti (Lima) (Guevara et al., 1992). En el caso específico de hongos, en Costa Rica se observó la ocurrencia natural de especies fúngicas del género Stigmatomyces (Karsten), en la superficie externa (patas, abdomen, tórax, noto) de A. striata (Schiner), plaga que afecta el cultivo de guayabo, y también se ha establecido que la transmisión del hongo entre las moscas ocurre durante la copulación (Hedström, 1994).
La mosca de la fruta desarrolla sus hábitos alimenticios, reproductivos y fisiológicos en diferentes hábitats, asociándose con un amplio rango de hospedantes y se distribuye extensamente, dentro de cada país y en climas variados (Hernández, 1992). Por otro lado, la mayoría de los hongos fitopatógenos necesitan de medios de transporte para poder diseminarse de una planta a otra e incluso en las distintas partes de una misma planta, necesitando vectores como los insectos (Agrios, 1995). Estas características convierten a las moscas de la fruta en un vector potencial de microorganismos.
El presente trabajo tuvo como objetivo aislar, identificar y hacer el recuento de especies fúngicas de importancia agrícola asociadas a moscas de la fruta del valle de Ica.
Colección del material biológico
La investigación se realizó durante los meses de abril y mayo del 2005, programando capturas de moscas de la fruta por exposición de trampas en campo. El material de estudio estuvo constituido por especímenes de mosca de la fruta de las especies Ceratitis capitata, Anastrepha fraterculus (Wiedemann) y A. distincta (Greene), representativas del valle de Ica y registradas por el Servicio Nacional de Sanidad AgrariaIca, (SENASA, 2001). Se realizaron 5 muestreos de Ceratitis capitata y 5 muestreos de Anastrepha sp. para el aislamiento de hongos; en diferentes huertos vergeles de la zona media del valle de Ica (Tate, Pueblo Nuevo y Los Aquijes), caracterizados por presentar cultivos mixtos de mango, pacae, ciruelo, cítricos, entre otros. La captura de especímenes se realizó utilizando trampas McPhail, modificándolas según criterio de los investigadores. Así, para capturar especímenes de Ceratitis capitata se dispuso de la estructura completa de la trampa McPhail, acondicionada con el atrayente sexual Trimedlure (Shelly, 1999); y para el caso de Anastrepha sp., la trampa McPhail fue acondicionada con 250 mL de fosfato diamónico diluido para la atracción de carácter sensorial. Una vez capturados, los especímenes fueron colectados in situ a través de mallas de tul y colocados en frascos de vidrio estériles para su posterior procesamiento.
Procesamiento de las muestras
Se pesó 1 g de muestra (moscas de la fruta) y se suspendió en un tubo de ensayo con 9 mL de agua peptonada 0,1% con Tween 80; la suspensión obtenida se consideró como dilución 10-1; se agitó suavemente la muestra para homogenizarla, dejando reposar por dos horas. Luego se hicieron diluciones decimales sucesivas de 1/100 (10-2) y 1/1000 (10-3) (Ulacio et al., 1997; Fernández, 1999); de las cuales se inoculó por duplicado 0,1 mL de cada dilución en placas Petri que contenían Agar Papa Dextrosa (APD) con cloranfenicol. La siembra se realizó por diseminación y la incubación se realizó por 3 a 5 días a temperatura ambiental (DIGESA, 2001; Ulacio et al., 1997; Fernández, 1999), luego de lo cual se realizó la lectura de resultados y el recuento estándar en placa (Standard Plate Count), determinando el número de UFC/g de muestra (APHA, 1993; DIGESA, 2001). La identificación taxonómica de los hongos se llevó a cabo con la ayuda de manuales y claves dicotómicas, siguiendo las descripciones macroscópicas y microscópicas de Barnett (1960), Smith (1963), Gilman (1963); Finch y Finch (1974); Koneman y Roberts (1987); Abarca (2000) y Carrillo (2003). Para ello se hicieron preparados con azul algodón de lactofenol, siguiendo el método de montaje húmedo y la técnica con cinta scotch o Rush Munro. Se realizó el cepario de hongos aislados a partir de moscas de la fruta para su posterior identificación. Los aislamientos fueron depositados en el cepario del laboratorio de Microbiología y Parasitología de la Facultad de Ciencias de la Universidad Nacional «San Luis Gonzaga» de Ica, Perú.
Análisis de datos
Según lo propuesto por Lara et al. (2003), se calculó el Índice de Valor de Importancia para cada uno de los géneros aislados. Se define mediante la siguiente fórmula:
(IVI%) = DivR% + DenR% + FreR%; donde se considera que:
DivR% (Diversidad Relativa) = [(# de especies del género / # total de especies) x 100];
DenR% (Densidad Relativa) = [(# de colonias del género / # total de colonias) x 100]; y
FreR% (Frecuencia Relativa) = [(# de géneros de moscas de la fruta donde se presentó cada género fúngico / sumatoria de la frecuencia de cada género fúngico en el total de géneros de moscas de la fruta) x 100].
La diversidad fúngica entre los generos de moscas se comparó con el Índice de Similitud (Odum, 1986), definido y adaptado por la siguiente fórmula: (IS) = 2c/(a+b); donde:
a = Nº de especies fúngicas en las muestras de C. capitata.
b = Nº de especies fúngicas en las muestras de Anastrepha sp.
c = Nº de especies fúngicas en común.
Resultados y discusión
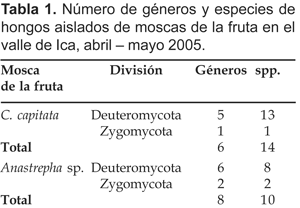
Se encontró entre 8x103 a 8x104 UFC/g de hongos en el análisis de especímenes de Ceratitis capitata; mientras que la numeración de mohos para el género Anastrepha comprendió de 7 x 103 a 7 x 104 UFC/g. Se obtuvieron un total de 366 colonias axénicas, encontrando dentro de ellas 8 géneros y 18 especies de mohos (Tabla 3), observándose además levaduras, y micelios estériles. De C. capitata se aislaron un total de 6 géneros y 14 especies, mientras que de Anastrepha sp. se obtuvieron 8 géneros y 10 especies (Tabla 1).
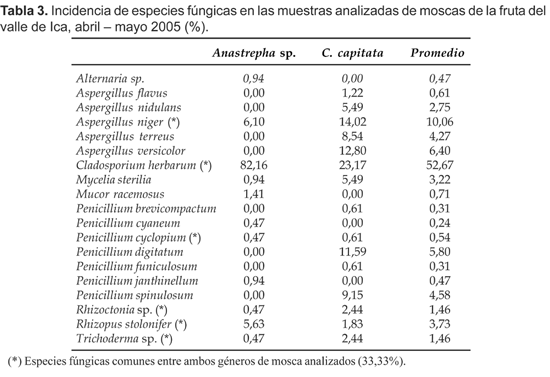
De acuerdo a la incidencia, Cladosporium (Link), es el género que presenta mayor incidencia en las muestras analizadas con un 23,17% para C. capitata y 82,16% para Anastrepha sp., calculándose un promedio de 52,67% de casos ocurridos; le siguen Aspergillus (Micheli) con un promedio de 24,09% y Penicillium (Link) con 12,25% de promedio (Tabla 3).
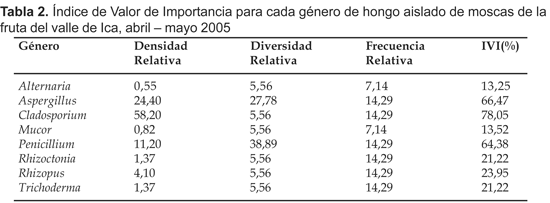
Las especies de Cladosporium son consideradas como saprófitas, favoreciéndoles una distribución más amplia y una mayor tolerancia a condiciones ambientales (Ulacio et al., 1997). El Índice de Valor de Importancia mostró que Cladosporium es el género con mayor valor ecológico (78,05%) seguido por Aspergillus y Penicillium con 66,47% y 64,38%, respectivamente, y con un valor ecológico intermedio los géneros Rhizoctonia (de Candole) (21,22%), Rhizopus (Ehrenberg) (23,95%) y Trichoderma (Persoon) (21,22%) (Tabla 2). El género Cladosporium presentó la mayor densidad, y Penicillium presentó la mayor diversidad de especies (Tabla 3).
Se encontraron 6 especies fúngicas comunes entre los géneros de mosca de la fruta analizados (A. niger, C. herbarum, P. cyclopium, Rhizoctonia sp., Rhizopus sp. y Trichoderma sp.), equivalentes al 33,33% del total de especies encontradas, presentando un Índice de Similitud de 0,5 entre ambos géneros analizados (Tabla 3).
Se observó que las especies fúngicas encontradas en el análisis, corresponden a hongos reportados como fitopatógenos, controladores biológicos y saprófitos productores de sustancias de interés. El género Penicillium es caracterizado por causar pudriciones a los frutos y otros órganos carnosos (Agrios, 1995). Penicillium digitatum (Saccardo), reportado en el presente trabajo, ha sido señalado por Finch y Finch (1974) y Timmer y Menge (2000) en las pudriciones de frutos de cítricos. Otra especie, P. spinulosum (Thom) puede producir inulinasa, enzima que hidroliza la inulina; y que ha demostrado tener aplicaciones potenciales en la preparación de jarabes de fructosa de inulina y de azucares en la industria alimentaria (Ertan et al., 2003). P. funiculosum (Thom), participa en la síntesis de hormonas vegetales como giberelinas (GA3), y es utilizado para transformar residuos industriales, como los provenientes de fábricas de aceite de oliva, según estudio realizado por Özcan y Topçuclu (2001).
Las especies del género Penicillium: P. janthinellum (Biourge); P. brevicompactum (Dierckx); P. cyclopium (Westling) y P. cyaneum (Bainier y Sartory) Biourge, han sido reportadas como saprófitas en suelos y vegetación caída (Smith, 1963) y productoras de sustancias antimicrobianas y fitotóxicas (Ácido micofenólico, cianeína, Ocratoxina A, y ácido penicílico) (Bird y Campbell, 1982; Cline et al., 1969; Abraham, 1945; Papacharilaou y Pisano, 1984; Keromnes y Thouvenot, 1985), pigmentos tóxicos y micotoxinas (Xantomegnina, Viomelleína y tremórgenos), muy dañinas para el ganado, ratones, ratas, cerdos y animales de laboratorio (Comerio, 2000; Gallagher et al., 1980; Carrillo, 2003).
Por otra parte, Mucor racemosus (Fresenius), es considerada como causante de putrefacciones de frutos de los cítricos así como Rhizopus stolonifer (Ehrenberg), origina el «transit rot» en cultivos de mango (Timmer y Menge, 2000; Pernezny, 2000).
Aspergillus niger (van Tieghem); especie saprófita competitiva de amplia distribución (Smith, 1963; Ulacio et al., 1997), esta implicada ocasionalmente, en enfermedades como la putrefacción negra del mango y de cítricos (Timmer y Menge, 2000; Pernezny, 2000). Con respecto a Aspergillus terreus (Thom), A. flavus (Link), A. nidulans (Eidam) Winter y A. versicolor (Vuillemin) Tiraboschi; aislados en el presente estudio, si bien no se ha reportado su capacidad parasítica, algunos investigadores sostienen que A. terreus y A. flavus cuando se encuentran en el suelo muestran propiedades antagónicas sobre especies de Fusarium (Link), Rhizoctonia y Sclerotium rolfsii (Saccardo) (Ulacio et al., 1997). En ocasiones A. flavus puede actuar como parásito en frutos de maíz causando pudriciones, y en cítricos es causa del «albinismo» (Timmer y Menge, 2000; Pernezny, 2000; CIMMYT, 2004); además puede producir aflatoxinas que pueden ser tóxicas para mamíferos, aves, y producir cáncer hepático en el hombre (CIMMYT, 2004; Carrillo, 2003), este tipo de toxinas son consideradas como hepatotóxicas, carcinogénicas, teratogénicas y mutagénicas (Abarca et al., 2000). También A. versicolor y A. nidulans tienen la capacidad de producir micotoxinas como la esterigmatocistina, considerada mutágeno in vivo y cancerígeno potencial para el hombre (Carrillo, 2003).
El género Alternaria, común en el suelo; y consideradas sus especies como parásitas de cultivos vegetales (Koneman y Roberts, 1987; Smith, 1963), forma parte de la carga fúngica encontrada en especies de mosca de la fruta del género Anastrepha. Como dato referencial, se realizó aislamientos de hongos fitopatógenos a partir de tejidos enfermos, en un huerto de mango donde se realizó la colección de especímenes; dicha zona se caracteriza por presentar en su totalidad, árboles con sintomatología necrótica en los bordes de las hojas y poblaciones elevadas de moscas de la fruta tanto del género Ceratitis como Anastrepha. Determinado el agente causal de dicha patología como Alternaria sp. y siendo éste, parte de la microbiota vectorizada por moscas de la fruta del género Anastrepha (Ver tabla 3), según criterios macroscópicos y microscópicos comparativos y de identificación, se deduce que la propagación del microorganismo se debe en parte al desarrollo de poblaciones altas de Anastrepha dentro del estrato arbóreo, inoculando esporas tal vez al momento de la oviposición o durante su alimentación. Esto sugiere la posibilidad de que las especies de mosca de la fruta analizadas puedan a su vez, propagar la carga fúngica presente en ellas, a diversos cultivos de interés comercial.
El aislamiento de Trichoderma sp. adquiere real importancia agrícola, pues este hongo es conocido por su efectividad como controlador biológico de patógenos del suelo, especialmente se menciona su actividad antagónica sobre hongos como Rhizoctonia solani (Kühn), Sclerotium rolfsii, Pythium (Pringsh), Phytophthora (Medlar) y Fusarium (Ulacio et al., 1997; Ezziyyani et al., 2004). En el presente estudio se aisló una cepa de Trichoderma sp., que mostraba un marcado parasitismo sobre colonias de Rhizoctonia sp., observándose esta relación por macroscopía y microscopía. Aunque este hallazgo no es objeto de nuestro estudio, reafirma la capacidad antagónica de Trichoderma sobre especies fitopatógenas, como Rhizoctonia sp. Otros autores (Seyis y Aksoz, 2004) sugieren el uso de especies de Trichoderma en procesos industriales y biotecnológicos para la producción de lactasa (enzima que hidroliza la lactosa, en glucosa y sacarosa) con gran potencial para ser aplicado en el procesamiento de la leche y la fabricación de productos lácteos.
La relación insectohospedante es primordial para el desarrollo de moscas de la fruta, de estas son posibles deducir mecanismos por los cuales una mosca de la fruta puede diseminar las esporas de hongos de importancia agrícola en los cultivos. Uno de los mecanismos puede ser la oviposición de las hembras en los frutos, inoculando la carga fúngica y causar desarrollo micelar, infecciones secundarias, esporulación, pudriciones y producción de micotoxinas; como producto de la lesión causada por el ovipositor y el inóculo de esporas. Los hábitos fisiológicos de estas moscas, combinados con factores ambientales; pueden trasladar sus poblaciones de un cultivo a otro, y dentro de un cultivo a las diversas plantas del mismo, rescatando así; la actividad polífaga (en múltiples hospedantes) de Ceratitis capitata y Anastrepha fraterculus. En vista que la carga fúngica determinada, está representada por especies reportadas como fitopatógenas, se establece un punto de riesgo a tomar en cuenta durante el manejo de cultivos agrícolas de importancia económica.
Debemos rescatar que otras especies fúngicas transportadas por moscas de la fruta, podrían contribuir con el control natural de enfermedades fitopatógenas, ya que estos microorganismos son capaces de producir sustancias de interés como antibióticos, antifúngicos, y reguladores de crecimiento vegetal, así como también revelar su capacidad antagónica para el control de otros microorganismos.
Agradecimientos
Manifestamos nuestro agradecimiento al personal especializado del Servicio Nacional de Sanidad Agraria (SENASA) Ica, por su apoyo técnico relacionado a la captura de especímenes de mosca de la fruta y préstamo de materiales; en orden alfabético: Fernández Mejía, Giuliana; Hernández Carrión, Jesenia; Orozco Garro, Giovanna; Paragulla Garibay, Daniza; Quijandría Elías, Ghisela; Siguas Figueroa, Martha Alicia y Yarasca Chipana, Ysela. Nuestro reconocimiento especial al inspector de campo Francisco Chuquihuaccha Aliaga, cuyo aporte y experiencia fue indispensable para la colección de especímenes de mosca de la fruta.
Literatura citada
Abarca M. L. 2000 . Taxonomía e identificación de especies implicadas en la aspergilosis nosocomial. Rev Iberoam Micol [En línea] 17: s79-s84. <http://www.reviberoammicol.com/2000-17/S79S84.pdf > Fecha de acceso 16 de mayo del 2005.
Abarca M.L., M. R. Bragulat, G . Castellá, F. Accensi, F. J. Cabañes. 2000. Hongos productores de micotoxinas emergentes. Rev Iberoam Micol [En línea] 17: s63-s68. <http://www.reviberoammicol.com/2000-17/S63S68.pdf > Fecha de acceso 16 de mayo del 2005
Abraham E. P. 1945. The effect of mycophenolic acid on the growth of Staphylococcus aureus in heart broth. Biochem J; 39:398-404.
Agrios G. 1995. Fitopatología. 2a ed. México. Limusa; pp. 808.
American Public Health Association (APHA). 1993. Standard methods for the examination of dairy products. Washington, DC: American Public Health Association. pp. 546.
Barnett H. 1960. Illustrated Genera of Imperfect Fungi. 2th ed. Minneapolis, Minnesota: Burgess Publishing Company.
Bird B. A.& I.M. Campbell. 1982. Disposition of Mycophenolic Acid, Brevianamide A, Asperphenamate, and Ergosterol in solid cultures of Penicillium brevicompactum. Appl Environ Microbiol [En línea] 43(2): 345-348. <http://www.pubmedcentral.nih.gov/articlerender.fcgi?artid=241829 > Fecha de acceso 26 de julio del 2005.
Carrillo L. 2003. Los hongos de los alimentos y forrajes. Salta, Argentina: Universidad Nacional de Salta; 1999. pp. 128.
Cline J. C., J. D. Nelson, K. Gerzon, R. H. Williams & D. C. Delong. 1969. In vitro antiviral activity of Mycophenolic Acid and it's reversal by guanine compounds. Appl Microbiol [En línea] 18: 14-20. <http://www.pubmedcentral.gov/article render.fcgi?tool=pubmed&pubmedid =4308535> Fecha de acceso 24 de julio del 2005.
Comerio R.M. 2000. Nefrotoxinas y especies nefrotóxicas del género Penicillium Link. Rev Iberoam Micol [En línea], 17: 82-89. http://www.revibero ammicol.com/2000-17/082089.pdf Fecha de acceso 16 de mayo del 2005
Dirección General de Salud ambiental (DIGESA). 2001. Manual de análisis microbiológicos de alimentos. Lima, Perú: Ministerio de Salud.
Ertan F., F. Ekinci & T. Aktaç. 2003. Production of Inulinases from Penicillium spinulosum, Aspergillus parasiticus NRRL2999 and Trichoderma viride. Pak. J. Biol. Sci. [En línea] 6(15): 1332-1335. <http://www.ansinet.org /fulltext/pjbs/pjbs6151332-1335.pdf> Fecha de acceso 23 de julio del 2005
Ezziyyani M., C. Pérez, A. S. Ahmed, M. E. Requena & M. E. Candela. 2004. Trichoderma harzianum como biofungicida para el biocontrol de Phytophthora capsici en plantas de pimiento (Capsicum annuum L.). Anales de Biología [En línea] 26: 35-45. <http://www.um.es/anales debiologia/numeros/26/PDF/05-TRICHO DERMA.pdf> Fecha de acceso 26 de julio del 2005
Fernández M. 1999. Poblaciones de hongos presentes en la rizósfera de tomate (Lycopersicon esculentum L. Mill) en las zonas alta y baja del estado de Lara. Venezuela: Universidad Centroccidental Lisandro Alvarado - Biblioteca de Agronomia y Veterinária. pp. 89.
Finch H. & A. Finch. 1974. Los hongos comunes que atacan a los cultivos en América Latina. México: Trillas;. pp. 189.
Gallagher R. T., G. C. Latch & R. G. Keogh. 1980. The Janthitrems: fluorescent tremorgenic toxins produced by Penicillium janthinellum isolates from ryegrass pastures. Appl Environ Microbiol [En línea]; 39(1): 272-273. <http://www.pubmedcentral.nih.gov/articlerender. fcgi?artid=291316> Fecha de acceso 16 de julio del 2005
Gilman J. 1963. Manual de los hongos del suelo. México: Compañía Editorial Continental. pp. 544.
Guevara V, A. Rondón, E. Arnal, Z. Suárez, A. Navas. 1992. La pudrición bacterial del tallo de la yuca en Venezuela. Fitopatol Venez [En línea] 5(2): 33-36. <http://www.redpav-fpolar.info.ve/fitopato/v052/v052a030.html > Fecha de acceso 24 de mayo del 2005.
Hedström I. 1994. Stigmatomyces species on guava fruit flies in seasonal and non-seasonal tropical forest environments. Mycol. Res. 98(4): 403-407.
Hernández-Ortiz, V. 1992, El género Anastrepha Schiner en México (Diptera: Tephritidae). Taxonomía, distribución y sus plantas huéspedes: Instituto de Ecología Publ. 33. Xalapa, Veracruz, Mexico. 162 pp.
Keromnes J.& D. Thouvenot. 1985. Role of Penicillic Acid in the phytotoxicity of Penicillium cyclopium and Penicillium canescens to the germination of corn seeds. Appl Environ Microbiol [En línea]] 49(3): 660-663. <http://www.pubmedcentral.nih.gov/picrender.fcgi? artid=373566&blobtype=pdf> Fecha de acceso 24 de julio del 2005
Koneman E. & G. Roberts. 1987. Micología. Práctica de Laboratorio. 3a ed. Buenos Aires, Argentina: Editorial Médica Panamericana. pp. 74162.
Lara J. F. R., J. F. Macedo, M. Brandao. 2003. Meadow holm pasture weeds in fields in the State of Minas Gerais. Planta daninha [En línea] 21(1): 11-20. <http://www.scielo.br/scielo.php?pid= S0100-83582003000100002&script= sciarttext> Fecha de acceso 24 de mayo del 2005.
Odum E. 1986. Fundamentos de Ecología. México: Interamericana. pp. 310-314.
Özcan B., S. F. Topçuclu. 2001. GA3, ABA and Cytokinin Production by Lentinus tigrinus and Laetiporus sulphureus Fungi cultured in the Medium of Olive Oil Mill Waste. Turk J Biol [En línea] 25: 453-462 <http://journals.tubitak. gov.tr/biology/issues/biy-01-25-4/biy-25-4-11-9912-1.pdf > Fecha de acceso 23 de julio del 2005.
Papacharilaou E.& M. A. Pisano. 1984. Changes in the Lipid Composition of Paecilomyces persicinus P-10 M1 during Growth and Cephalosporin C Production. Appl Environ Microbiol [En línea] 48(6): 1084-1087. <http://www.pubmed central.nih.gov/picrender.fcgi?artid= 241690&blobtype=pdf> Fecha de acceso 22 de julio del 2005
Pernezny K. & G. Simone. 2000. Diseases of mango (Mangifera indica L.), Common Names of Plant Diseases. Georgia, EE.UU.: American Phytopathological Society (APS); [Publicación virtual] <http://www.apsnet.org/online/common/names/mango.asp >
CIMMYT, Programa de Maíz del. 2004. Enfermedades del maíz: una guía para su identificación en el campo. 4a ed. México, CIMMYT. pp. 64-66.
Quezada M. 1992. Insectos portadores de la bacteria causante del «cáncer del mango» (Mangifera indica). Agronomía Costarricense [En línea].16(2): 231-236. <http://www.mag.go.cr/rev_agr/v16n02_231.pdf > Fecha de acceso 29 de abril del 2005.
Servicio Nacional de Sanidad Agraria (SENASA). 2001. Manual del Sistema Nacional de Detección de Moscas de la Fruta. Ica, Perú: Programa Nacional de Moscas de la Fruta. pp. 35-48.
Seyis I. & N.Aksoz. 2004. Production of Lactase by Trichoderma sp. Food Technol Biotechnol [En línea] 42(2):121124. <http://pubwww.srce.hr/ftbrfd/42-121.pdf> Fecha de acceso 23 de julio del 2005
Shelly T. 1999. Trimedlure and the Mating Competitiveness of Irradiated Male Mediterranean Fruit Flies (Diptera: Tephritidae). Environ Entomol [En línea] 28(5): 780-786. <http://www.ingentaconnect.com/content/esa/envent /1999/00000028/00000005/art00002> Fecha de acceso 26 de julio del 2005
Smith G. 1963. Introducción a la micología industrial. 5a ed. Zaragoza, España: Acribia;. pp. 443.
Timmer L.& J. Menge. 2000. Diseases of Citrus (Citrus spp.), Common Names of Plant Diseases. Georgia, EE.UU.: American Phytopathological Society (APS); Ago 11 [Publicación virtual]; <http://www.apsnet.org/online/common/names/citrus.asp >
Ulacio M, C. Pérez, J. Pineda. 1997. Micoflora asociada a las raíces de plantas de tabaco (Nicotiana tabacum) provenientes del Estado Portuguesa. Bioagro [En línea] 9(1):3-11. <http://pegasus.ucla.edu.ve/bioagro/archivobioagro /9(1)%20en%20PDF/1.%20Micoflora%20asociada.pdf>. Fecha de acceso 16 de mayo del 2005.
Correspondencia:
1Laboratorio de Microbiología y Parasitología. Escuela Académica Profesional de Biología. Facultad de Ciencias. Universidad Nacional San Luis Gonzaga de Ica, Perú.
E-mail Carlos Tipismana: carlos_th21@yahoo.com













