Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Revista Peruana de Biología
On-line version ISSN 1727-9933
Rev. peru biol. vol.13 no.3 Lima July 2007
TRABAJOS ORIGINALES
Inducción de la reacción acrosómica en espermatozoides de ratón mediante solubilizados de zona pelucida de alpaca (Lama pacos L.)
Induction of the acrosomal reaction in mouse spermatozoa by the solution of pellucid zone from alpaca (Lama pacos L.)
Luis Guzmán1; Susan Pérez1 y Martha Valdivia1
1 Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Biológicas, Instituto de investigaciones de Ciencias Biológicas Antonio Raimondi.
Resumen
La acrosina, es uno de los componentes principales del acrosoma, presenta actividad similar a la tripsina, y es liberado luego de la reacción acrosómica (RA). El objetivo del presente trabajo fue estudiar la inducción de la RA en espermatozoides de ratón con zonas pelúcidas homólogas y heterólogas. Espermatozoides de ratón capacitados por 2 horas en medio IVF suplementado con albúmina, heparina y suero sintético a 37 ºC y 5% CO2 fueron incubados en ausencia de Zona Pelucida (ZP) o en presencia de solubilizados de ZP aisladas de ratón (0,78 mg/ml) y alpaca (0,78 mg/ml y 2,35 mg/ml). La RA se evaluó mediante inmunocitoquímica con anticuerpo monoclonal anti-acrosina humana C5F10 a intervalos de 1 hora durante 4 horas. Los resultados obtenidos en espermatozoides de ratón evidencian un incremento significativo (p< 0,05) de la reacción acrosómica inducida con ZP homóloga y heteróloga.
Palabras claves: Capacitación espermática, reacción acrosómica, zona pelúcida.
Abstract
Acrosin is one of the principal components in the acrosome, has trypsin-like activity and is secreted after the Acrosome Reaction (RA). The aim of this study was to study the induction of the acrosomal reaction in mouse sperms with homologous- Pellucid Zone and heterologous- Pellucid Zone. Mouse sperms were capacitated by two hours in IVF medium, supplemented with albumin, heparin and synthetic serum to 37 °C and 5% CO2, and before they were incubated in absence of ZP and in present of solubilized ZP from mouse (0,78 mg/ml) and alpaca (0,78 mg/ml y 2,35 mg/ml). The RA was evaluated through immunocytochemistry with monoclonal antibodies anti-human acrosin C5F10 within intervals of 1 hour during four hours. The results show a significant increase (p<0,05) in acrosome reaction induced with homologous-ZP and heterologous-ZP.
Keywords: sperm capacitation, acrosome reaction, pellucid zone.
Introducción
El acrosoma es una gran vesícula secretora, ubicada en la región apical de la cabeza de los espermatozoides. La reacción acrosómica (RA) es una múltiple fusión de la membrana externa del acrosoma y la membrana plasmática en la región anterior de la cabeza del espermatozoide, caracterizada por una extensiva fusión de vesículas híbridas de estas membranas con la liberación del contenido acrosomal y exposición de la membrana acrosomal interna (Yanagimachi, 1994).
La capacitación es definida como el tiempo que el espermatozoide debe residir en el tracto reproductor femenino antes de que adquiera la habilidad de fecundar al ovocito. Mientras que la capacitación in vitro es el tiempo de incubación de los espermatozoides en un medio de cultivo apropiado (Austin, 1951; Chang, 1951; Austin, 1952). La capacitación in vitro implica una serie de procesos tales como el acoplamiento de los pasos de traducción de señales que regulan el inicio de la reacción acrosómica, fosforilación de proteínas, modificación de los patrones de movilidad del flagelo, desarrollo de la capacidad de fusionarse con el ovocito, hiperpolarización del potencial de membrana y la elevación del pH y de los niveles de calcio intracelular.
La zona pelúcida (ZP) es una matriz proteica extracelular que rodea al gameto femenino de los mamíferos, está compuesta por tres distintas glicoproteínas ZP1, ZP2 y la ZP3 en ratones (Wassarman y Albertini, 1994; Wassarman, 1995) y se ha demostrado que el inductor natural de la reacción acrosómica es ZP3, la cual induce la liberación del contenido acrosomal; permitiendo el inicio de la segunda fase en la interacción espermatozoide-ZP. Esta fase involucra una interacción más estable con la membrana acrosomal interna, y donde la glicoproteína ZP2 es la responsable (Bleil et al., 1988; Yanagimachi, 1994).
Materiales y métodos
Muestras de Espermatozoides
Cinco ratones de la cepa Balb C de 8 semanas de edad alimentados con comida balanceada y agua ad libitum, mantenidos a fotoperíodo de 14 horas luz y 10 horas oscuridad fueron sacrificados por dislocación cervical, se les extrajo la cola del epidídimo homogenizándolo en medio de cultivo de solución salina balanceada de Earle suplementado con suero sustituto sintético, BSA (Sigma Aldrich), piruvato de sodio, heparina 10 UI/ml, bicarbonato de sodio, estreptomicina 50 mg/L y penicilina 50 UI/ml.
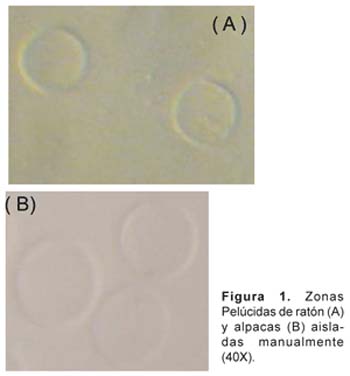
Aislamiento de Zonas Pelúcidas
Los ovarios fueron disectados en Buffer Fosfato Salino; las zonas pelúcidas, reconocidas en el microscopio-estereoscopio, colectadas con la menor cantidad de volumen de PBS, transferidas a un tubo de microcentrífuga, centrífugadas a 16000 RPM por 15 minutos, eliminando el sobrenadante se procedió a solubilizar a 68 ºC por una hora, posteriormente se centrifugó a 16000 RPM por 15 minutos, cuidadosamente se extrajo el sobrenadante y se almacenó a -20 ºC (Miller et al., 1992).
Separación y Capacitación Espermática
La selección de espermatozoides se realizó por swim up por 30 minutos en medio de cultivo IVF (Medicult), el proceso de capacitación fue por un periodo de 2 horas a 37 ºC y 5% CO2, de donde se recuperaron los espermatozoides capacitados desde la parte superior del tubo.
Inducción de la Reacción Acrosómica
La reacción acrosómica fue inducida en espermatozoides de ratón capacitados, incubados con soluciones de zona pelúcidas (ZP) aisladas de ovocitos de ratones y de alpacas hembras (Huancavelica-Perú) (Miller et al., 1992) durante 2 horas. Se cuantifico la concentración de proteína de ZP aislada con la técnica de Bradford (Fig. 1).
Evaluación de la Reacción Acrosómica
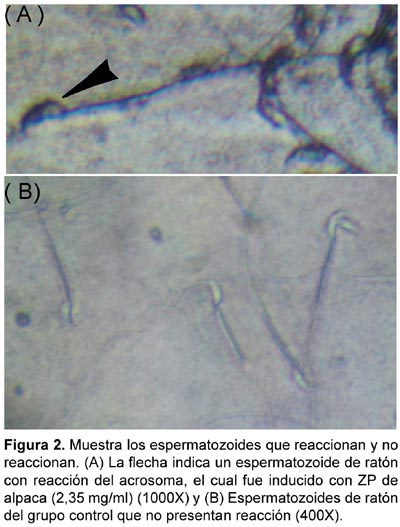
Se tomaron 20 mL de espermatozoides capacitados de cada de muestra a intervalos de una hora y fijados en paraformaldehido 4% sobre láminas limpias. La muestra posteriormente es incubada en solución de bloqueo (BSA 0,8%, IGSS 0,1%, suero sustituto 5%, NaN3 2 mM a pH 7,4) por 30 minutos; enfrentada la muestra al anticuerpo C5F10 (anticuerpo monoclonal anti-acrosina humana) en buffer de incubación (BSA 0,8%, IGSS 0,1%, suero sustituto 1%, NaN3 2 mM) por 1 hora, posteriormente la muestra fue incubada con anticuerpo secundario (Inmunogold ™) en oscuridad por 12 horas a temperatura ambiente. Las muestras fueron lavadas con PBS después de cada paso, post-fijadas en glutaraldehido 2%, amplificadas con plata y evaluadas a microscopio de luz, contabilizando los espermatozoides como no reaccionados cuando el acrosoma es refringente y como reaccionado cuando el mismo está coloreado.
Estadística
La comparación estadística de los parámetros evaluados se realizó con prueba estadística no paramétrica Kruskal-Wallis con un nivel de significancia p<0,05, todos los análisis se hicieron con el paquete estadístico MINITAB versión 14.0.
Resultados
La muestra de espermatozoides obtenida de cola de epidídimo de ratones Balb C muestra una concentración promedio de 4,5 x 108 espermatozoides/ml, luego de realizado el proceso de selección espermática y capacitación in vitro la motilidad espermática fue del 95% y se trabajó con una muestra 10 veces diluida a la concentración inicial.
La concentración proteica total aislada desde 200 zonas pelúcidas de ratón y alpaca fueron de 0,78 mg/ml y 2,35 mg/ml respectivamente, realizándose una dilución para comparar los niveles de reacción acrosómica en los espermatozoides de ratón con cada una de las especies.
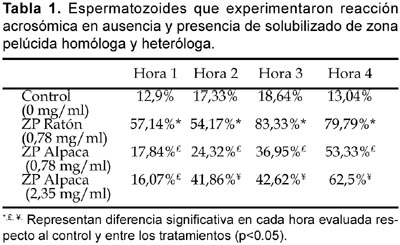
La tabla 1 presenta los porcentajes de evaluación del estado del acrosoma en espermatozoides de ratón posterior a la incubación con los solubilizados de ZP de ratón y 2 diferentes concentraciones de proteínas para ZP de alpaca.
El estado del acrosoma fue evaluado de acuerdo a la presencia de un acrosoma refringente en un espermatozoide no reaccionado y región acrosomal coloreado de uno reaccionado como se muestra en la figura 2.
Discusión
Durante la incubación para la capacitación in vitro de los espermatozoides de ratón se retira el colesterol de la membrana plasmática del espermatozoide, debido a la capacidad de la albúmina de aceptar moléculas de colesterol, lo que produce un incremento de la fluidez por remoción de componentes y reordenamiento de las proteínas de membrana (Cardona-Maya, 2005). Se ha establecido que zonas pelúcidas de ovocitos no fertilizados de hámster inducen la reacción acrosómica en espermatozoides capacitados de ratón, humano y rata, mientras que la zona pelúcida de estas especies no induce reacción acrosómica en los espermatozoides de hámster (Uto et al., 1988). Para el caso de Alpaca-Ratón los resultados obtenidos mediante inmunocitoquímica después de la inducción de la RA son significativos (p<0,05) y muestran que los solubilizados de ZP de ratón inducen niveles mayores de reacción acrosómica en los cuatro tiempos, mientras que ZP alpaca (2,35 mg/ml) muestra un alto incremento de inducción de RA al tiempo 2, respecto a la muestra ZP alpaca (0,78 mg/ml); demostrándose que en los solubilizados de alpaca se encuentra el inductor de la RA, que interactúa con los receptores en la cabeza de los espermatozoides de ratón e induce la reacción acrosómica de manera especie-interespecífica.
Altas concentraciones de ZP3 de ratón inducen reacción acrosómica, mientras pequeños glicopéptidos de ZP3 se unen al espermatozoide inhibiendo su unión al ovocito (Wassarman, 1988); estos resultados respaldan que los solubilizados concentrados de ZP de ratón y de alpacas inducen reacción acrosómica en espermatozoides de ratón in vitro, demostrando que en los solubilizados de ZP de alpaca se encuentra un inductor de la reacción acrosómica.
Las restricciones impuestas por la ZP no son absolutas in vitro (Wassarman y Litscher; 2001), cambios en la estructura de los oligosacáridos (composición, secuencia, uniones y/o modificaciones) junto con los cambios en las proteínas de unión en el espermatozoide deben ser tomados en cuenta para la unión especie-específica entre los gametos (Wassarman y Litscher, 1995), así el espermatozoide de ratón se une al ovocito de hamster in vitro (Moller et al., 1990), a ovocitos humanos y ovocitos de ratón que expresan ZP3 recombinante humana (Rankin et al., 1998), y a además experimenta reacción acrosómica in vitro con solubilizados de ZP de alpacas a concentraciones de 0,78 mg/ml y 2,35 mg/ml esto debido probablemente a similaridad en la secuencia de las glicoproteínas de ZP y en las modificaciones post-traduccionales.
Agradecimientos
Este trabajo de investigación esta enmarcado dentro del trabajo de tesis de maestría de Luis Guzmán Masias y esta enmarcado dentro del proyecto: «Molecular Análisis of Gametes Interaction in Alpaca Part II» CSI Nº 051001022 financiado por la ICGEB
Literatura citada
Austin CR. 1951. Observations on the penetration of sperm into the mammalian egg. Aust J Sci Res 4 (series B), 581-596. [ Links ]
Austin CR. 1952. The capacitation of sperm. Nature 170: 326.
Bleil JD, Greve JM, Wassarman PM. 1988. Identification of a secondary sperm receptor in the mouse egg zona pellucida: role in maintenance of binding of acrosome-reacted sperm to eggs. Develop Biol 128: 376-385.
Cardona-Maya W, Cadavid A. 2005. Evaluación de la reacción acrosomal en espermatozoides humanos inducida por los monosacáridos manosa y N-acetilgucosamina. Act. Urol. Esp. 29: 676-684.
Chang MC. 1951. Fertilizing capacity of spermatozoa deposited into the fallopian tubes. Nature 168: 697-698.
Miller C, Fayrer-Hosken R, Timmons T, Lee A, Caudle A, Dunbar B. 1992. Characterization of equine zona pellucida glycoproteins by polyacrylamide gel electrophoresis and immunological techniques. J. Reprod. Fert. 96, 815:825.
Moller C, Bleil R, Kinloch P, Wassarman PM. 1990. Structural and functional relationship between mouse and hamster zona pellucida glycoproteins. Dev. Biol. 137: 276-286.
Rankin T, Tong Z-B, Castle PE, Lee E, Gore-Langton R, Nelson LM, Dean J.1998. Human ZP3 restores fertility in Zp3-null mice without affecting order-specific sperm binding. Development. 125: 24152424.
Uto N, Yoshimatsu N, Lopata A, Yanagimachi R. 1988. Zona-induced acrosome reaction of hamster spermatozoa. J. Exp. Zool. 248: 113-120.
Wassarman PM, Albertini DF. 1994. The mammalian ovum. In The Physiology of Reproduction 2nd Edn pp 79-122 Eds E Knobil, JD Neill. Raven Press Ltd. New York.
Wassarman PM, Litscher ES. 1995. Sperm-egg recognition mechanisms in mammals. Curr. Top. Dev. Biol. 30:1-19
Wassarman PM, Litscher ES. 2001. Towards the molecular basis of sperm and egg interaction during mammalian fertilization. Cell Tissue Organs. 168:36-45.
Wassarman PM. 1988. Zone pellucida glycoproteins. Annu. Rev. Biochem. 57:415-442.
Wassarman PM. 1995. Towards molecular mechanisms for gamete adhesion and fusion in mammalian fertilization. Current Opinion in Cell Biology 7: 658-664.
Yanagimachi R. 1994. En Knobil E y Neil JD (eds) The physiology of Reproduction, 3ra Ed. Raven Press, Ltd, New York, pp. 189-317.
Correspondencia:
Universidad Nacional Mayor de San Marcos, Facultad de Ciencias Biológicas, Instituto de investigaciones de Ciencias Biológicas Antonio Raimondi. Casilla Postal 11-058. Lima 11. Lima, Perú.
Email Luis Guzmán: luis_guzman@ipbiomol.com