Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.14 n.1 Lima ago. 2007
Jonathan Liria
Departamento de Biología, Facultad de Ciencias y Tecnología, Universidad de Carabobo. Campus Barbula, Valencia, Estado Carabobo, Venezuela.
Resumen
El presente trabajo caracteriza la asociación de mosquitos y otros invertebrados sobre bromelias del Parque Nacional San Esteban del Estado Carabobo, Venezuela. Se estudiaron 18 plantas de Aechmea fendleri (11) y Hohenbergia stellata (7) durante las épocas lluvia (Septiembre 2004) y sequía (Marzo 2005). Fueron colectados un total de 2020 macroinvertebrados. Los taxa más importantes fueron las Familias Chironomidae (43%), Culicidae (25%) y Chaoboridae (6%) del Orden Diptera, y Scyrtidae (5%) del Orden Coleoptera. En Culicidae las especies más abundantes fueron: Culex consolador (31%), Cx. neglectus (27%) y Wyeomyia celaenocephala (17%). La mayor abundancia y riqueza se encontró en la época de sequía, con el aumento de diversidad en Culicidae. La diversidad y equitabilidad de macroinvertebrados fue mayor H. stellata, pero similares entre estaciones para las comunidades de A. fendleri y H. stellata.
Palabras clave: Bromeliaceae, Culicini, Sabethini, insectos acuáticos, ecología, diversidad, equitabilidad
Abstract
In the present work, we characterize the associations of mosquitoes species and other invertebrates on bromeliads from San Esteban National Park in Carabobo State, Venezuela. Eighteen plants of Aechmea fendleri (11) and Hohenbergia stellata (7) were sampled in rainy (September 2004) and dry (March 2005) seasons. A total of 2020 macroinvertebrates were collected. The most important was the Diptera Order, with the Families Chironomidae (43%), Chaoboridae (25%) and Culicidae (6%), and the Coleoptera, Scyrtidae (5%). In Culicidae the most abundant species were Culex consolator (31%), Cx. neglectus (27%) and Wyeomyia celaenocephala (17%). The highest abundance and richness was in dry season, when Culicidae diversity increases. The diversity and evenness was similar among season and it was highest in H. stellata.
Keywords: Bromeliaceae, Culicini, Sabethini, aquatic insects, ecology, diversity, evenness
Introducción
Las fitotelmata, definidas como plantas terrestres que poseen ciertas estructuras como hojas modificadas, axilas de hojas, flores, etc, capaces de almacenar agua para el desarrollo de una o varias comunidades de organismos asociados (Fish 1983; Greeney 2001). Distintos autores señalan la importancia de los fitotelmata en diversos procesos ecológicos, especialmente en dispersión, colonización e interacción entre especies, y también como elementos estructurales de los bosques tropicales. (Seifert 1980; Seifert y Barrera 1981; Frank 1983; Machado-Allison et al., 1985; Engwald et al., 2000; Armbruster et al., 2002; Ospina-Bautista et al., 2004).
Greeney (2001), señala 29 familias de plantas y unas 1500 especies, como posibles fitotelmata, siendo las bromelias un taxón con gran número de representantes, así Frank (1983; 2002) indica la presencia de más de 2000 especies de bromelias Neotropicales, donde tal vez la mitad de estas especies pueden considerarse verdaderas fitotelmata. En Venezuela, Holst (1994) reporta 365 especies de Bromeliaceae, 160 especies para el norte y en el Estado Carabobo son referidas 28 especies, de las cuales ocho han sido comprobadas en otros estudios como fitotelmatas, mientras otras cinco especies probablemente tengan esta capacidad.
Las bromelias sirven como un claro ejemplo de plantas con alta complejidad estructural y persistencia de hábitat que sustentan comunidades complejas de insectos acuáticos, particularmente de mosquitos (Diptera, Culicidae). Entre estos mosquitos, las hembras de varias especies son vectores en la transmisión de enfermedades como malaria, fiebre amarilla, dengue, filariasis, entre otras.
Debido a esto se plantea caracterizar las especies de mosquitos y otros invertebrados asociados a dos especies de bromelias del Parque Nacional San Esteban, así como determinar algunos parámetros del microhábitat en bromelias y relacionarlos con la fauna presente, y estimar la riqueza de los invertebrados acuáticos asociados a las bromelias.
Materiales y métodos
Área de estudio
El Parque Nacional San Esteban (PNSE) tiene una superficie de 44050 Ha y se encuentra en la Cordillera de la Costa, tramo Occidental de la Serranía del Litoral, del Estado Carabobo de Venezuela (Fig. 1AB). La vegetación esta caracterizada por bosques tropófilos basimontanos, caducifolios entre los 0-400 m, y bosques ombrófilos semicaducifolios y subsiempreverdes entre los 400-1200 m. (Huber 1997)
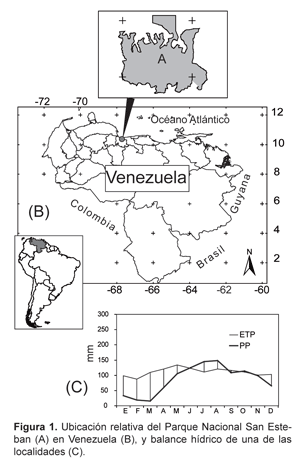
Los lugares estudiados fueron Puente los Españoles, (UTM P19 1.146.657 N y 609.859 E), ubicado a 427 m de altitud, con una precipitación anual de 1038 mm y temperatura promedio mensual de 24,7 ºC. El otro lugar fue El Paují, (UTM P19 1.146.903 N y 610.096 E), a 276 m, con una precipitación anual de 1033 mm y temperatura promedio mensual de 25,1 ºC (Fig. 1C). Los muestreos se realizaron en el período de lluvia (Septiembre 2004) y en el de sequía (Marzo 2005).
Colecta de Muestras
Durante cada período (lluvia o sequía), fueron identificadas las bromelias con la ayuda de claves gráficas (Oliva y Steyermark 1987), luego se procedió a determinar la temperatura del agua almacenada mediante un teletermómetro, y se tomó una alícuota para evaluar el pH y oxígeno disuelto, mediante un pH-metro y oxímetro portátiles.
Para la toma del agua retenida se empleo un método no destructivo, el cual consiste en succionado con lavado de las hojas a presión (Ingunza 1995). Este método tiene como ventaja, que la misma bromelia pueda ser muestreada nuevamente, y por otro lado es apropiado cuando se colecta en áreas protegidas (Parques Nacionales). Sin embargo, la principal desventaja radica en que el método es específico para la obtención de organismos acuáticos.
Seguidamente, el agua se trasfirió a un tamiz de malla fina (80 mesh/cm2) para concentrar la muestra. Luego se extrajeron las larvas de mosquitos para su cría en viales individuales, mientras que el resto de la muestra se re-concentró y almacenó en frascos plásticos con alcohol etílico al 70%.
En el laboratorio los insectos acuáticos y otros organismos fueron separados e identificados mediante claves taxonómicas: Culicidae (Lane y Whitman 1951; Lane 1953; González y Darsie 1996; Albuquerque y Lourenço-de-Oliveira 2000), Chironomidae (Epler 1995, 2001), Coleoptera acuáticos (Epler 1996), Chaoboridae (Lane 1942; Cook 1981), Odonata (Zygoptera) (Daigle 1991), Collembola (Christiansen et al. 2005), y resto de invertebrados (Fernández y Domínguez 2001).
Metodología estadística
Con los datos de abundancias totales (todos los morfotipos) y de especies de mosquitos, por bromelia y período, se construyeron matrices donde se calculó la riqueza, e índices de equidad de Alatalo (F2,1) y diversidad de Hill (N2) (Segnini 1995; Moreno 2001). Luego las variables fisicoquímicas (O2, pH y Temperatura), así como la abundancia y riqueza, fueron comparadas por período mediante la prueba de Kruskal-Wallis (Sokal & Rolhf 1979).
Posteriormente, ambas matrices de abundancias se examinaron mediante el Análisis Cluster (AC) con el método
UPGMA y empleando el coeficiente de similaridad porcentual (Krebs 1989) en el programa MVSP 3.12 (Kovach 2001), como técnica de clasificación para estudiar la composición de la comunidad.
Resultados y discusion
Fitotelmatas
En el Parque Nacional San Esteban se colectó el agua retenida en 18 bromelias pertenecientes a la Subfamilia Bromelioideae. De estos, 11 correspondieron con Aechmea fendleri Andre en la localidad El Paují, y siete a Hohenbergia stellata Schult en Puente de los Españoles. Según Smith (1971) e Ingunza (1995), ambas especies son similares en estructura, con numerosas hojas de 70-110 cm armadas con espinas, y una roseta embudiforme donde el tanque central concentra la mayor parte del agua.
Variables microambientales
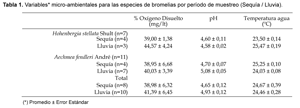
En la Tabla 1 se aprecian los promedios de oxígeno disuelto, pH y temperatura del agua, por especie de bromelia y período de muestreo, así como el promedio por bromelia y período, no se encontraron diferencias significativas (Kruskal-Wallis n= 18).
Los promedios totales de temperatura (24,5 ºC), pH (4,8) y oxígeno disuelto (40,3 mg/lt) difirieron de los valores obtenidos por Ospina-Bautista et al. (2004) para Tillandsia turneri Baker (10,8-17,5 ºC, pH 4,5-6,6 y O2 2,6-10,5 mg/lt). Esto puede explicarse por las variaciones en altitud donde se realizaron ambos estudios, T. turneri a 3000 m, H. stellata en 427 m y A. fendleri a 276 m. No obstante, los valores promedios obtenidos se encuentran dentro de los rangos reportados en otros estudios. (Laessle 1961; Maguire 1971).
Por otro lado, Ospina-Bautista et al. (2004) indican relación significativa entre la riqueza y diversidad de la comunidad, y el contenido de agua (obtenido a partir de variables morfométricas) y área de la planta. No obstante, en H. stellata y A. fendleri, estas variables morfométricas no fueron incluidas en el muestreo, por lo cual no se pudo inferir su importancia en la estructuración de la comunidad de invertebrados acuáticos.
Composición de especies de mosquitos
Se colectaron un total de 504 individuos (Tabla 2), los cuales se distribuyeron en las especies: Culex (Microculex) consolator Dyar & Knab (31%), Cx. (Mcx.) neglectus Lutz (27%), Wyeomyia (Wyeomyia) celaenocephala Dyar & Knab (17%), Wy. (Dendromyia) ypsipola Dyar & Wy. (Nunezia) bicornis Root ambas con (1%), y Chaoboridae: Corethrellinae sp. 1 (24%).
La mayoría de las especies reportadas en este estudio coinciden con otras investigaciones en Venezuela: Machado-Allison et al. (1986) en bromelias de panaquire, Estado Miranda, Ingunza (1995) en Sierra San Luis y Cerro Santa Ana, Estado Falcón, y Navarro et al. (1995,1998, 2007) en fitotelmatas de Parques Nacionales de Venezuela. Siendo la única excepción, Wy. ypsipola, donde su ocurrencia podría ser ocasional, debido a que Machado-Allison et al. (1986) en muestreos de varias fitotelmatas (bromelias, aráceas, huecos de árboles, heliconias, etc), señalan a Wy. ypsipola exclusivamente para Araceae, indicando la estrecha relación entre esta especie de mosquito y aráceas terrestres en el Norte de Venezuela.
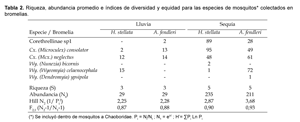
La abundancia total de mosquitos en sequía fue significativamente mayor (p<0,05 Kruskal-Wallis n= 17) al período de lluvia, mientras que entre H. stellata y A. fendleri se mantuvo igual.
La equitabilidad (índice F2,1) de las especies de mosquitos fue similar y con valores cercanos a la unidad (0,8-0,9) en H. stellata y A. fendleri en ambos períodos de muestro. Y la diversidad (índice N2) fue igual entre especies de bromelia, aumentando en el período de sequía.
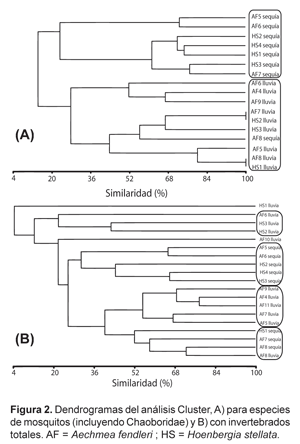
Machado-Allison et al. (1985) reportan para comunidades de mosquitos en fitotelmatas de Venezuela, relación positiva entre complejidad estructural y persistencia de hábitat, y riqueza de especies de mosquitos y depredadores. En el caso de H. stellata y A. fendleri, ambas bromelias son similares estructuralmente, lo cual explicaría la poca diferencia entre la equitabilidad y diversidad. Por otro lado, las variaciones estaciónales en abundancia y riqueza de Culicidae es señalada por Ingunza (1995), donde los mayores valores se alcanzan en sequía. Esta separación se aprecia en el dendrograma del Análisis de Cluster (Fig. 2A), con la conformación de dos grupos: Uno constituido por las muestras en sequía donde la comunidad se caracteriza por el aumento de individuos de Corethrellinae sp1, Cx. consolator y Cx. neglectus; y el grupo de las muestras en lluvia, donde la abundancia de estas especies disminuyen, con la excepción de una muestra de A. fendleri (AF8) colectada en sequía que fue agrupada con las de lluvia con base a la baja abundancia de especies.
Invertebrados totales
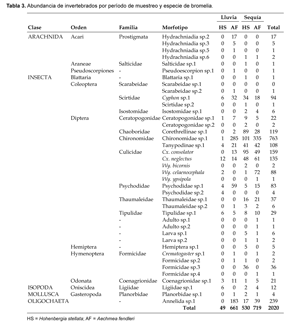
Se colectaron un total de 2020 individuos (Tabla 3), distribuidos en los taxa: Diptera (78%), Annelida (12%), Coleoptera (5%), Hymenoptera (2%), Acari (1%), Odonata (1%) e Isopoda (1%)
Estudios con diferentes especies de bromeliáceas en los géneros Aechmea, Guzmania, Hohenbergia, Tillandsia y Vriesea, han señalado que dentro de los organismos asociados a estas fitotelmatas, la Clase Insecta presenta la mayor abundancia y diversidad (Ingunza 1995; Greeney 2001; Mestre et al. 2001; Frank et al. 2004; Ospina-Batista et al. 2004).
La abundancia de individuos y riqueza de morfotipos aumentaron significativamente en el período de sequía (p<0,05 Kruskal-Wallis n= 18), mientras que entre H. stellata y A. fendleri se mantuvieron iguales.
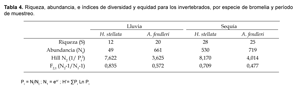
La equitabilidad y diversidad (Tabla 4) se mantuvieron iguales entre períodos de muestreo, sin embargo difirió entre especie de bromelia. El índice F2,1 aumentó en H. stellata con valores cercanos a la unidad (0,7-0,8) y disminuyó en A. stellata (0,4-0,5). El índice N2 de diversidad aumentó en H. stellata (7,6-8,1) y disminuyó en A. fendleri (3,6-4,0).
Las variaciones estaciónales en los invertebrados totales coinciden con los resultados de Ingunza (1995), la mayor abundancia y riqueza se registran en sequía, así como la predominancia de individuos y morfotipos del Orden Diptera. Luego las diferencias de diversidad y equitabilidad, entre H. stellata y A. fendleri, pueden deberse al aumento de individuos de Cx. consolator y Corethrellinae sp1 en H. stellata, y en A. fendleri por la predominancia de Chironomidae sp. 1 respecto a los otros morfotipos, trayendo como resultado la disminución de la equitabilidad en esta bromelia. Según Segnini (1995) el índice de diversidad N2 responde mejor a la variación en la equitabilidad de las muestras y es más robusto a los cambios en el número de especies raras.
El AC para invertebrados (Fig. 2B) muestra cuatro grupos. El primero formado por tres muestras (una de A. fendleri y dos de H. stellata) colectadas en la período de lluvia, caracterizado por la ausencia de individuos de la mayoría de los morfotipos; el segundo grupo formado por cinco muestras (dos de A. fendleri y tres de H. stellata) colectadas en sequía, constituido por la abundancia de individuos de Cx. consolador, Corethrellinae sp. 1, Tanypodinae sp. 1 y Thaumaleidae sp. 1; luego el tercer grupo compuesto por cinco muestras de A. fendleri colectadas en lluvia, caracterizado por Chironomidae sp1, Cx. consolador (pocos individuos) y Psychodidae sp. 1; y finalmente el cuarto grupo con mezcla de tres muestras de sequía y una de lluvia, representado por la alta abundancia de Chironomidae sp1 y la presencia de Coenagrionidae sp. 1.
Agradecimientos
Al Instituto Nacional de Parques (INPARQUES) del Ministerio del Ambiente, por facilitar el permiso de colecta. A los estudiantes de Departamento de Biología: Carlos Moreno, Douglas Mora, Massiel Pinto, Karen Gaviria, Mónica Núñez y Angel Quevedo, por el apoyo durante las colectas, y Lisette Goncalves y Beatriz Medina por el trabajo de laboratorio. Este trabajo fue realizado gracias al financiamiento del Consejo de Desarrollo Científico y Humanístico de la Universidad de Carabobo nº 448-2004.
Literatura citada
Albuquerque, M., and R. Lourenco-De-Oliveira. 2000. The Subgenus Dendromyia Theobald: A Review with redescription of four Species (Diptera: Culicidae). Memoria Instituto Oswaldo Cruz. 95(5): 649-683. [ Links ]
Armbruster, P., R.A. Hutchinson and P. Cotgreave. 2002. Factors influencing community structure in South America tank bromeliad fauna. Oikos. 96: 225-234.
Christiansen, K.A, P. Greenslade, L. Deharveng, et al. 2005. Checklist of the Collembola: Key to the extant families of Collembola. <http://www.collembola.org/key/collembo.htm > Acceso 4/3/2005.
Cook, E.F. 1981. Chaoboridae pp. 335-339, Chapter 24. In: McAlpine J.F., B.V. Peterson, G.E. Shewell, H.J. Teskey, J.R. Wockeroth and D.M. Wood, eds. Manual of Nearctic Diptera. Volume 1. Agriculture Canada Monograph 27. 674p.
Daigle, J.J. 1991. Florida damselflies (Zygoptera): A species key to the aquatic larval stage. Department of Environmental Regulation, Technical Series 11(1). Florida. 16p
Engwald, S., V. Schmit-Neuerburg, and W. Barthlott. 2000. Epiphytes in rain forest of Venezuela _ diversity and dinamics of a biocenosis. In: Breckle S.W., B. Schweizer and U. Arndt, eds. Results of worldwide ecological studies. Proceedings of the 1st Symposium by the AFW Schimper-Foundation _ from H. and E. Walker _ Hoheneim, Oktober 1998. Stuttgart-Hohenheim, Verlag Gunter Heimbach: 425-434.
Epler, J.H. 1995. Identification manual for the larval Chironomidae (Diptera) of Florida. Department of Environmental Protection, Division of Water Facilities. Tallahassee, Florida. 320p.
Epler, J.H. 1996. Identification manual for the water beetles of Florida. Department of Environmental Protection, Division of Water Facilities. Tallahassee, Florida. 259p.
Epler, J.H. 2001. Identification manual for the larval Chironomidae (Diptera) of North and South Carolina. North Carolina Department of Environmental, Natural Resources. Raleigh, North Carolina. 526 pp.
Fernández, H.R., and E. Domínguez. 2001. Guía para la determinación de los artrópodos bentónicos Sudamericanos. Serie Investigaciones de UNT, Subserie Ciencias Exactas y Naturales. Editorial Universitaria de Tucumán, Argentina. 282p.
Fish, D. 1983. Phytotelmata: Flora and Fauna. In: Frank J.H. and Lounibos L.P., eds. Phytotelmata: terrestrial plants as hosts for aquatic insect communities. Plexus publishing, New Jersey, 1-25p.
Frank, J.H. 1983. Bromeliad phytotelmata and their biota, especially mosquitoes. In: Frank J.H. and L.P. Lounbos, eds. Phytotelmata: terrestrial plants as hosts for aquatic insect communities. Plexus publishing, New Jersey, 101-128p.
Frank, J.H. 2002. Bromeliad Biota. <http://bromeliadbiota.ifas.ufl.edu/> Acceso 4/3/2005.
Frank, J.H., S.S. Reenivasan, P.J. Benshoff, et al. 2004. Invertebrate animals extracted from native Tillandsia (Bromeliales: Bromeliaceae) in Sarasota County, Florida. Florida Entomologist. 87(2): 176-185.
González, R., and R. Darsie Jr. 1996. Clave ilustrada para la determinación genérica de larvas de Culicidae de Colombia y el nuevo mundo. Boletín del Museo Entomológico de la Universidad del Valle. 4(1): 21-37.
Greeney, H.F. 2001. The insects of plant-held waters: a review and bibliography. Journal of Tropical Ecology. 17:241-260.
Kovach W. 2001. Multi-variate statistical package (MVSP), ver 3.12d. Pentraeth, UK: Kovach Computing Service.
Huber O. 1997. Ambientes Fisiográficos y vegetales de Venezuela. In: La Marca E, ed. Vertebrados actuales y fósiles de Venezuela, Serie catálogo zoológico de Venezuela. Vol.1 Museo de Ciencias y Tecnología de Mérida, Venezuela. p 279-298.
Holst, B.K. 1994. Checklist of Venezuelan bromeliaceae with notes on species distribution by state and levels of endemism. Selbyana. 15(1):132-149.
Ingunza, J. 1995. Composición de especies y caracterización ecobiológica de mosquitos (Diptera: Culicidae) y otros insectos acuáticos de bromelias (Bromeliaceae) en la Sierra de San Luis y Cerro Santa Ana, Edo. Falcón. Trabajo Especial de Grado, Facultad de Ciencias, Universidad Central de Venezuela. Caracas. 94p.
Krebs, C.J. 1989. Ecological methodology. Harper Collins Publishers. New York. 654 pp.
Laessle, A.M. 1961. A microlimnological survey of Jamaican bromeliads. Ecology. 24: 499-517.
Lane, J. 1942. Dixinae e Chaoborinae. Revisão das espécies neotrópicas (Diptera: Culicidae). Revista de Entomologia. 13(l-2): 81-148.
Lane, J., and L. Whitiman. 1951. The subgenus Microculex in Brazil (Diptera Culicidae). Revista Brasilera de Biologia. 11: 34 l-366.
Lane, J. 1953. Neotropical Culicidae. Vol. 2, University of São Paulo, Brazil.
Machado-Allison, C.E. 1982. Ecología de mosquitos (Culicidae). II. Larvas y pupas. Acta Biologica Venezuelica. 11:51-129.
Machado-Allison, C.E, R. Barrera, J.H. Frank, et al. 1985. Mosquitoes communities in venezuela phytotelmata In: Lounibos L.P, J.R Rey, and J.H. Frank, eds. Ecology of mosquitoes. Vero Beach, Florida. USA. 79-93p.
Machado-Allison, C.E, R. Barrera, L. Delgado, C. et al. 1986. Mosquitos (Diptera: Culicidae) de los Fitotelmata de Panaquire, Venezuela. Acta Biológica Venezuelica. 12(2): 1-12.
Maguire, B. 1971. Phytotelmata biota and community structure determination in plant-held waters. Annual Review of Ecology and Systematics. 2: 439-464.
Mestre, L.A, J.M. Aranha, and M. Esper. 2001. Macroinvertebrate Fauna Associated to the Bromeliad Vriesea inflata of the Atlantic Forest (Paraná State, Southern Brazil). Brazilian Archives of Biology and Technology. 44 (1): 89-94.
Moreno, C.E. 2001. Métodos para medir la biodiversidad. Manuales y Tesis Sociedad Entomológica Aragonesa (SEA), Vol. 1. CYTED, ORCYT/UNESCO & SEA. Zaragoza. 84p.
Navarro, J.C., J. Ingunza, Z. Fernández and R. Barrera. 1995. Mosquitoes and bromeliads: species-specific selectivity patterns on the northern coast and southern Guiana Shields in Venezuela. Journal American Mosquito Control Association. 11(3): 345-346.
Navarro, J.C., J. Liria and R. Barrera. 1998. Mosquito-Phytotelmata Biogeography in Venezuela using Parsimony Analysis of Endemicity. Journal American Mosquito Control Association. 14(3):229.
Navarro, J.C., J. Liria, H. Piñango and R. Barrera. 2007. Biogeographic area relationships in Venezuela: A Parsimony analysis of Culicidae—Phytotelmata distribution in National Parks. Zootaxa. 1547: 1-19
Oliva, F. and J. Steyermark. 1987. Las Bromeliaceae de Venezuela. Editor E. Armitano, Caracas. 397p.
Ospina-Bautista, F., J.V. Estévez-Varón, J. Betancur and E. Realpe-Rebolledo. 2004. Estructura y Composición de la comunidad de macro invertebrados acuáticos asociados a Tillandsia turneri Baker (Bromeliaceae) en un bosque Alto Andino Colombiano. Acta Zoológica Mexicana. 20(1): 153-166.
Segnini S. 1995. Medición de la diversidad en una comunidad de insectos. Boletín de Entomología Venezolana. 10(1): 105-113.
Seifert, R.P. 1980. Neotropical Heliconia insect communities. Quaterly Review of Biology. 57:1-28.
Seifert, R.P. and R. Barrera. 1981. Cohort studies on mosquito (Diptera: Culicidae) larval living in the water-filled floral bracts of Heliconia caribaea (Zingiberales, Musaceae). Ecological Entomology. 6:191-197.
Smith, L.B. 1971. Bromeliaceae Vol XII. Primera Parte. Instituto Botánico, Dirección de Recursos Naturales Renovables. Ministerio de Agricultura y Cría, Caracas. 361p.
Sokal, R.R. and J.F. Rolhf. 1979. Biometry. 2nd ed. W.H. Freeman, San Francisco, California. USA. 775p.
Correspondencia
Departamento de Biología, Facultad de Ciencias y Tecnología, Universidad de Carabobo. Campus Barbula, Valencia, Estado Carabobo, Venezuela.
Email Jonathan Liria: liria@uc.edu.ve
Presentado: 26/12/2006
Aceptado: 15/03/2007