Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Revista Peruana de Biología
versión On-line ISSN 1727-9933
Rev. peru biol. v.14 n.2 Lima dic. 2007
Omar Martínez y Josef Rechberger
Colección Boliviana de Fauna, Museo Nacional de Historia Natural, Instituto de Ecología, La Paz, Bolivia.
Resumen
El presente trabajo analiza la diversidad y composición de la avifauna en tres localidades ubicadas dentro del Parque Nacional y Área Natural de Manejo Integrado de Cotapata, La Paz, Bolivia. Las tres localidades se distribuyeron en gradiente altitudinal y tres tipos de bosques húmedos andinos (ceja de monte a 3170 m, bosque nublado a 2620 m y bosque nublado secundario a 1850 m) de la zona Yungas. Se realizó un esfuerzo total de 3286 horas-red niebla, 324 horas de caminatas y 216 horas de conteos por puntos en los tres lugares de estudio. Un total de 220 especies fueron registradas, la mayoría capturadas en redes (100 spp., 45%). Veinticinco familias fueron representadas en las capturas por redes y 42 mediante los censos. Tyrannidae y Thraupidae fueron las más representativas mediante ambos métodos. Las curvas acumulativas de especies fueron similares en todos los sitios. La riqueza de especies para la ceja de monte, bosque nublado y bosque secundario a partir de las capturas y censos fueron de 44, 40, 44 especies y 69, 57, 86 especies, respectivamente. Un total de 16 especies de rango restringido fueron registradas (p.e. Odontophorus balliviani, Andigena cucullata). La diversidad para la ceja de monte fue H´= 1,41; para el bosque nublado (H´= 0,98) y el bosque nublado secundario (H´= 0,96). La diversidad beta fue 0,74 basada en datos de capturas con redes y 0,79 basada en datos de censos en las tres alturas.
Palabras claves: Yungas, ceja de monte, bosque nublado andino, avifauna, Parque Cotapata, La Paz, Bolivia.
Abstract
This study analyzes the diversity and composition of the birds at three locations within the National Park and Natural Area Integrated Management of Cotapata, La Paz, Bolivia. The three locations were distributed in altitudinal gradient and three Andean rainforests (ceja de monte -Cloud forest ridges- to 3170 m, cloud forest to 2620 m and secondary cloud forest to 1850 m) of the Yungas area. We make a total effort of 3282 mist, 324 random walks hours and 216 point counts hours in the three study sites. A total of 220 species were recorded, most caught in nets (100 spp., 45%). Twenty-five families were represented in catches by mist net and 42 through censuses. Tyrannids and Thraupids were more representatives by both methods. Species cumulative curves were similar at all sites with major cumulative number of species by census data. Species richness in the elfin forest, cloud forest and secondary forest based on netting data and count data was 44, 40, 44 species and 69, 57, 86 species, respectively. A total of 16 restricted range species were registered (e.g. Odontophorus balliviani, Andigena cucullata). Diversity for cloud forest ridges was H´= 1,41; for cloud forest (H´= 0,98) and secondary cloud forest (H´= 0,96). Beta diversity was 0,74 based on netting data and 0,79 based on count data from three elevations.
Keywords: Yungas, cloud forest ridges, Andean cloud forest, avifauna, Park Cotapata, La Paz, Bolivia.
Introducción
La alta diversidad de aves en los bosques neotropicales esta relacionada en parte a la presencia de recursos ausentes en otros ecosistemas boscosos, tales como la abundante materia foliar suspendida (Gradwohl y Greenberg, 1982), hábitats ribereños (Rosenberg, 1990) y pasajes con bambú (Parker, 1982). En particular las epífitas (bromelias, orquídeas, hongos y líquenes) de los bosques húmedos montanos tropicales, incrementan la diversidad de aves debido a la especialización en el forrajeo (Orians, 1969; Terborgh, 1971; Nadkarni y Matelson, 1989; Kratter, 1993; Sillett et al., 1997).
Los patrones de diversidad de aves a lo largo de un gradiente altitudinal muestran una declinación de la riqueza de especies con la elevación (Terborgh, 1977; Blake y Loiselle, 2000), atribuidas a factores bióticos (disminución de la abundancia de insectos) y abióticos (disminución de la altura del bosque y cambios en las condiciones ambientales). Migraciones locales de las aves a lo largo de un gradiente altitudinal son un importante factor en el recambio de la composición de las especies.
Las barreras geográficas dividen a los bosques húmedos neotropicales en unidades discretas con una avifauna distinta. La altura tiene un impacto en la composición de la avifauna, cambiando de un 10—15% con cada 100 m de altura incrementadas en los bosques montanos de los Andes, además estos bosques tienen más especies endémicas que los bosques de tierras bajas en una relación de 318 vs. 152 especies (40% vs. 19%) (Stotz et al., 1996).
Los bosques húmedos del este de la Cordillera de los Andes desde el sudeste del Perú, Bolivia y el noroeste de la Argentina son conocidos como las Yungas. La altura fluctúa entre los 1800—3700 m, desde la Cordillera Central de los departamentos de Cuzco y Puno en el Perú hasta los departamentos de La Paz, Cochabamba y el extremo oeste de Santa Cruz en Bolivia (Stattersfield et al., 1998). Las comunidades de aves en estos bosques incluyen algunas especies más localizadas y ecológicamente especializadas. Las aves especialistas tienden a ser vulnerables y una gran cantidad de ellas, en los bosques húmedos desde México hasta Brasil han disminuido el tamaño de sus poblaciones, estando actualmente en la categoría de amenazadas o en peligro (Stattersfield et al., 1998, BirdLife Internacional & Conservation Internacional, 2005).
Algunas especies de aves con rango de distribución restringido son típicas de los bosques montanos del sudeste de Perú y Bolivia, entre ellas están los picaflores Aglaeactis pamela (endémica boliviana) y Metallura aeneocauda, Cranioleuca albiceps, C. marcapatae, Schizoeaca harterti (endémica boliviana) y S. helleri que ocurren en la transición de ceja de monte y páramo yungueño. Otras especies de rango restringido incluyen a las endémicas bolivianas: Grallaria erythrotis, Simoxenops striatus, Myrmotherula grisea, Phibalura boliviana y Atlapetes rufinucha; otras como O. balliviani, Hapalopsittaca melanotis, A. cucullata, Scytalopus (femoralis) bolivianus, Hemispingus calophrys, Iridosornis jelskii, Diglossa carbonaria.
En el presente estudio se describen las características de la avifauna en un gradiente de altitud en el Parque Nacional y Área Natural de Manejo Integrado (PN-ANMI) Cotapata.
Material y métodos
Área de estudio
Son tres localidades ubicadas dentro del Parque Nacional y Área Natural de Manejo Integrado (PN-ANMI) Cotapata: Mina Copacabana (16º17´S y 67º50´O; 3170 m), Sacramento Alto (16º16´S y 67º48´O; 2620 m) y San Antonio (16º15´S y 67º47´O; 1850 m) (Fig. 1). Se hallan ubicadas en el valle de Cotapata en el extremo sudeste del área reservada (Ribera, 1995).
El clima de la región está influenciado por la Cordillera de los Andes, siendo del tipo mesotérmico húmedo con lluvias permanentes. Entre los 3400 y 2300 m predomina el clima frío y perhúmedo, con lluvias frecuentes y lloviznas orográficas. El efecto de las lloviznas mojadoras (precipitación horizontal) es constante todo el año (Ribera, 1995).
La vegetación del gradiente corresponde a dos tipos de bosque siempreverdes típicos (ceja de monte y bosque nublado). En la ceja de montaña (> 3000 m) es típica el bambú (Chusquea sp.) y helechos arbóreos (Cyathea sp.). Los árboles comunes incluyen a las melastomatáceas Miconia sp. y Weinmania boliviana; Myrica pubescens y Podocarpus rusbyi, abundan las epifitas, musgos y líquenes, cubriendo los fustes, ramas y copas de los árboles (Paniagua et al. 2003). En el bosque nublado (2000—3000 m) se encuentran árboles típicos como Brunellia boliviana, Juglans sp. y Meliosma boliviensis (Beck, 1988).
Las actividades humanas de minería se realizan en la Mina Copacabana (3170 m), donde se explota el oro y el plomo. La agricultura de subsistencia es más prospera en las cotas más bajas (1850 m) como en San Antonio, donde se cultiva el café (Coffea arabica), la coca (Erytroxylon coca), la racacha (Arracacia tuberosa), la hualusa (Xanthosoma sp.) y frutos tropicales.
Métodos
De abril a septiembre de 1997, se estudio las comunidades de aves en la ceja de monte y el bosque nublado de Yungas, cubriendo un gradiente altitudinal entre los 3170-1850 m en tres tipos de bosque (ceja de monte a 3170 m, bosque nublado en su límite intermedio, 2620 m y bosque nublado secundario en su límite inferior, 1850 m). Registros adicionales fueron acumulados en los mismos sitios durante los periodos 1998-2003 (doce campañas en cada localidad).
Redes niebla
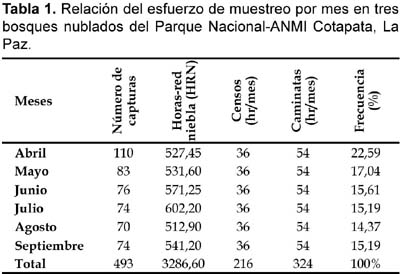
En cada parcela: Mina Copacabana (3170—2800 m, 12 ha), Sacramento Alto (2700—2620, 11 ha) y San Antonio (1910—1850, 11 ha), se utilizaron ocho redes de (12 m x 2,8 m, 36 mm de malla) para muestrear aves del sotobosque. Las ubicaciones de las redes fueron al azar con respecto a la topografía, plantas con frutos, pasajes con bambú u otros factores que pudieran influenciar tasas de captura. Las redes en un sitio dado fueron operadas por tres días (cerrándose, cuando las condiciones climáticas fueron extremas), con un total de 9 días durante cada periodo de muestreo. Conducimos seis periodos, durante 6 meses en las tres parcelas. El esfuerzo de trampeo fue de 3286 horas-red, distribuidos en 1267 horas-red para la Mina Copacabana, 1039 horas-red para Sacramento Alto y 979 horas-red para San Antonio.
Conteo por puntos
En cada parcela se seleccionó ocho sitios al azar, donde se realizaron los conteos por puntos (point counts) de las aves usando binoculares. Ralph et al. (1993, 1994), indican que la distancia mínima entre los puntos debe ser de 250 m y un radio de observación de 50 m para bosques templados o zonas abiertas. En el estudio se consideró una distancia de 200 m entre puntos y un radio de 25 m al igual que Hutto et al. (1986), debido a la topografía abrupta del lugar y la espesura del bosque. El esfuerzo de muestreo fue de 12 horas/mes por sitio (36 horas/mes en los tres sitios), totalizando 216 horas en seis meses. En cada sitio se observó durante un período de 15 minutos para efectuar los censos sobre la composición de las especies. Se realizó dos sesiones diarias, una en la mañana (06:00-08:00) y otra en la tarde (16:00-18:00) con un esfuerzo de muestreo diario de 4 horas.
Anillamiento de aves
Todas las aves capturadas fueron anilladas (excepto colibríes) con bandas numeradas de aluminio en la pata izquierda y bandas de plástico en la pata derecha, mediante series combinadas únicas de siete colores, normalmente pocos individuos pudieron ser distinguidos durante los conteos, pero utilizamos datos de capturas totales (incluyendo recapturas) y observaciones para los índices de diversidad y riqueza de especies.
Caminatas
Se realizaron caminatas cubriendo todos los lugares posibles de cada parcela para monitorear la avifauna y observar las aves anilladas, revisar las redes abiertas y estudiar los grupos tróficos de las aves en los diferentes tipos de bosques. El esfuerzo de muestreo fue de seis horas diarias, distribuidas en tres horas matinales (09:00—12:00) y tres vespertinas (13:00—16:00), totalizando 18 horas/mes por lugar (54 horas/mes en los tres sitios) y 108 horas por lugar (324 horas en los tres sitios) durante los seis meses de muestreo. Las aves fueron identificadas principalmente por observación directa o mediante capturas y secundariamente mediante grabaciones de cantos para lo cual utilizamos el CD de Cantos de Aves de Bolivia de Mayer (2000). El uso de registros fonográficos ayuda a maximizar esfuerzos sobre la composición de especies de un determinado lugar en términos de tiempo y número de observadores (Parker, 1991). El análisis de los grupos tróficos fue basado en observaciones sobre el comportamiento de forrajeo (Martínez, 2003) y la literatura (Remsen, 1985; Isler y Isler, 1987; Fjeldså y Krabbe, 1990). Las especies migrantes fueron determinadas según Stotz et al. (1996), Hennessey et al. (2003) y BirdLife International (2006).
Diversidad de especies
El índice de diversidad de Shannon-Weaver (H´) y el índice de equitatividad (E) (Hair, 1987; Feisinger, 2004) permiten obtener resultados comparativos entre poblaciones animales y es un método muy utilizado en diversidad de comunidades de aves. Se calculó la diversidad beta para todas las altitudes en función a las zonas de vida de Holdridge (1967, citado en Young et al. 1998; Blake y Loiselle, 2000):
β = γ / α n
Donde γ es la diversidad gamma (número total de especies), a es el número promedio de especies por zona de vida y n es el número de zonas de vida. Se calculo la diversidad beta separada para las aves capturadas en redes niebla y para las observadas en total.
Similitud entre hábitats
Para poder comparar las tres parcelas de estudio en términos de similitud o diferencia en función a la variedad de las especies de aves capturadas se utilizó el Coeficiente de similitud de Sorensen (Cs):
Cs = 100 (2j/a+b)
Donde j es el número de especies encontradas en común en los sitios A y B, a es el número de especies capturadas en el sitio A y b es el número de especies capturadas en el sitio B.
Resultados
Riqueza y diversidad de especies
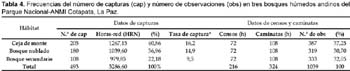
Un total de 220 especies (42 familias) de aves fueron registradas en los tres sitios de estudio, combinando datos de capturas y observaciones, de las cuales 100 especies (45%, 25 familias) fueron capturadas en redes de un total de 493 capturas, 3286 horas-red niebla (HRN), 324 horas de caminatas aleatorias y 216 horas de conteos por puntos (Tabla 1). Mediante capturas, la familia Tyrannidae fue la más representativa con un 25%, Thraupidae (20%) y Emberizidae (12%), mientras que los datos de censos indican que Tyrannidae fue la más representativa con un 16%, seguida de Thraupidae y Parulidae, ambos con un 11% (Tabla 2).
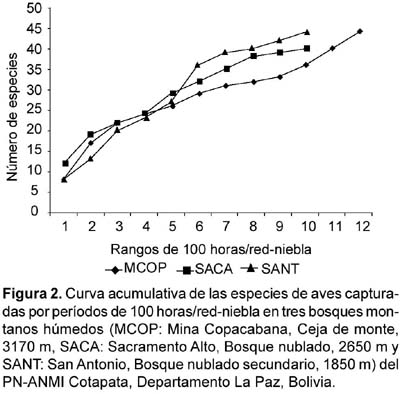
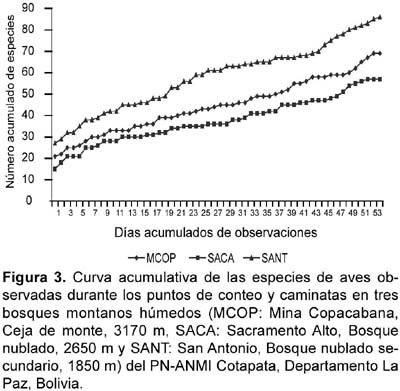
La riqueza para los tres tipos de bosques a partir de los datos combinados de capturas y censos indica que el bosque nublado secundario (1850 m) fue el más rico con 114 especies, seguido por la ceja de monte (3170 m) y el bosque nublado (2650 m) con 82 y 79 especies, respectivamente. La riqueza fue mayor a partir de los datos de censos y caminatas (Tabla 3, Anexo 1). Sin embargo, las curvas acumulativas de las especies observadas y capturadas indican que el muestreo no fue completo y fueron virtualmente similares en todos los tipos de bosques para cada método por separado, tendiendo a una asíntota hacia las 45 especies para los datos por capturas y entre las 60-90 especies para los datos de censos (Fig. 2 y Fig. 3).
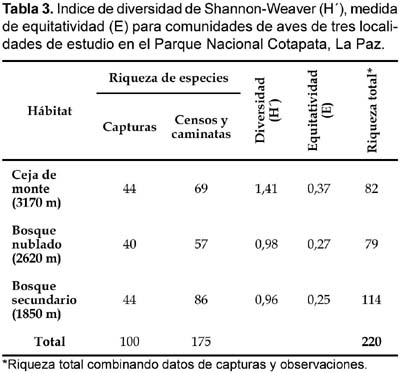
La diversidad avifaunística difiere entre sitios para datos con redes niebla y censos. La diversidad beta en todo el gradiente altitudinal (3170—1830 m) fue 0,74 basado en datos de capturas con redes niebla y 0,79 basado en datos de conteo directo a partir de las tres altitudes. En general, la diversidad de especies de aves (Índice de Shannon-Weaver) tuvo su valor más alto (H'= 1,41) en la ceja de monte, similarmente el valor mas alto del coeficiente de equitatividad (E) fue para este tipo de bosque (E= 0,37) (ver Tabla 3). Por otra parte, la ceja de monte (Mina Copacabana) tuvo la mayor frecuencia de capturas (41%) y censos (37%). Contrariamente, la menor frecuencia de capturas fue para el bosque secundario (San Antonio) con un 22%, mientras que con datos de censos fue para el bosque nublado (31%) (Tabla 4).
El coeficiente de Sorensen, señala una similitud muy representativa entre las comunidades de aves de la ceja de monte (3170 m) y bosque nublado (2620 m) con un valor de Cs= 43,9%, seguido por el bosque nublado secundario (1820 m) versus bosque nublado (Cs= 17,3). Por el contrario, en la ceja de monte y bosque nublado secundario, se obtuvo una similitud muy baja con un valor de Cs= 14,1%.
Aunque muchas especies de aves fueron registradas a partir de los censos, caminatas y capturas en redes, la relación de familias predominantes registradas por los diferentes métodos no difiere sustancialmente. El número de especies registrado sólo en el rango de 1830—1910 m fue de 91 especies (42% del total en todo el gradiente altitudinal); entre 2620—2700 m fue de 32 especies (15% del total) y entre 2980—3170 m fue de 49 especies (22%), mientras que, el 21% de la avifauna fue común en los tres rangos de elevación. Sólo A. rufinucha y Mionectes striaticollis fueron registradas a lo largo de todo el transecto altitudinal por medio de las capturas y observaciones, siendo las más comunes en los tres tipos de bosque estudiados.
Especies de rango restringido, endémicas y migrantes
Un total de 16 especies de aves de rango restringido fueron registradas, de las cuales 14 (p.e. O. balliviani, A. cucullata) se encuentran en la categoría de menor importancia de riesgo (lc, least concern) y solo Myiotheretes fuscorufus se encuentra casi amenazado (nt, Near threatened). Se incluyen tres especies endémicas (S. harterti, G. erythrotis y A. rufinucha) para Bolivia. Once especies son propias del área endémica de aves (055, ubicada entre 1800—3700 m) que corresponde a los bosques nublados de Yungas y cinco especies son primariamente del área (054, entre 400—2000 m) en bosques de Yungas bajos, ambas áreas ubicadas en los bosques húmedos de los Andes de Bolivia y Perú (ver Anexo).
Doce especies fueron capturadas en una sola oportunidad en el rango 2980—3170 m (p.e. Grallaricula ferrugineipectus, Amblycercus holosericeus). Entre 2620—2700 m las capturas únicas fueron siete (p.e. Ramphomicron microrhynchum, Henicorhina leucophrys). A 1830—1910 m capturamos en una sola ocasión a 13 especies (p.e. Pseudocolopteryx acutipennis, Sporophila caerulescens) estas dos últimas especies migrantes australes (ver más adelante). Los registros únicos a partir de los censos y caminatas en el rango 2980—3170 m fueron cinco (p.e. Scytalopus schulenbergi, una nueva especie descrita para Bolivia por Whitney, 1994). A 2620—2700 m los censos únicos fueron siete (p.e. Chamaepetes goudotii, Chamaeza mollisima). En el rango de 1830—1910 m, nueve especies fueron registradas en una sola oportunidad (p.e. Uropsalis segmentata, Thamnophilus ruficapillus).
Un total de 24 especies fueron consideradas en alguna categoría de migración, de las cuales sólo una fue migrante boreal estricta (Catharus ustulatus). Por otra parte, registramos 10 migrantes australes estrictos, cuatro fueron capturados (p.e. Pseudocolopteryx acutipennis) y seis fueron detectadas por censos (p.e. Pygochelidon cyanoleuca). Además, 12 especies fuerovvvvvvvβ#946;&&ββ#946;β#946;#946; migrantes australe s parciales y sólo una fue a partir de capturas (Thraupis bonariensis) (ver Anexo 1).
Grupos tróficos
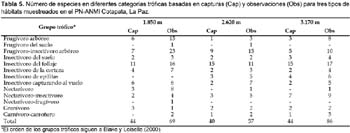
Los datos de capturas y conteos difieren en representación proporcional de especies dentro de algunos grupos tróficos. Los grupos tróficos dominantes fueron los insectívoros del follaje, frugívoros-insectívoros arbóreos y frugívoros arbóreos (Tabla 5). Los insectívoros del follaje (como Thamnophilus caerulescens) fueron representados en grandes proporciones en las capturas mas que en las observaciones; especies representativas de estos grupos, forrajean a nivel de las redes, mientras que frugívoros-insectívoros arbóreos fueron mejor representados en las observaciones. Por otra parte, insectívoros del suelo, insectívoros de la corteza y granívoros fueron igualmente representados por los dos métodos. Lo contrario fue para los frugívoros-insectívoros arbóreos y frugívoros arbóreos, muchos de los cuales forrajean a nivel de las redes, pero mas frecuentemente en el dosel y fueron más representados por las observaciones.
Las diferencias entre datos de conteo y capturas fueron menos pronunciadas cuando las proporciones de especies por tipo de bosque fueron comparadas. Los frugívoros arbóreos y frugívoros-insectívoros arbóreos fueron relativamente más numerosos en elevaciones bajas (1850 m), mientras insectívoros del follaje fueron más importantes desde los 2620 a 3170 m. Similarmente, nectarívoros-insectívoros, insectívoros de epífitas (bromelias, hongos, líquenes, ericáceas) e insectívoros del suelo fueron proporcionalmente más importantes a altas elevaciones (3170 m). En general, los grupos tróficos fueron mejor representados por los censos y caminatas para los tres tipos de bosque.
Discusión
Composición de las comunidades de aves
La diversidad de especies de aves cambia gradualmente desde los 1850 hasta los 3170 m a lo largo del transecto. Las capturas en redes y observaciones en los puntos de conteo, ambas sugieren que la diversidad fue alta en las cotas mas bajas. A pesar del número casi similar de especies en estos sitios, la composición de especies cambia sustancialmente, particularmente desde los 2980 hasta los 3170 m (cota más alta de estudio). La riqueza de especies fue mucho más baja en el bosque nublado (2650 m). Estos datos indican que el recambio en la composición de especies ocurre a distancias relativamente cortas pero también, la distancia per se no es la única causa de diferencias en la composición de especies.
Cambios en la composición de las comunidades de aves con relación a la altura, reflejan cambios en los tipos de recursos presentes. Especies insectívoras son menos numerosas en altas elevaciones (Terborgh, 1971; 1977). La baja importancia relativa de las especies insectívoras parece estar asociada con la disminución de la abundancia de los insectos en altas elevaciones y se advierte una disminución de grandes insectívoros (> 80 g), ocurriendo pocas especies en la ceja de monte (p.e. Cyanolyca viridicyana, Cacicus leucoramphus). Por el contrario, las especies que forrajean principalmente en epífitas (p.e. Pseudocolaptes boissonneautti, Margarornis squamiger) son más comunes en bosques de montaña, reflejando la gran importancia de las plantas epífitas como fuente de recursos alimenticios.
Especies migrantes y movimientos altitudinales inusuales
Las especies migrantes fueron un componente importante de la avifauna a lo largo del gradiente, incluyendo migrantes latitudinales y altitudinales. De las 24 especies de migrantes, sólo 12 fueron migrantes estrictos (sensu Stotz et al., 1996; Hennessey et al., 2003; BirdLife International, 2006). Cinco especies capturadas (Elaenia albiceps, Pseudocolopteryx acutipennis, Sporophila caerulescens, T. bonariensis y Pheucticus aureoventris) y dos censadas (Zonotrichia capensis y Thraupis sayaca) fueron migrantes australes comunes a los detectados en dos tipos de hábitats chaqueños de Bolivia por Jahn et al. (2002). El migrante boreal más distante fue Catharus ustulatus observado en un grupo mixto en San Antonio (1850 m).
El movimiento altitudinal más extremo fue de Creurgops dentata observado en un grupo mixto a 2800 m, siendo el registro de mayor altura para la especie. C. dentata ocurre entre los 1500—2150 m (Isler y Isler, 1987; Fjeldså y Krabbe, 1990) y 1400—2600 (Hennessey et al. 2003). El carpintero (Dryocopus lineatus) fue registrado a 1850 m, siendo considerado visitante en San Antonio, cuyo rango altitudinal es de 100—1700 m (Hennessey et al., 2003).
Especies de rango restringido
De las 20 especies (15 exclusivas) de rango restringido para la EBA (Endemic Bird Area) 055 que incluye a los bosques nublados de los Yungas en su límite superior de Bolivia y Perú (Stattersfield et al. 1998), 12 especies fueron registradas en el estudio (ver Anexo), de las cuales M. fuscorufus se encuentra en la categoría de casi amenazada (nt, Near Threathened) por Stattersfield et al. (1998) y no figura para Cotapata (Hennessey et al., 2003); ésta especie fue capturada en un bosque de ceja de monte adyacente a un afloramiento rocoso.
En general, muchas de las especies de rango restringido, detectadas a lo largo del gradiente fueron primariamente de bosque montano siempreverde y algunos como Cranioleuca albiceps y S. harterti fueron observados principalmente en la transición de la ceja de monte y bosque nublado con parches secundarios abiertos. De las 15 especies (7 exclusivas) de rango restringido para la EBA (054) propias para los bosques nublados de yungas en su límite bajo de Bolivia y Perú, sólo cinco especies fueron detectadas en el gradiente (p. e. Chiroxiphia boliviana, Pseudotriccus simplex).
Uso de redes niebla versus conteo por puntos
El uso de redes continúa siendo controversial, puesto que no llegan a muestrear todas las aves de un determinado hábitat. Por otra parte, los conteos por puntos también tienen muchas limitaciones y están sujetas a diferencias del observador. Blake y Loiselle (2000) indican que los conteos por puntos detectan más especies, pero las redes menudo son más efectivas para detectar ciertos tipos de aves. Borges y Stouffer (1999) determinaron que las observaciones fueron más exitosas que las capturas para detectar especies de aves en fragmentos de vegetación sucesional antropogénica en la Amazonía Central. Similares patrones encontramos en nuestro estudio. Sin embargo, ciertas aves poco comunes (p.e. G. ferrugineipectus, M. fuscorufus), con plumaje críptico (p.e. Thripadectes holostictus) o muy pequeñas (p.e. Haplospiza rustica, Zimmerius bolivianus) sólo fueron detectados a partir de redes niebla.
Remsen y Good (1996), han remarcado las desventajas del uso de redes para comparar la abundancia en comunidades de aves, señalando también que las redes llegan a muestrear únicamente la avifauna que se mueve dentro de 2—3 m de altura. Sin embargo, aves del dosel (p.e. P. boissonneautii, Entomodestes leucotis) fueron capturadas en nuestras parcelas, donde la topografía del terreno con laderas con pendiente pronunciada (> 45º), además de la alta velocidad de vuelo de muchas aves parecen favorecer las capturas.
En la Cordillera Central de Costa Rica, diez familias de aves, incluyendo Psittacidae y Cotingidae, no fueron representados por las capturas (Blake y Loiselle, 2000). En nuestro estudio, diez familias no fueron representadas en las capturas, pero muchas aves grandes (> 100 g) fueron capturadas como los Psittacidae (Hapalopsittaca melanotis, Pyrrhura molinae), Cotingidae (Pipreola intermedia, P. arcuata) e incluso un Ramphastidae (Aulacorhynchus coeruleicinctis). En general, datos de capturas con redes y observaciones difieren en importancia relativa de algunos grupos tróficos como nectarívoros e insectívoros del suelo (incluidas aves seguidoras de hormigas, fundamentalmente en el bosque nublado montano bajo a 1800 m) fueron más comunes en los datos de capturas, mientras que insectívoros del follaje y frugívoros arbóreos fueron más representativos en los datos de conteo.
El número de capturas disminuye notablemente en días sujetos a lluvias persistentes, aumentando relativamente en días con lluvias intermitentes ("chilchi"). Sin embargo, tasas de captura suelen incrementarse después de una jornada intensa de lluvias, cuando repentinamente se manifiestan rayos de sol en el firmamento. Algunos hábitats con características específicas de cobertura vegetal (materia foliar suspendida, hojas muertas), independientemente de los niveles de humedad y/o nubosidad dificulta la detección de ciertas especies con tendencias gregarias, en los bosques nublados con predominancia de bambúes (Chusquea sp.), epífitas y arbustos lianescentes, se ha verificado mayor grado de homocromía o crípsis, con relación a hábitats de bosques secundarios. Las curvas de acumulación de especies indican que los muestreos con redes en nuestro estudio tienden a aproximarse a una asíntota hacia las 45 especies para los tres tipos de bosque, sugiriendo que la mayoría de las especies comunes han sido detectadas. Blake y Loiselle (2000) obtuvieron similares resultados a partir de censos a 1500 y 2000 m en dos sitios de bosque montano tropical de la Cordillera Central, Parque Nacional Braulio Carrillo, Costa Rica. En este estudio, las especies adicionales han sido parcialmente completadas a partir de los conteos.
Diversidad de especies de aves
Graves (1985), estimó 280 especies a lo largo de los "bosques andinos" (600—3500 m) de toda la Cordillera Oriental de los Andes peruanos. La avifauna de nuestro estudio representa el 51% de la avifauna de los bosques andinos del Perú, con 142 especies compartidas en común. Walker (2001), registró 231 especies de aves en el bosque húmedo montano de la región del Machu Picchu en Cuzco, Perú (3400—2500 m). En relación con nuestros datos, 152 especies (66%) son comunes en ambos sitios. La diversidad de especies resulto ser alta a lo largo del gradiente altitudinal del bosque nublado de nuestras parcelas. Blake y Loiselle (2000) encontraron 168 especies en 7312 capturas en un gradiente altitudinal de 500 a 2000 m en la Cordillera Central de Costa Rica. Blake (1989) registró 85 especies en 732 capturas a tres diferentes altitudes en San Blas, Panamá. Restrepo y Gómez (1998), acumularon 1789 capturas registrando a 82 especies en un bosque montano (1800 m) de la Reserva Natural La Planada en el departamento de Nariño, Colombia. En nuestros sitios, se capturó 100 especies (220 totales) en 493 capturas en un gradiente de 1850 a 3100 m, donde los patrones en la composición de las comunidades fueron similares en muchos aspectos entre las parcelas de estudio. Las cuatro familias más ricas en especies de aves fueron Trochilidae, Tyrannidae, Thraupidae y Parulidae.
Remsen (1985) indica la alta proporción de especies de aves que participan en bandadas mixtas en bosques húmedos de Bolivia y que son virtualmente idénticas a las encontradas en Costa Rica. Se registró 33 especies de aves en bandadas mixtas en la ceja de monte (3100—2800): 13 de Thraupidae, cinco de Tyrannidae, cuatro de Furnariidae y Parulidae, dos de Icteridae y Picidae, y una de Cotingidae, Corvidae y Emberizidae (Martínez, 2003).
La diversidad beta de las comunidades aviares a lo largo del gradiente fue alta. En la Cordillera Central de Costa Rica registra una diversidad beta de 0,60 basado en datos de capturas y 0,52 para datos de conteo para un gradiente altitudinal de 500 a 2000 m (Blake y Loiselle, 2000). La diversidad beta en nuestro estudio fue 0,74 para datos de capturas con redes niebla y 0,79 para los datos de censos para un gradiente altitudinal de 1830 a 3170 m.
En la Cordillera Tilarán (Costa Rica) la diversidad beta fue de 0,45 (Young et al. 1998). Similar dato fue registrado para Trinidad (0,43) para una superficie de 5000 km² de la isla con hábitats de manglares hasta bosque nublado (Cox & Ricklefs 1977). La diversidad beta varío de 0,51 a 0,72 en regiones de bosque húmedo en África y América Central cruzando hábitats desde pastizales hasta bosque maduro (Karr, 1971; 1976). La avifauna de nuestras parcelas de estudio, claramente exhibe diversidad beta alta para ambos métodos, considerando la pequeña escala geográfica del área y la similaridad de hábitats maduros y secundarios muestreados en cada tipo de bosque.
Con relación a los valores arrojados por el índice de Sorensen para inferir grados de similitud entre hábitats estudiados, el valor más bajo (Cs= 14,12%) le corresponde a la zona de transición en ceja de monte (3170 m) y el bosque nublado secundario (1820 m), esto se debe a la marcada diferencia altitudinal entre una y otra parcela (1350 m de diferencia) con variaciones marcadas en las condiciones climáticas, fundamentalmente los niveles de precipitación pluvial. Por otra parte, la diferencia de la vegetación entre ambas zonas es bien notable, especies como los helechos arbóreos, bambúes y epífitas son más comunes en la ceja de monte y en el bosque secundario, la vegetación fue introducida (plantas cultivadas: cítricos, coca y café) en gran parte de la parcela con predominancia de helechos y matorrales pioneros; únicamente en los filos o límites del bosque la vegetación fue nativa.
Grupos tróficos
Algunos insectívoros son particularmente comunes en los límites bajos del transecto de estudio (1850 m) y son raros o ausentes en la ceja de montaña (3170 m). Por ejemplo, existen en Bolivia 77 especies de la familia insectívora Thamnophilidae, la mayoría ocurren en tierras bajas tropicales. A lo largo del gradiente, sólo tres especies fueron registradas (T. ruficapillus y Pyriglena leuconota a 1850 m y T. caerulescens a 2650 m). Insectívoros de captura en pleno vuelo pero de hábitos crepusculares, incluyeron a Uropsalis segmentata. La aparente rareza de U. segmentata en Bolivia, probablemente se deba, porque es una especie localizada a cierto hábitat y por la falta de colecciones en sitios apropiados (Vuilleumier, 1969).
Los nectarívoros y frugívoros son componentes importantes en los bosques tropicales y frecuentemente se incrementan en importancia con la altura (Terborgh, 1971; Blake y Loiselle, 2000). La gran predominancia de los nectarívoros, especialmente en la ceja de montaña parece estar asociada a cambios en la importancia de las plantas polinizadas por aves, particularmente epífitas (Bromeliaceae, Ericaceae y Orchidaceae). Un patrón similar explica la importancia de frugívoros en los bosques húmedos montanos que forrajean normalmente en Melastomataceae (varias especies de Miconia) y Moraceae (Cecropia sp.). Ampelion rubrocristatus fue observado forrajeando en frutos de Miconia a 3100 m y árboles bajos (3—5 m) con ramas densamente cubiertas de líquenes. Vuilleumier (1969) observo una pareja de A. rubrocristatus en un bosque similar de la Enrramada a 3350 m cerca de la Mina Chojlla, provincia Sud Yungas, La Paz.
Nadkarni y Matelson (1989) señalan que las familias más frecuentemente citadas forrajeando epífitas son Thraupidae, Trochilidae, Tyrannidae, Furnariidae, Emberizidae, Parulidae y Turdidae. En nuestros sitios, las mismas familias fueron frecuentes en el forrajeo de aves, pero en el caso de los emberízidos la única especie (de cinco registradas) forrajeando en epífitas (musgos) fue A. rufinucha. En el caso de Turdidae, la única especie (de seis registradas) observada forrajeando en epífitas (bromelias) fue E. leucotis.
Los sitios de forrajeo de las aves están definidos según los hábitos alimenticios de las especies. Grupos de loros como H. melanotis, Pionus tumultuosus y P. molinae fueron frecuentes en bosques secundarios. La disponibilidad de recursos alimenticios estacionales como los cítricos y musáceas (plátano), facilitan la agrupación de estas aves. Otras aves frugívoras oportunistas fueron P. aureoventris, P. montagnii, A. coeruleicinctis y Ramphocelus carbo especie muy conspicua en las yungas amazónicas. Entre los frugívoros arbóreos, tres especies de crácidos fueron registradas a lo largo del gradiente. Ortalis guttata, conocido localmente como "wiluko", busca insistentemente frutos de Inga spp. (Leguminosae). Penelope montagnii, es la pava más común en el bosque nublado, frecuentemente observado en grupos de 8—12 individuos, en vuelos cortos y torpes. Chamaepetes goudotii, es muy rara, sólo en una oportunidad (agosto de 1997) fue observado en Sacramento Alto (2650 m), en un árbol densamente cubierto por epífitas (musgos y bromelias), con una actitud cautelosa y pasiva; éste crácido fue descubierto para Bolivia por Cardiff y Remsen (1981). Remsen y Traylor (1983) reportaron otros tres especimenes colectados a 3050 m al filo del bosque húmedo nublado a 1 km al sur de Chuspipata, La Paz.
Conservación
Los datos a partir de los puntos de conteo y redes niebla demuestran alta diversidad de especies de aves a lo largo del transecto altitudinal desde San Antonio (1850 m) hasta la Mina Copacabana (3170 m). La importancia para la conservación de esta región es evidente a partir del número de especies presentes, la variación en la composición específica de una zona de vida con respecto a otra, 16 especies de rango restringido, la presencia de especies amenazadas (p.e. A. cucullata, H. melanotis) y tres endémicas (S. harterti, G. erythrotis, A. rufinucha). La variación geográfica en los patrones de plumaje y tamaño de las aves ("leapfrog pattern") para las aves de bosques montanos de los Andes es muy alta (Remsen, 1984a, 1984b, 1993; Maijer y Fjeldså, 1997). Por otra parte, muchos migrantes altitudinales ocurren a lo largo del gradiente, reflejando la importancia para la protección de estos bosques montanos como refugio para muchas aves. Los esfuerzos de conservación están enfocados a regiones que soportan especies endémicas, amenazadas o raras. En nuestro estudio, estas especies fueron igualmente comunes desde los 1800 hasta los 3100 m, indicando la necesidad para la protección de los bosques a lo largo del gradiente.
Agradecimientos
A la Liga de Defensa del Medio Ambiente (LIDEMA) por brindarnos su apoyo financiero. A Susan E. Davis, Marco Octavio Ribera y Mario Baudoin por supervisarnos el proyecto. A Byron Swift del Environment Law Institute (USA) por su apoyo en el trabajo de campo y su contribución bibliográfica. A nuestros colegas Andrea Loayza, Denisse Quiroga, Marcela Zamora, Hugo Araníbar, Daniel Larrea, Prem Vidaurre, Fernando Guerra y Jan Ohlson por su apoyo en el trabajo de campo. Un reconocimiento sincero a Bennett Hennessey de Armonía-BirdLife Internacional (Bolivia) por sus aportes e importantes sugerencias al manuscrito. A Bette A. Loiselle del International Center for Tropical Ecology (University of Missouri-St. Louis, USA), François Sagot de Armonía-Birdlife (Bolivia) y Timothy J. Killeen del Missouri Botanical Garden por la revisión y contribuciones al manuscrito.
Literatura citada
Beck S. 1988. Las ecoregiones y las unidades fitogeográficas de Bolivia. En: C. B. Morales, ed. Manual de Ecología. Instituto de Ecología. UMSA, La Paz, Bolivia. Pp. 233-267.
BirdLife International & Conservation International. 2005. Áreas importantes para la conservación de las aves en los Andes tropicales: sitios prioritarios para la conservación de la biodiversidad. Quito, Ecuador: BirdLife Internacional. 769 p.
BirdLife International. 2006. Conservando las aves migratorias neotropicales en los Andes tropicales. Quito, Ecuador: BirdLife International y U. S. Fish and Wildlife Service. 69 p.
Blake J. G. 1989. Birds of primary forest undergrowth in western San Blas, Panama. Journal Field Ornithologist 60 (2): 178-189.
Blake J. G. & B. A. Loiselle. 1991. Variation in resources abundance affects capture rates of birds in three lowland habitats in Costa Rica. Auk 108: 114-127.
Blake J. G. & B. A. Loiselle. 2000. Diversity of birds along an elevational gradient in the Cordillera Central, Costa Rica. Auk 117: 663-686.
Borges S. H. & P. Stouffer. 1999. Bird communities in two types of anthropogenic successional vegetation in Central Amazonia. Condor 101: 529-536.
Cardiff S. W. & J. V. Remsen, Jr. 1981. Three bird species new to Bolivia. Bulletin British Ornithological Club 101: 304-305.
Cox G. W. & R. E. Ricklefs. 1977. Species diversity, ecological release, and community structuring in Caribbean land bird faunas. Oikos 28: 113-122.
Feisinger, P. 2004. El diseño de estudios de campo para la conservación de la biodiversidad. Editorial FAN, Santa Cruz de la Sierra, Bolivia.
Fjeldså J. & N. Krabbe. 1990. Birds of the high Andes. Zoological Museum, University of Copenhagen, Denmark. 876 p.
Gradwohl J. & R. Greenberg. 1982. The effect of a single species of avian predator on the arthropods of aerial leaf litter. Ecology 63: 581-583.
Graves G. R. 1985. Elevational correlates of speciation and intraspecific geographic variation in plumage in Andean forest birds. Auk 102: 556-579.
Hair J. D. 1987. Medidas de diversidad biológica. En: R. Rodriguez Tarrés, ed. Manual de Técnicas de gestión de vida silvestre. Canadá. Pp. 283-290.
Hennessey A. B., S. K. Herzog & F. Sagot. 2003. Lista anotada de las aves de Bolivia. Asociación Armonía/BirdLife International. Santa Cruz de la Sierra, Bolivia. 238 p.
Holdridge L. R. 1967. Life zone ecology. Revised edition. Tropical Science Center. San José, Costa Rica.
Hutto R. L., S. M. Pletschet & P. Hendricks. 1986. A fixed-radius point count method for nonbreeding and breeding season use. Auk 103: 593-602.
Isler M. L. & P. R. Isler. 1987. The tanagers. Natural history, distribution and identification. Smithsonian Institution Press. Washington, D. C. 404 p.
Jahn A. E., S. E. Davis & A. M. Saavedra Z. 2002. Patrones en la migración austral de aves entre temporadas y hábitats en el Chaco boliviano, con notas de observaciones y una lista de especies. Ecología en Bolivia 37 (2): 31-50.
Karr J. R. 1971. Structure of Avian communities in selected Panama and Illinois habitats. Ecological Monographs 41: 207-233.
Karr J. R. 1976. Within and between habitat avian diversity in African and Neotropical lowland habitats. Ecological Monographs 46: 457-481.
Kratter A. W. 1993. Geographic variation in the yellow-billed cacique, Amblycercus holosericeus, a partial bamboo specialist. Condor 95: 641-651.
Loiselle B. A. & J. G. Blake. 1991. Temporal variation in birds and fruits along an elevational gradient in Costa Rica. Ecology 72: 180-193.
Maijer S. & J. Fjeldså. 1997. Description of a new Cranioleuca spinetail from Bolivia and a "leapfrog pattern" of geographic variation in the genus. Ibis 139: 606-616.
Martínez O. 2003. Composición específica y uso de substratos por las bandadas mixtas de aves en un bosque nublado andino de Bolivia. Ecología en Bolivia 38(2): 99-119.
Mayer S. 2000. Aves de Bolivia 2.0. Internacional Bird Sounds, Holanda.
Nadkarni N. M. & T. J. Matelson. 1989. Bird use of epiphyte resources in Neotropical trees. Condor 91: 891-907.
Orians G. H. 1969. The number of bird species in some tropical forest. Ecology 50: 783-801.
Paniagua N., C. Maldonado & C. Chumacero. 2003. Mapa de vegetación de los alrededores de la Estación Biológica de Tunquini, Bolivia. Ecología en Bolivia 38 (1): 15-26.
Parker T. A. III. 1982. Observations of some unusual rainforest and marsh birds in southeastern Peru. Wilson Bulletin 94: 477-493.
Parker T. A. III. 1991. On the use of tape recorders in avifaunal surveys. Auk 108: 443-444.
Ralph J., S. Droege & J. Saver. 1993. Managing and monitoring using point counts: standarts and applications research wildlife biologist. Redwood Sciences Laboratory, USDA Forest. CA. 18 p.
Ralph J., G. R. Geupel, P. Pyle, T. E. Martin, D. F. DeSante & B. Milá. 1994. Manual de métodos de campo para el monitoreo de aves terrestres. General Technical Report, Albany, CA: Pacific Southwest Station, Forest Service, U.S. Deparment of Agriculture. 46 p.
Remsen J. V. Jr. & M. A. Traylor, Jr. 1983. Additions to the avifauna of Bolivia, part 2. Condor 85: 95-98.
Remsen J. V., Jr. 1984a. Geographic variation, zoogeography, and possible rapid evolution in some Cranioleuca spinetails. Wilson Bulletin 96: 515-523.
Remsen J. V., Jr. 1984b. High incidence of "leapfrog" pattern of geographic variation in Andean birds: implications for the speciation process. Science 224: 171-173.
Remsen J.V. Jr. 1985. Community organization and ecology of birds of the high elevational humid forest of the bolivian Andes. In: P. A. Buckley, M. S. Foster, E. S. Morton, R. S. Ridgely y F. G. Buckley, eds. Neotropical Ornithology. Ornithological Monographs 36. Pp. 733-756.
Remsen J. V., Jr. 1993. Zoogeography and geographic variation of Atlapetes rufinucha (Aves: Emberizinae), including a distinctive new subspecies, in southern Peru and Bolivia. Proceedings of the biological society of Washington 106 (3): 429-435.
Remsen J.V., Jr. & D. Good. 1996. Misuse of data from mist-net captures to assess relative abundance in bird populations. Auk 113 (2): 381-398.
Restrepo C. & N. Gómez. 1998. Responses of understory birds to anthropogenic edges in a Neotropical montane forest. Ecological applications 8 (1): 170-182.
Ribera M. O. 1995. Aspectos ecológicos, del uso de la tierra y conservación en el Parque Nacional y Área Natural de Manejo Integrado Cotapata. En: C. B. Morales, ed. Caminos de Cotapata. Instituto de Ecología. La Paz, Bolivia. Pp. 1-84.
Rosenberg G. H. 1990. Habitat specialization and foraging behavior by birds of Amazonian river islands in northeastern Peru. Condor 92: 427-443.
Sillett T. S., A. James & K. B. Sillett. 1997. Bromeliad foraging specialization and diet selection of Pseudocolaptes lawrencii (Furnariidae). Ornithological Monographs 48: 733-742.
Stattersfield A. J., M. J. Crosby, A. J. Long & D. C. Wege. 1998. Endemic bird areas of the world. Priorites for biodiversity conservation. Bird-life International. Cambridge,UK. 846 p.
Stotz D. F., J. W. Fitzpatrick, T. A. Parker III & D. K. Moskovits. 1996. Neotropical birds. Ecology and conservation. The University of Chicago, U.S.A. 478 p.
Terborgh J. 1971. Distribution on environmental gradients: Theory and a preliminary interpretation of distributional patterns in the avifauna of the Cordillera Vilcabamba, Peru. Ecology 52: 23-40.
Terborgh J. 1977. Bird species diversity on an Andean elevational gradient. Ecology 58: 1007-1019.
Vuilleumier F. 1969. Field notes on some birds from the Bolivian Andes. Ibis 111: 599-608.
Walker B. 2001. Field guide to the birds of Machu Picchu. Peruvian National Trust Fund for Parks and Protected Areas (PROFONANPE) and Machu Picchu Program. 216 p.
Whitney B. M. 1994. A new Scytalopus tapaculo (Rhinocryptidae) from Bolivia, with notes on other Bolivian members of the genus and the magellanicus complex. Wilson Bulletin 106: 585-614.
Young B. E., D. DeRosier & G. V. N. Powell. 1998. Diversity and conservation of understory birds in the Tilarán mountains, Costa Rica. Auk 115 (4): 998-1016.
Correspondencia
Colección Boliviana de Fauna, Museo Nacional de Historia Natural, Instituto de Ecología, Casilla 8706, La Paz-Bolivia.
Email Omar Martínez o_martinez25@hotmail.com
Email Josef Rechberger josefrb@hotmail.com
Presentado: 23/04/2007
Aceptado: 16/11/2007